需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用基于读板器的荧光测定法评估线粒体耗氧量
Erratum Notice
摘要
耗氧量评估提供有关线粒体功能的完整信息。使用带有荧光读板机的磷光探针,无需专用设备即可轻松获得准确且可重现的数据。该测定使任何实验室都能测量分离线粒体的耗氧量并计算呼吸控制比率。
摘要
线粒体具有许多重要功能,包括细胞呼吸、ATP 产生、控制细胞凋亡以及作为代谢途径的中心枢纽。因此,通过实验评估线粒体功能可以深入了解不同人群或疾病状态之间的差异。此外,评估分离的线粒体是否足够健康以进行实验也很有价值。通常用于比较不同样本中线粒体功能的一个特征是耗氧率。耗氧量和随后计算完整细胞或从组织中分离的线粒体中的呼吸控制比率可以用于所有三个目的。使用从刷蜥肝脏中分离的线粒体与对溶液氧浓度波动敏感的磷光探针,我们使用荧光读板器测量了耗氧量。这种方法不仅快速有效,而且可以用少量线粒体进行,并且不需要专门的设备。此处描述的分步协议增加了研究人员对线粒体功能评估的可及性。
引言
线粒体是在真核细胞中发现的细胞器,大小与细菌差不多。它们是独特的细胞器,因为它们含有 DNA 并有两层膜,一层外膜和内膜。线粒体的外膜和内膜由膜间隙隔开,内膜折叠成围绕最内层隔室(称为基质)的嵴结构。这些嵴增加了内膜的表面积,因此使用嵴的多个过程可以同时发生。虽然线粒体参与许多细胞功能,例如控制细胞凋亡和容纳多种代谢途径,但它们在 ATP 产生中的重要作用对于细胞存活至关重要。事实上,细胞 90% 的能量来自线粒体1。ATP 的产生涉及跨外膜和内膜的电化学差异,称为线粒体膜电位 (Δψ),当 H+ 离子从基质泵入膜间空间时产生。ATP 的产生最终是通过电子通过线粒体呼吸链 (ETC) 的电子运动来氧化还原当量的。最后一个电子受体是分子氧 (O2)。随着氧气的消耗,H+ 浓度差会累积到最大值,此时 H+ 离子通过通过 ATP 合酶复合物从膜间空间向下移动到基质。H+ 离子的运动导致 ATP 合酶的构象变化,ADP 与无机磷酸盐靠近反应并生成 ATP。最后,ATP 从线粒体基质转移到胞质溶胶中,由于其磷酸盐水解过程中释放的大量自由能,可以储存或用于促进反应。这整个过程称为氧化磷酸化,由于消耗了氧气,因此据说线粒体会呼吸2。
Δψ 的积累和强度、O2 减少的量(称为耗氧量)以及 ATP 的产生都可以用作细胞健康的指标。线粒体功能研究,例如 Δψ、总 ATP 含量和产生以及耗氧量的测量,可以通过传统的生化方法或基于板的测定中的荧光和发光来量化。例如,可以使用荧光染料(如与线粒体特异性结合的四甲基罗丹明乙酯)比较不同样品之间的线粒体膜电位。可以通过向反应中添加发光蛋白来监测 ATP 的生成,其变化与 ATP 浓度相关。在 OXPHOS 期间量化耗氧率或绝对呼吸率有助于阐明线粒体功能和能量代谢差异的原因。耗氧量评估可用于计算呼吸控制比率 (RCR)。RCR 值描述了线粒体响应 ADP 流入而制造 ATP 的能力,ADP 是线粒体的主要功能。RCR 值表示分离线粒体的整体状况,并允许比较对不同实验治疗的反应。RCR 值的差异可能代表线粒体功能障碍或表明从两个或多个来源分离的不同线粒体之间存在生物学差异。分离线粒体中另一个重要的功能指标是线粒体效率,定义为每摩尔 O 合成的 ATP 摩尔数2,或 P/O 比3。
鉴于可以通过测量线粒体参数收集的信息量以及可以利用这些信息的各种实例,有效收集功能数据的能力在许多不同的研究领域都很有用。几十年来,线粒体耗氧量测量一直使用非常特殊的仪器进行——使用 Clark 电极,这可能会受到进行测量所需的样本量的限制,最近,可以测量线粒体呼吸和多个其他参数但成本高昂的复杂仪器。该方案是一种使用氧敏感磷光探针 (MitoXpress) 的适应性替代方法4,5。使用读板器在时间分辨荧光模式下检测探针信号,以便随时间进行连续测量。与荧光相比,磷光在吸收和发射的光子之间具有更大的能量差,因此更适合连续监测信号的变化。这使得几乎任何实验室都可以进行这些测量,而不仅仅是那些专注于线粒体代谢或能够负担得起高度专业化设备的实验室。我们使用的模型系统是从三只树蜥蜴中分离的线粒体,两种亲本物种和一种渗入物种(包含来自一个亲本物种的核 DNA 和来自另一个亲本物种的线粒体——杂交种)。选择这些蜥蜴是因为我们假设具有不同核和线粒体 DNA 来源的杂交种会产生代谢和能量后果。我们使用了带有多功能读板器的市售检测试剂盒,可以增加更多研究人员和研究领域对此类检测的访问。
研究方案
蜥蜴被 CO2 窒息安乐死,然后根据动物实验室福利办公室和 Elon 机构动物护理和使用委员会指南概述的政策立即斩首。
1. 线粒体的分离6
注意:在这些步骤中,保持所有溶液低温(表 1)并将样品置于冰上。
- 取出肝脏,称重,然后用 ~3 mL 冰冷的磷酸盐缓冲盐水 (1x, -/-) 冲洗。
- 用新鲜的剃须刀片在 1 mL L-MIB 中将肝脏切碎。
- 将组织加 L-MIB 的总体积调至 2 mL,并使用 Dounce 匀浆器机械破坏肝细胞四次。
- 将匀浆在 300 × g (37 °C,10 分钟)下旋转。
- 将上清液转移到新管中,并将其置于冰上。
- 将沉淀重悬于 2 mL L-MIB 中,重新匀浆,然后在 300 × g (37 °C,10 分钟)下再次离心。
- 合并来自两个离心的上清液,并以 10,000 × g (37 °C,10 分钟)离心。
- 将沉淀重悬于 ~0.350 mL 的 L-MIB 中。
- 确定总蛋白的量(mg 线粒体/mL L-MIB)用作线粒体含量 4,5,6 的近似值。
2. 耗氧量
- 将以下步骤中使用的所有溶液(表 1)在水浴中预热至 30 °C。
- 根据步骤 1.9 中蛋白质浓度测定的结果,将 LEB 中的线粒体稀释至 6 mg/mL。
- 在无菌的 96 孔黑壁透明底板中设置测定(表 2)。
- 将 50 μL 样品(L-EB 缓冲液或线粒体样品)添加到适当的孔中。
- 添加 50 μL 处理液(L-EB、谷氨酸/苹果酸或谷氨酸/苹果酸 w/ADP)。
- 在 L-EB 中以 1:10 的比例稀释探针储备液,然后向每个孔中加入 100 μL 荧光探针。
- 向每个孔中轻轻添加 50 μL 重矿物油以排除环境氧气。
- 每 1.5 分钟以 380/650 nm 激发/发射从板底部读取荧光测量值,持续 45 分钟。使用时间延迟为 30,000 μs、测量窗口为 100 μs 的动力学模式。
3. 数据分析
- 将 Plate Reader 计算机的原始数据文件导出为 .xls 文件。
- 打开文件,然后将原始数据复制并粘贴到新选项卡中,并相应地标记行和列。
- 将仅 L-EB 缓冲液绘制到对照样品和 L-EB + G/M 作为相对荧光单位 (RFU) 与时间的关系。
注意:这些线应该是相对平坦的,因为不存在线粒体,因此,不应检测到氧浓度的变化。 - 将 L-EB + G/M 样本值绘制为 RFU 与时间的关系。
- 确定读数在哪些地方变得更加一致,并为控件变平。
注意:这是实验样品数据分析应该开始的地方( 在图 1A 中用箭头标记)。反应可能需要 10-15 分钟才能趋于平缓并达到最大值。 - 制作一个仅包含步骤 3.5 中建立的时间点之后的数据(称为“修剪”数据)的新图,并添加最适合的线以可视化要分析的原始数据。
- 计算修剪的仅控制缓冲区数据的平均 RFU 值(以黄色突出显示)。该值用作最小 RFU 值,作为下面氧气计算中的基线。
- 耗氧率的计算 (μM O2/min)
- 复制并粘贴步骤 3.6 中原始数据的线性区域(即修剪后的数据),以确定每个时间点 7,8,9,10 中 G/M + ADP 处理中线粒体样品中的氧浓度。
- 使用等式 (1)5 确定每个时间点的氧浓度。[注2]a 是空气饱和缓冲液中的氧浓度(30 °C 时为 235 mM)。I(t)、Ia 和 Io 分别是样品 + 探针在时间 t 的荧光信号(例如,样品 + G/M + ADP)、步骤 3.7 中计算的探针在空气饱和缓冲液中的平均信号,以及脱氧缓冲液中的最大信号(设置为可实现的最大信号)。
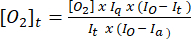 (1)
(1) - 绘制步骤 3.8.2 中计算的 [O2]t 值与时间的关系图,并添加一条线性趋势线以及最佳拟合线的方程。
注意: 使用每条线的斜率作为耗氧率。任何样品的重复或三重复都可以汇总并用于比较消耗率。
- 通过将有和没有 ADP 的线粒体呼吸除以分别代表状态 3 和 2 来计算 RCR。
结果
使用带有磷光氧传感探针和标准荧光读板器的检测试剂盒,从三种不同蜥蜴的线粒体中测定耗氧率和线粒体 RCR。先前的研究确定,该试剂盒中的探针与耗氧量直接相关,其中磷光被分子氧淬灭,并且荧光信号随着线粒体呼吸引起的氧水平降低而增加 7,11。随着时间的推移,记录对照和实验样品的 RFU 值,然后进行分析。对照孔?...
讨论
在比较不同的样本时,测量线粒体功能很有用,例如疾病与非疾病状态、同一动物的不同组织类型或不同样本类型之间的比较。我们使用后面的比较来检验我们的假设,即渗入线粒体的杂交树蜥蜴有代谢后果。有多种方法可以通过实验确定线粒体功能,包括 Δψ、总 ATP 含量、ATP 产生以及呼吸控制和耗氧率的定量。分离线粒体的耗氧量测量可以使用专用设备进行,例如 Cla...
披露声明
作者没有需要声明的利益冲突。
致谢
这项研究由 NSF CHE-1229562 (VDGM) 资助,并获得了伊隆大学教师研究与发展委员会 (VDGM 和 GH) 和本科生研究计划 (AJ) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
参考文献
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。