Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка потребления кислорода митохондриями с помощью флуоресцентного анализа на основе считывателя планшетов
В этой статье
Erratum Notice
Резюме
Оценка потребления кислорода дает интегральную информацию о функции митохондрий. Используя фосфоресцирующий зонд с флуоресцентным считывателем пластин, можно легко получить точные и воспроизводимые данные без специализированного оборудования. Этот анализ позволяет любой лаборатории измерить потребление кислорода изолированными митохондриями и рассчитать коэффициенты контроля дыхания.
Аннотация
Митохондрии выполняют множество важных функций, включая клеточное дыхание, выработку АТФ, контроль апоптоза и выполнение функций центрального узла метаболических путей. Таким образом, экспериментальная оценка функциональности митохондрий может дать представление о вариациях среди различных популяций или состояний заболевания. Кроме того, важно оценить, достаточно ли здоровы изолированные митохондрии, чтобы продолжать эксперименты. Одной из характеристик, часто используемых для сравнения функции митохондрий в разных образцах, является скорость потребления кислорода. Потребление кислорода и последующий расчет соотношения контроля дыхания в интактных клетках или митохондриях, выделенных из ткани, могут служить всем трем целям. Используя митохондрии, выделенные из печени щеточных ящериц в сочетании с фосфоресцирующим зондом, чувствительным к колебаниям концентрации кислорода в растворе, мы измерили потребление кислорода с помощью считывателя флуоресцентных пластин. Этот метод не только быстр и эффективен, но и может быть проведен с небольшим количеством митохондрий и без необходимости использования специализированного оборудования. Описанный здесь пошаговый протокол повышает доступность оценки митохондриального функционирования для исследователей.
Введение
Митохондрии – это органеллы, размером примерно с бактерии, обнаруженные в эукариотических клетках. Они являются уникальными органеллами, потому что содержат ДНК и имеют две мембраны, внешнюю и внутреннюю. Внешняя и внутренняя мембраны митохондрий разделены межмембранным пространством, а внутренняя мембрана сворачивается в структуры, называемые кристаллами, вокруг самого внутреннего отсека, называемого матрицей. Эти кристаллы увеличивают площадь поверхности внутренней мембраны, так что несколько процессов, использующих кристаллы, могут происходить одновременно. В то время как митохондрии участвуют во многих клеточных функциях, таких как контроль апоптоза и обеспечение нескольких метаболических путей, их жизненно важная роль в производстве АТФ имеет важное значение для выживания клеток. На самом деле, 90% клеточной энергии поступает из митохондрий1. Производство АТФ включает в себя генерацию электрохимической разницы между внешней и внутренней мембранами, называемой потенциалом митохондриальной мембраны (Δψ), которая возникает при закачивании ионов H+ из матрицы в межмембранное пространство. Производство АТФ в конечном итоге используется во время окисления восстановительных эквивалентов посредством движения электронов по митохондриальной дыхательной цепи (ETC). Конечным акцептором электронов является молекулярный кислород (O2). По мере потребления кислорода дифференциал концентраций H+ увеличивается до максимума, после чего ионы H+ перемещаются вниз по градиенту концентрации из межмембранного пространства в матрицу, проходя через комплекс АТФ-синтазы. Движение ионов H+ вызывает конформационные изменения в АТФ-синтазе, и АДФ вступает в контакт с неорганическим фосфатом, чтобы вступить в реакцию и образовать АТФ. Наконец, АТФ перемещается из митохондриального матрикса в цитозоль и может либо храниться, либо использоваться для облегчения реакций благодаря большому количеству свободной энергии, выделяемой во время гидролиза ее фосфатов. Весь этот процесс называется окислительным фосфорилированием, и поскольку кислород потребляется, митохондрии, как говорят, дышат2.
Накопление и сила Δψ, количество пониженногоO2 (называемое потреблением кислорода), а также образование АТФ могут быть использованы в качестве показателей здоровья клеток. Митохондриальные функциональные исследования, такие как измерение Δψ, общего содержания и продукции АТФ, а также потребления кислорода, могут быть количественно оценены либо традиционными биохимическими методами, либо флуоресценцией и люминесценцией в анализах на основе планшетов. Например, потенциал митохондриальной мембраны можно сравнить среди различных образцов с помощью флуоресцентных красителей, таких как этиловый эфир тетраметилродамина, который специфически связывается с митохондриями. Выработку АТФ можно контролировать, добавляя в реакцию люминесцентный белок, изменения которого коррелируют с концентрацией АТФ. Количественная оценка скорости потребления кислорода, или абсолютной скорости дыхания, во время OXPHOS может помочь выяснить причины различий в функции митохондрий и энергетическом обмене. Оценка потребления кислорода может быть использована для расчета коэффициентов контроля дыхания (RCR). Значения RCR описывают способность митохондрий вырабатывать АТФ в ответ на приток АДФ, который является основной функцией митохондрий. Значения RCR указывают на общее состояние изолированных митохондрий и позволяют сравнивать ответы на различные экспериментальные методы лечения. Различия в значениях RCR могут отражать митохондриальную дисфункцию или указывать на биологическую разницу между различными митохондриями, выделенными из двух или более источников. Другим важным показателем функции изолированных митохондрий является эффективность митохондрий, определяемая как количество синтезированных молей АТФ на моль O2, или отношение P/O3.
Учитывая объем информации, которая может быть собрана при измерении митохондриальных параметров, и различные случаи, в которых эта информация может быть использована, возможность эффективного сбора функциональных данных может быть полезна во многих различных областях исследований. Измерения потребления кислорода в митохондриях проводились в течение десятилетий с помощью очень специфических приборов — с использованием электрода Кларка, который может быть ограничен размером выборки, необходимой для проведения измерений, а в последнее время — с помощью сложных инструментов, которые могут измерять митохондриальное дыхание и множество других параметров, но могут быть непомерно дорогими. Этот протокол представляет собой адаптированный альтернативный подход с использованием кислород-чувствительного фосфоресцирующего зонда (MitoXpress)4,5. Сигнал зонда обнаруживается с помощью планшетного считывателя в режиме флуоресценции с временным разрешением для непрерывных измерений во времени. Фосфоресценция имеет большую разницу в энергии между поглощенным и испускаемым фотоном по сравнению с флуоресценцией и, следовательно, лучше подходит для непрерывного мониторинга изменений сигнала. Это позволяет выполнять эти измерения практически любой лаборатории, а не только той, которая специализируется на метаболизме митохондрий или может позволить себе узкоспециализированное оборудование. Модельная система, которую мы используем, представляет собой изолированные митохондрии от трех древесных ящериц, двух родительских видов и одного интрогрессированного (содержащего ядерную ДНК от одного родительского вида и митохондрии от другого — гибридов). Эти ящерицы были выбраны, потому что мы предположили, что существуют метаболические и энергетические последствия для гибридов с различными источниками ядерной и митохондриальной ДНК. Мы использовали коммерчески доступный набор для анализа с многорежимным считывателем планшетов, который может расширить доступ к этому типу анализа для большего числа исследователей и областей исследований.
Access restricted. Please log in or start a trial to view this content.
протокол
Ящерицы были усыплены путем удушения CO2 с последующим немедленным обезглавливанием в соответствии с политикой, изложенной Управлением по благополучию животных в лабораториях и руководящими принципами Комитета Илона по уходу за животными и их использованию.
1. Выделение митохондрий6
ПРИМЕЧАНИЕ: Храните все растворы в холоде (Таблица 1) и образцы на льду на протяжении всех этих этапов.
- Удалите печень, взвесьте ее, а затем промойте ~3 мл ледяного фосфатно-солевого буфера (1x, -/-).
- Измельчите печень в 1 мл L-MIB с помощью свежего бритвенного лезвия.
- Доведите общий объем ткани плюс L-MIB до 2 мл и механически разрушайте клетки печени в течение четырех проходов с помощью гомогенизатора Dounce.
- Открутите гомогенат при 300 × г (37 °C, 10 минут).
- Переложите надосадочную жидкость в свежую пробирку и положите ее на лед.
- Повторно суспендируйте гранулу в 2 мл L-MIB, повторно гомогенизируйте и снова отжмите при 300 × г (37 °C, 10 минут).
- Соедините надосадочную жидкость из обоих отжимов и центрифуги при 10 000 × г (37 °C, 10 мин).
- Ресуспендируйте гранулу в ~0,350 мл L-MIB.
- Определите количество общего белка (мг митохондрий/мл L-MIB) для использования в качестве приближенного значения содержания митохондрий 4,5,6.
2. Потребление кислорода
- Подогрейте все используемые растворы (Таблица 1) на следующих этапах до 30 °C на водяной бане.
- Разбавляют митохондрии в ЛЭБ до 6 мг/мл на основании результатов анализа концентрации белка на шаге 1.9.
- Установите анализ в стерильную 96-луночную прозрачную нижнюю пластину с черными стенками (Таблица 2).
- Добавьте 50 мкл образца (буфера L-EB или образца митохондрий) в соответствующие лунки.
- Добавьте 50 мкл лечебного вещества (L-EB, глутамат/малат или глутамат/малат с АДФ).
- Разбавьте зонд в соотношении 1:10 в L-EB, а затем добавьте 100 мкл флуоресцентного зонда в каждую лунку.
- Осторожно добавьте 50 μл тяжелого минерального масла в каждую скважину, чтобы исключить кислород из окружающей среды.
- Считывайте флуоресцентные измерения с нижней части пластины при волнении/излучении 380/650 нм каждые 1,5 минуты в течение 45 минут. Используйте кинетический режим с временной задержкой 30 000 μс и окном измерения 100 μс.
3. Анализ данных
- Экспортируйте файл необработанных данных с компьютера для чтения номерных знаков в виде файла .xls.
- Откройте файл, затем скопируйте и вставьте необработанные данные в новую вкладку и соответствующим образом пометьте строки и столбцы.
- Нанесите график буфера L-EB только на контрольный образец и L-EB + G/M как относительные флуоресцентные единицы (RFU) в зависимости от времени.
Примечание: Эти линии должны быть относительно плоскими, так как митохондрий нет, и, следовательно, не должно быть обнаружено никаких изменений в концентрации кислорода. - Построение графика значений выборки L-EB + G/M в зависимости от времени RFU.
- Определите, где показания становятся более стабильными и выравниваются для элементов управления.
ПРИМЕЧАНИЕ: Именно здесь следует начать анализ данных для экспериментальных образцов (отмечено стрелками на рисунке 1A). Реакции могут занять 10-15 минут, чтобы выровняться и достичь максимума. - Создайте новый график, содержащий данные только после момента времени, установленного на шаге 3.5 (так называемые «обрезанные» данные), и добавьте наиболее подходящую линию, чтобы визуализировать исходные данные, подлежащие анализу.
- Вычислите среднее значение RFU для данных усеченного буфера управления (выделено желтым цветом). Это значение используется в качестве минимального значения RFU в качестве исходного уровня при расчете кислорода ниже.
- Расчет расхода кислорода (μM O2/мин)
- Скопируйте и вставьте линейную область исходных данных из шага 3.6 (т.е. обрезанные данные) для определения концентрации кислорода в митохондриальных образцах при лечении G/M + ADP в каждой временной точке 7,8,9,10.
- Используйте уравнение (1)5 для определения концентрации кислорода в каждой временной точке. [О2]a – концентрация кислорода в насыщенном воздухом буфере (235 мМ при 30 °C). I(t), Ia и Io – флуоресцентный сигнал образца + зонда в момент времени t (например, образец + G/M + ADP), средний сигнал зонда в насыщенном воздухом буфере, рассчитанный на шаге 3.7, и максимальный сигнал в дезоксигенированном буфере (установленный на максимально достижимом сигнале), соответственно.
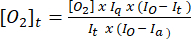 (1)
(1) - Постройте график зависимости значений [O2]t , рассчитанных на шаге 3.8.2, от времени и добавьте линейную линию тренда вместе с уравнением наиболее подходящей линии.
ПРИМЕЧАНИЕ: Используйте наклон каждой линии в качестве нормы потребления кислорода. Дубликаты или тройки для любой выборки могут быть агрегированы и использованы для сравнения нормы потребления.
- Рассчитайте RCR путем деления митохондриального дыхания с АДФ и без него, которые представляют состояния 3 и 2 соответственно.
Access restricted. Please log in or start a trial to view this content.
Результаты
Скорость потребления кислорода и митохондриальная RCR были определены по митохондриям трех разных ящериц с использованием набора для анализа с фосфоресцирующим зондом, чувствительным к кислороду, и стандартным считывателем флуоресцентных пластин. Предыдущие исслед...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Измерение функции митохондрий полезно при сравнении различных образцов, таких как болезненные и неболезненные состояния, различные типы тканей одного и того же животного или между разными типами образцов. Мы использовали более позднее сравнение, чтобы проверить наш...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Это исследование финансировалось NSF CHE-1229562 (VDGM) и грантами Комитета по исследованиям и разработкам факультета Университета Элона (VDGM и GH) и Исследовательской программы бакалавриата (AJ).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
Ссылки
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076(2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957(2017).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. , Springer. New York. (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены