Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mitokondriyal Oksijen Tüketiminin Plaka Okuyucu Tabanlı Floresan Testi Kullanılarak Değerlendirilmesi
Bu Makalede
Erratum Notice
Özet
Oksijen tüketiminin değerlendirilmesi, mitokondriyal fonksiyon hakkında bütünleyici bilgi sağlar. Floresan plaka okuyuculu bir fosforlu prob kullanılarak, özel ekipman olmadan kolayca doğru ve tekrarlanabilir veriler elde edilebilir. Bu test, herhangi bir laboratuvarın izole edilmiş mitokondrinin oksijen tüketimini ölçmesini ve solunum kontrol oranlarını hesaplamasını sağlar.
Özet
Mitokondri, hücresel solunum, ATP üretimi, apoptozu kontrol etme ve metabolik yolların merkezi bir merkezi olarak hareket etme dahil olmak üzere birçok önemli işleve hizmet eder. Bu nedenle, mitokondriyal işlevselliğin deneysel olarak değerlendirilmesi, farklı popülasyonlar veya hastalık durumları arasındaki farklılıklar hakkında fikir verebilir. Ek olarak, izole edilmiş mitokondrinin deneylere devam etmek için yeterince sağlıklı olup olmadığını değerlendirmek değerlidir. Farklı örneklerde mitokondriyal fonksiyonu karşılaştırmak için sıklıkla kullanılan bir özellik, oksijen tüketim oranıdır. Oksijen tüketimi ve ardından dokudan izole edilen sağlam hücrelerde veya mitokondride solunum kontrol oranının hesaplanması her üç amaca da hizmet edebilir. Fırça kertenkelelerinin karaciğerlerinden izole edilen mitokondriyi, bir çözeltinin oksijen konsantrasyonundaki dalgalanmalara duyarlı fosforlu bir prob ile birlikte kullanarak, bir floresan plaka okuyucu kullanarak oksijen tüketimini ölçtük. Bu yöntem sadece hızlı ve verimli olmakla kalmaz, aynı zamanda az miktarda mitokondri ile ve özel ekipmana ihtiyaç duymadan da gerçekleştirilebilir. Burada açıklanan adım adım protokol, mitokondriyal fonksiyonel değerlendirmenin araştırmacılar için erişilebilirliğini artırır.
Giriş
Mitokondri, ökaryotik hücrelerde bulunan yaklaşık bakteri büyüklüğünde organellerdir. DNA içerdikleri ve dış ve iç olmak üzere iki zara sahip oldukları için benzersiz organellerdir. Mitokondrinin dış ve iç zarları, zarlar arası bir boşlukla ayrılır ve iç zar, matris adı verilen en içteki bölmenin etrafında cristae adı verilen yapılara katlanır. Bu kristaller, iç zarın yüzey alanını arttırır, böylece kristali kullanan birden fazla işlem aynı anda gerçekleşebilir. Mitokondri, apoptozu kontrol etmek ve çoklu metabolik yolları barındırmak gibi birçok hücresel fonksiyonda yer alırken, ATP üretimindeki hayati rolleri hücrenin hayatta kalması için gereklidir. Aslında, bir hücrenin enerjisinin %90'ı mitokondri1'den elde edilir. ATP üretimi, mitokondriyal zar potansiyeli (Δψ) olarak adlandırılan ve H+ iyonlarının matristen zarlar arası boşluğa pompalanmasıyla ortaya çıkan dış ve iç zarlar boyunca bir elektrokimyasal farkın oluşturulmasını içerir. ATP üretimi, nihai olarak, mitokondriyal solunum zinciri (ETC) boyunca elektron hareketi yoluyla indirgeyici eşdeğerlerin oksidasyonu sırasında kullanılır. Son elektron alıcısı moleküler oksijendir (O2 ). Oksijen tüketildikçe, H+ konsantrasyon farkı maksimuma çıkar, bu noktada H+ iyonları, ATP sentaz kompleksinden geçerek konsantrasyon gradyanlarını zarlar arası boşluktan matrise doğru hareket ettirir. H+ iyonlarının hareketi, ATP sentazda konformasyonel bir değişikliğe neden olur ve ADP, reaksiyona girmek ve ATP oluşturmak için inorganik fosfat ile yakınlaştırılır. Son olarak, ATP, mitokondriyal matristen sitozole translokasyona yerleştirilir ve fosfatlarının hidrolizi sırasında açığa çıkan büyük miktarda serbest enerji nedeniyle reaksiyonları kolaylaştırmak için depolanabilir veya kullanılabilir. Tüm bu süreç oksidatif fosforilasyon olarak adlandırılır ve oksijen tüketildiği için mitokondrinin solunum yaptığı söylenir2.
Δψ'nin birikmesi ve gücü, azaltılmışO2 miktarı (oksijen tüketimi olarak adlandırılır) ve ATP oluşumunun tümü hücre sağlığının göstergeleri olarak kullanılabilir. Δψ ölçümü, toplam ATP içeriği ve üretimi ve oksijen tüketimi gibi mitokondriyal fonksiyonel çalışmalar, geleneksel biyokimyasal yöntemlerle veya plaka bazlı deneylerde floresan ve lüminesans ile ölçülebilir. Örneğin, mitokondriyal zar potansiyeli, spesifik olarak mitokondriye bağlanan tetrametilrodamin etil ester gibi floresan boyalar kullanılarak farklı numuneler arasında karşılaştırılabilir. ATP üretimi, değişiklikleri ATP konsantrasyonu ile ilişkili olan bir reaksiyona ışıldayan bir protein eklenerek izlenebilir. OXPHOS sırasında oksijen tüketim oranlarının veya mutlak solunum oranlarının ölçülmesi, mitokondriyal fonksiyon ve enerji metabolizmasındaki eşitsizliklerin nedenlerini aydınlatmaya yardımcı olabilir. Oksijen tüketimi değerlendirmesi, solunum kontrol oranlarını (RCR'ler) hesaplamak için kullanılabilir. RCR değerleri, mitokondrinin ana işlevi olan ADP akışına yanıt olarak mitokondrinin ATP yapma yeteneğini tanımlar. RCR değerleri, izole mitokondrinin genel durumunu gösterir ve farklı deneysel tedavilere verilen yanıtların karşılaştırılmasına izin verir. RCR değerlerindeki farklılıklar mitokondriyal disfonksiyonu temsil edebilir veya iki veya daha fazla kaynaktan izole edilen farklı mitokondriler arasındaki biyolojik bir farkı gösterebilir. İzole mitokondrideki bir diğer önemli fonksiyon ölçüsü,O2'nin molleri başına sentezlenen ATP'nin molleri veya P/O oranı3 olarak tanımlanan mitokondriyal verimliliktir.
Mitokondriyal parametrelerin ölçülmesinden toplanabilecek bilgi miktarı ve bu bilgilerin kullanılabileceği çeşitli durumlar göz önüne alındığında, fonksiyonel verileri verimli bir şekilde toplama yeteneği birçok farklı araştırma alanında faydalı olabilir. Mitokondriyal oksijen tüketimi ölçümleri, ölçümleri gerçekleştirmek için gerekli numune boyutu ile sınırlandırılabilen bir Clark elektrodu ve daha yakın zamanda, mitokondriyal solunumu ve diğer birçok parametreyi ölçebilen sofistike aletler kullanılarak çok özel enstrümantasyonla onlarca yıldır gerçekleştirilmiştir. Bu protokol, oksijene duyarlı fosforlu prob (MitoXpress) kullanılarak uyarlanmış alternatif bir yaklaşımdır4,5. Prob sinyali, zaman içinde sürekli ölçümler için zamana bağlı floresan modunda bir plaka okuyucu ile algılanır. Fosforesans, floresansa kıyasla emilen ve yayılan foton arasında daha büyük bir enerji farkına sahiptir ve bu nedenle, sinyaldeki değişiklikleri sürekli olarak izlemek için daha uygundur. Bu, sadece mitokondriyal metabolizmaya odaklanan veya son derece özel ekipman sağlayabilen laboratuvarların değil, hemen hemen her laboratuvarın bu ölçümleri gerçekleştirmesini sağlar. Kullandığımız model sistem, üç ağaç kertenkelesi, iki ebeveyn türü ve bir içe geçmiş (bir ebeveyn türünden nükleer DNA ve diğerinden mitokondri içeren melezler) izole edilmiş mitokondridir. Bu kertenkeleler, farklı nükleer ve mitokondriyal DNA kaynaklarına sahip melezler için metabolik ve enerji sonuçları olduğunu varsaydığımız için seçildi. Bu tür tahlillere daha fazla araştırmacı ve araştırma alanına erişimi artırabilecek çok modlu bir plaka okuyucuya sahip ticari olarak temin edilebilen bir tahlil kiti kullandık.
Protokol
Kertenkeleler, CO2 boğulması ile ötenazi yapıldı ve ardından Hayvan Laboratuvarı Refah Ofisi ve Elon'un Kurumsal Hayvan Bakımı ve Kullanımı Komitesi yönergeleri tarafından belirtilen politikalara uygun olarak derhal başlarının kesilmesi izledi.
1. Mitokondri izolasyonu6
NOT: Tüm çözeltileri soğuk tutun (Tablo 1) ve sampbu adımlar boyunca buz üzerinde.
- Karaciğeri çıkarın, tartın ve ardından ~ 3 mL buz gibi soğuk fosfat tamponlu tuzlu su (1x, -/-) ile durulayın.
- Karaciğeri taze bir tıraş bıçağıyla 1 mL L-MIB'de kıyın.
- Toplam doku hacmini artı L-MIB'yi 2 mL'ye getirin ve bir Dounce homojenizatör ile karaciğer hücrelerini dört geçiş boyunca mekanik olarak parçalayın.
- Homojenatı 300 × g'da (37 °C, 10 dakika) döndürün.
- Süpernatanı yeni bir tüpe aktarın ve buzun üzerine yerleştirin.
- Peleti 2 mL L-MIB içinde yeniden süspanse edin, yeniden homojenize edin ve 300 × g'da (37 °C, 10 dakika) tekrar döndürün.
- Süpernatanları her iki spinden birleştirin ve 10.000 × g'da (37 °C, 10 dakika) santrifüjleyin.
- Peleti ~ 0.350 mL L-MIB içinde yeniden süspanse edin.
- Mitokondriyal içerik 4,5,6 için yaklaşık olarak kullanılacak toplam protein miktarını (mg mitokondri / mL L-MIB) belirleyin.
2. Oksijen tüketimi
- Kullanılan tüm solüsyonları (Tablo 1) aşağıdaki adımlarda bir su banyosunda 30 °C'ye kadar önceden ısıtın.
- LEB'deki mitokondriyi, adım 1.9'daki protein konsantrasyonu testinin sonuçlarına dayanarak 6 mg / mL'ye seyreltin.
- Tahlili steril 96 oyuklu siyah duvarlı, şeffaf alt plakaya yerleştirin (Tablo 2).
- Uygun kuyucuklara 50 μL numune (L-EB tamponu veya mitokondri numunesi) ekleyin.
- 50 μL tedavi ekleyin (L-EB, Glutamat / Malat veya Glutamat / Malat w / ADP).
- Prob stoğunu 1:10 oranında L-EB oranında seyreltin ve ardından her oyuğa 100 μL floresan prob ekleyin.
- Ortam oksijenini dışlamak için her kuyucuğa yavaşça 50 μL ağır mineral yağ ekleyin.
- 45 dakika boyunca her 1,5 dakikada bir 380/650 nm uyarma/emisyonda plakanın altından floresan ölçümlerini okuyun. 30.000 μs'lik bir zaman gecikmesi ve 100 μs'lik bir ölçüm penceresi ile kinetik modu kullanın.
3. Veri analizi
- Ham veri dosyasını plaka okuyucu bilgisayardan .xls dosyası olarak dışa aktarın.
- Dosyayı açın, ardından ham verileri kopyalayıp yeni bir sekmeye yapıştırın ve satırları ve sütunları uygun şekilde etiketleyin.
- L-EB tamponunu yalnızca kontrol numunesine ve L-EB + G/M'yi zamana karşı bağıl floresan birimler (RFU) olarak çizin.
NOT: Mitokondri bulunmadığından bu çizgiler nispeten düz olmalıdır ve bu nedenle oksijen konsantrasyonunda herhangi bir değişiklik tespit edilmemelidir. - L-EB + G/M örnek değerlerini zamana karşı RFU olarak çizin.
- Okumaların nerede daha tutarlı hale geldiğini belirleyin ve kontroller için düzleştirin.
NOT: Deneysel numuneler için veri analizinin başlaması gereken yer burasıdır ( Şekil 1A'da oklarla işaretlenmiştir). Reaksiyonların düzleşmesi ve maksimuma ulaşması 10-15 dakika sürebilir. - Yalnızca adım 3.5'te belirlenen zaman noktasından ("kırpılmış" veriler olarak adlandırılır) sonraki verileri içeren yeni bir çizim oluşturun ve analiz edilecek ham verileri görselleştirmek için en uygun çizgiyi ekleyin.
- Yalnızca kırpılmış kontrol arabelleği verilerinin (sarı renkle vurgulanmıştır) ortalama RFU değerini hesaplayın. Bu değer, aşağıdaki oksijen hesaplamasında temel olarak minimum RFU değeri olarak kullanılır.
- Oksijen tüketim oranının hesaplanması (μM O2/dak)
- Her 7,8,9,10 zaman noktasında G/M + ADP muamelesindeki mitokondriyal numunelerdeki oksijen konsantrasyonunu belirlemek için adım 3.6'daki ham verilerin doğrusal bölgesini (yani kırpılmış veriler) kopyalayıp yapıştırın.
- Her zaman noktasındaki oksijen konsantrasyonunu belirlemek için denklem (1)5'i kullanın. [O2]a , havaya doymuş tampondaki oksijen konsantrasyonudur (30 °C'de 235 mM). I(t), Ia ve Io, numune + probun t zamanındaki floresan sinyalidir (örneğin, numune + G/M + ADP), adım 3.7'de hesaplanan havaya doymuş tampondaki probun ortalama sinyali ve oksijeni giderilmiş tampondaki maksimum sinyaldir (elde edilebilecek maksimum sinyale ayarlanmıştır), sırasıyla.
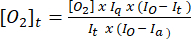 (1)
(1) - Adım 3.8.2'de hesaplanan [O2]t değerlerini zamana karşı çizin ve en uygun çizginin denklemiyle birlikte doğrusal bir eğilim çizgisi ekleyin.
NOT: Oksijen tüketim oranı olarak her çizginin eğimini kullanın. Herhangi bir numune için kopyalar veya üçlüler toplanabilir ve tüketim oranının karşılaştırılması için kullanılabilir.
- RCR'yi, sırasıyla 3 ve 2 durumlarını temsil eden ADP'li ve ADP'siz mitokondriyal solunumu bölerek hesaplayın.
Sonuçlar
Oksijen tüketim oranı ve mitokondriyal RCR, fosforlu oksijen algılama probu ve standart bir floresan plaka okuyucusu olan bir tahlil kiti kullanılarak üç farklı kertenkelenin mitokondrisinden belirlendi. Önceki araştırmalar, bu kitteki probun, fosforesansın moleküler oksijen tarafından söndürüldüğü ve mitokondriyal solunumnedeniyle oksijen seviyeleri azaldıkça floresan sinyalinin arttığı oksijen tüketimi ile doğrudan ilişkili olduğunu o...
Tartışmalar
Mitokondriyal fonksiyonun ölçülmesi, hastalıklı ve hastalıksız durumlar, aynı hayvandan alınan farklı doku tipleri veya farklı numune türleri gibi farklı numuneleri karşılaştırırken yararlıdır. Daha sonraki karşılaştırmayı, mitokondriye sahip melez ağaç kertenkelelerinin metabolik bir sonucu olduğu hipotezimizi test etmek için kullandık. Mitokondri fonksiyonunu deneysel olarak tespit etmenin, Δψ'nin miktarının belirlenmesi, toplam ATP içeriği, ATP üre...
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu araştırma NSF CHE-1229562 (VDGM) tarafından finanse edildi ve Elon Üniversitesi Fakülte Araştırma ve Geliştirme Komitesi (VDGM ve GH) ve Lisans Araştırma Programı (AJ) tarafından hibe edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
Referanslar
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır