JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Assessment of Mitochondrial oxygen consumption using a plate reader-based fluorescent assay(플레이트 리더 기반 형광 분석을 사용한 미토콘드리아 산소 소비량 평가)
Erratum Notice
요약
산소 소비량 평가는 미토콘드리아 기능에 대한 필수 정보를 제공합니다. 형광판 리더가 있는 인광 프로브를 사용하면 특수 장비 없이 정확하고 재현 가능한 데이터를 쉽게 얻을 수 있습니다. 이 분석을 통해 모든 실험실에서 분리된 미토콘드리아의 산소 소비량을 측정하고 호흡 조절 비율을 계산할 수 있습니다.
초록
미토콘드리아는 세포 호흡, ATP 생성, 세포사멸 조절, 대사 경로의 중앙 허브 역할을 포함한 많은 중요한 기능을 수행합니다. 따라서 미토콘드리아 기능을 실험적으로 평가하면 다양한 인구 집단 또는 질병 상태 간의 차이에 대한 통찰력을 얻을 수 있습니다. 또한 분리된 미토콘드리아가 실험을 진행할 수 있을 만큼 건강한지 평가하는 것이 중요합니다. 서로 다른 샘플에서 미토콘드리아 기능을 비교하는 데 자주 사용되는 한 가지 특성은 산소 소비율입니다. 산소 소비량과 온전한 세포 또는 조직에서 분리된 미토콘드리아의 호흡 조절 비율 계산은 세 가지 목적을 모두 수행할 수 있습니다. 덤불도마뱀의 간에서 분리한 미토콘드리아를 용액의 산소 농도 변동에 민감한 인광 프로브와 함께 사용하여 형광판 판독기를 사용하여 산소 소비량을 측정했습니다. 이 방법은 빠르고 효율적일 뿐만 아니라 소량의 미토콘드리아로 특수 장비 없이도 수행할 수 있습니다. 여기에 설명된 단계별 프로토콜은 연구자에 대한 미토콘드리아 기능 평가의 접근성을 높입니다.
서문
미토콘드리아는 진핵 세포에서 발견되는 대략 박테리아 크기의 세포 기관입니다. 그들은 DNA를 포함하고 외부 및 내부 막의 두 개의 막을 가지고 있기 때문에 독특한 세포 기관입니다. 미토콘드리아의 외막과 내막은 막간 공간으로 분리되어 있으며, 내막은 기질(matrix)이라고 하는 가장 안쪽 구획 주위의 크리스테(cristae)라는 구조로 접힙니다. 이러한 크리스테는 내막의 표면적을 증가시켜 크리스테를 사용하는 여러 프로세스가 동시에 발생할 수 있도록 합니다. 미토콘드리아는 세포사멸(apoptosis)을 조절하고 여러 대사 경로를 수용하는 등 많은 세포 기능에 관여하지만, ATP 생성에서 미토콘드리아의 중요한 역할은 세포 생존에 필수적입니다. 실제로 세포 에너지의 90%는 미토콘드리아1에서 파생됩니다. ATP 생산은 미토콘드리아 막 전위(Δψ)라고 하는 외막과 내막에 걸쳐 전기화학적 차이를 생성하는 것을 포함하며, 이는 H+ 이온이 매트릭스에서 막간 공간으로 펌핑될 때 발생합니다. ATP 생산은 궁극적으로 미토콘드리아 호흡계(ETC)를 통한 전자 이동을 통해 환원 등가물을 산화하는 동안 활용됩니다. 최종 전자 수용체는 분자 산소(O2)입니다. 산소가 소비됨에 따라 H+ 농도 차이는 최대치까지 증가하며, 이 시점에서 H+ 이온은 ATP 합성효소 복합체를 통과하여 막간 공간에서 매트릭스로 농도 구배를 내려갑니다. H+ 이온의 이동은 ATP 합성효소에 구조적 변화를 일으키고, ADP는 무기 인산염과 근접하여 반응하여 ATP를 생성합니다. 마지막으로, ATP는 미토콘드리아 기질에서 세포질로 전위되며, 인산염의 가수분해 중에 방출되는 많은 양의 자유 에너지로 인해 저장되거나 반응을 촉진하는 데 사용될 수 있습니다. 이 모든 과정을 산화적 인산화라고 하며, 산소가 소비되기 때문에 미토콘드리아가 호흡한다고 합니다2.
Δψ의 축적 및 강도,O2 감소량(산소 소비량이라고 함), ATP의 생성은 모두 세포 건강의 지표로 사용될 수 있습니다. Δψ 측정, 총 ATP 함량 및 생산, 산소 소비량과 같은 미토콘드리아 기능 연구는 기존의 생화학적 방법 또는 플레이트 기반 분석의 형광 및 발광으로 정량화할 수 있습니다. 예를 들어, 미토콘드리아 막 전위는 미토콘드리아에 특이적으로 결합하는 테트라메틸로다민 에틸 에스테르와 같은 형광 염료를 사용하여 여러 샘플 간에 비교할 수 있습니다. ATP 생성은 ATP 농도와 상관관계가 있는 변화 반응을 발광 단백질에 추가하여 모니터링할 수 있습니다. OXPHOS 중 산소 소비율 또는 절대 호흡 속도의 정량화는 미토콘드리아 기능과 에너지 대사의 불균형의 원인을 밝히는 데 도움이 될 수 있습니다. 산소 소비량 평가는 호흡 조절 비율(RCR)을 계산하는 데 사용할 수 있습니다. RCR 값은 미토콘드리아의 주요 기능인 ADP의 유입에 반응하여 ATP를 만드는 미토콘드리아의 능력을 설명합니다. RCR 값은 고립된 미토콘드리아의 전반적인 상태를 나타내며 다른 실험 치료에 대한 반응을 비교할 수 있습니다. RCR 값의 차이는 미토콘드리아 기능 장애를 나타내거나 둘 이상의 소스에서 분리된 서로 다른 미토콘드리아 간의 생물학적 차이를 나타낼 수 있습니다. 고립된 미토콘드리아의 기능을 측정하는 또 다른 중요한 척도는O2의 몰당 합성된 ATP의 몰 또는 P/O 비율3으로 정의되는 미토콘드리아 효율입니다.
미토콘드리아 매개변수를 측정하여 수집할 수 있는 정보의 양과 이 정보를 활용할 수 있는 다양한 사례를 감안할 때 기능 데이터를 효율적으로 수집하는 능력은 다양한 연구 분야에서 유용할 수 있습니다. 미토콘드리아 산소 소비량 측정은 측정을 수행하는 데 필요한 샘플 크기에 의해 제한될 수 있는 Clark 전극을 사용하는 매우 구체적인 기기로 수십 년 동안 수행되어 왔으며, 최근에는 미토콘드리아 호흡 및 기타 여러 매개변수를 측정할 수 있지만 비용이 많이 들 수 있는 정교한 기기를 사용하여 수행되었습니다. 이 프로토콜은 산소에 민감한 인광 프로브(MitoXpress)4,5를 사용하는 적응형 대체 접근 방식입니다. 프로브 신호는 시간 분해 형광 모드의 플레이트 리더로 감지되어 시간이 지남에 따라 지속적으로 측정됩니다. 인광은 형광에 비해 흡수된 광자와 방출된 광자 사이의 에너지 차이가 더 크므로 신호의 변화를 지속적으로 모니터링하는 데 더 적합합니다. 이를 통해 미토콘드리아 대사에 중점을 두거나 고도로 전문화된 장비를 구입할 수 있는 실험실뿐만 아니라 거의 모든 실험실에서 이러한 측정을 수행할 수 있습니다. 우리가 사용하는 모델 시스템은 3 개의 나무 도마뱀, 2 개의 부모 종 및 1 개의 도입 된 미토콘드리아입니다 (한 부모 종의 핵 DNA와 다른 부모 종의 미토콘드리아를 포함하는 잡종). 이 도마뱀은 서로 다른 핵 및 미토콘드리아 DNA 공급원을 가진 잡종에 대한 신진대사 및 에너지 결과가 있다는 가설을 세웠기 때문에 선택되었습니다. 우리는 더 많은 연구자와 연구 분야에서 이러한 유형의 분석에 대한 접근성을 높일 수 있는 다중 모드 플레이트 리더와 함께 상업적으로 이용 가능한 분석 키트를 활용했습니다.
프로토콜
도마뱀은 CO2 질식으로 안락사된 후 동물 실험실 복지국(Office of Animal Laboratory Welfare)과 Elon의 기관 동물 관리 및 사용 위원회 지침에 설명된 정책에 따라 즉시 참수되었습니다.
1. 미토콘드리아분리 6
알림: 모든 용액을 차갑게 유지하고(표 1) 이 단계를 통해 얼음 위에 샘플을 보관하십시오.
- 간을 제거하고 무게를 잰 다음 ~3mL의 얼음처럼 차가운 인산염 완충 식염수(1x, -/-)로 헹굽니다.
- 새 면도날로 L-MIB 1mL에 간을 다집니다.
- 조직의 총 부피와 L-MIB를 2mL로 늘리고 Dounce 균질기로 간 세포를 4회 동안 기계적으로 파괴합니다.
- 균질산염을 300 × g (37 ° C, 10 분)에서 회전시킵니다.
- 상층액을 새 튜브에 옮기고 얼음 위에 놓습니다.
- 펠릿을 L-MIB 2mL에 재현탁하고 재균질화한 후 300× g( 37°C, 10분)에서 다시 회전합니다.
- 스핀과 원심분리기의 상층액을 10,000 × g (37 °C, 10분)에서 결합합니다.
- 펠릿을 ~0.350mL의 L-MIB에 재현탁합니다.
- 미토콘드리아 함량에 대한 근사치로 사용할 총 단백질의 양(미토콘드리아 mg/L-MIB mL)을 결정합니다 4,5,6.
2. 산소 소비량
- 다음 단계에서 사용된 모든 용액(표 1)을 수조에서 30°C로 예열합니다.
- 1.9단계의 단백질 농도 분석 결과에 따라 LEB의 미토콘드리아를 6mg/mL로 희석합니다.
- 멸균 96웰 검은색 벽의 투명한 바닥 플레이트에 분석을 설정합니다(표 2).
- 50μL의 샘플(L-EB 완충액 또는 미토콘드리아 샘플)을 적절한 웰에 추가합니다.
- 50μL의 치료제(L-EB, 글루타메이트/말레이트 또는 글루타메이트/말레이트 w/ADP)를 추가합니다.
- 프로브 스톡을 L-EB로 1:10으로 희석한 다음 모든 웰에 형광 프로브 100μL를 추가합니다.
- 주변 산소를 차단하기 위해 모든 웰에 50μL의 중광유를 부드럽게 첨가합니다.
- 380/650nm 여기/방출에서 45분 동안 1.5분마다 플레이트 바닥에서 형광 측정값을 읽습니다. 30,000 μs의 시간 지연과 100 μs의 측정 창에서 키네틱 모드를 사용합니다.
3. 데이터 분석
- 플레이트 리더 컴퓨터에서 원시 데이터 파일을 .xls 파일로 내보냅니다.
- 파일을 연 다음 원시 데이터를 복사하여 새 탭에 붙여넣고 행과 열에 적절하게 레이블을 지정합니다.
- L-EB 버퍼를 대조군 샘플에만 플롯하고 L-EB + G/M을 시간 대비 상대 형광 단위(RFU)로 플롯합니다.
참고: 이 선은 미토콘드리아가 없기 때문에 비교적 평평해야 하므로 산소 농도의 변화를 감지해서는 안 됩니다. - L-EB + G/M 샘플 값을 RFU 대 시간으로 플롯합니다.
- 판독값이 더 일관되고 컨트롤에 대해 평평해지는 위치를 결정합니다.
참고: 여기에서 실험 샘플에 대한 데이터 분석이 시작되어야 합니다( 그림 1A에서 화살표로 표시). 반응이 평평해지고 최대치에 도달하는 데 10-15분이 걸릴 수 있습니다. - 3.5단계에서 설정한 시점 이후의 데이터("트리밍된" 데이터라고 함)만 포함하는 새 플롯을 만들고 최적선을 추가하여 분석할 원시 데이터를 시각화합니다.
- 트리밍된 제어 버퍼 전용 데이터(노란색으로 강조 표시됨)의 평균 RFU 값을 계산합니다. 이 값은 아래 산소 계산에서 기준선으로 최소 RFU 값으로 사용됩니다.
- 산소 소비율 계산 (μM O2 / min)
- 3.6단계에서 원시 데이터(즉, 트리밍된 데이터)의 선형 영역을 복사하고 붙여넣어 각 시점 7,8,9,10에서 G/M + ADP 처리에서 미토콘드리아 샘플의 산소 농도를 확인합니다.
- 방정식 (1)5 를 사용하여 각 시점의 산소 농도를 결정합니다. [오우2]a 는 공기 포화 완충액(30°C에서 235mM)의 산소 농도입니다. I(t), Ia 및 Io는 시간 t 에서 샘플 + 프로브의 형광 신호(예: 샘플 + G/M + ADP), 3.7단계에서 계산된 공기 포화 버퍼에서 프로브의 평균 신호 및 탈산소 버퍼의 최대 신호(달성 가능한 최대 신호로 설정)입니다.
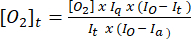 (1)
(1) - 3.8.2단계에서 계산된 [O2]t 값을 시간에 대해 플롯하고 최적선 방정식과 함께 선형 추세선을 추가합니다.
알림: 각 선의 기울기를 산소 소비율로 사용합니다. 모든 샘플에 대한 중복 또는 삼중을 집계하여 소비율 비교에 사용할 수 있습니다.
- ADP가 있는 미토콘드리아 호흡과 없는 미토콘드리아 호흡을 각각 상태 3과 2를 나타내는 것으로 나누어 RCR을 계산합니다.
결과
산소 소비율과 미토콘드리아 RCR은 인광 산소 감지 프로브와 표준 형광 플레이트 리더가 있는 분석 키트를 사용하여 세 가지 도마뱀의 미토콘드리아에서 측정되었습니다. 이전 연구에서는 이 키트의 프로브가 산소 소비와 직접적인 상관관계가 있음을 확인했으며, 여기서 인광은 분자 산소에 의해 소멸되고 미토콘드리아 호흡으로 인해 산소 수치가 감소함에 따라 형광 신...
토론
미토콘드리아 기능 측정은 질병 상태와 비질병 상태, 동일한 동물의 다른 조직 유형 또는 다른 샘플 유형과 같은 다른 샘플을 비교할 때 유용합니다. 우리는 미토콘드리아를 도입한 잡종 나무 도마뱀에 대한 대사 결과가 있다는 가설을 테스트하기 위해 나중의 비교를 사용했습니다. 미토콘드리아 기능을 실험적으로 확인하는 방법에는 Δψ의 정량화, 총 ATP 함량, ATP 생성, ...
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 NSF CHE-1229562(VDGM)과 Elon University의 교수 연구 및 개발 위원회(VDGM 및 GH) 및 학부 연구 프로그램(AJ)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
참고문헌
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유