È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione del consumo di ossigeno mitocondriale utilizzando un saggio fluorescente basato su lettore di piastre
In questo articolo
Erratum Notice
Riepilogo
La valutazione del consumo di ossigeno fornisce informazioni integrali sulla funzione mitocondriale. Utilizzando una sonda fosforescente con un lettore di piastre fluorescenti, è possibile ottenere facilmente dati accurati e riproducibili senza apparecchiature specializzate. Questo test consente a qualsiasi laboratorio di misurare il consumo di ossigeno dei mitocondri isolati e di calcolare i rapporti di controllo respiratorio.
Abstract
I mitocondri svolgono molte funzioni importanti, tra cui la respirazione cellulare, la produzione di ATP, il controllo dell'apoptosi e l'agire come hub centrale delle vie metaboliche. Pertanto, la valutazione sperimentale della funzionalità mitocondriale può fornire informazioni sulle variazioni tra diverse popolazioni o stati patologici. Inoltre, è utile valutare se i mitocondri isolati sono abbastanza sani per procedere con gli esperimenti. Una caratteristica spesso utilizzata per confrontare la funzione mitocondriale in diversi campioni è il tasso di consumo di ossigeno. Il consumo di ossigeno e il successivo calcolo del rapporto di controllo respiratorio in cellule intatte o mitocondri isolati dal tessuto possono servire a tutti e tre gli scopi. Utilizzando mitocondri isolati dal fegato di lucertole a spazzola in combinazione con una sonda fosforescente sensibile alle fluttuazioni della concentrazione di ossigeno di una soluzione, abbiamo misurato il consumo di ossigeno utilizzando un lettore di piastre fluorescenti. Questo metodo non è solo rapido ed efficiente, ma può anche essere condotto con una piccola quantità di mitocondri e senza la necessità di attrezzature specializzate. Il protocollo passo-passo qui descritto aumenta l'accessibilità della valutazione funzionale mitocondriale per i ricercatori.
Introduzione
I mitocondri sono organelli, delle dimensioni approssimativamente di un batterio, che si trovano nelle cellule eucariotiche. Sono organelli unici perché contengono DNA e hanno due membrane, una esterna e una interna. Le membrane esterne e interne dei mitocondri sono separate da uno spazio intermembrana e la membrana interna si ripiega in strutture chiamate cristae attorno al compartimento più interno, chiamato matrice. Queste cristae aumentano la superficie della membrana interna in modo che possano verificarsi contemporaneamente più processi che utilizzano le cristae. Sebbene i mitocondri siano coinvolti in molte funzioni cellulari come il controllo dell'apoptosi e l'alloggiamento di molteplici vie metaboliche, il loro ruolo vitale nella produzione di ATP è essenziale per la sopravvivenza cellulare. Infatti, il 90% dell'energia di una cellula deriva dai mitocondri1. La produzione di ATP comporta la generazione di una differenza elettrochimica tra le membrane esterne e interne, chiamata potenziale di membrana mitocondriale (Δψ), che si verifica quando gli ioni H+ vengono pompati dalla matrice nello spazio intermembrana. La produzione di ATP viene infine sfruttata durante l'ossidazione degli equivalenti riducenti attraverso il movimento degli elettroni attraverso la catena respiratoria mitocondriale (ETC). L'accettore finale di elettroni è l'ossigeno molecolare (O2). Man mano che l'ossigeno viene consumato, il differenziale di concentrazione di H+ raggiunge il suo massimo, a quel punto gli ioni H+ si spostano lungo il loro gradiente di concentrazione dallo spazio intermembrana alla matrice passando attraverso il complesso ATP sintasi. Il movimento degli ioni H+ provoca un cambiamento conformazionale nell'ATP sintasi e l'ADP viene portato in prossimità del fosfato inorganico per reagire e generare ATP. Infine, l'ATP viene traslocato dalla matrice mitocondriale nel citosol e può essere immagazzinato o utilizzato per facilitare le reazioni a causa della grande quantità di energia libera rilasciata durante l'idrolisi dei suoi fosfati. L'intero processo è chiamato fosforilazione ossidativa e, poiché l'ossigeno viene consumato, si dice che i mitocondri respirino2.
L'accumulo e la forza di Δψ, la quantità di O2 ridotta (chiamata consumo di ossigeno), così come la generazione di ATP possono essere utilizzati come indicazioni della salute delle cellule. Gli studi funzionali mitocondriali, come la misurazione di Δψ, il contenuto e la produzione totale di ATP e il consumo di ossigeno, possono essere quantificati con metodi biochimici tradizionali o con fluorescenza e luminescenza in saggi basati su piastra. Ad esempio, il potenziale della membrana mitocondriale può essere confrontato tra diversi campioni utilizzando coloranti fluorescenti come l'estere etilico tetrametilrodamina, che si lega specificamente ai mitocondri. La generazione di ATP può essere monitorata aggiungendo una proteina luminescente a una reazione le cui variazioni sono correlate alla concentrazione di ATP. La quantificazione dei tassi di consumo di ossigeno, o tassi assoluti di respirazione, durante l'OXPHOS, può aiutare a chiarire le cause delle disparità nella funzione mitocondriale e nel metabolismo energetico. La valutazione del consumo di ossigeno può essere utilizzata per calcolare i rapporti di controllo respiratorio (RCR). I valori di RCR descrivono la capacità dei mitocondri di produrre ATP in risposta all'afflusso di ADP, che è la funzione principale dei mitocondri. I valori di RCR indicano la condizione generale dei mitocondri isolati e consentono il confronto delle risposte a diversi trattamenti sperimentali. Le differenze nei valori di RCR possono rappresentare una disfunzione mitocondriale o indicare una differenza biologica tra diversi mitocondri isolati da due o più fonti. Un'altra importante misura della funzione nei mitocondri isolati è l'efficienza mitocondriale definita come moli di ATP sintetizzato per moli di O2, o il rapporto P/O3.
Data la quantità di informazioni che possono essere raccolte dalla misurazione dei parametri mitocondriali e i vari casi in cui queste informazioni possono essere utilizzate, la capacità di raccogliere in modo efficiente dati funzionali può essere utile in molte aree di ricerca diverse. Le misurazioni del consumo di ossigeno mitocondriale sono state eseguite per decenni con strumentazione molto specifica, utilizzando un elettrodo di Clark, che può essere limitato dalla dimensione del campione necessario per eseguire le misurazioni, e, più recentemente, strumenti sofisticati in grado di misurare la respirazione mitocondriale e molti altri parametri, ma possono essere proibitivi in termini di costi. Questo protocollo è un approccio alternativo adattato che utilizza una sonda fosforescente sensibile all'ossigeno (MitoXpress)4,5. Il segnale della sonda viene rilevato con un lettore di piastre in modalità fluorescenza risolta nel tempo per misurazioni continue nel tempo. La fosforescenza ha una differenza di energia maggiore tra il fotone assorbito ed emesso rispetto alla fluorescenza e, pertanto, è più adatta per il monitoraggio continuo dei cambiamenti nel segnale. Ciò consente a quasi tutti i laboratori di eseguire queste misurazioni, non solo a quelli che si concentrano sul metabolismo mitocondriale o che possono permettersi apparecchiature altamente specializzate. Il sistema modello che utilizziamo è costituito da mitocondri isolati da tre lucertole arboricole, due specie parentali e una introgredita (contenente DNA nucleare da una specie parentale e mitocondri dall'altra, ibridi). Queste lucertole sono state scelte perché abbiamo ipotizzato che ci siano conseguenze metaboliche ed energetiche per gli ibridi che hanno diverse fonti di DNA nucleare e mitocondriale. Abbiamo utilizzato un kit di analisi disponibile in commercio con un lettore di piastre multimodale in grado di aumentare l'accesso a questo tipo di test a un maggior numero di ricercatori e campi di ricerca.
Protocollo
Le lucertole sono state soppresse mediante asfissia da CO2 seguita da decapitazione immediata in conformità con le politiche delineate dall'Office of Animal Laboratory Welfare e dalle linee guida del Comitato istituzionale per la cura e l'uso degli animali di Elon.
1. Isolamento dei mitocondri6
NOTA: Mantenere tutte le soluzioni fredde (Tabella 1) e i campioni sul ghiaccio durante questi passaggi.
- Rimuovere il fegato, pesarlo e poi sciacquarlo con ~3 ml di soluzione salina ghiacciata tamponata con fosfato (1x, -/-).
- Tritare il fegato in 1 mL di L-MIB con una lametta fresca.
- Portare il volume totale di tessuto più L-MIB a 2 mL e disgregare meccanicamente le cellule epatiche per quattro passaggi con un omogeneizzatore Dounce.
- Centrifugare l'omogeneizzato a 300 × g (37 °C, 10 min).
- Trasferire il surnatante in un tubo nuovo e metterlo sul ghiaccio.
- Risospendere il pellet in 2 mL di L-MIB, riomogeneizzare e centrifugare nuovamente a 300 × g (37 °C, 10 minuti).
- Unire i surnatanti di entrambe le centrifughe e centrifugare a 10.000 × g (37 °C, 10 min).
- Risospendere il pellet in ~0,350 mL di L-MIB.
- Determinare la quantità di proteine totali (mg di mitocondri/mL di L-MIB) da utilizzare come approssimazione per il contenuto mitocondriale 4,5,6.
2. Consumo di ossigeno
- Preriscaldare tutte le soluzioni utilizzate (Tabella 1) nei passaggi seguenti a 30 °C a bagnomaria.
- Diluire i mitocondri in LEB a 6 mg/mL in base ai risultati del saggio della concentrazione proteica al punto 1.9.
- Impostare il test in una piastra sterile a fondo trasparente a 96 pozzetti con parete nera (Tabella 2).
- Aggiungere 50 μl del campione (tampone L-EB o campione mitocondriale) nei pozzetti appropriati.
- Aggiungere 50 μL di trattamento (L-EB, glutammato/malato o glutammato/malato con ADP).
- Diluire il brodo della sonda 1:10 in L-EB e quindi aggiungere 100 μl della sonda fluorescente a ogni pozzetto.
- Aggiungere delicatamente 50 μl di olio minerale pesante a ogni pozzetto per escludere l'ossigeno ambientale.
- Leggere le misure fluorescenti dal fondo della piastra a 380/650 nm di eccitazione/emissione ogni 1,5 minuti per 45 minuti. Utilizzare la modalità cinetica con un ritardo di 30.000 μs e una finestra di misura di 100 μs.
3. Analisi dei dati
- Esportare il file di dati grezzi dal computer lettore di piastre come file .xls.
- Apri il file, quindi copia e incolla i dati non elaborati in una nuova scheda ed etichetta le righe e le colonne in modo appropriato.
- Tracciare il tampone L-EB solo sul campione di controllo e L-EB + G/M come unità fluorescenti relative (RFU) in funzione del tempo.
NOTA: Queste linee dovrebbero essere relativamente piatte in quanto non sono presenti mitocondri e, pertanto, non dovrebbe essere rilevato alcun cambiamento nella concentrazione di ossigeno. - Traccia i valori del campione L-EB + G/M come RFU in funzione del tempo.
- Determina dove le letture diventano più coerenti e si appiattiscono per i controlli.
NOTA: È qui che dovrebbe iniziare l'analisi dei dati per i campioni sperimentali (contrassegnati da frecce nella Figura 1A). Le reazioni possono richiedere 10-15 minuti per appiattirsi e raggiungere il loro massimo. - Crea un nuovo grafico contenente solo i dati successivi al punto temporale stabilito nel passaggio 3.5 (chiamati dati "tagliati") e aggiungi la linea più adatta per visualizzare i dati grezzi da analizzare.
- Calcolare il valore RFU medio dei dati del solo buffer di controllo trimmato (evidenziato in giallo). Questo valore viene utilizzato come valore RFU minimo come valore di base nel calcolo dell'ossigeno riportato di seguito.
- Calcolo del tasso di consumo di ossigeno (μM Ø2/min)
- Copia e incolla la regione lineare dei dati grezzi del passaggio 3.6 (cioè i dati tagliati) per determinare la concentrazione di ossigeno nei campioni mitocondriali in trattamento G/M + ADP in ogni punto temporale 7,8,9,10.
- Utilizzare l'equazione (1)5 per determinare la concentrazione di ossigeno in ogni punto temporale. [O2]a è la concentrazione di ossigeno nel tampone saturo d'aria (235 mM a 30 °C). I(t), Ia e Io sono rispettivamente il segnale fluorescente del campione + sonda al tempo t (ad esempio, campione + G/M + ADP), il segnale medio della sonda in tampone saturo d'aria calcolato al passo 3.7 e il segnale massimo in tampone deossigenato (impostato al segnale massimo ottenibile).
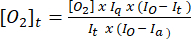 (1)
(1) - Tracciare i valori [O2]t calcolati nel passaggio 3.8.2 rispetto al tempo e aggiungere una linea di tendenza lineare insieme all'equazione della linea più adatta.
NOTA: Utilizzare la pendenza di ciascuna linea come tasso di consumo di ossigeno. I duplicati o i triplicati di qualsiasi campione possono essere aggregati e utilizzati per il confronto del tasso di consumo.
- Calcola l'RCR dividendo la respirazione mitocondriale con e senza ADP, che rappresentano rispettivamente gli stati 3 e 2.
Risultati
Il tasso di consumo di ossigeno e l'RCR mitocondriale sono stati determinati dai mitocondri di tre diverse lucertole utilizzando un kit di analisi con una sonda di rilevamento dell'ossigeno fosforescente e un lettore di piastre a fluorescenza standard. Ricerche precedenti hanno stabilito che la sonda in questo kit è direttamente correlata al consumo di ossigeno, dove la fosforescenza viene attenuata dall'ossigeno molecolare e il segnale fluorescente aumenta al diminuire dei livelli di o...
Discussione
La misurazione della funzione mitocondriale è utile quando si confrontano campioni diversi, come stati di malattia rispetto a stati non patologici, diversi tipi di tessuto dello stesso animale o tra diversi tipi di campioni. Abbiamo usato il confronto successivo per testare la nostra ipotesi che ci sia una conseguenza metabolica per le lucertole arboricole ibride che hanno introgredito i mitocondri. Esistono diversi modi per accertare sperimentalmente la funzione dei mitocondri, tra cui...
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questa ricerca è stata finanziata da NSF CHE-1229562 (VDGM) e sovvenzioni dal Comitato di ricerca e sviluppo della facoltà di Elon University (VDGM e GH) e dal Programma di ricerca universitaria (AJ).
Materiali
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
Riferimenti
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon