Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Evaluación del consumo de oxígeno mitocondrial mediante un ensayo fluorescente basado en un lector de placas
En este artículo
Erratum Notice
Resumen
La evaluación del consumo de oxígeno proporciona información integral sobre la función mitocondrial. Utilizando una sonda fosforescente con un lector de placas fluorescentes, se pueden obtener fácilmente datos precisos y reproducibles sin necesidad de un equipo especializado. Este ensayo permite a cualquier laboratorio medir el consumo de oxígeno de las mitocondrias aisladas y calcular las proporciones de control respiratorio.
Resumen
Las mitocondrias cumplen muchas funciones importantes, como la respiración celular, la producción de ATP, el control de la apoptosis y la actuación como eje central de las vías metabólicas. Por lo tanto, la evaluación experimental de la funcionalidad mitocondrial puede proporcionar información sobre las variaciones entre diferentes poblaciones o estados de enfermedad. Además, es valioso evaluar si las mitocondrias aisladas son lo suficientemente saludables como para proceder con los experimentos. Una característica que se utiliza a menudo para comparar la función mitocondrial en diferentes muestras es la tasa de consumo de oxígeno. El consumo de oxígeno y el cálculo posterior de la tasa de control respiratorio en células intactas o mitocondrias aisladas de tejido pueden servir para los tres propósitos. Usando mitocondrias aisladas de los hígados de lagartijas de cepillo junto con una sonda fosforescente que es sensible a las fluctuaciones en la concentración de oxígeno de una solución, medimos el consumo de oxígeno utilizando un lector de placas fluorescentes. Este método no solo es rápido y eficiente, sino que también se puede realizar con una pequeña cantidad de mitocondrias y sin la necesidad de equipos especializados. El protocolo paso a paso descrito aquí aumenta la accesibilidad de la evaluación funcional mitocondrial para los investigadores.
Introducción
Las mitocondrias son orgánulos, aproximadamente del tamaño de una bacteria, que se encuentran en las células eucariotas. Son orgánulos únicos porque contienen ADN y tienen dos membranas, una externa y otra interna. Las membranas externa e interna de las mitocondrias están separadas por un espacio intermembrana, y la membrana interna se pliega en estructuras llamadas crestas alrededor del compartimento más interno, llamado matriz. Estas crestas aumentan el área de superficie de la membrana interna para que múltiples procesos que utilizan las crestas puedan ocurrir simultáneamente. Si bien las mitocondrias están involucradas en muchas funciones celulares, como el control de la apoptosis y el alojamiento de múltiples vías metabólicas, su papel vital en la producción de ATP es esencial para la supervivencia celular. De hecho, el 90% de la energía de una célula se deriva de las mitocondrias1. La producción de ATP implica la generación de una diferencia electroquímica entre las membranas externa e interna, denominada potencial de membrana mitocondrial (Δψ), que surge cuando los iones H+ se bombean desde la matriz al espacio intermembrana. La producción de ATP se aprovecha en última instancia durante la oxidación de los equivalentes reductores a través del movimiento de electrones a través de la cadena respiratoria mitocondrial (ETC). El aceptor final de electrones es el oxígeno molecular (O2). A medida que se consume oxígeno, el diferencial de concentración de H+ se acumula hasta su máximo, momento en el que los iones H+ bajan por su gradiente de concentración desde el espacio intermembrana hasta la matriz pasando a través del complejo ATP sintasa. El movimiento de los iones H+ provoca un cambio conformacional en la ATP sintasa, y el ADP se acerca al fosfato inorgánico para reaccionar y generar ATP. Finalmente, el ATP se transloca de la matriz mitocondrial al citosol y puede almacenarse o usarse para facilitar las reacciones debido a la gran cantidad de energía libre liberada durante la hidrólisis de sus fosfatos. Todo este proceso se denomina fosforilación oxidativa, y dado que se consume oxígeno, se dice que las mitocondriasrespiran.
La acumulación y la fuerza de Δψ, la cantidad de O2 reducida (denominada consumo de oxígeno), así como la generación de ATP pueden utilizarse como indicadores de la salud celular. Los estudios funcionales mitocondriales, como la medición de Δψ, el contenido y la producción total de ATP y el consumo de oxígeno, se pueden cuantificar mediante métodos bioquímicos tradicionales o fluorescencia y luminiscencia en ensayos basados en placas. Por ejemplo, el potencial de membrana mitocondrial se puede comparar entre diferentes muestras utilizando colorantes fluorescentes como el éster etílico de tetrametilrodamina, que se une específicamente a las mitocondrias. La generación de ATP se puede monitorear agregando una proteína luminiscente a una reacción cuyos cambios se correlacionan con la concentración de ATP. La cuantificación de las tasas de consumo de oxígeno, o tasas absolutas de respiración, durante OXPHOS, puede ayudar a dilucidar las causas de las disparidades en la función mitocondrial y el metabolismo energético. La evaluación del consumo de oxígeno se puede utilizar para calcular las tasas de control respiratorio (RCR). Los valores de RCR describen la capacidad de las mitocondrias para producir ATP en respuesta a la afluencia de ADP, que es la función principal de las mitocondrias. Los valores de RCR indican la condición general de las mitocondrias aisladas y permiten la comparación de las respuestas a diferentes tratamientos experimentales. Las diferencias en los valores de RCR pueden representar una disfunción mitocondrial o indicar una diferencia biológica entre diferentes mitocondrias aisladas de dos o más fuentes. Otra medida importante de la función en las mitocondrias aisladas es la eficiencia mitocondrial definida como moles de ATP sintetizados por moles deO2, o la relación P/O3.
Dada la cantidad de información que se puede recopilar a partir de la medición de los parámetros mitocondriales y los diversos casos en los que se puede utilizar esta información, la capacidad de recopilar datos funcionales de manera eficiente puede ser útil en muchas áreas de investigación diferentes. Las mediciones del consumo de oxígeno mitocondrial se han realizado durante décadas con instrumentación muy específica, utilizando un electrodo Clark, que puede estar limitado por el tamaño de la muestra necesaria para llevar a cabo las mediciones, y más recientemente, instrumentos sofisticados que pueden medir la respiración mitocondrial y muchos otros parámetros, pero pueden tener un costo prohibitivo. Este protocolo es un enfoque alternativo adaptado que utiliza una sonda fosforescente sensible al oxígeno (MitoXpress)4,5. La señal de la sonda se detecta con un lector de placas en modo de fluorescencia resuelta en el tiempo para mediciones continuas a lo largo del tiempo. La fosforescencia tiene una mayor diferencia de energía entre el fotón absorbido y el fotón emitido en comparación con la fluorescencia y, por lo tanto, es más adecuada para monitorear continuamente los cambios en la señal. Esto permite que casi cualquier laboratorio realice estas mediciones, no solo aquellos que se centran en el metabolismo mitocondrial o que pueden permitirse equipos altamente especializados. El sistema modelo que utilizamos es mitocondrias aisladas de tres lagartos arborícolas, dos especies parentales y una introgredida (que contiene ADN nuclear de una especie parental y mitocondrias de la otra, híbridos). Estos lagartos fueron elegidos porque planteamos la hipótesis de que hay consecuencias metabólicas y energéticas para los híbridos que tienen diferentes fuentes de ADN nuclear y mitocondrial. Utilizamos un kit de ensayo disponible comercialmente con un lector de placas multimodo que puede aumentar el acceso a este tipo de ensayo a más investigadores y campos de investigación.
Protocolo
Los lagartos fueron sacrificados por asfixia con CO2 seguida de decapitación inmediata de acuerdo con las políticas descritas por la Oficina de Bienestar de Laboratorio Animal y las pautas del Comité Institucional de Cuidado y Uso de Animales de Elon.
1. Aislamiento de mitocondrias6
NOTA: Mantenga todas las soluciones frías (Tabla 1) y las muestras en hielo durante estos pasos.
- Retire el hígado, péselo y luego enjuáguelo con ~ 3 mL de solución salina tamponada con fosfato helada (1x, -/-).
- Pica el hígado en 1 mL de L-MIB con una cuchilla de afeitar nueva.
- Lleve el volumen total de tejido más L-MIB a 2 mL y altere mecánicamente las células hepáticas durante cuatro pasadas con un homogeneizador Dounce.
- Centrifugar el homogeneizado a 300 × g (37 °C, 10 min).
- Transfiera el sobrenadante a un tubo nuevo y colóquelo sobre hielo.
- Vuelva a suspender el pellet en 2 mL de L-MIB, vuelva a homogeneizar y vuelva a centrifugar a 300 × g (37 °C, 10 minutos).
- Combine los sobrenadantes de ambos centrifugados y centrifugue a 10.000 × g (37 °C, 10 min).
- Vuelva a suspender el pellet en ~0.350 mL de L-MIB.
- Determine la cantidad de proteína total (mg de mitocondrias/mL de L-MIB) para usar como aproximación del contenido mitocondrial 4,5,6.
2. Consumo de oxígeno
- Precalentar todas las soluciones utilizadas (Tabla 1) en los siguientes pasos a 30 °C en un baño de agua.
- Diluya las mitocondrias en LEB a 6 mg/mL según los resultados del ensayo de concentración de proteínas en el paso 1.9.
- Coloque el ensayo en una placa inferior transparente estéril de pared negra de 96 pocillos (Tabla 2).
- Añada 50 μL de la muestra (tampón L-EB o muestra de mitocondrias) a los pocillos adecuados.
- Añadir 50 μL de tratamiento (L-EB, glutamato/malato o glutamato/malato con ADP).
- Diluya el material de la sonda 1:10 en L-EB y luego agregue 100 μL de la sonda fluorescente a cada pocillo.
- Agregue suavemente 50 μL de aceite mineral pesado a cada pocillo para excluir el oxígeno ambiental.
- Lea las mediciones fluorescentes desde la parte inferior de la placa a 380/650 nm de excitación/emisión cada 1,5 minutos durante 45 minutos. Utilice el modo cinético con un retardo de tiempo de 30.000 μs y una ventana de medición de 100 μs.
3. Análisis de datos
- Exporte el archivo de datos sin procesar desde el equipo lector de placas como un archivo .xls.
- Abra el archivo, copie y pegue los datos sin procesar en una nueva pestaña y etiquete las filas y columnas correctamente.
- Represente el tampón L-EB solo en la muestra de control y L-EB + G/M como unidades fluorescentes relativas (RFU) en función del tiempo.
NOTA: Estas líneas deben ser relativamente planas ya que no hay mitocondrias presentes y, por lo tanto, no se debe detectar ningún cambio en la concentración de oxígeno. - Represente los valores de muestra L-EB + G/M como RFU en función del tiempo.
- Determine dónde las lecturas se vuelven más consistentes y se aplanan para los controles.
NOTA: Aquí es donde debe comenzar el análisis de datos para muestras experimentales (marcado con flechas en la Figura 1A). Las reacciones pueden tardar entre 10 y 15 minutos en aplanarse y alcanzar su máximo. - Realice una nueva gráfica que contenga solo los datos después del punto de tiempo establecido en el paso 3.5 (llamados datos "recortados") y agregue la línea de mejor ajuste para visualizar los datos brutos a analizar.
- Calcule el valor promedio de RFU de los datos de solo búfer de control recortados (resaltados en amarillo). Este valor se utiliza como el valor mínimo de RFU como referencia en el cálculo de oxígeno que se muestra a continuación.
- Cálculo de la tasa de consumo de oxígeno (μM O2/min)
- Copie y pegue la región lineal de los datos sin procesar del paso 3.6 (es decir, los datos recortados) para determinar la concentración de oxígeno en las muestras mitocondriales en el tratamiento G/M + ADP en cada puntode tiempo 7,8,9,10.
- Utilice la ecuación (1)5 para determinar la concentración de oxígeno en cada punto de tiempo. [O2]a es la concentración de oxígeno en el tampón saturado de aire (235 mM a 30 °C). I(t), Ia e Io son la señal fluorescente de la muestra + sonda en el tiempo t (por ejemplo, muestra + G/M + ADP), la señal media de la sonda en tampón saturado de aire calculada en el paso 3.7 y la señal máxima en tampón desoxigenado (establecida en la señal máxima alcanzable), respectivamente.
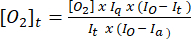 (1)
(1) - Trace los valores [O2]t calculados en el paso 3.8.2 en función del tiempo y agregue una línea de tendencia lineal junto con la ecuación de la línea de mejor ajuste.
NOTA: Utilice la pendiente de cada línea como la tasa de consumo de oxígeno. Los duplicados o triplicados de cualquier muestra pueden agregarse y utilizarse para la comparación de la tasa de consumo.
- Calcule el RCR dividiendo la respiración mitocondrial con y sin ADP, que representan los estados 3 y 2, respectivamente.
Resultados
La tasa de consumo de oxígeno y el RCR mitocondrial se determinaron a partir de las mitocondrias de tres lagartos diferentes utilizando un kit de ensayo con una sonda de detección de oxígeno fosforescente y un lector de placa de fluorescencia estándar. Investigaciones previas establecieron que la sonda de este kit se correlaciona directamente con el consumo de oxígeno, donde la fosforescencia es apagada por el oxígeno molecular y la señal fluorescente aumenta a medida que disminuy...
Discusión
La medición de la función mitocondrial es útil cuando se comparan diferentes muestras, como estados de enfermedad frente a estados no patológicos, diferentes tipos de tejido del mismo animal o entre diferentes tipos de muestras. Utilizamos la comparación posterior para probar nuestra hipótesis de que hay una consecuencia metabólica en los lagartos arborícolas híbridos que tienen mitocondrias introgredidas. Hay una variedad de formas de determinar experimentalmente la función de...
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Esta investigación fue financiada por NSF CHE-1229562 (VDGM) y subvenciones del Comité de Investigación y Desarrollo de la Facultad de la Universidad de Elon (VDGM y GH) y el Programa de Investigación de Pregrado (AJ).
Materiales
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
Referencias
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados