Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung des mitochondrialen Sauerstoffverbrauchs mit einem Platten-Reader-basierten Fluoreszenz-Assay
In diesem Artikel
Erratum Notice
Zusammenfassung
Die Bewertung des Sauerstoffverbrauchs liefert integrale Informationen über die Mitochondrienfunktion. Durch die Verwendung einer Phosphoreszenzsonde mit einem Fluoreszenzplatten-Lesegerät können genaue und reproduzierbare Daten ohne spezielle Ausrüstung erhalten werden. Dieser Assay ermöglicht es jedem Labor, den Sauerstoffverbrauch isolierter Mitochondrien zu messen und die Atemkontrollverhältnisse zu berechnen.
Zusammenfassung
Mitochondrien erfüllen viele wichtige Funktionen, darunter die Zellatmung, die ATP-Produktion, die Kontrolle der Apoptose und die Funktion als zentraler Knotenpunkt der Stoffwechselwege. Daher kann die experimentelle Bewertung der mitochondrialen Funktionalität Aufschluss über Variationen zwischen verschiedenen Populationen oder Krankheitszuständen geben. Darüber hinaus ist es wertvoll zu beurteilen, ob isolierte Mitochondrien gesund genug sind, um mit Experimenten fortzufahren. Ein Merkmal, das häufig zum Vergleich der mitochondrialen Funktion in verschiedenen Proben herangezogen wird, ist die Rate des Sauerstoffverbrauchs. Der Sauerstoffverbrauch und die anschließende Berechnung des respiratorischen Kontrollverhältnisses in intakten Zellen oder aus Gewebe isolierten Mitochondrien können allen drei Zwecken dienen. Mit Mitochondrien, die aus der Leber von Pinselechsen isoliert wurden, in Verbindung mit einer phosphoreszierenden Sonde, die empfindlich auf die Schwankungen der Sauerstoffkonzentration einer Lösung reagiert, maßen wir den Sauerstoffverbrauch mit einem Fluoreszenzplatten-Reader. Diese Methode ist nicht nur schnell und effizient, sondern kann auch mit einer kleinen Menge an Mitochondrien und ohne spezielle Ausrüstung durchgeführt werden. Das hier beschriebene Schritt-für-Schritt-Protokoll erhöht die Zugänglichkeit der mitochondrialen Funktionsbewertung für Forscher.
Einleitung
Mitochondrien sind Organellen, etwa so groß wie Bakterien, die in eukaryotischen Zellen vorkommen. Sie sind einzigartige Organellen, da sie DNA enthalten und zwei Membranen haben, eine äußere und eine innere. Die äußere und die innere Membran der Mitochondrien sind durch einen Intermembranraum getrennt, und die innere Membran faltet sich um das innerste Kompartiment, die Matrix, zu Strukturen, die Cristae, genannt werden. Diese Crista vergrößern die Oberfläche der inneren Membran, so dass mehrere Prozesse, bei denen die Crista verwendet werden, gleichzeitig ablaufen können. Während Mitochondrien an vielen zellulären Funktionen beteiligt sind, wie z. B. der Kontrolle der Apoptose und der Beherbergung mehrerer Stoffwechselwege, ist ihre wichtige Rolle bei der Produktion von ATP für das Überleben der Zellen unerlässlich. Tatsächlich werden 90 % der Energie einer Zelle aus den Mitochondriengewonnen 1. Bei der ATP-Produktion entsteht eine elektrochemische Differenz zwischen der äußeren und der inneren Membran, die als mitochondriales Membranpotential (Δψ) bezeichnet wird und entsteht, wenn H+ -Ionen aus der Matrix in den Intermembranraum gepumpt werden. Die ATP-Produktion wird schließlich während der Oxidation von reduzierenden Äquivalenten durch Elektronenbewegung durch die mitochondriale Atmungskette (ETC) nutzbar gemacht. Der endgültige Elektronenakzeptor ist molekularer Sauerstoff (O2). Wenn Sauerstoff verbraucht wird, baut sich die H+ -Konzentrationsdifferenz bis zu ihrem Maximum auf, woraufhin sich H+ -Ionen in ihrem Konzentrationsgradienten vom Intermembranraum zur Matrix bewegen, indem sie den ATP-Synthase-Komplex passieren. Die Bewegung von H+- Ionen bewirkt eine Konformationsänderung der ATP-Synthase, und ADP wird in die Nähe von anorganischem Phosphat gebracht, um zu reagieren und ATP zu erzeugen. Schließlich wird ATP aus der mitochondrialen Matrix in das Zytosol transloziert und kann aufgrund der großen Menge an freier Energie, die bei der Hydrolyse seiner Phosphate freigesetzt wird, entweder gespeichert oder zur Erleichterung von Reaktionen verwendet werden. Dieser ganze Prozess wird als oxidative Phosphorylierung bezeichnet, und da Sauerstoff verbraucht wird, soll man sagen, dass die Mitochondrienatmen 2.
Der Aufbau und die Stärke von Δψ, die reduzierte Menge an O2 (sogenannter Sauerstoffverbrauch) sowie die Bildung von ATP können als Hinweise auf die Zellgesundheit verwendet werden. Mitochondriale funktionelle Studien, wie z. B. die Messung von Δψ, des Gesamt-ATP-Gehalts und der Produktion sowie des Sauerstoffverbrauchs, können entweder durch traditionelle biochemische Methoden oder durch Fluoreszenz und Lumineszenz in plattenbasierten Assays quantifiziert werden. Zum Beispiel kann das mitochondriale Membranpotential zwischen verschiedenen Proben mit Fluoreszenzfarbstoffen wie Tetramethylrhodaminethylester verglichen werden, der spezifisch an Mitochondrien bindet. Die ATP-Erzeugung kann überwacht werden, indem einer Reaktion, deren Änderungen mit der ATP-Konzentration korrelieren, ein lumineszierendes Protein hinzugefügt wird. Die Quantifizierung der Sauerstoffverbrauchsraten oder absoluten Atmungsraten während der OXPHOS kann helfen, die Ursachen für Ungleichheiten in der mitochondrialen Funktion und im Energiestoffwechsel aufzuklären. Die Bewertung des Sauerstoffverbrauchs kann zur Berechnung der Atemkontrollverhältnisse (RCRs) verwendet werden. RCR-Werte beschreiben die Fähigkeit der Mitochondrien, ATP als Reaktion auf den Einstrom von ADP zu bilden, was die Hauptfunktion der Mitochondrien ist. RCR-Werte geben Aufschluss über den Gesamtzustand isolierter Mitochondrien und ermöglichen den Vergleich des Ansprechens auf verschiedene experimentelle Behandlungen. Unterschiede in den RCR-Werten können eine mitochondriale Dysfunktion darstellen oder auf einen biologischen Unterschied zwischen verschiedenen Mitochondrien hinweisen, die aus zwei oder mehr Quellen isoliert wurden. Ein weiteres wichtiges Maß für die Funktion in isolierten Mitochondrien ist die mitochondriale Effizienz, definiert als Mol ATP, die pro Mol O2 synthetisiert werden, oder das P/O-Verhältnis3.
Angesichts der Menge an Informationen, die durch die Messung mitochondrialer Parameter gesammelt werden können, und der verschiedenen Fälle, in denen diese Informationen genutzt werden können, kann die Fähigkeit, funktionelle Daten effizient zu sammeln, in vielen verschiedenen Forschungsbereichen nützlich sein. Messungen des mitochondrialen Sauerstoffverbrauchs werden seit Jahrzehnten mit sehr spezifischen Instrumenten durchgeführt – mit einer Clark-Elektrode, die durch die für die Durchführung von Messungen erforderliche Probengröße begrenzt werden kann, und in jüngerer Zeit mit hochentwickelten Instrumenten, die die mitochondriale Atmung und mehrere andere Parameter messen können, aber unerschwinglich sein können. Dieses Protokoll ist ein angepasster alternativer Ansatz unter Verwendung einer sauerstoffempfindlichen Phosphoreszenzsonde (MitoXpress)4,5. Das Sondensignal wird mit einem Plattenleser im zeitaufgelösten Fluoreszenzmodus für kontinuierliche Messungen über die Zeit detektiert. Die Phosphoreszenz hat im Vergleich zur Fluoreszenz eine größere Energiedifferenz zwischen dem absorbierten und dem emittierten Photon und eignet sich daher besser für die kontinuierliche Überwachung von Signaländerungen. Dies ermöglicht es fast jedem Labor, diese Messungen durchzuführen, nicht nur diejenigen, die sich auf den mitochondrialen Stoffwechsel konzentrieren oder sich hochspezialisierte Geräte leisten können. Das Modellsystem, das wir verwenden, besteht aus isolierten Mitochondrien von drei Baumeidechsen, zwei Elternarten und einer introgressiven Art (mit Kern-DNA von einer Elternart und Mitochondrien von der anderen – Hybriden). Diese Eidechsen wurden ausgewählt, weil wir die Hypothese aufstellten, dass es metabolische und energetische Konsequenzen für Hybride mit unterschiedlichen nuklearen und mitochondrialen DNA-Quellen gibt. Wir haben ein kommerziell erhältliches Assay-Kit mit einem Multi-Mode-Platten-Reader verwendet, der den Zugang zu dieser Art von Assay für mehr Forscher und Forschungsbereiche verbessern kann.
Protokoll
Die Eidechsen wurden durch CO2 -Erstickung eingeschläfert, gefolgt von einer sofortigen Enthauptung in Übereinstimmung mit den Richtlinien des Office of Animal Laboratory Welfare und den Richtlinien des Institutional Animal Care and Use Committee von Elon.
1. Isolierung der Mitochondrien6
HINWEIS: Halten Sie alle Lösungen (Tabelle 1) und die Proben während dieser Schritte auf Eis.
- Nehmen Sie die Leber, wiegen Sie sie und spülen Sie sie dann mit ~3 mL eiskalter, phosphatgepufferter Kochsalzlösung (1x, -/-) aus.
- Zerkleinern Sie die Leber in 1 mL L-MIB mit einer frischen Rasierklinge.
- Bringen Sie das Gesamtvolumen des Gewebes plus L-MIB auf 2 ml und unterbrechen Sie die Leberzellen mechanisch für vier Durchgänge mit einem Dounce Homogenisator.
- Das Homogenat bei 300 × g (37 °C, 10 min) schleudern.
- Den Überstand in eine frische Tube umfüllen und auf Eis legen.
- Das Pellet in 2 mL L-MIB resuspendieren, rehomogenisieren und erneut bei 300 × g (37 °C, 10 Minuten) schleudern.
- Kombinieren Sie die Überstände aus beiden Schleudern und zentrifugieren Sie bei 10.000 × g (37 °C, 10 min).
- Resuspendieren Sie das Pellet in ~0,350 mL L-MIB.
- Bestimmen Sie die Gesamtproteinmenge (mg Mitochondrien/ml L-MIB), die als Näherung für den mitochondrialen Gehalt verwendet werdensoll 4,5,6.
2. Sauerstoffverbrauch
- Alle verwendeten Lösungen (Tabelle 1) werden in den folgenden Schritten im Wasserbad auf 30 °C erwärmt.
- Verdünnen Sie die Mitochondrien in LEB auf 6 mg/ml, basierend auf den Ergebnissen des Proteinkonzentrationsassays in Schritt 1.9.
- Richten Sie den Assay in einer sterilen, schwarzwandigen, durchsichtigen 96-Well-Bodenplatte ein (Tabelle 2).
- Geben Sie 50 μl der Probe (L-EB-Puffer oder Mitochondrienprobe) in die entsprechenden Vertiefungen.
- Fügen Sie 50 μl Behandlung hinzu (L-EB, Glutamat/Malat oder Glutamat/Malat mit ADP).
- Verdünnen Sie das Sondenmaterial 1:10 in L-EB und geben Sie dann 100 μl der Fluoreszenzsonde in jede Vertiefung.
- Geben Sie vorsichtig 50 μl Schweröl in jede Vertiefung, um Fremdsauerstoff auszuschließen.
- Lesen Sie Fluoreszenzmessungen von der Unterseite der Platte bei 380/650 nm Anregung/Emission alle 1,5 min für 45 min. Verwenden Sie den kinetischen Modus mit einer Zeitverzögerung von 30.000 μs und einem Messfenster von 100 μs.
3. Datenanalyse
- Exportieren Sie die Rohdatendatei vom Plattenlesegerät als .xls Datei.
- Öffnen Sie die Datei, kopieren Sie die Rohdaten, fügen Sie sie in eine neue Registerkarte ein, und beschriften Sie die Zeilen und Spalten entsprechend.
- Plotten Sie den L-EB-Puffer nur auf die Kontrollprobe und L-EB + G/M als relative Fluoreszenzeinheiten (RFU) über die Zeit.
HINWEIS: Diese Linien sollten relativ flach sein, da keine Mitochondrien vorhanden sind und daher keine Änderung der Sauerstoffkonzentration festgestellt werden sollte. - Plotten Sie die Abtastwerte L-EB + G/M als RFU über die Zeit.
- Bestimmen Sie, wo die Messwerte konsistenter werden und für die Kontrollen abflachen.
HINWEIS: Hier sollte die Datenanalyse für experimentelle Proben beginnen (markiert durch Pfeile in Abbildung 1A). Es kann 10-15 Minuten dauern, bis die Reaktionen abflachen und ihr Maximum erreichen. - Erstellen Sie einen neuen Plot, der nur die Daten nach dem in Schritt 3.5 festgelegten Zeitpunkt enthält (sogenannte "getrimmte" Daten) und fügen Sie die am besten angepasste Linie hinzu, um die zu analysierenden Rohdaten zu visualisieren.
- Berechnen Sie den durchschnittlichen RFU-Wert der getrimmten Nur-Puffer-Daten der Steuerung (gelb hervorgehoben). Dieser Wert wird als minimaler RFU-Wert als Ausgangswert in der folgenden Sauerstoffberechnung verwendet.
- Berechnung des Sauerstoffverbrauchs (μMØ 2/min)
- Kopieren Sie den linearen Bereich der Rohdaten aus Schritt 3.6 (d. h. die getrimmten Daten) und fügen Sie ihn ein, um die Sauerstoffkonzentration in den mitochondrialen Proben bei der G/M + ADP-Behandlung zu jedem Zeitpunkt 7,8,9,10 zu bestimmen.
- Verwenden Sie Gleichung (1)5 , um die Sauerstoffkonzentration zu jedem Zeitpunkt zu bestimmen. [O2]a ist die Sauerstoffkonzentration in luftgesättigtem Puffer (235 mM bei 30 °C). I(t), Ia und Io sind das Fluoreszenzsignal der Probe + Sonde zum Zeitpunkt t (z. B. Probe + G/M + ADP), das in Schritt 3.7 berechnete durchschnittliche Signal der Sonde in luftgesättigtem Puffer bzw. das maximale Signal in sauerstoffarmem Puffer (eingestellt auf das maximal erreichbare Signal).
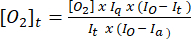 (1)
(1) - Zeichnen Sie die in Schritt 3.8.2 berechneten [O2]t-Werte in Abhängigkeit von der Zeit und fügen Sie eine lineare Trendlinie zusammen mit der Gleichung der am besten angepassten Linie hinzu.
HINWEIS: Verwenden Sie die Steigung jeder Linie als Sauerstoffverbrauchsrate. Duplikate oder Triplikate für jede Stichprobe können aggregiert und für den Vergleich der Verbrauchsrate verwendet werden.
- Berechnen Sie die RCR, indem Sie die mitochondriale Atmung mit und ohne ADP dividieren, die die Zustände 3 bzw. 2 darstellen.
Ergebnisse
Die Sauerstoffverbrauchsrate und die mitochondriale RCR wurden aus den Mitochondrien von drei verschiedenen Eidechsen unter Verwendung eines Assay-Kits mit einer phosphoreszierenden Sauerstoffsensorsonde und einem Standard-Fluoreszenzplatten-Reader bestimmt. Frühere Forschungen haben gezeigt, dass die Sonde in diesem Kit direkt mit dem Sauerstoffverbrauch korreliert, wobei die Phosphoreszenz durch molekularen Sauerstoff gelöscht wird und das Fluoreszenzsignal zunimmt, wenn der Sauersto...
Diskussion
Die Messung der mitochondrialen Funktion ist nützlich beim Vergleich verschiedener Proben, z. B. Krankheits- und Nicht-Krankheitszustände, verschiedener Gewebetypen desselben Tieres oder zwischen verschiedenen Probentypen. Den späteren Vergleich nutzten wir, um unsere Hypothese zu testen, dass hybride Baumeidechsen, die Mitochondrien introgressiert haben, eine metabolische Konsequenz haben. Es gibt eine Vielzahl von Möglichkeiten, die Funktion der Mitochondrien experimentell zu besti...
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Diese Forschung wurde vom NSF CHE-1229562 (VDGM) und Zuschüssen des Faculty Research and Development Committee (VDGM und GH) der Elon University und des Undergraduate Research Program (AJ) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
Referenzen
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten