Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation de la consommation d’oxygène mitochondriale à l’aide d’un test fluorescent basé sur un lecteur de plaque
Dans cet article
Erratum Notice
Résumé
L’évaluation de la consommation d’oxygène fournit des informations intégrales sur la fonction mitochondriale. À l’aide d’une sonde phosphorescente équipée d’un lecteur de plaques fluorescentes, il est possible d’obtenir facilement des données précises et reproductibles sans équipement spécialisé. Ce test permet à n’importe quel laboratoire de mesurer la consommation d’oxygène de mitochondries isolées et de calculer les rapports de contrôle respiratoire.
Résumé
Les mitochondries remplissent de nombreuses fonctions importantes, notamment la respiration cellulaire, la production d’ATP, le contrôle de l’apoptose et le rôle de plaque tournante des voies métaboliques. Par conséquent, l’évaluation expérimentale de la fonctionnalité mitochondriale peut donner un aperçu des variations entre différentes populations ou états pathologiques. De plus, il est utile d’évaluer si les mitochondries isolées sont suffisamment saines pour procéder à des expériences. Une caractéristique souvent utilisée pour comparer la fonction mitochondriale dans différents échantillons est le taux de consommation d’oxygène. La consommation d’oxygène et le calcul ultérieur du rapport de contrôle respiratoire dans des cellules intactes ou des mitochondries isolées des tissus peuvent servir à ces trois fins. En utilisant des mitochondries isolées du foie de lézards des broussailles en conjonction avec une sonde phosphorescente sensible aux fluctuations de la concentration en oxygène d’une solution, nous avons mesuré la consommation d’oxygène à l’aide d’un lecteur de plaques fluorescentes. Cette méthode est non seulement rapide et efficace, mais peut également être menée avec une petite quantité de mitochondries et sans avoir besoin d’équipement spécialisé. Le protocole étape par étape décrit ici augmente l’accessibilité de l’évaluation fonctionnelle mitochondriale pour les chercheurs.
Introduction
Les mitochondries sont des organites, de la taille d’une bactérie, que l’on trouve dans les cellules eucaryotes. Ce sont des organites uniques car ils contiennent de l’ADN et ont deux membranes, une externe et une intérieure. Les membranes externe et interne des mitochondries sont séparées par un espace intermembranaire, et la membrane interne se replie en structures appelées crêtes autour du compartiment le plus interne, appelé matrice. Ces crêtes augmentent la surface de la membrane interne, de sorte que plusieurs processus qui utilisent les crêtes peuvent se produire simultanément. Bien que les mitochondries soient impliquées dans de nombreuses fonctions cellulaires telles que le contrôle de l’apoptose et l’hébergement de plusieurs voies métaboliques, leur rôle vital dans la production d’ATP est essentiel à la survie cellulaire. En fait, 90 % de l’énergie d’une cellule provient des mitochondries1. La production d’ATP implique la génération d’une différence électrochimique entre les membranes externe et interne, appelée potentiel de membrane mitochondriale (Δψ), qui se produit lorsque les ions H+ sont pompés de la matrice dans l’espace intermembranaire. La production d’ATP est finalement exploitée lors de l’oxydation des équivalents réducteurs via le mouvement des électrons à travers la chaîne respiratoire mitochondriale (CTE). L’accepteur final d’électrons est l’oxygène moléculaire (O2). Au fur et à mesure que l’oxygène est consommé, le différentiel de concentration H+ s’accumule jusqu’à son maximum, auquel cas les ions H+ descendent leur gradient de concentration de l’espace intermembranaire vers la matrice en passant à travers le complexe ATP synthase. Le mouvement des ions H+ provoque un changement de conformation de l’ATP synthase, et l’ADP est rapproché du phosphate inorganique pour réagir et générer de l’ATP. Enfin, l’ATP est transloqué hors de la matrice mitochondriale dans le cytosol et peut être stocké ou utilisé pour faciliter les réactions en raison de la grande quantité d’énergie libre libérée lors de l’hydrolyse de ses phosphates. L’ensemble de ce processus est appelé phosphorylation oxydative, et comme l’oxygène est consommé, on dit que les mitochondries respirent2.
L’accumulation et la force de Δψ, la quantité d’O2 réduite (appelée consommation d’oxygène), ainsi que la génération d’ATP peuvent toutes être utilisées comme indications de la santé cellulaire. Les études fonctionnelles mitochondriales, telles que la mesure de Δψ, la teneur et la production totales d’ATP et la consommation d’oxygène, peuvent être quantifiées soit par des méthodes biochimiques traditionnelles, soit par fluorescence et luminescence dans des tests sur plaque. Par exemple, le potentiel de la membrane mitochondriale peut être comparé entre différents échantillons à l’aide de colorants fluorescents tels que l’ester éthylique de tétraméthylrhodamine, qui se lie spécifiquement aux mitochondries. La génération d’ATP peut être surveillée en ajoutant une protéine luminescente à une réaction dont les modifications sont corrélées à la concentration d’ATP. La quantification des taux de consommation d’oxygène, ou taux absolus de respiration, pendant l’OXPHOS, peut aider à élucider les causes des disparités dans la fonction mitochondriale et le métabolisme énergétique. L’évaluation de la consommation d’oxygène peut être utilisée pour calculer les rapports de contrôle respiratoire (RCR). Les valeurs RCR décrivent la capacité des mitochondries à produire de l’ATP en réponse à l’afflux d’ADP, qui est la fonction principale des mitochondries. Les valeurs RCR signifient l’état général des mitochondries isolées et permettent de comparer les réponses à différents traitements expérimentaux. Les différences dans les valeurs RCR peuvent représenter un dysfonctionnement mitochondrial ou indiquer une différence biologique entre différentes mitochondries isolées de deux sources ou plus. Une autre mesure importante de la fonction dans les mitochondries isolées est l’efficacité mitochondriale définie comme les moles d’ATP synthétisées par mole de O2, ou le rapport P/O3.
Compte tenu de la quantité d’informations qui peuvent être recueillies à partir de la mesure des paramètres mitochondriaux et des divers cas dans lesquels ces informations peuvent être utilisées, la capacité de recueillir efficacement des données fonctionnelles peut être utile dans de nombreux domaines de recherche différents. Les mesures de la consommation d’oxygène mitochondriale sont effectuées depuis des décennies à l’aide d’instruments très spécifiques – à l’aide d’une électrode Clark, qui peut être limitée par la taille de l’échantillon nécessaire pour effectuer des mesures, et plus récemment, d’instruments sophistiqués qui peuvent mesurer la respiration mitochondriale et de multiples autres paramètres, mais dont le coût peut être prohibitif. Ce protocole est une approche alternative adaptée utilisant une sonde phosphorescente sensible à l’oxygène (MitoXpress)4,5. Le signal de la sonde est détecté à l’aide d’un lecteur de plaques en mode de fluorescence résolue dans le temps pour des mesures continues dans le temps. La phosphorescence présente une plus grande différence d’énergie entre le photon absorbé et le photon émis par rapport à la fluorescence et, par conséquent, est mieux adaptée à la surveillance continue des changements de signal. Cela permet à presque tous les laboratoires d’effectuer ces mesures, pas seulement ceux qui se concentrent sur le métabolisme mitochondrial ou qui peuvent se permettre un équipement hautement spécialisé. Le système modèle que nous utilisons est constitué de mitochondries isolées de trois lézards arboricoles, de deux espèces parentales et d’une espèce introgressée (contenant de l’ADN nucléaire d’une espèce parentale et des mitochondries de l’autre – des hybrides). Ces lézards ont été choisis parce que nous avons émis l’hypothèse qu’il y a des conséquences métaboliques et énergétiques pour les hybrides ayant des sources d’ADN nucléaire et mitochondrial différentes. Nous avons utilisé un kit de test disponible dans le commerce avec un lecteur de plaques multimode qui peut augmenter l’accès à ce type de test à un plus grand nombre de chercheurs et de domaines de recherche.
Protocole
Les lézards ont été euthanasiés par asphyxie au CO2 suivie d’une décapitation immédiate, conformément aux politiques définies par le Bureau du bien-être des laboratoires animaliers et les directives du Comité institutionnel de protection et d’utilisation des animaux d’Elon.
1. Isolement des mitochondries6
REMARQUE : Conservez toutes les solutions froides (tableau 1) et les échantillons sur de la glace tout au long de ces étapes.
- Retirez le foie, pesez-le, puis rincez-le avec ~3 mL de solution saline glacée tamponnée au phosphate (1x, -/-).
- Hachez le foie dans 1 mL de L-MIB à l’aide d’une lame de rasoir fraîche.
- Amenez le volume total de tissu plus le L-MIB à 2 mL et perturbez mécaniquement les cellules hépatiques pendant quatre passages avec un homogénéisateur Dounce.
- Essorer l’homogénat à 300 × g (37 °C, 10 min).
- Transférez le surnageant dans un tube frais et placez-le sur de la glace.
- Remettre la pastille en suspension dans 2 mL de L-MIB, réhomogénéiser et essorer à nouveau à 300 × g (37 °C, 10 minutes).
- Mélanger les surnageants des deux centrifugations et centrifuger à 10 000 × g (37 °C, 10 min).
- Remettre la pastille en suspension dans ~0,350 mL de L-MIB.
- Déterminer la quantité de protéines totales (mg de mitochondries/mL de L-MIB) à utiliser comme approximation du contenu mitochondrial 4,5,6.
2. Consommation d’oxygène
- Préchauffez toutes les solutions utilisées (tableau 1) dans les étapes suivantes à 30 °C dans un bain-marie.
- Diluer les mitochondries dans la LEB à 6 mg/mL en fonction des résultats du test de concentration en protéines à l’étape 1.9.
- Installer le test dans une plaque inférieure stérile à paroi noire et transparente de 96 puits (tableau 2).
- Ajouter 50 μL de l’échantillon (tampon L-EB ou échantillon de mitochondries) dans les puits appropriés.
- Ajouter 50 μL de traitement (L-EB, Glutamate/Malate ou Glutamate/Malate avec ADP).
- Diluez la sonde à l’ordre de 1:10 dans L-EB, puis ajoutez 100 μL de la sonde fluorescente dans chaque puits.
- Ajoutez doucement 50 μL d’huile minérale lourde dans chaque puits pour exclure l’oxygène ambiant.
- Lire les mesures fluorescentes depuis le bas de la plaque à 380/650 nm d’excitation/émission toutes les 1,5 min pendant 45 min. Utilisez le mode cinétique avec une temporisation de 30 000 μs et une fenêtre de mesure de 100 μs.
3. Analyse des données
- Exportez le fichier de données brutes à partir de l’ordinateur du lecteur de plaques sous forme de fichier .xls.
- Ouvrez le fichier, puis copiez et collez les données brutes dans un nouvel onglet et étiquetez les lignes et les colonnes de manière appropriée.
- Tracez le tampon L-EB uniquement sur l’échantillon de contrôle et L-EB + G/M en unités fluorescentes relatives (RFU) en fonction du temps.
REMARQUE : Ces lignes doivent être relativement plates car il n’y a pas de mitochondries présentes, et par conséquent, aucun changement dans la concentration d’oxygène ne doit être détecté. - Tracez les valeurs de l’échantillon L-EB + G/M en fonction du temps.
- Déterminez où les lectures deviennent plus cohérentes et aplatissent pour les commandes.
REMARQUE : C’est là que l’analyse des données pour les échantillons expérimentaux doit commencer (indiquée par des flèches à la figure 1A). Les réactions peuvent prendre 10 à 15 minutes pour s’aplatir et atteindre leur maximum. - Faites un nouveau graphique contenant uniquement les données après le point temporel établi à l’étape 3.5 (appelées données « tronquées ») et ajoutez la ligne la mieux ajustée pour visualiser les données brutes à analyser.
- Calculez la valeur RFU moyenne des données de tampon de contrôle tronquées uniquement (surlignées en jaune). Cette valeur est utilisée comme valeur minimale RFU comme référence dans le calcul de l’oxygène ci-dessous.
- Calcul du taux de consommation d’oxygène (μM O2/min)
- Copiez et collez la région linéaire des données brutes de l’étape 3.6 (c’est-à-dire les données tronquées) pour déterminer la concentration d’oxygène dans les échantillons mitochondriaux en traitement G/M + ADP à chaque point temporel 7,8,9,10.
- Utilisez l’équation (1)5 pour déterminer la concentration d’oxygène à chaque point temporel. [O2]a est la concentration en oxygène dans un tampon saturé en air (235 mM à 30 °C). I(t), Ia et Io sont le signal fluorescent de l’échantillon + de la sonde au temps t (par exemple, échantillon + G/M + ADP), le signal moyen de la sonde dans un tampon saturé d’air calculé à l’étape 3.7 et le signal maximal dans un tampon désoxygéné (réglé au signal maximum réalisable), respectivement.
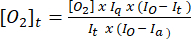 (1)
(1) - Tracez les valeurs [O2]t calculées à l’étape 3.8.2 en fonction du temps et ajoutez une ligne de tendance linéaire avec l’équation de la droite la mieux ajustée.
REMARQUE : Utilisez la pente de chaque ligne comme taux de consommation d’oxygène. Les doublons ou les triplés de n’importe quel échantillon peuvent être agrégés et utilisés pour la comparaison du taux de consommation.
- Calculez le RCR en divisant la respiration mitochondriale avec et sans ADP, qui représentent respectivement les états 3 et 2.
Résultats
Le taux de consommation d’oxygène et le RCR mitochondrial ont été déterminés à partir des mitochondries de trois lézards différents à l’aide d’un kit de dosage avec une sonde phosphorescente de détection d’oxygène et un lecteur de plaque de fluorescence standard. Des recherches antérieures ont établi que la sonde de ce kit est directement corrélée à la consommation d’oxygène, où la phosphorescence est éteinte par l’oxygène moléculaire et le signal fluores...
Discussion
La mesure de la fonction mitochondriale est utile pour comparer différents échantillons, tels que des états pathologiques ou non pathologiques, différents types de tissus provenant d’un même animal ou entre différents types d’échantillons. Nous avons utilisé cette dernière comparaison pour tester notre hypothèse selon laquelle il existe une conséquence métabolique aux lézards arboricoles hybrides qui ont des mitochondries introgressées. Il existe diverses façons de dé...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Cette recherche a été financée par la NSF CHE-1229562 (VDGM) et des subventions du Comité de recherche et de développement de la faculté de l’Université Elon (VDGM et GH) et du programme de recherche de premier cycle (AJ).
matériels
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
Références
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon