このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
プレートリーダーベースの蛍光アッセイを使用したミトコンドリア酸素消費量の評価
Erratum Notice
要約
酸素消費量の評価は、ミトコンドリアの機能に関する重要な情報を提供します。蛍光プレートリーダー付きの蓄光プローブを使用すると、特殊な機器なしで正確で再現性のあるデータを簡単に取得できます。このアッセイにより、どのラボでも単離されたミトコンドリアの酸素消費量を測定し、呼吸制御比を計算できます。
要約
ミトコンドリアは、細胞呼吸、ATP産生、アポトーシスの制御、代謝経路の中心的なハブとしての機能など、多くの重要な機能を果たしています。したがって、ミトコンドリアの機能を実験的に評価することで、異なる集団や疾患状態の違いについての洞察を得ることができます。さらに、単離されたミトコンドリアが実験を進めるのに十分な健康状態にあるかどうかを評価することも重要です。異なるサンプルのミトコンドリア機能を比較するためによく使用される特性の1つは、酸素消費量です。無傷の細胞または組織から単離されたミトコンドリアのいずれかにおける酸素消費量とその後の呼吸制御比の計算は、3つの目的すべてに役立ちます。ブラシトカゲの肝臓から分離したミトコンドリアと、溶液中の酸素濃度の変動に敏感な燐光プローブを併用し、蛍光プレートリーダーを用いて酸素消費量を測定しました。この方法は、迅速かつ効率的であるだけでなく、少量のミトコンドリアで、特殊な機器を必要とせずに実施できます。ここで説明する段階的なプロトコルにより、研究者はミトコンドリアの機能評価にアクセスできるようになります。
概要
ミトコンドリアは、真核細胞に見られる、細菌とほぼ同じ大きさの細胞小器官です。それらはDNAを含み、外側と内側の2つの膜を持っているため、ユニークな細胞小器官です。ミトコンドリアの外膜と内膜は膜間空間によって分離されており、内膜はマトリックスと呼ばれる最も内側のコンパートメントの周りにクリステと呼ばれる構造に折り畳まれています。これらのクリステは、内膜の表面積を増加させるため、クリステを使用する複数のプロセスが同時に発生する可能性があります。ミトコンドリアは、アポトーシスの制御や複数の代謝経路の収容など、多くの細胞機能に関与していますが、ATPの産生におけるミトコンドリアの重要な役割は、細胞の生存に不可欠です。実際、細胞のエネルギーの90%はミトコンドリア1に由来しています。ATPの産生には、ミトコンドリア膜電位(Δψ)と呼ばれる外膜と内膜の電気化学的な差が生じ、これはH+ イオンがマトリックスから膜間空間に送り込まれるときに発生します。ATP産生は、最終的にミトコンドリア呼吸鎖(ETC)を通る電子移動による還元当量の酸化中に利用されます。最終的な電子受容体は酸素分子(O2)です。酸素が消費されると、H+ の濃度差は最大まで蓄積され、その時点でH+ イオンはATP合成酵素複合体を通過して膜間空間からマトリックスへの濃度勾配を下ります。H+ イオンの移動により、ATP合成酵素の立体配座が変化し、ADPは無機リン酸塩と近接して反応してATPを生成します。最後に、ATPはミトコンドリアマトリックスからサイトゾルに移され、リン酸の加水分解中に放出される大量の自由エネルギーにより、保存または反応を促進するために使用できます。この全過程を酸化的リン酸化といい、酸素を消費するため、ミトコンドリアは呼吸すると言われています2。
Δψの蓄積と強度、O2 の減少量(酸素消費量と呼ばれる)、およびATPの生成はすべて、細胞の健康状態の指標として使用できます。Δψ、総ATP含有量と総産生、酸素消費量の測定などのミトコンドリア機能研究は、従来の生化学的方法、またはプレートベースのアッセイでの蛍光と発光のいずれかで定量化できます。例えば、ミトコンドリアに特異的に結合するテトラメチルローダミンエチルエステルなどの蛍光色素を用いて、ミトコンドリア膜電位を異なるサンプル間で比較することができます。ATPの生成は、ATP濃度と相関する変化を持つ反応に発光タンパク質を添加することでモニターできます。OXPHOS中の酸素消費率、つまり絶対呼吸速度を定量化することで、ミトコンドリア機能とエネルギー代謝の格差の原因を解明することができます。酸素消費量の評価は、呼吸制御比(RCR)を計算するために使用できます。RCR値は、ミトコンドリアの主要な機能であるADPの流入に応答してミトコンドリアがATPを作る能力を表しています。RCR値は、単離されたミトコンドリアの全体的な状態を示し、さまざまな実験的治療に対する反応の比較を可能にします。RCR値の差は、ミトコンドリアの機能不全を表している場合もあれば、2つ以上の供給源から分離された異なるミトコンドリア間の生物学的な違いを示している場合もあります。単離されたミトコンドリアの機能の別の重要な尺度は、O2のモルあたりに合成されるATPのモル、またはP / O比3として定義されるミトコンドリア効率です。
ミトコンドリアのパラメータを測定することで収集できる情報量や、その情報を活用できるさまざまな事例を考えると、機能データを効率的に収集する能力は、さまざまな研究分野で役立つと考えられます。ミトコンドリアの酸素消費量の測定は、測定に必要なサンプルサイズによって制限されるクラーク電極や、最近ではミトコンドリアの呼吸やその他の複数のパラメータを測定できる洗練された機器など、非常に特殊な機器を使用して何十年にもわたって行われてきましたが、コストがかかりすぎる可能性があります。このプロトコルは、酸素感受性燐光プローブ(MitoXpress)4,5を使用した適応された代替アプローチです。プローブ信号は、時間分解蛍光モードのプレートリーダーで検出され、経時的な連続測定が行われます。燐光は、蛍光と比較して、吸収された光子と放出された光子の間のエネルギー差が大きいため、信号の変化を継続的に監視するのに適しています。これにより、ミトコンドリアの代謝に焦点を当てた研究室や、高度に専門化された機器を購入できる研究室だけでなく、ほぼすべての研究室でこれらの測定を行うことができます。私たちが利用するモデルシステムは、3つのツリートカゲ、2つの親種、および1つの侵入種(1つの親種からの核DNAと他の親種のミトコンドリアを含む)から分離されたミトコンドリアです。これらのトカゲが選ばれたのは、異なる核DNA源とミトコンドリアDNA源を持つ雑種には代謝とエネルギーの影響があるという仮説を立てたためです。私たちは、より多くの研究者や研究分野がこのタイプのアッセイへのアクセスを増やすことができるマルチモードプレートリーダーを備えた市販のアッセイキットを利用しました。
プロトコル
トカゲは、動物実験福祉局とイーロンの施設動物管理および使用委員会のガイドラインに概説された方針に従って、CO2 窒息によって安楽死させられ、その後直ちに斬首されました。
1. ミトコンドリアの単離6
注:これらのステップ全体を通して、すべての溶液(表1)を冷たく保ち、サンプルを氷の上に置いてください。
- 肝臓を取り出して重量を量り、~3 mL の氷冷リン酸緩衝生理食塩水 (1x、-/-) ですすいでください。
- 新鮮なかみそりの刃で1mLのL-MIBで肝臓をミンチにします。
- 組織とL-MIBの総量を2 mLにし、Dounceホモジナイザーで肝細胞を4回機械的に破壊します。
- ホモジネートを300 × g (37°C、10分)で遠心します。
- 上清を新しいチューブに移し、氷の上に置きます。
- ペレットを2mLのL-MIBに再懸濁し、再ホモジナイズし、300 × g (37°C、10分)で再度遠心します。
- 両方のスピンからの上清を混合し、10,000 × g (37°C、10分)で遠心分離します。
- ペレットを~0.350 mLのL-MIBに再懸濁します。
- ミトコンドリア含有量の近似値として使用する総タンパク質の量(ミトコンドリアmg/L-MIB1mL)を決定します4,5,6。
2.酸素消費量
- 次の手順で使用するすべての溶液(表1)をウォーターバスで30°Cに予温します。
- ステップ1.9のタンパク質濃度アッセイの結果に基づいて、LEB中のミトコンドリアを6 mg/mLに希釈します。
- アッセイを滅菌済みの96ウェル黒壁透明底板にセットアップします(表2)。
- サンプル(L-EBバッファーまたはミトコンドリアサンプル)50 μLを適切なウェルに加えます。
- 50 μLの処理剤(L-EB、グルタミン酸/リンゴ酸、またはグルタミン酸/リンゴ酸とADP付き)を加えます。
- プローブストックをL-EBで1:10に希釈し、蛍光プローブ100μLを各ウェルに加えます。
- すべてのウェルに50μLの重鉱物油を静かに加えて、周囲の酸素を排除します。
- プレートの底面から380/650 nmの励起/発光で、1.5分ごとに45分間蛍光測定値を読み取ります。30,000 μsの時間遅延と100 μsの測定ウィンドウでキネティックモードを使用します。
3. データ分析
- プレートリーダーのコンピュータから生データファイルを.xlsファイルとしてエクスポートします。
- ファイルを開き、生データをコピーして新しいタブに貼り付け、行と列に適切なラベルを付けます。
- L-EBバッファーのみをコントロールサンプルにプロットし、L-EB + G/Mを相対蛍光単位(RFU)対時間としてプロットします。
注:ミトコンドリアが存在しないため、これらの線は比較的平坦でなければならず、したがって、酸素濃度の変化は検出されません。 - L-EB + G/M サンプル値を RFU 対時間としてプロットします。
- 読み取り値がより一貫性を持つ場所を決定し、コントロールに対して平坦化します。
注:ここから実験サンプルのデータ解析を開始する必要があります( 図1Aの矢印でマークされています)。反応が平らになり、最大に達するまでに10〜15分かかる場合があります。 - ステップ 3.5 で設定した時点以降のデータ (「トリミング済み」データと呼ばれます) のみを含む新しいプロットを作成し、分析する生データを視覚化するための最適な線を追加します。
- トリミングされた制御バッファのみのデータ (黄色で強調表示) の平均 RFU 値を計算します。この値は、以下の酸素計算のベースラインとして最小RFU値として使用されます。
- 酸素消費率の計算(μM O2/min)
- ステップ3.6の生データの線形領域(つまり、トリミングされたデータ)をコピーして貼り付け、各時点7、8、9、10でのG / M + ADP処理のミトコンドリアサンプル中の酸素濃度を決定します。
- 式(1)5 を使用して、各時点の酸素濃度を求めます。[O2]a は、空気飽和バッファー中の酸素濃度(30°Cで235mM)です。I(t)、Ia、およびIoは、時間 t (例:サンプル+ G / M + ADP)におけるサンプル+プローブの蛍光シグナル、ステップ3.7で計算された空気飽和バッファー中のプローブの平均シグナル、および脱酸素バッファー内の最大シグナル(達成可能な最大シグナルに設定)です。
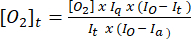 (1)
(1) - ステップ 3.8.2 で計算した [O2]t 値と時間の関係をプロットし、線形近似曲線と最適近似線の方程式を追加します。
注意: 各線の傾きを酸素消費率として使用します。任意のサンプルの重複または三重化を集約し、消費率の比較に使用できます。
- ADPありのミトコンドリア呼吸とADPなしのミトコンドリア呼吸をそれぞれ状態3と2で割ってRCRを計算します。
結果
酸素消費率とミトコンドリアRCRは、燐光性酸素感知プローブと標準的な蛍光プレートリーダーを備えたアッセイキットを使用して、3つの異なるトカゲのミトコンドリアから決定されました。以前の研究では、このキットのプローブは酸素消費に直接相関しており、そこでは燐光が分子状酸素によって消光され、ミトコンドリア呼吸により酸素レベルが低下すると蛍?...
ディスカッション
ミトコンドリアの機能測定は、疾患状態と非疾患状態、同じ動物の異なる組織タイプ、または異なるサンプルタイプ間など、異なるサンプルを比較する場合に役立ちます。私たちは、ミトコンドリアを侵入させたハイブリッドツリートカゲに代謝的な結果があるという仮説を検証するために、後者の比較を使用しました。ミトコンドリアの機能を実験的に確認するに...
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は、NSF CHE-1229562(VDGM)と、イーロン大学の教員研究開発委員会(VDGMおよびGH)および学部研究プログラム(AJ)からの助成金によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
参考文献
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved