É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação do consumo de oxigênio mitocondrial usando um ensaio fluorescente baseado em leitor de placas
Neste Artigo
Erratum Notice
Resumo
A avaliação do consumo de oxigênio fornece informações integrais sobre a função mitocondrial. Usando uma sonda fosforescente com um leitor de placa fluorescente, dados precisos e reprodutíveis podem ser obtidos facilmente sem equipamento especializado. Este ensaio permite que qualquer laboratório meça o consumo de oxigênio de mitocôndrias isoladas e calcule as taxas de controle respiratório.
Resumo
As mitocôndrias desempenham muitas funções importantes, incluindo respiração celular, produção de ATP, controle da apoptose e atuação como um hub central de vias metabólicas. Portanto, avaliar experimentalmente a funcionalidade mitocondrial pode fornecer informações sobre as variações entre diferentes populações ou estados de doença. Além disso, é valioso avaliar se as mitocôndrias isoladas são saudáveis o suficiente para prosseguir com os experimentos. Uma característica frequentemente usada para comparar a função mitocondrial em diferentes amostras é a taxa de consumo de oxigênio. O consumo de oxigênio e o cálculo subsequente da taxa de controle respiratório em células intactas ou mitocôndrias isoladas do tecido podem servir a todos os três propósitos. Usando mitocôndrias isoladas do fígado de lagartos em conjunto com uma sonda fosforescente sensível às flutuações na concentração de oxigênio de uma solução, medimos o consumo de oxigênio usando um leitor de placas fluorescentes. Este método não é apenas rápido e eficiente, mas também pode ser realizado com uma pequena quantidade de mitocôndrias e sem a necessidade de equipamentos especializados. O protocolo passo a passo descrito aqui aumenta a acessibilidade da avaliação funcional mitocondrial para os pesquisadores.
Introdução
As mitocôndrias são organelas, aproximadamente do tamanho de bactérias, encontradas em células eucarióticas. São organelas únicas porque contêm DNA e possuem duas membranas, uma externa e uma interna. As membranas externa e interna das mitocôndrias são separadas por um espaço intermembranar, e a membrana interna se dobra em estruturas chamadas cristas ao redor do compartimento mais interno, chamado de matriz. Essas cristas aumentam a área de superfície da membrana interna para que vários processos que usam as cristas possam ocorrer simultaneamente. Embora as mitocôndrias estejam envolvidas em muitas funções celulares, como controlar a apoptose e abrigar múltiplas vias metabólicas, seu papel vital na produção de ATP é essencial para a sobrevivência celular. Na verdade, 90% da energia de uma célula é derivada das mitocôndrias1. A produção de ATP envolve a geração de uma diferença eletroquímica entre as membranas externa e interna, denominada potencial de membrana mitocondrial (Δψ), que surge quando os íons H+ são bombeados da matriz para o espaço intermembranar. A produção de ATP é finalmente aproveitada durante a oxidação de equivalentes redutores por meio do movimento de elétrons através da cadeia respiratória mitocondrial (ETC). O aceptor final de elétrons é o oxigênio molecular (O2). À medida que o oxigênio é consumido, o diferencial de concentração de H+ aumenta até seu máximo, ponto em que os íons H+ descem seu gradiente de concentração do espaço intermembranar para a matriz, passando pelo complexo ATP sintase. O movimento dos íons H+ causa uma mudança conformacional na ATP sintase, e o ADP é aproximado do fosfato inorgânico para reagir e gerar ATP. Finalmente, o ATP é translocado da matriz mitocondrial para o citosol e pode ser armazenado ou usado para facilitar as reações devido à grande quantidade de energia livre liberada durante a hidrólise de seus fosfatos. Todo esse processo é denominado fosforilação oxidativa e, como o oxigênio é consumido, diz-se que as mitocôndrias respiram2.
O acúmulo e a força de Δψ, a quantidade de O2 reduzida (denominada consumo de oxigênio), bem como a geração de ATP, podem ser usados como indicações da saúde celular. Estudos funcionais mitocondriais, como medição de Δψ, conteúdo e produção total de ATP e consumo de oxigênio, podem ser quantificados por métodos bioquímicos tradicionais ou fluorescência e luminescência em ensaios baseados em placas. Por exemplo, o potencial da membrana mitocondrial pode ser comparado entre diferentes amostras usando corantes fluorescentes, como o éster etílico tetrametilrodamina, que se liga especificamente às mitocôndrias. A geração de ATP pode ser monitorada pela adição de uma proteína luminescente a uma reação cujas alterações se correlacionam com a concentração de ATP. A quantificação das taxas de consumo de oxigênio, ou taxas absolutas de respiração, durante o OXPHOS, pode ajudar a elucidar as causas das disparidades na função mitocondrial e no metabolismo energético. A avaliação do consumo de oxigênio pode ser usada para calcular as taxas de controle respiratório (RCRs). Os valores de RCR descrevem a capacidade das mitocôndrias de produzir ATP em resposta ao influxo de ADP, que é a principal função das mitocôndrias. Os valores de RCR significam a condição geral das mitocôndrias isoladas e permitem a comparação das respostas a diferentes tratamentos experimentais. As diferenças nos valores de RCR podem representar disfunção mitocondrial ou indicar uma diferença biológica entre diferentes mitocôndrias isoladas de duas ou mais fontes. Outra medida importante de função em mitocôndrias isoladas é a eficiência mitocondrial definida como moles de ATP sintetizados por moles de O2, ou a relação P / O3.
Dada a quantidade de informações que podem ser coletadas a partir da medição de parâmetros mitocondriais e vários casos em que essas informações podem ser utilizadas, a capacidade de coletar dados funcionais com eficiência pode ser útil em muitas áreas de pesquisa diferentes. As medições do consumo de oxigênio mitocondrial são realizadas há décadas com instrumentação muito específica - usando um eletrodo de Clark, que pode ser limitado pelo tamanho da amostra necessária para realizar medições e, mais recentemente, instrumentos sofisticados que podem medir a respiração mitocondrial e vários outros parâmetros, mas podem ter um custo proibitivo. Este protocolo é uma abordagem alternativa adaptada usando uma sonda fosforescente sensível ao oxigênio (MitoXpress)4,5. O sinal da sonda é detectado com um leitor de placas no modo de fluorescência resolvido no tempo para medições contínuas ao longo do tempo. A fosforescência tem uma diferença de energia maior entre o fóton absorvido e emitido em comparação com a fluorescência e, portanto, é mais adequada para monitorar continuamente as mudanças no sinal. Isso permite que quase todos os laboratórios realizem essas medições, não apenas aqueles que se concentram no metabolismo mitocondrial ou que podem pagar por equipamentos altamente especializados. O sistema modelo que utilizamos é mitocôndrias isoladas de três lagartos arbóreos, duas espécies parentais e uma introgressada (contendo DNA nuclear de uma espécie parental e mitocôndrias da outra - híbridos). Esses lagartos foram escolhidos porque hipotetizamos que há consequências metabólicas e energéticas para híbridos com diferentes fontes de DNA nuclear e mitocondrial. Utilizamos um kit de ensaio disponível comercialmente com um leitor de placas multimodo que pode aumentar o acesso a esse tipo de ensaio para mais pesquisadores e campos de pesquisa.
Protocolo
Os lagartos foram sacrificados por asfixia por CO2 seguida de decapitação imediata, de acordo com as políticas descritas pelo Escritório de Bem-Estar de Laboratórios Animais e pelas diretrizes do Comitê Institucional de Cuidados e Uso de Animais de Elon.
1. Isolamento das mitocôndrias6
NOTA: Mantenha todas as soluções frias (Tabela 1) e as amostras no gelo durante essas etapas.
- Remova o fígado, pese-o e enxágue-o com ~ 3 mL de solução salina tamponada com fosfato gelado (1x, -/-).
- Pique o fígado em 1 mL de L-MIB com uma lâmina de barbear nova.
- Traga o volume total de tecido mais L-MIB para 2 mL e interrompa mecanicamente as células do fígado por quatro passagens com um homogeneizador Dounce.
- Centrifugar o homogeneizado a 300 × g (37 °C, 10 min).
- Transfira o sobrenadante para um tubo novo e coloque-o no gelo.
- Ressuspenda o pellet em 2 mL de L-MIB, homogeneize novamente e gire novamente a 300 × g (37 ° C, 10 minutos).
- Combine os sobrenadantes de ambos os spins e centrifugue a 10.000 × g (37 °C, 10 min).
- Ressuspenda o pellet em ~0,350 mL de L-MIB.
- Determine a quantidade de proteína total (mg de mitocôndria / mL de L-MIB) para usar como uma aproximação para o conteúdo mitocondrial 4,5,6.
2. Consumo de oxigênio
- Pré-aqueça todas as soluções utilizadas (Tabela 1) nas etapas seguintes a 30 °C em banho-maria.
- Diluir as mitocôndrias em LEB para 6 mg/ml com base nos resultados do ensaio de concentração de proteínas no passo 1.9.
- Configure o ensaio em uma placa de fundo transparente de parede preta estéril de 96 poços (Tabela 2).
- Adicionar 50 μL da amostra (tampão L-EB ou amostra de mitocôndrias) aos alvéolos apropriados.
- Adicione 50 μL de tratamento (L-EB, glutamato / malato ou glutamato / malato com ADP).
- Dilua o estoque da sonda 1:10 em L-EB e, em seguida, adicione 100 μL da sonda fluorescente a cada poço.
- Adicione suavemente 50 μL de óleo mineral pesado a cada poço para excluir o oxigênio ambiente.
- Leia as medições fluorescentes da parte inferior da placa a 380/650 nm de excitação/emissão a cada 1,5 min por 45 min. Use o modo cinético com um atraso de tempo de 30.000 μs e uma janela de medição de 100 μs.
3. Análise dos dados
- Exporte o arquivo de dados brutos do computador leitor de placas como um arquivo .xls.
- Abra o arquivo, copie e cole os dados brutos em uma nova guia e rotule as linhas e colunas adequadamente.
- Plotar o tampão L-EB apenas para a amostra de controle e L-EB + G/M como unidades fluorescentes relativas (RFU) em função do tempo.
NOTA: Essas linhas devem ser relativamente planas, pois não há mitocôndrias presentes e, portanto, nenhuma alteração na concentração de oxigênio deve ser detectada. - Plote os valores de amostra L-EB + G/M como RFU versus tempo.
- Determine onde as leituras se tornam mais consistentes e se achatam para os controles.
NOTA: É aqui que a análise de dados para amostras experimentais deve começar (marcada por setas na Figura 1A). As reações podem levar de 10 a 15 minutos para se achatar e atingir o máximo. - Faça um novo gráfico contendo apenas os dados após o ponto de tempo estabelecido na etapa 3.5 (chamados de dados "cortados") e adicione a linha de melhor ajuste para visualizar os dados brutos a serem analisados.
- Calcule o valor médio de RFU dos dados somente de buffer de controle cortados (destacados em amarelo). Este valor é usado como o valor mínimo de RFU como linha de base no cálculo de oxigênio abaixo.
- Cálculo da taxa de consumo de oxigênio (μM O2/min)
- Copie e cole a região linear dos dados brutos da etapa 3.6 (ou seja, os dados aparados) para determinar a concentração de oxigênio nas amostras mitocondriais no tratamento G / M + ADP em cada ponto de tempo 7,8,9,10.
- Use a equação (1)5 para determinar a concentração de oxigênio em cada ponto de tempo. [O2]a é a concentração de oxigénio em tampão saturado de ar (235 mM a 30 °C). I(t), Ia e Io são o sinal fluorescente da amostra + sonda no tempo t (por exemplo, amostra + G/M + ADP), o sinal médio da sonda em tampão saturado de ar calculado na etapa 3.7 e o sinal máximo em tampão desoxigenado (definido no sinal máximo alcançável), respectivamente.
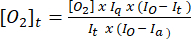 Características (1)
Características (1) - Plote os valores de [O2]t calculados na etapa 3.8.2 em relação ao tempo e adicione uma linha de tendência linear junto com a equação da linha de melhor ajuste.
NOTA: Use a inclinação de cada linha como a taxa de consumo de oxigênio. Duplicatas ou triplicatas para qualquer amostra podem ser agregadas e usadas para a comparação da taxa de consumo.
- Calcule o RCR dividindo a respiração mitocondrial com e sem ADP, que representam os estados 3 e 2, respectivamente.
Resultados
A taxa de consumo de oxigênio e a RCR mitocondrial foram determinadas a partir das mitocôndrias de três lagartos diferentes usando um kit de ensaio com uma sonda de detecção de oxigênio fosforescente e um leitor de placa de fluorescência padrão. Pesquisas anteriores estabeleceram que a sonda neste kit se correlaciona diretamente com o consumo de oxigênio, onde a fosforescência é extinta pelo oxigênio molecular e o sinal fluorescente aumenta à medida que os níveis de oxigên...
Discussão
Medir a função mitocondrial é útil ao comparar diferentes amostras, como estados de doença versus não doença, diferentes tipos de tecido do mesmo animal ou entre diferentes tipos de amostra. Usamos a comparação posterior para testar nossa hipótese de que há uma consequência metabólica para lagartos híbridos que têm mitocôndrias introgessadas. Existem várias maneiras de determinar a função das mitocôndrias experimentalmente, incluindo quantificação de Δψ, conteúdo...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Esta pesquisa foi financiada pela NSF CHE-1229562 (VDGM) e bolsas do Comitê de Pesquisa e Desenvolvimento do Corpo Docente da Elon University (VDGM e GH) e do Programa de Pesquisa de Graduação (AJ).
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
Referências
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados