需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在单神经元分辨率下新生小鼠感觉皮层自发活动的体内可视化
* 这些作者具有相同的贡献
摘要
新皮层的初级感觉区域在发育过程中表现出独特的自发活动。本文介绍了如何可视化单个神经元活动和初级感觉区域,以分析 体内新生小鼠的面积特异性同步活动。
摘要
哺乳动物大脑在整个产前和产后期间在细胞和回路水平上经历动态发育变化。在发现许多导致这些发育变化的基因之后,现在已知神经元活动也显着调节这些过程。在发育中的大脑皮层中,神经元表现出特定于每个主要感觉区域的同步活动模式。这些模式与在成熟皮层中观察到的模式明显不同,强调了它们在调节特定区域发育过程中的作用。发育过程中神经元活动的缺陷会导致各种脑部疾病。这些发现强调了检查神经元发育中活动模式背后的调节机制的必要性。本文总结了一系列协议,用于可视化新生小鼠的初级感觉区域和神经元活动,在 体内使用双光子显微镜对皮层子场内单个神经元的活动进行成像,并分析与子场相关的活动相关性。我们展示了体感皮层中单个桶内拼凑状同步活动的代表性结果。我们还讨论了该协议的各种潜在应用和一些局限性。
引言
大脑皮层包含几个具有不同功能的感觉区域。这些区域接收来自其相应感觉器官的输入,主要通过脊髓或脑干传递并通过丘脑传递 1,2。值得注意的是,每个初级感觉区的神经元在早期发育阶段表现出独特的同步活动,这些活动也起源于感觉器官或下神经中枢,但与在成熟皮层中观察到的活动本质上不同3。
例如,在新生啮齿动物中,初级视觉区域 (V1) 显示波状活动,该活动起源于视网膜(视网膜波)并通过整个视觉通路传播,同时保留视网膜4。初级听觉区域 (A1) 表现出同步活动,组织在与成熟大脑中的等频带相对应的带状子区域中。这种活动来自耳蜗的内毛细胞 5,6。初级体感区 (S1) 的桶状皮层表现出一种拼凑状的活动模式,其中单个桶内的第 4 层神经元,即对单个胡须做出反应的神经元,被同步激活7。虽然提出起源于三叉神经节,但活动的来源仍然未知7。因此,新生儿活动模式在每个主要感觉区域和区域内子领域内都是专门的。神经元活动和初级感觉区域结构的同时可视化可能有助于探究这些活动模式对感觉系统发育的贡献。
在本文中,我们总结了一系列方案:(1) 使用稀疏标记 GCaMP 和初级感觉区域来可视化单个神经元活动,使用在丘脑皮质轴突中表达红色荧光蛋白的 TCA-RFP 小鼠7,(2) 在 体内使用双光子显微镜对新生小鼠的单细胞水平活动进行成像,以及 (3) 分析 S1 桶皮层内的活动相关性。代表性结果显示出生后第 (P)6 小鼠的各个桶内呈拼凑状的同步活动。尽管存在一些限制,但该技术可用于慢性成像、跨多个感觉区域的宽场成像和各种操作实验。对发育过程中神经元活动的多方面分析将丰富我们对大脑回路形成机制的理解。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验均按照熊本大学和国立遗传学研究所的动物实验指南进行,并得到动物实验委员会的批准。
1. 宫内 电穿孔 (IUE)
- 将 ICR 背景的雄性 TCA-RFP 小鼠与雌性野生型 ICR 小鼠交配。观察阴道塞,检查第二天清晨的交配情况。观察腹部,2 周后检查是否怀孕。
- 在 ddH2O 中制备含有 5 ng/μL TRE-nCre、1 μg/μL CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE 和 0.02% 台盼蓝的质粒溶液,以使用 Supernova 系统通过 GCaMP 稀疏标记神经元8。
- 制备含有 0.5 mg/mL 卡洛芬和 0.01 mg/mL 丁丙诺啡的镇痛溶液。避光保存,并在室温下保存。
- 在胚胎日 (E)14,按如下方式进行 IUE。IUE 方法与以前的报告9、10、11 基本相同。
- 用 70% 乙醇或戊二醛溶液擦拭实验室工作台。通过高压灭菌对所有手术器械进行消毒。戴上口罩和实验服,以降低感染小鼠的风险。
- 使用微量移液器拉拔器准备玻璃微量移液器。使用吸管将质粒混合物溶液放入玻璃微量移液器中。
- 使用异氟醚 (空气中 2.0%) 在 E14 对怀孕小鼠进行麻醉。在手术过程中用异氟醚(空气中 1.2%)保持小鼠麻醉。捏住脚趾以确保麻醉足够深。使用眼药膏防止眼睛干涩。
- 对腹部区域进行至少三次消毒,交替使用碘磨砂膏和 70% 乙醇。放置无菌窗帘以覆盖手术区域。做一个中线切口,将子宫暴露在窗帘上。
- 重复将温盐水滴在子宫上,以防止其干燥或冷却,直到腹部闭合(步骤 1.4.8)。
- 使用微量移液管和吸管将质粒溶液一一注射到胚胎侧脑室的一侧。
- 使用镊子型电极捏住胚胎头,并使用电穿孔仪以 1 秒的间隔提供方脉冲 (40 V, 50 ms) 五次。
- 将子宫放回腹腔。将 ~3 mL 温盐水注入腔中。缝合腹膜和腹部皮肤。在脖子后部的皮下施用 10 μL/g 重量的镇痛溶液(卡洛芬为 5 μg/g 重量,丁丙诺啡为 0.1 μg/g 重量)。
- 将鼠标放在加热垫 (37 °C) 上的恢复笼中,以从麻醉中恢复。将老鼠放在它的腹部,以防止它的舌头和唾液窒息喉咙。将鼠标与其他鼠标分开并对其进行监控,直到它恢复正常移动。将鼠标放回固定架。
- 出生后,进行基因分型以检查 RFP 等位基因,并对没有等位基因的幼崽实施安乐死。推荐此步骤,特别是如果在出生后第 2 周进行成像,此时 TCA-RFP 信号较弱且难以在步骤 2.2.7 中检查。
2. 颅窗手术
- 在手术前一天,准备含有 125 mM NaCl、5 mM KCl、10 mM 葡萄糖、10 mM HEPES、2 mM CaCl2 和 2 mM MgSO4 的皮层缓冲液(pH 值用 1 M NaOH 调节至7.4)12。使用真空过滤器对缓冲液进行消毒。
注意:缓冲液可在 4 °C 下保存长达 3 个月。所需的体积为每只幼犬 5-10 mL。 - 在 P3-12 中执行以下步骤。另请参阅之前描述此过程的报告13,14.
- 将 50 mg 琼脂糖与 5 mL 皮质缓冲液混合,并通过加热完全溶解琼脂糖。将一些溶液放入 1.5 mL 试管中,并保持在 42 °C。
- 将一些皮质缓冲液放入 50 mL 锥形管中,并保持在室温下。将一些生理盐水放入容器中(例如,50 mL 锥形管的盖子)中,并保持在室温下。
- 制备含有 0.01 mg/mL 丁丙诺啡的镇痛溶液。避光保存,并在室温下保存。
- 通过高压灭菌对所有手术器械进行消毒。用 70% 乙醇对荧光立体显微镜进行消毒。
- 使用异氟醚蒸发器用异氟醚(空气中 2.0%)在幼犬中诱导麻醉。注意小狗,当它的呼吸稍微减慢时把它取出来。
注意: 如果麻醉时间延长,幼犬的呼吸可能会停止几秒钟。即使幼犬恢复呼吸,长时间麻醉也可能减少幼犬的脑血流量并造成不可逆的脑损伤。 - 用交替轮换的碘磨砂膏和 70% 乙醇对幼犬头部进行至少 3 次消毒。将幼崽放在荧光立体显微镜下的加热垫(35°C)上。始终用异氟醚(空气中 1.5%-2.5%)麻醉幼犬。
- 通过观察头骨的荧光来选择表达 TCA-RFP 和 GCaMP 的幼仔。对不表达两者的幼崽实施安乐死。
- 尽可能小心地去除大脑半球以上的头皮,以免引起出血。用浸有盐水的无菌棉签擦拭颅骨,以去除结缔组织。
- 颅骨干燥后,用组织粘合剂将切开的头皮表面粘附到颅骨上。
- 将幼犬转移到 37 °C 加热垫上以从麻醉中恢复。等待至少 15 分钟让胶粘剂凝固。
注意:在进行下一步之前,暂停最多 1 小时。在此期间,如果需要,以类似的方式准备其他幼崽。 - 用异氟醚麻醉幼犬。在荧光立体显微镜下将幼崽放在加热垫(37°C)上,同时麻醉(空气中1.5%-2.5%异氟醚)。
注意:如果麻醉时间超过终点的时间(60 分钟),请在用异氟醚麻醉期间通过斩首对幼犬实施安乐死。 - 用无菌永久性标记物在颅骨上标记 GCaMP 表达位置。将 cortex buffer 应用于该位置。
- 将剃须刀片的一角插入颅骨。慢慢推动刀片以剃掉头骨并打一个洞。用镊子捏掉破裂的头骨,然后将其取出。
- 通过观察孔中的血管来检查颅孔是否成功形成。如果发生出血,请使用微量移液器用皮质缓冲液快速冲洗孔。重复冲洗,直到出血完全停止。
- 将一滴皮质缓冲液滴在颅孔上,并放入孔上方直径为 3 毫米的无菌圆形盖玻片中。用无纺布擦去多余的缓冲液。等到玻璃杯周围的区域干燥。
- 使用微量移液器在玻璃边缘周围涂抹温热的琼脂糖溶液。由于过多的琼脂糖可能会降低荧光信号,因此请从上方轻轻推动玻璃杯,以去除玻璃杯下多余的溶液。
- 使用镊子去除玻璃上或远离玻璃边缘的琼脂糖。仅将琼脂糖留在玻璃外周。
- 等到琼脂糖凝固。如果琼脂糖收缩在玻璃下方形成空间,请从侧面添加琼脂糖溶液以覆盖整个玻璃边缘。用无纺布去除颅骨表面的任何液体。
- 将丙烯酸树脂粉末和液体在橡胶容器中混合。用微量移液管吸出混合物并倒入,以用树脂覆盖玻璃边缘周围的琼脂糖。
注意:由于树脂在粉末和液体混合后很快就会凝固,因此在涂抹前需要反复混合。每次混合所需的量为液体 ~500 μL 和粉末 ~0.15 g。 - 将含树脂的钛棒固定在对侧半球。保持杆角度与盖玻片平行。用树脂固定整个颅骨表面。
- 以 10 μL/g 重量(丁丙诺啡为 0.1 μg/g 重量)在颈后部皮下施用镇痛溶液。将幼崽放回 37 °C 加热垫进行麻醉恢复。等待 >60 分钟让树脂凝固后再成像。
注意:成像前暂停 1-5 小时。在此期间以类似的方式对其他幼崽进行手术。
3. 双光子钙成像
- 将带有钛板的双轴测角仪连接到载物台板上,XY 定位在显微镜下方。在载物台上设置加热垫 (35 °C)。
- 在满足以下条件的情况下打开扫描软件: 像素,512 x 512;双向,ON;平均,无;成像区域,600 x 600 μm ,配备 20 倍物镜。设置设置,使 扫描速率 快于 1 Hz。
- 将幼犬放在加热垫上,用螺丝将头戴式钛棒固定在钛板上。通过放置异氟醚管端口(空气中 1.5-2.0%)来保持幼犬麻醉。
- 通过测角仪水平调整窗口角度。打开背光,用 5 倍物镜观察大脑表面,通过 XY 定位选择成像区域。
- 将滴眼液滴在颅窗上。将物镜切换到 20 倍水浸镜头。观察皮质表面以确认在大脑表面看到血流。
- 关闭背光并使用单光子模式扫描大脑表面。增加激光功率,使玻璃和大脑表面的绿色自发荧光可见。
- 将异氟醚浓度降低至 1.0%-1.5%。盖上显微镜以避免漏光。将扫描软件切换到双光子模式。
- 调整适合扫描 GCaMP 和 RFP 信号的激光功率和检测器增益。找到看到 TCA-RFP 信号的深度。确保深度为第 4 层,比 P6 的大脑表面 低 ~300 μm 。选择可以看到许多 GCaMP 表达神经元的成像区域。
- 开始 GCaMP 和 RFP 信号的延时成像。如果双通道同时扫描不适用,请在成像前捕获 GCaMP 和 TCA-RFP 图像。
- 停止异氟醚以减弱麻醉并观察自发活动 ~20 分钟。使用红外相机在成像过程中监测幼犬的运动。如果观察到任何表明痛苦的反应,请立即恢复异氟醚麻醉(空气中 2%)。
- 幼犬停止移动后,重复步骤 3.9 中的成像。如果需要,请更改成像区域。
- 用过量的异氟醚对幼犬实施安乐死。通过盐水和 4% PFA 的经心灌注固定大脑,然后在 4% PFA 中后固定过夜,以制备切向切片并进行免疫组织化学。否则,用过量的麻醉剂对幼崽实施安乐死,然后斩首。
- 如果母鼠没有其他幼崽,则用过量的麻醉剂对母鼠实施安乐死,然后进行颈椎脱位。
4. 分析
- 启动 MATLAB 并运行 EZcalcium 工具箱15 以打开图形用户界面 (GUI) “初始 GUI”。
- 补偿由于鼠标移动或其他原因导致的图像帧漂移。
- 点击 Initial GUI 中的 Motion Correction 以打开 Motion Correction GUI。单击“添加文件...”以加载成像数据的 TIF 文件。
- 按如下方式设置设置: 非刚性运动校正,空白; 上采样因子,50; Max Shift,15 岁; 初始批次大小,200; 箱宽度,200。点击 'Run Motion Correction' 执行校正。将自动保存运动校正的成像数据。
注意:应根据成像数据属性调整设置。如果由于非线性帧失真或皮层在深度方向上的移动而无法补偿某些帧的漂移,请在 ImageJ Fiji 中打开未经校正的原始成像数据并删除帧,然后重新开始步骤 4.2。
- 检测神经元并绘制感兴趣区域 (ROI)。
- 单击 Initial GUI 中的 Automated ROI Detection 以打开 ROI Detection GUI。单击 Add Files...(添加文件... )以加载运动校正的成像数据。
- 按如下方式设置设置: Initialization、Greedy;Search Method、Ellipse;反卷积,约束 FOOPSI-SPGL1;自回归,衰变;估计的 ROI #,60(建议超过目测检测到的数量的两倍);估计 ROI 宽度,17 (~20 μm);合并阈值,0.95;软糖因子,0.95;空间下采样, 1;温度下采样,1;Temp. 迭代,5.
注意:应根据成像数据属性调整设置。 - 单击 Run ROI Detection (运行 ROI 检测 ) 以执行检测。ROI 数据将自动保存。
- 单击 Initial GUI 中的 ROI Refinement 以打开 ROI Refinement GUI。单击 Load Data 以加载 ROI 数据。选择活动频率低 (<1 Hz)、位于颅骨下方或包含其他神经元神经突的 ROI。单击 Exclude ROI 以从分析中排除 ROI。
- 选择 将数据导出格式 为 XLSX ,然后单击 导出数据 以获取具有原始 dF/F 值的 Excel 文件。dF/F 使用公式 (1),其中 F 是每帧中像素的平均强度,F0 是基线信号强度,Fb 是背景荧光。
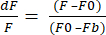 (1)
(1)
- 计算 ROI 之间 dF/F 的 Pearson 相关系数并制作相关系数矩阵。仅在麻醉减弱且开始发生自发活动后(停止异氟醚后 ~10 分钟)使用 dF/F。
- 使用 Fiji 从 TCA-RFP 图像定义桶形边缘。将 ROI 分类到各自的桶或隔垫。比较同一桶内和不同桶之间的成对相关性。
- 通过随机打乱 ROI 和 Ca2+ 跟踪之间的对应关系,生成 1000 到 10000 个代理数据。计算每个代理数据中单个桶内的平均相关系数,并评估相关性在实际数据中的统计显著性。
注意:如果 10,000 个代理项中有一个代理项的值高于实际值,则统计显著性为 0.0001。步骤 4.5 和 4.6 中描述的分析可以针对来自多个动物的汇总数据进行,如在其他地方执行的那样 7,16。
Access restricted. Please log in or start a trial to view this content.
结果
图 1 显示了使用本协议可视化的 P6 幼崽桶状皮层中第 4 层神经元活动的代表性结果。绿色通道 (GCaMP) 和红色通道 (TCA-RFP) 的双光子图像进行了时间平均,如图 1A 所示。由于 TCA-RFP 荧光比 GCaMP 荧光弱得多,因此 GCaMP 信号泄漏到红色通道中(图 1A1,A2)。在表达 GCaMP 的神经元上绘制了 14 ...
Access restricted. Please log in or start a trial to view this content.
讨论
鉴于自发活动从感觉器官或下神经系统出现,并通过相当于成熟神经系统的通路传播到初级感觉区域3,因此定义初级感觉区域和该区域内成像神经元的位置至关重要。在该协议中,我们通过使用可视化丘脑皮质轴突的转基因小鼠和稀疏表达 GCaMP 的 Supernova 系统来满足这一要求8。这些技术能够分析每个感觉区域内以及区域内子领域的活?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有需要申报的相互竞争的经济利益。
致谢
这项工作得到了日本科学振兴会变革性研究领域资助资助 (B) (22H05092, 22H05094) 和科学研究资助 20K06876,AMED,资助号 21wm0525015、武田科学基金会、内藤基金会、加藤纪念生物科学基金会、Kowa 生命科学基金会、NIG-JOINT (24A2021)(至 HM);以及日本科学振兴会科学研究补助金 19K06887 和 22K06446、儿玉医学研究纪念基金、上原纪念基金会、加藤纪念生物科学基金会和武田科学基金会(至 N.N-T.)。我们感谢 Takuji Iwasato 博士的 TCA-RFP 小鼠。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
参考文献
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340(2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245(2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679(2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173(2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1(2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942(2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143(2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106(2018).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。