Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация in vivo спонтанной активности в сенсорной коре новорожденных мышей с разрешением одного нейрона
* Эти авторы внесли равный вклад
В этой статье
Резюме
Первичные сенсорные области в неокортексе демонстрируют уникальную спонтанную активность во время развития. В этой статье описывается, как визуализировать активность отдельных нейронов и первичных сенсорных областей для анализа синхронной активности, специфичной для конкретных областей, у неонатальных мышей in vivo.
Аннотация
Мозг млекопитающих претерпевает динамические изменения в развитии как на клеточном, так и на сетевом уровнях на протяжении пренатального и постнатального периодов. После открытия многочисленных генов, способствующих этим изменениям в развитии, теперь известно, что нейронная активность также существенно модулирует эти процессы. В развивающейся коре головного мозга нейроны демонстрируют синхронизированные паттерны активности, которые специализированы для каждой первичной сенсорной области. Эти паттерны заметно отличаются от тех, которые наблюдаются в зрелой коре, подчеркивая их роль в регуляции процессов развития, специфичных для данной области. Дефицит нейронной активности во время развития может привести к различным заболеваниям головного мозга. Эти результаты подчеркивают необходимость изучения регуляторных механизмов, лежащих в основе паттернов активности в развитии нейронов. В этой статье обобщен ряд протоколов для визуализации первичных сенсорных областей и нейронной активности у неонатальных мышей, для визуализации активности отдельных нейронов в корковых подполях с помощью двухфотонной микроскопии in vivo, а также для анализа корреляций активности, связанных с подполем. Мы демонстрируем репрезентативные результаты лоскутной синхронной активности в отдельных бочках соматосенсорной коры. Мы также обсудим различные потенциальные применения и некоторые ограничения этого протокола.
Введение
Кора головного мозга содержит несколько сенсорных областей с различными функциями. Эти области получают входные сигналы, поступающие от соответствующих органов чувств, в основном передаваемые через спинной мозг или ствол головного мозга и ретранслируемые через таламус 1,2. Примечательно, что нейроны в каждой первичной сенсорной области демонстрируют уникально синхронизированную активность на ранних стадиях развития, которая также исходит от органов чувств или нижних нервных центров, но существенно отличается от активности, наблюдаемой в зрелой коре головногомозга.
У неонатальных грызунов, например, первичная зрительная область (V1) проявляет волнообразную активность, которая зарождается в сетчатке (волна сетчатки) и распространяется по всему зрительному пути, сохраняя при этом ретинотопию4. Первичная слуховая область (А1) демонстрирует синхронную активность, организованную в полосчатые субобласти, которые соответствуют изочастотным полосам в зрелом мозге. Активность исходит от внутренних волосковых клеток улитки 5,6. Кора ствола головного мозга в первичной соматосенсорной области (S1) демонстрирует лоскутную картину активности, при которой нейроны слоя 4 внутри отдельных бочек, а именно нейроны, реагирующие на отдельные усы, синхронно активируются7. Хотя предполагается, что он происходит из тройничного ганглия, источник активности остается неизвестным7. Следовательно, паттерны неонатальной активности специализированы как в каждой первичной сенсорной области, так и во внутриареальных подобластях. Одновременная визуализация нейронной активности и структуры первичных сенсорных областей может облегчить исследование вклада этих паттернов активности в развитие сенсорных систем.
В этой статье мы обобщили ряд протоколов: (1) визуализировать индивидуальную активность нейронов с помощью разреженной маркировки GCaMP и первичных сенсорных областей с использованием мышей TCA-RFP, экспрессирующих красный флуоресцентный белок в таламокортикальных аксонах7, (2) визуализировать активность на уровне одиночных клеток у неонатальных мышей с помощью двухфотонной микроскопии in vivoи (3) для анализа корреляций активности в коре ствола S1. Репрезентативные результаты показывают лоскутную синхронизированную активность в отдельных бочонках мыши после родового дня (P)6. Несмотря на некоторые ограничения, этот метод может быть использован для хронической визуализации, широкоугольной визуализации в нескольких сенсорных областях и различных экспериментов по манипулированию. Многогранный анализ нейронной активности во время развития обогатит наше понимание механизмов формирования мозговых цепей.
протокол
Все эксперименты проводились в соответствии с руководящими принципами экспериментов на животных Университета Кумамото и Национального института генетики и были одобрены комитетами по экспериментам на животных.
1. Внутриутробная электропорация (ИУЭ)
- Спаривание самцов мышей TCA-RFP на фоне ICR с самками мышей ICR дикого типа. Наблюдайте за вагинальной пробкой, чтобы проверить наличие случки рано утром следующего дня. Понаблюдайте за животом, чтобы проверить беременность через 2 недели.
- Приготовьте плазмидный раствор, содержащий 5 нг/мкл TRE-nCre, 1 мкг/мкл CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE и 0,02 % Trypan Blue в ddH2O для разреженной маркировки нейронов GCaMP с помощью системы Supernova8.
- Приготовьте обезболивающий раствор, содержащий 0,5 мг/мл карпрофена и 0,01 мг/мл бупренорфина. Защищайте его от света и храните при комнатной температуре.
- На эмбриональный день (E)14 выполните ВМЭ следующим образом. Методы IUE по существу те же, что и в предыдущих отчетах 9,10,11.
- Протрите лабораторный стол 70% раствором этанола или глутаральдегида. Стерилизуйте все хирургические инструменты путем автоклавирования. Носите маску и лабораторный халат, чтобы снизить риск заражения мыши.
- Подготовьте стеклянные микропипетки с помощью съемника микропипеток. Наберите раствор плазмидной смеси в стеклянную микропипетку с помощью аспираторной трубки.
- Вызвать анестезию беременным мышам на уровне Е14 с использованием изофлурана (2,0% на воздухе). Держите мышей под наркозом во время процедуры с изофлураном (1,2% на воздухе). Зажмите палец ноги, чтобы убедиться, что анестезия достаточно глубокая. Используйте офтальмологическую мазь для профилактики сухости глаз.
- Продезинфицируйте область живота не менее трех раз, чередуя раунды скраба на основе йода и 70% этанола. Накройте операционную область стерильной простыней. Сделайте разрез по средней линии и обнажите матку на простыне.
- Повторите капание теплого физиологического раствора на матку, чтобы предотвратить ее высыхание или охлаждение до закрытия брюшной полости (Шаг 1.4.8).
- Вводите плазмидный раствор в одну сторону бокового желудочка эмбрионов поочередно с помощью микропипетки и аспираторной трубки.
- С помощью электрода типа щипцов защемите головки эмбриона и подайте квадратные электрические импульсы (40 В, 50 мс) пять раз с интервалом в 1 с с помощью электропоратора.
- Вернуть матку в брюшную полость. Нанесите ~3 мл теплого физиологического раствора в полость. Зашиваем перитонеальную оболочку и кожу живота. Вводите обезболивающий раствор в концентрации 10 мкг/г (карпрофен в концентрации 5 мкг/г и бупренорфин в концентрации 0,1 мкг/г) под кожу в задней части шеи.
- Поместите мышь в клетку для восстановления на грелку (37 °C), чтобы восстановиться после анестезии. Положите мышь на брюхо, чтобы язык и слюна не захлебнули горло. Держите мышь отдельно от других мышей и следите за ней, пока она не восстановится, чтобы нормально двигаться. Верните мышь в клетку.
- После рождения проведите генотипирование для проверки аллеля RFP и усыпьте щенков без аллеля. Этот шаг рекомендуется, особенно если визуализация проводится в течение второй послеродовой недели, когда сигнал TCA-RFP слабый и его трудно проверить на шаге 2.2.7.
2. Хирургия черепных окон
- Приготовьте корковый буфер, содержащий 125 мМ NaCl, 5 мМ KCl, 10 мМ глюкозу, 10 мМ HEPES, 2 мМ CaCl2 и 2 мМ MgSO4 в ddH2O (pH скорректирован до 7,4 с 1 М NaOH)12 до дня операции. Стерилизуйте буфер с помощью вакуумного фильтра.
ПРИМЕЧАНИЕ: Буфер можно хранить при температуре 4 °C до 3 месяцев. Необходимый объем составляет 5-10 мл на одного щенка. - Выполните следующие шаги на стр. 3-12. Также смотрите предыдущие отчеты, в которых описывалась эта процедура13,14.
- Смешайте 50 мг агарозы с 5 мл буфера коры головного мозга и полностью растворите агарозу путем нагревания. Возьмите немного раствора в пробирку объемом 1,5 мл и поддерживайте ее при температуре 42 °C.
- Возьмите немного коркового буфера в коническую пробирку объемом 50 мл и держите ее при комнатной температуре. Возьмите немного физиологического раствора в емкость (например, крышку конической пробирки объемом 50 мл) и держите ее при комнатной температуре.
- Приготовьте обезболивающий раствор, содержащий 0,01 мг/мл бупренорфина. Защищайте его от света и храните при комнатной температуре.
- Стерилизуйте все хирургические инструменты путем автоклавирования. Продезинфицируйте флуоресцентный стереомикроскоп 70% этанолом.
- Используйте испаритель изофлурана, чтобы вызвать анестезию у щенка с изофлураном (2,0% на воздухе). Обратите внимание на щенка и вынимайте его, когда его дыхание немного замедлится.
ПРИМЕЧАНИЕ: Если анестезия длительная, дыхание щенка может остановиться на несколько секунд. Даже если дыхание щенка возобновится, длительная анестезия может уменьшить мозговой кровоток щенка и вызвать необратимое повреждение мозга. - Продезинфицируйте голову щенка не менее трех раз, чередуя раунды скраба на основе йода и 70% этанола. Поместите щенка на грелку (35 °C) под флуоресцентным стереомикроскопом. Всегда держите щенка под наркозом изофлурана (1,5%-2,5% на воздухе).
- Выберите детенышей, экспрессирующих TCA-RFP и GCaMP, наблюдая за флуоресценцией через череп. Усыпляйте щенков, у которых не проявляется и то, и другое.
- Удаляйте волосистую часть головы над полушариями головного мозга как можно шире осторожно, чтобы не вызвать кровотечение. Потрите череп стерильным ватным тампоном, смоченным в физрастворе, чтобы удалить соединительную ткань.
- После того, как череп высохнет, приклейте надрезанную поверхность кожи головы к черепу тканевым клеем.
- Переложите щенка на грелку с температурой 37 °C, чтобы восстановиться после анестезии. Подождите не менее 15 минут, чтобы клей застыл.
ПРИМЕЧАНИЕ: Сделайте паузу на 1 час, прежде чем переходить к следующему шагу. Подготовьте других щенков аналогичным образом, если это необходимо в течение этого времени. - Обезболите щенка изофлураном. Поместите щенка на грелку (37 °C) под флуоресцентным стереомикроскопом под наркозом под наркозом (1,5%-2,5% изофлурана на воздухе).
ПРИМЕЧАНИЕ: Если анестезия длится дольше, чем время до конечной точки (60 минут), усыпьте щенка путем обезглавливания во время анестезии изофлураном. - Отметьте на черепе место, экспрессирующее GCaMP, стерильным перманентным маркером. Нанесите на место буфер коры головного мозга.
- Вставьте уголок лезвия бритвы в череп. Медленно надавливайте на лезвие, чтобы сбрить череп и сделать отверстие. Отщипните пинцетом треснувший череп и удалите его.
- Убедитесь, что черепное отверстие успешно выполнено, наблюдая за кровеносными сосудами в отверстии. При возникновении кровотечения быстро промойте отверстие корковым буфером с помощью микропипетки. Повторяйте полоскание до полной остановки кровотечения.
- Нанесите каплю коркового буфера на отверстие черепа и поместите на отверстие стерильное круглое покровное стекло диаметром 3 мм. Излишки буфера сотрите нетканым материалом. Подождите, пока область вокруг стекла высохнет.
- Нанесите теплый раствор агарозы по краю стекла с помощью микропипетки. Поскольку слишком большое количество агарозы может снизить флуоресцентные сигналы, удалите излишки раствора под стеклом, осторожно надавливая на стекло сверху.
- Удалите агарозу на стекле или в отдалении от края стекла с помощью пинцета. Агарозу оставьте только по периметру внешнего стекла.
- Подождите, пока агароза застынет. Если агарозная усадка создает пространство под стеклом, добавьте раствор агарозы сбоку, чтобы покрыть весь край стекла. Удалите любую жидкость с поверхности черепа с помощью нетканого материала.
- Смешайте порошок акриловой смолы и жидкость в резиновой емкости. Отсадите смесь с помощью микропипетки и залейте ее, чтобы покрыть смолой агарозу, окружающую стеклянный край.
ПРИМЕЧАНИЕ: Поскольку смола затвердевает вскоре после смешивания порошка и жидкости, их необходимо многократно перемешать перед нанесением. Количество, необходимое для каждого смешивания, составляет ~500 μL для жидкости и ~0,15 г для порошка. - Закрепите титановый брусок со смолой на контралатеральной полусфере. Угол стержня должен быть параллельен покровному стеклу. Зафиксируйте смолой всю поверхность черепа.
- Вводите обезболивающий раствор в концентрации 10 л/г (бупренорфин в концентрации 0,1 мкг/г веса) под кожу на задней части шеи. Верните щенка к грелке при температуре 37 °C для восстановления после анестезии. Подождите >60 минут, чтобы смола застыла, прежде чем делать вывод.
ПРИМЕЧАНИЕ: Сделайте паузу на 1-5 часов перед визуализацией. В течение этого времени проводите операции на других щенках аналогичным образом.
3. Двухфотонная визуализация кальция
- Прикрепите двухосевой угломеритель с титановой пластиной к пластине предметного стола с расположением XY под микроскопом. Установите на сцене грелку (35 °C).
- Включите программу сканирования со следующими условиями: Пиксели, 512 x 512; Двунаправленный, ВКЛ; Усреднение, нет; Область визуализации, 600 x 600 μм с 20-кратным объективом. Установите настройки так, чтобы частота сканирования была выше 1 Гц.
- Поместите щенка на грелку, а титановый стержень закрепите на титановой пластине винтами. Держите щенка под наркозом, поместив трубочный порт для изофлурана (1,5-2,0% на воздухе).
- Отрегулируйте угол наклона окна по горизонтали с помощью угломера. Включите подсветку и наблюдайте за поверхностью мозга с помощью объектива с 5-кратным увеличением, а затем выберите область изображения по оси XY.
- Нанесите глазные капли на черепное окно. Переключите объектив на 20-кратную линзу с водяным погружением. Понаблюдайте за поверхностью коры головного мозга, чтобы убедиться, что на поверхности мозга виден кровоток.
- Выключите подсветку и сканируйте поверхность мозга в однофотонном режиме. Увеличьте мощность лазера, чтобы сделать видимой зеленую автофлуоресценцию стекла и поверхности мозга.
- Снизьте концентрацию изофлурана до 1,0%-1,5%. Накройте микроскоп крышкой, чтобы избежать утечки света. Переключите программное обеспечение сканирования в двухфотонный режим.
- Отрегулируйте мощность лазера и коэффициент усиления детектора, подходящие для сканирования сигналов GCaMP и RFP. Найдите глубину, на которой видны сигналы TCA-RFP. Убедитесь, что глубина слоя 4, ~300 мкм ниже, чем поверхность мозга в точке P6. Выберите область визуализации, в которой видно много GCaMP-экспрессирующих нейронов.
- Запуск таймлапс-визуализации сигналов GCaMP и RFP. Если двухканальное одновременное сканирование неприменимо, захватите изображения GCaMP и TCA-RFP перед созданием изображения.
- Прекратите прием изофлурана для ослабления анестезии и наблюдайте за спонтанной активностью в течение ~20 минут. Следите за движениями щенка во время съемки с помощью инфракрасной камеры. Немедленно возобновите анестезию изофлураном (2% на воздухе) при возникновении какой-либо реакции, указывающей на дистресс.
- После того как щенок перестанет двигаться, повторите визуализацию, полученную в шаге 3.9. При необходимости измените область изображения.
- Усыпьте щенка с помощью передозировки изофлурана. Фиксация головного мозга путем транскардиальной перфузии физиологического раствора и 4% PFA с последующей фиксацией в 4% PFA в течение ночи для приготовления тангенциальных срезов и выполнения иммуногистохимии. В противном случае усыпьте щенка с помощью передозировки анестетика с последующей обезглавливанием.
- Если у матери нет других детенышей, усыпьте мышь-мать с помощью передозировки анестетика с последующим вывихом шейки матки.
4. Анализ
- Запустите MATLAB и запустите EZcalcium toolbox15, чтобы открыть графический интерфейс пользователя (GUI) 'Initial GUI'.
- Компенсируйте смещение кадра изображения из-за движений мыши или по другим причинам.
- Нажмите «Коррекция движения » в исходном графическом интерфейсе, чтобы открыть графический интерфейс «Коррекция движения». Нажмите «Добавить файлы...», чтобы загрузить файл TIF с данными изображения.
- Установите следующие настройки: Коррекция нежесткого движения, пусто; Повышающий коэффициент дискретизации, 50; Макс Шифт, 15 лет; Начальный размер партии, 200; Ширина бункера, 200. Нажмите «Запустить коррекцию движения», чтобы выполнить коррекцию. Данные изображения с коррекцией движения будут сохранены автоматически.
ПРИМЕЧАНИЕ: Настройки должны быть отрегулированы в соответствии со свойствами данных изображения. Если дрейф некоторых кадров не компенсируется из-за нелинейных искажений кадров или движения коры головного мозга в направлении глубины, откройте исходные данные изображения без коррекции в ImageJ Fiji и удалите кадры, а затем перезапустите шаг 4.2.
- Обнаруживайте нейроны и рисуйте области интереса (ROI).
- Нажмите «Автоматическое определение ROI » в начальном графическом интерфейсе, чтобы открыть графический интерфейс «Обнаружение ROI». Нажмите кнопку «Добавить файлы...», чтобы загрузить данные изображения с коррекцией движения.
- Установите следующие настройки: Инициализация, Жадность; метод поиска, эллипс; Деконволюция, ограниченный FOOPSI-SPGL1; Авторегрессия, Распад; Предполагаемый # ROI, 60 (рекомендуется более чем в два раза больше визуально обнаруженного числа); Предполагаемая ширина ROI, 17 (~20 μм); порог слияния, 0,95; фактор помадки, 0,95; Пространственное понижение дискретизации, 1; Временная даунсэмплинг, 1; Временные итерации, 5.
ПРИМЕЧАНИЕ: Настройки должны быть отрегулированы в соответствии со свойствами данных изображения. - Нажмите кнопку Run ROI Detection, чтобы выполнить обнаружение. Данные ROI будут сохранены автоматически.
- Нажмите кнопку ROI Refinement в начальном графическом интерфейсе, чтобы открыть графический интерфейс ROI Refinement. Нажмите кнопку Загрузить данные , чтобы загрузить данные ROI. Выберите ROI, которые имели низкую частоту активности (<1 Гц), располагались под черепом или содержали невриты других нейронов. Нажмите кнопку Исключить ROI , чтобы исключить ROI из анализа.
- Выберите формат экспорта данных в XLSX и нажмите кнопку Экспорт данных , чтобы получить файл Excel с необработанными значениями dF/F. dF/F использует уравнение (1), где F — средняя интенсивность пикселей в каждом кадре, F0 — интенсивность сигнала на базовой линии, а Fb — фоновая флуоресценция.
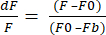 (1)
(1)
- Рассчитаем коэффициент корреляции Пирсона dF/F между ROI и построим матрицу коэффициентов корреляции. Используйте dF/F только после ослабления анестезии и начала возникать спонтанная активность (~10 минут после прекращения приема изофлурана).
- Определите кромки ствола на изображении TCA-RFP с помощью Fiji. Классифицируйте ROI по соответствующим бочкам или перегородкам. Сравните попарную корреляцию в пределах одной бочки и корреляцию между разными бочками.
- Генерируйте от 1 000 до 10 000 суррогатных данных, случайным образом перетасовывая соответствие между ROI и трассировками Ca2+ . Рассчитайте средний коэффициент корреляции в пределах отдельных баррелей в каждом суррогатном данных и оцените статистическую значимость корреляции в реальных данных.
Примечание: Если один из 10 000 суррогатов имеет значение выше действительного, статистическая значимость равна 0,0001. Анализы, описанные на шагах 4.5 и 4.6, могут быть проведены для объединенных данных от нескольких животных, как это было выполнено в других разделах 7,16.
Результаты
На рисунке 1 представлены репрезентативные результаты активности нейронов 4-го слоя в коре головного мозга щенка P6, визуализированные с использованием настоящего протокола. Двухфотонные изображения зеленого канала (GCaMP) и красного канала (TCA-RFP) были ус...
Обсуждение
Учитывая, что спонтанные действия исходят из органа чувств или низшей нервной системы и перемещаются в первичную сенсорную область попути, эквивалентному пути зрелой нервной системы, крайне важно определить первичную сенсорную область и расположение в?...
Раскрытие информации
У авторов нет конкурирующих финансовых интересов, о которых они могли бы заявить.
Благодарности
Эта работа была поддержана Японским обществом содействия научным грантам в помощь для трансформационных областей исследований (B) (22H05092, 22H05094) и грантами на научные исследования 20K06876, AMED под номером гранта 21wm0525015, Научным фондом Такеда, Фондом Найто, Мемориальным фондом бионауки Като, Фондом науки о жизни Кова, NIG-JOINT (24A2021) (Х.М.); и Японское общество содействия научным грантам на научные исследования 19K06887 и 22K06446, Мемориальный фонд медицинских исследований Кодама, Мемориальный фонд Уэхара, Мемориальный фонд бионауки Като и Научный фонд Такэда (N.N-T.). Мы благодарим доктора Такудзи Ивасато за мышей TCA-RFP.
Материалы
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
Ссылки
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340 (2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245 (2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25 (2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679 (2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173 (2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -. C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1 (2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942 (2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143 (2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены