Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yenidoğan Fare Duyusal Korteksinde Tek Nöron Çözünürlükte Spontan Aktivitenin İn vivo Görselleştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Neokorteksteki birincil duyusal alanlar, gelişim sırasında benzersiz spontan aktiviteler sergiler. Bu makale, yenidoğan farelerde alana özgü senkron aktiviteleri in vivo olarak analiz etmek için bireysel nöron aktivitelerinin ve birincil duyusal alanların nasıl görselleştirileceğini açıklamaktadır.
Özet
Memeli beyni, doğum öncesi ve doğum sonrası dönemler boyunca hem hücresel hem de devre düzeyinde dinamik gelişimsel değişikliklere uğrar. Bu gelişimsel değişikliklere katkıda bulunan çok sayıda genin keşfedilmesinin ardından, nöronal aktivitenin de bu süreçleri önemli ölçüde modüle ettiği bilinmektedir. Gelişmekte olan serebral kortekste, nöronlar, her bir birincil duyusal alana özelleşmiş senkronize aktivite modelleri sergiler. Bu kalıplar, olgun kortekste gözlemlenenlerden belirgin şekilde farklıdır ve bölgeye özgü gelişimsel süreçleri düzenlemedeki rollerini vurgular. Gelişim sırasında nöronal aktivitedeki eksiklikler çeşitli beyin hastalıklarına yol açabilir. Bu bulgular, nöronal gelişimdeki aktivite modellerinin altında yatan düzenleyici mekanizmaların incelenmesi ihtiyacını vurgulamaktadır. Bu makale, yenidoğan farelerde birincil duyusal alanları ve nöronal aktiviteyi görselleştirmek, in vivo olarak iki foton mikroskobu kullanarak kortikal alt alanlardaki bireysel nöronların aktivitesini görüntülemek ve alt alanla ilgili aktivite korelasyonlarını analiz etmek için bir dizi protokolü özetlemektedir. Somatosensoriyel korteksteki bireysel variller içindeki yama işi benzeri senkron aktivitenin temsili sonuçlarını gösteriyoruz. Ayrıca çeşitli potansiyel uygulamaları ve bu protokolün bazı sınırlamalarını da tartışıyoruz.
Giriş
Serebral korteks, farklı işlevlere sahip birkaç duyusal alan içerir. Alanlar, çoğunlukla omurilik veya beyin sapı yoluyla iletilen ve talamus 1,2 yoluyla iletilen karşılık gelen duyu organlarından kaynaklanan girdileri alır. Özellikle, her bir birincil duyusal alandaki nöronlar, aynı zamanda duyusal organlardan veya alt sinir merkezlerinden kaynaklanan, ancak esasen olgun korteks3'te gözlemlenen aktivitelerden farklı olan erken gelişim aşamalarında benzersiz bir şekilde senkronize aktivite sergiler.
Örneğin yenidoğan kemirgenlerinde, birincil görme alanı (V1), retinadan (retina dalgası) kaynaklanan ve retinotopiyi korurken tüm görme yolu boyunca yayılan dalga benzeri aktivite gösterir4. Birincil işitme alanı (A1), olgun beyindeki izofrekans bantlarına karşılık gelen bant şeklindeki alt bölgelerde düzenlenen senkron aktivite sergiler. Aktivite, kokleanın iç tüy hücrelerinden 5,6 yayılır. Birincil somatosensoriyel alandaki (S1) varil korteksi, tek tek variller içindeki katman 4 nöronlarının, yani bireysel bıyıklara yanıt veren nöronların eşzamanlı olarak aktive edildiği yama işi benzeri bir aktivite modeli gösterir7. Trigeminal gangliondan kaynaklandığı öne sürülmesine rağmen, aktivitenin kaynağı bilinmemektedir7. Sonuç olarak, neonatal aktivite paternleri hem her bir birincil duyusal alanda hem de alan içi alt alanlarda uzmanlaşmıştır. Nöronal aktivitenin ve birincil duyusal alanların yapısının eşzamanlı olarak görselleştirilmesi, bu aktivite modellerinin duyusal sistemlerin gelişimine katkısının araştırılmasını kolaylaştırabilir.
Bu makalede, bir dizi protokolü özetledik: (1) talamokortikal aksonlar7'de kırmızı floresan proteini eksprese eden TCA-RFP farelerini kullanarak GCaMP'nin seyrek etiketlemesini ve birincil duyusal alanları kullanarak bireysel nöronal aktiviteleri görselleştirmek, (2) in vivo olarak iki foton mikroskobu kullanarak yenidoğan farelerde tek hücre düzeyinde aktiviteyi görüntülemek içinve (3) S1 varil korteksi içindeki aktivite korelasyonlarını analiz etmek. Temsili sonuçlar, doğum sonrası bir gün (P)6 faresinin bireysel varilleri içinde yama işi benzeri senkronize aktiviteyi gösterir. Bazı sınırlamalara rağmen, bu teknik kronik görüntüleme, çoklu duyusal alanlarda geniş alan görüntüleme ve çeşitli manipülasyon deneyleri için kullanılabilir. Gelişim sırasındaki nöronal aktivitenin çok yönlü analizi, beyin devresi oluşum mekanizmalarına ilişkin anlayışımızı zenginleştirecektir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm deneyler, Kumamoto Üniversitesi ve Ulusal Genetik Enstitüsü'nün hayvan deneyleri yönergelerine uygun olarak gerçekleştirildi ve hayvan deneyleri komiteleri tarafından onaylandı.
1. In utero elektroporasyon (IUE)
- ICR arka planına sahip erkek TCA-RFP farelerini dişi vahşi tip ICR fareleri ile eşleştirin. Ertesi gün sabahın erken saatlerinde çiftleşmeyi kontrol etmek için vajinal tıkacı gözlemleyin. 2 hafta sonra hamileliği kontrol etmek için karnı gözlemleyin.
- Süpernovasistemini 8 kullanarak nöronları GCaMP ile seyrek olarak etiketlemek için 5 ng / μL TRE-nCre, 1 μg / μL CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE ve% 0.02Tripan Mavisi içeren plazmid çözeltisi hazırlayın.
- 0.5 mg / mL carprofen ve 0.01 mg / mL buprenorfin içeren bir analjezik çözelti hazırlayın. Işıktan koruyun ve oda sıcaklığında tutun.
- Embriyonik gün (E)14'te İEÜ'yü aşağıdaki gibi gerçekleştirin. İEÜ yöntemleri esasen öncekiraporlar 9,10,11 ile aynıdır.
- Laboratuvar tezgahını %70 etanol veya gluteraldehit solüsyonu ile silin. Tüm cerrahi aletleri otoklavlama ile sterilize edin. Fareye bulaşma riskini azaltmak için bir maske ve laboratuvar önlüğü giyin.
- Bir mikropipet çekicisi kullanarak cam mikropipetleri hazırlayın. Plazmid karışım solüsyonunu bir aspiratör tüpü kullanarak cam mikropipete alın.
- İzofluran (havada% 2.0) kullanarak E14'te hamile farelere anestezi indükleyin. İşlem sırasında fareleri izofluran (havada% 1.2) ile uyuşturulmuş halde tutun. Anestezinin yeterince derin olduğundan emin olmak için ayak parmağınızı sıkıştırın. Göz kuruluğunu önlemek için oftalmik merhem kullanın.
- Karın bölgesini alternatif olarak iyot bazlı ovma ve% 70 etanol ile en az üç kez dezenfekte edin. Cerrahi alanı kaplamak için steril bir örtü yerleştirin. Orta hatta bir kesi yapın ve uterusu örtünün üzerine maruz bırakın.
- Karın kapanana kadar kurumasını veya soğumasını önlemek için uterusun üzerine ılık salin damlatmayı tekrarlayın (Adım 1.4.8).
- Plazmid solüsyonunu, bir mikropipet ve bir aspiratör tüpü kullanarak embriyoların lateral ventrikülünün bir tarafına tek tek enjekte edin.
- Embriyo kafalarını sıkıştırmak için forseps tipi bir elektrot kullanın ve bir elektroporatör kullanarak 1 s aralıklarla beş kez kare elektrik darbeleri (40 V, 50 ms) verin.
- Uterusu karın boşluğuna geri getirin. Boşluğa ~ 3 mL ılık tuzlu su uygulayın. Periton zarını ve karın derisini dikin. Analjezik solüsyonu 10 μL/g ağırlıkta (5 μg/g ağırlıkta carprofen ve 0.1 μg/g ağırlıkta buprenorfin) boynun arkasındaki deri altına uygulayın.
- Anesteziden kurtulmak için fareyi bir ısıtma yastığı (37 °C) üzerindeki bir kurtarma kafesine yerleştirin. Dilinin ve tükürüğünün boğazı tıkamasını önlemek için fareyi karnının üzerine yatırın. Fareyi diğer farelerden ayrı tutun ve normal şekilde hareket etmek için iyileşene kadar izleyin. Fareyi kafese geri koyun.
- Doğumdan sonra, RFP alelini kontrol etmek için genotipleme yapın ve alel olmadan yavruları ötenazi yapın. Bu adım, özellikle görüntüleme, TCA-RFP sinyalinin zayıf olduğu ve adım 2.2.7'de kontrol edilmesinin zor olduğu doğum sonrası ikinci haftada yapılırsa önerilir.
2. Kraniyal pencere ameliyatı
- ddH2O'da 125 mM NaCl, 5 mM KCl, 10 mM glikoz, 10 mM HEPES, 2 mM CaCl2 ve 2 mM MgSO4 içeren korteks tamponunu hazırlayın (pH 1 M NaOH ile 7.4'e ayarlanır)12 ameliyat gününden önce. Tamponu bir vakum filtresi kullanarak sterilize edin.
NOT: Tampon 4 °C'de 3 aya kadar tutulabilir. Gerekli hacim yavru başına 5-10 mL'dir. - P3-12'de aşağıdaki adımları gerçekleştirin. Ayrıca, bu yordamı açıklayan önceki raporlara da bakın13,14.
- 50 mg agarozu 5 mL korteks tamponu ile karıştırın ve agarozu ısıtarak tamamen çözün. Solüsyonun bir kısmını 1,5 mL'lik bir tüpe alın ve 42 °C'de tutun.
- 50 mL'lik konik bir tüpe biraz korteks tamponu alın ve oda sıcaklığında tutun. Bir kaba (örneğin, 50 mL'lik bir konik tüpün kapağı) biraz tuzlu su alın ve oda sıcaklığında tutun.
- 0.01 mg / mL buprenorfin içeren bir analjezik çözelti hazırlayın. Işıktan koruyun ve oda sıcaklığında tutun.
- Tüm cerrahi aletleri otoklavlama ile sterilize edin. Floresan stereo mikroskobu% 70 etanol ile dezenfekte edin.
- İzofluran (havada% 2.0) ile yavruda anesteziyi indüklemek için bir izofluran buharlaştırıcı kullanın. Yavruya dikkat edin ve solunumu hafifçe yavaşladığında onu çıkarın.
NOT: Anestezi uzarsa, yavrunun solunumu birkaç saniye durabilir. Yavrunun solunumu devam etse bile, uzun süreli anestezi yavrunun beyin kan akışını azaltabilir ve geri dönüşü olmayan beyin hasarına neden olabilir. - Yavru kafasını alternatif turlarda iyot bazlı ovma ve% 70 etanol ile en az üç kez dezenfekte edin. Yavruyu floresan stereo mikroskop altında ısıtma yastığının (35 °C) üzerine yerleştirin. Yavruyu her zaman izofluran ile anestezi altında tutun (havada% 1.5 -% 2.5).
- Kafatasındaki floresansı gözlemleyerek TCA-RFP ve GCaMP'yi ifade eden yavruları seçin. Her ikisini de ifade etmeyen yavrulara ötenazi yapın.
- Kanamaya neden olmamak için serebral hemisferlerin üzerindeki kafa derisini mümkün olduğunca geniş bir şekilde dikkatlice çıkarın. Bağ dokusunu çıkarmak için kafatasını tuzlu suyla ıslatılmış steril bir pamuklu çubukla ovalayın.
- Kafatası kuruduktan sonra, kesilen kafa derisi yüzeyini bir doku yapıştırıcısı ile kafatasına yapıştırın.
- Anesteziden kurtulmak için yavruyu 37 °C'lik bir ısıtma yastığına aktarın. Yapıştırıcının katılaşması için en az 15 dakika bekleyin.
NOT: Bir sonraki adıma geçmeden önce 1 saate kadar bekleyin. Bu süre zarfında gerekirse diğer yavruları da benzer şekilde hazırlayın. - Yavruyu izofluran ile uyuşturun. Yavruyu anestezi altındayken (havada% 1.5 -% 2.5 izofluran) bir floresan stereo mikroskop altında ısıtma yastığının (37 ° C) üzerine yerleştirin.
NOT: Anestezi, son nokta için geçen süreden (60 dakika) daha uzun sürerse, izofluran ile anestezi sırasında yavruyu dekapitasyon ile ötenazi yapın. - Kafatası üzerindeki GCaMP ifade eden konumu steril bir kalıcı işaretleyici ile işaretleyin. Konuma korteks tamponu uygulayın.
- Bir tıraş bıçağının köşesini kafatasına sokun. Kafatasını tıraş etmek ve bir delik açmak için bıçağı yavaşça itin. Çatlak kafatasını cımbızla sıkıştırın ve çıkarın.
- Delikteki kan damarlarını gözlemleyerek kafatası deliğinin başarılı bir şekilde açılıp açılmadığını kontrol edin. Kanama meydana gelirse, bir mikropipet kullanarak deliği korteks tamponu ile hızlı bir şekilde durulayın. Kanama tamamen durana kadar durulamayı tekrarlayın.
- Kraniyal deliğe bir damla korteks tamponu uygulayın ve deliğin üzerine 3 mm çapında steril yuvarlak bir örtü camı yerleştirin. Fazla tamponu dokunmamış kumaşla silin. Camın etrafındaki alan kuruyana kadar bekleyin.
- Bir mikropipet kullanarak cam kenarının etrafına ılık agaroz solüsyonu uygulayın. Çok fazla agaroz floresan sinyallerini azaltabileceğinden, camı yukarıdan hafifçe iterek camın altındaki fazla çözeltiyi çıkarın.
- Cımbız kullanarak camın üzerindeki veya cam kenarından uzaktaki agarozu çıkarın. Agarozu sadece dış cam çevresinin etrafında bırakın.
- Agaroz katılaşana kadar bekleyin. Agaroz büzülmesi camın altında bir boşluk bırakırsa, tüm cam kenarını kaplayacak şekilde yandan agaroz solüsyonu ekleyin. Dokunmamış kumaşla kafatası yüzeyindeki herhangi bir sıvıyı çıkarın.
- Akrilik reçine tozunu ve sıvıyı kauçuk bir kapta karıştırın. Karışımı bir mikropipet ile aspire edin ve cam kenarını çevreleyen agarozu reçine ile kaplayacak şekilde dökün.
NOT: Reçine, toz ve sıvıyı karıştırdıktan kısa bir süre sonra katılaştığından, uygulamadan önce tekrar tekrar karıştırılmaları gerekir. Her karışımda ihtiyaç duyulan miktarlar sıvı için ~500 μL ve toz için ~0.15 g'dır. - Kontralateral hemisfer üzerine reçineli bir titanyum çubuk sabitleyin. Çubuk açısını kapak camına paralel tutun. Tüm kafatası yüzeyini reçine ile sabitleyin.
- Analjezik solüsyonu 10 μL/g ağırlıkta (0.1 μg/g ağırlıkta buprenorfin) boynun arkasındaki deri altına uygulayın. Anestezi iyileşmesi için yavruyu 37 °C'lik bir ısıtma yastığına geri koyun. Görüntüleme öncesi reçine katılaşması için >60 dakika bekleyiniz.
NOT: Görüntülemeden önce 1-5 saat bekleyin. Bu süre zarfında diğer yavrular üzerinde de benzer şekilde ameliyat yapın.
3. İki fotonlu kalsiyum görüntüleme
- Titanyum plakalı iki eksenli bir açıölçeri, mikroskobun altında XY konumlandırmalı bir sahne plakasına takın. Sahneye bir ısıtma yastığı (35 °C) kurun.
- Tarama yazılımını aşağıdaki koşullarla açın: Piksel, 512 x 512; Çift yönlü, AÇIK; Ortalama, yok; görüntüleme alanı, 600x objektif ile 600 x 20 μm. Ayarları, tarama hızı 1 Hz'den daha hızlı olacak şekilde ayarlayın.
- Yavruyu ısıtma yastığının üzerine yerleştirin ve başa takılan titanyum çubuğu vidalarla titanyum plakaya sabitleyin. İzofluran için bir tüp portu (havada% 1.5-2.0) yerleştirerek yavruyu uyuşturun.
- Açıyı açı ile yatay olarak açı olarak ayarlayın. Arka ışığı açın ve 5x objektif lens ile beyin yüzeyini gözlemleyin ve XY konumlandırma ile görüntüleme alanını seçin.
- Kraniyal pencereye göz damlası koyun. Objektifi 20x suya daldırmalı lense geçirin. Beyin yüzeyinde kan akışının görüldüğünü doğrulamak için kortikal yüzeyi gözlemleyin.
- Arka ışığı kapatın ve tek foton modunu kullanarak beyin yüzeyini tarayın. Camın ve beyin yüzeyinin yeşil otofloresansını görünür hale getirmek için lazer gücünü artırın.
- İzofluran konsantrasyonunu% 1.0 -% 1.5'e düşürün. Işık sızıntılarını önlemek için mikroskobu örtün. Tarama yazılımını iki foton moduna geçirin.
- GCaMP ve RFP sinyallerini taramak için uygun lazer gücünü ve dedektör kazancını ayarlayın. TCA-RFP sinyallerinin görüldüğü derinliği bulun. Derinliğin katman 4, P6'daki beyin yüzeyinden ~ 300 μm daha düşük olduğundan emin olun. Birçok GCaMP eksprese eden nöronun görüldüğü görüntüleme alanını seçin.
- GCaMP ve RFP sinyallerinin timelapse görüntülemesini başlatın. İki kanallı eşzamanlı tarama uygulanamıyorsa, görüntülemeden önce GCaMP ve TCA-RFP görüntülerini yakalayın.
- Anesteziyi zayıflatmak için izofluranı durdurun ve ~ 20 dakika boyunca spontan aktiviteleri gözlemleyin. Bir kızılötesi kamera kullanarak görüntüleme sırasında yavrunun hareketlerini izleyin. Sıkıntıyı gösteren herhangi bir yanıt gözlenirse derhal izofluran anestezisine (havada% 2) devam edin.
- Yavru hareket etmeyi bıraktıktan sonra, Adım 3.9'daki görüntülemeyi tekrarlayın. Gerekirse görüntüleme alanını değiştirin.
- Yavruyu aşırı dozda izofluran ile ötenazi yapın. Beyni, salin ve% 4 PFA'nın transkardiyal perfüzyonu ile sabitleyin, ardından teğetsel dilimler hazırlamak ve immünohistokimya yapmak için gece boyunca% 4 PFA'da son fiksasyon yapın. Aksi takdirde, yavruya aşırı dozda anestezik ile ötenazi yapın ve ardından dekapitasyon yapın.
- Barajın başka yavrusu yoksa, anne fareye aşırı dozda anestezik ve ardından servikal çıkık ile ötenazi yapın.
4. Analiz
- MATLAB'ı başlatın ve bir grafik kullanıcı arayüzü (GUI) 'İlk GUI' açmak için EZcalcium araç kutusu15'i çalıştırın.
- Fare hareketleri veya diğer nedenlerden dolayı görüntü çerçevesi kaymalarını telafi edin.
- Hareket Düzeltme GUI'sini açmak için İlk GUI'de Hareket Düzeltme'ye tıklayın. Görüntüleme verilerinin bir TIF dosyasını yüklemek için 'Dosya Ekle...'yi tıklayın.
- Ayarları aşağıdaki gibi ayarlayın: Rijit Olmayan Hareket Düzeltme, boş; Örnekleme Faktörü, 50; Maksimum Vardiya, 15; İlk parti büyüklüğü, 200; Bölme genişliği, 200. Düzeltmeyi gerçekleştirmek için 'Hareket Düzeltmeyi Çalıştır'a tıklayın. Hareket düzeltmeli görüntüleme verileri otomatik olarak kaydedilecektir.
NOT: Ayarlar, görüntüleme verileri özelliklerine göre ayarlanmalıdır. Doğrusal olmayan çerçeve bozulmaları veya korteksin derinlik yönündeki hareketi nedeniyle bazı karelerin sapmaları telafi edilmezse, orijinal görüntüleme verilerini ImageJ Fiji'de düzeltme yapmadan açın ve kareleri çıkarın ve adım 4.2'yi yeniden başlatın.
- Nöronları tespit edin ve ilgi alanlarını (ROI'ler) çizin.
- ROI Algılama GUI'sini açmak için İlk GUI'de Otomatik ROI Algılama'ya tıklayın. Hareket düzeltmeli görüntüleme verilerini yüklemek için Dosya Ekle...'ye tıklayın.
- Ayarları aşağıdaki gibi ayarlayın: Başlatma, Açgözlü; Arama Yöntemi, Elips; Dekonvolüsyon, kısıtlı FOOPSI-SPGL1; otoregresyon, bozunma; Tahmini # ROI, 60 (görsel olarak algılanan sayının iki katından fazlası önerilir); Tahmini ROI Genişliği, 17 (~20 μm); Birleştirme Eşiği, 0.95; Geçiştirme Faktörü, 0.95; Uzamsal Altörnekleme, 1; Sıcaklık Altörnekleme, 1; Temp. Yinelemeler, 5.
NOT: Ayarlar, görüntüleme verileri özelliklerine göre ayarlanmalıdır. - Algılamayı yürütmek için ROI Algılamasını Çalıştır'a tıklayın. ROI verileri otomatik olarak kaydedilecektir.
- ROI İyileştirme GUI'sini açmak için İlk GUI'de ROI İyileştirme'ye tıklayın. ROI verilerini yüklemek için Verileri Yükle'ye tıklayın. Düşük aktivite frekansına (<1 Hz) sahip, kafatasının altında bulunan veya diğer nöronların nöritlerini içeren ROI'leri seçin. ROI'leri analizden hariç tutmak için ROI'yi hariç tut'a tıklayın.
- XLSX'e Veri Dışa Aktarma Formatı'nı seçin ve ham dF/F değerlerine sahip bir Excel dosyası elde etmek için Verileri Dışa Aktar'a tıklayın. dF/F, F'nin her karedeki piksellerin ortalama yoğunluğu, F0'ın temel sinyal yoğunluğu ve Fb'nin arka plan floresansı olduğu denklem (1)'i kullanır.
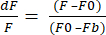 (1)
(1)
- ROI'ler arasındaki Pearson'ın dF/F korelasyon katsayısını hesaplayın ve bir korelasyon katsayısı matrisi yapın. dF/F'yi sadece anestezi zayıfladıktan ve spontan aktivite oluşmaya başladıktan sonra kullanın (izofluran durduktan ~ 10 dakika sonra).
- Fiji kullanarak TCA-RFP görüntüsünden namlu kenarlarını tanımlayın. ROI'leri kendi varillerine veya septalarına göre kategorilere ayırın. Aynı namlu içindeki ikili korelasyonu ve farklı namlular arasındaki korelasyonu karşılaştırın.
- ROI ve Ca2+ izlemeleri arasındaki yazışmaları rastgele karıştırarak 1.000 ila 10.000 yapay veri oluşturun. Her bir vekil verideki tek tek varillerdeki ortalama korelasyon katsayısını hesaplayın ve gerçek verilerdeki korelasyonun istatistiksel anlamlılığını değerlendirin.
NOT: 10.000 vekilden biri gerçek değerden daha yüksek bir değere sahipse, istatistiksel anlamlılık 0.0001'dir. Adım 4.5 ve 4.6'da açıklanan analizler, başka bir yerdegerçekleştirildiği gibi, birden fazla hayvandan toplanan veriler için yapılabilir 7,16.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Şekil 1, mevcut protokol kullanılarak görselleştirilen bir P6 yavrusunun namlu korteksindeki katman 4 nöron aktivitelerinin temsili sonuçlarını göstermektedir. Yeşil kanalın (GCaMP) ve kırmızı kanalın (TCA-RFP) iki foton görüntülerinin zamansal olarak ortalaması alındı ve Şekil 1A'da gösterildi. TCA-RFP floresansı, GCaMP floresansından çok daha zayıf olduğundan, GCaMP sinyali kırmızı kanala sızdı...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Spontan aktivitelerin duyu organından veya alt sinir sisteminden çıktığı ve olgun bir sinir sistemininkine eşdeğer bir yol yoluyla birincil duyu alanınagittiği göz önüne alındığında 3, birincil duyu alanını ve görüntülenen nöronların alan içindeki yerini tanımlamak çok önemlidir. Bu protokolde, talamokortikal aksonları görselleştiren transgenik fareler ve GCaMP'yi seyrekolarak ifade eden Süpernova sistemi 8 k...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların beyan etmek için rekabet eden hiçbir mali çıkarları yoktur.
Teşekkürler
Bu çalışma, Japonya Bilimi Teşvik Derneği tarafından desteklenmiştir Dönüştürücü Araştırma Alanları için Yardım Hibeleri (B) (22H05092, 22H05094) ve Bilimsel Araştırma Hibeleri 20K06876, AMED için 21wm0525015 Hibe Numarası, Takeda Bilim Vakfı, Naito Vakfı, Kato Memorial Biyobilim Vakfı, Kowa Yaşam Bilimleri Vakfı, NIG-JOINT (24A2021) (HM'ye); ve Japonya Bilimi Teşvik Derneği Bilimsel Araştırma Hibeleri 19K06887 ve 22K06446, Kodama Memorial Tıbbi Araştırma Fonu, Uehara Memorial Vakfı, Kato Memorial Bioscience Vakfı ve Takeda Bilim Vakfı (N.N-T.). TCA-RFP fareleri için Dr. Takuji Iwasato'ya teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
Referanslar
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340(2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245(2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679(2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173(2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1(2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942(2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143(2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106(2018).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır