JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
단일 뉴런 해상도에서 신생아 마우스 감각 피질의 자발적 활동에 대한 In vivo 시각화
* 이 저자들은 동등하게 기여했습니다
요약
신피질(neocortex)의 일차 감각 영역은 발달 과정에서 독특한 자발적 활동을 보입니다. 이 기사에서는 생체 내 신생아 마우스의 영역별 동기 활동을 분석하기 위해 개별 뉴런 활동과 주요 감각 영역을 시각화하는 방법을 설명합니다.
초록
포유류의 뇌는 출생 전과 출생 후 기간 동안 세포 수준과 회로 수준 모두에서 역동적인 발달 변화를 겪습니다. 이러한 발달 변화에 기여하는 수많은 유전자의 발견에 따라, 이제 신경 세포 활동도 이러한 과정을 실질적으로 조절하는 것으로 알려져 있습니다. 발달 중인 대뇌 피질에서 뉴런은 각 주요 감각 영역에 특화된 동기화된 활동 패턴을 나타냅니다. 이러한 패턴은 성숙한 피질에서 관찰되는 것과 현저하게 다르며, 영역 특이적 발달 과정을 조절하는 역할을 강조합니다. 발달 중 신경 활동의 결핍은 다양한 뇌 질환으로 이어질 수 있습니다. 이러한 발견은 신경 발달의 활동 패턴의 기저에 있는 조절 메커니즘을 조사할 필요성을 강조합니다. 이 논문은 신생아 마우스의 주요 감각 영역과 신경 세포 활동을 시각화하고, 생체 내에서 이광자 현미경을 사용하여 대뇌 피질 하위 필드 내 개별 뉴런의 활동을 이미지화하고, 하위 필드 관련 활동 상관 관계를 분석하기 위한 일련의 프로토콜을 요약합니다. 우리는 체성 감각 피질의 개별 배럴 내에서 패치워크와 같은 동기 활동의 대표적인 결과를 보여줍니다. 또한 다양한 잠재적 응용 프로그램과 이 프로토콜의 몇 가지 제한 사항에 대해서도 설명합니다.
서문
대뇌 피질에는 뚜렷한 기능을 가진 여러 감각 영역이 있습니다. 영역은 해당 감각 기관에서 시작된 입력을 받으며, 대부분 척수 또는 뇌간을 통해 전달되고 시상 1,2을 통해 전달됩니다. 주목할 만한 점은, 각 주요 감각 영역의 뉴런은 초기 발달 단계에서 독특하게 동기화된 활동을 보이는데, 이는 또한 감각 기관 또는 하부 신경 중추에서 시작되지만, 성숙한 피질에서 관찰되는 활동과는 본질적으로 다르다3.
예를 들어, 신생아 설치류에서 주요 시각 영역(V1)은 망막(망막파)에서 시작되어 망막근두근을 보존하면서 전체 시각 경로를 통해 전파되는 파동과 같은 활동을 나타냅니다4. 일차 청각 영역(A1)은 성숙한 뇌의 등주파 대역에 해당하는 띠 모양의 하위 영역으로 조직된 동기 활동을 나타냅니다. 이 활동은 달팽이관의 내부 유모 세포(inner hair cells) 5,6에서 발산됩니다. 일차 체성 감각 영역(primary somatosensory area, S1)에 있는 배럴 피질(barrel cortex)은 개별 배럴 내의 레이어 4 뉴런, 즉 개별 수염에 반응하는 뉴런이 동시에 활성화되는 패치워크와 같은 활동 패턴을 보여준다7. 삼차신경절(trigeminal ganglion)에서 유래한 것으로 제안되었지만, 활동의 원인은 알려져 있지 않다7. 결과적으로, 신생아 활동 패턴은 각 주요 감각 영역과 영역 내 하위 영역 내에서 전문화됩니다. 신경 활동과 주요 감각 영역의 구조를 동시에 시각화하면 이러한 활동 패턴이 감각 시스템의 발달에 기여하는 바에 대한 조사를 용이하게 할 수 있습니다.
이 기사에서는 일련의 프로토콜을 요약했습니다: (1) 시상피질 축삭돌기7에서 적색 형광 단백질을 발현하는 TCA-RFP 마우스를 사용하여 GCaMP 및 일차 감각 영역의 희소 라벨링을 사용하여 개별 신경 세포 활동을 시각화하고, (2) 생체 내에서 이광자 현미경을 사용하여 신생아 마우스의 단일 세포 수준 활동을 이미지화합니다, (3) S1 배럴 피질 내의 활동 상관 관계를 분석합니다. 대표적인 결과는 출생 후 일(P)6 마우스의 개별 배럴 내에서 패치워크와 같은 동기화된 활동을 보여줍니다. 몇 가지 제한 사항에도 불구하고 이 기술은 만성 이미징, 여러 감각 영역에 걸친 광시야 이미징 및 다양한 조작 실험에 사용할 수 있습니다. 발달 중 신경 세포의 활동에 대한 다면적인 분석은 뇌 회로 형성 메커니즘에 대한 우리의 이해를 풍부하게 할 것입니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 실험은 구마모토 대학과 국립 유전학 연구소의 동물 실험 지침에 따라 실시하고 동물 실험위원회의 승인을 받았습니다.
1. 자궁 내 전기천공법(IUE)
- ICR 배경의 수컷 TCA-RFP 마우스와 암컷 야생형 ICR 마우스를 짝짓습니다. 다음날 이른 아침에 짝짓기 여부를 확인하기 위해 질 플러그를 관찰하십시오. 2주 후 임신 여부를 확인하기 위해 복부를 관찰합니다.
- 초신성 시스템8을 사용하여 GCaMP로 뉴런을 희박하게 라벨링하기 위해 ddH2O에 5ng/μL TRE-nCre, 1μg/μL CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE 및 0.02% Trypan Blue를 포함하는 플라스미드 용액을 준비합니다.
- 0.5mg/mL의 카프로펜과 0.01mg/mL의 부프레노르핀을 함유한 진통제를 준비합니다. 빛으로부터 보호하고 실온에 보관하십시오.
- 배아 일째 (E)14일에 다음과 같이 IUE를 수행합니다. IUE 방법은 기본적으로 이전 보고서 9,10,11과 동일합니다.
- 70% 에탄올 또는 글루타르알데히드 용액으로 실험실 벤치를 닦습니다. 고압멸균으로 모든 수술 기구를 멸균합니다. 마우스의 감염 위험을 줄이기 위해 마스크와 실험복을 착용하십시오.
- 마이크로피펫 풀러를 사용하여 유리 마이크로피펫을 준비합니다. 흡인기 튜브를 사용하여 플라스미드 혼합물 용액을 유리 마이크로피펫에 넣습니다.
- 이소플루란(공기 중 2.0%)을 사용하여 E14에서 임신한 쥐에게 마취를 유도합니다. 시술 중에 이소플루란(공기 중 1.2%)으로 마우스를 마취 상태로 유지하십시오. 마취가 충분히 깊은지 확인하기 위해 발가락을 꼬집습니다. 안구 건조증을 예방하기 위해 안과 연고를 사용하십시오.
- 요오드 기반 스크럽과 70% 에탄올을 번갈아 가며 복부를 세 번 소독합니다. 수술 부위를 덮기 위해 멸균 드레이프를 놓습니다. 정중선을 절개하고 자궁을 드레이프에 노출시킵니다.
- 자궁이 건조되거나 냉각되지 않도록 복부가 닫힐 때까지 따뜻한 식염수를 자궁에 반복적으로 떨어뜨립니다(1.4.8단계).
- 마이크로피펫과 흡인기 튜브를 사용하여 배아의 측심실 한쪽에 플라스미드 용액을 하나씩 주입합니다.
- 겸자형 전극을 사용하여 배아 머리를 끼우고 전기천공기를 사용하여 40초 간격으로 50V(1V, 5ms)의 사각 전기 펄스(1V, ms)를 전달합니다.
- 자궁을 복강으로 되돌려 놓는다. ~3mL의 따뜻한 식염수를 캐비티에 적용합니다. 복막과 복부 피부를 봉합합니다. 진통제를 10μL/g 중량(카프로펜 5μg/g, 부프레노르핀 0.1μg/g)으로 목 뒤쪽 피부 아래에 투여합니다.
- 마우스를 가열 패드(37°C)의 회복 케이지에 넣어 마취에서 회복합니다. 쥐를 배에 눕혀 혀와 타액이 목을 막는 것을 방지하십시오. 마우스를 다른 마우스와 분리하고 정상적으로 움직일 수 있을 때까지 모니터링하십시오. 마우스를 케이지로 되돌립니다.
- 출생 후 유전형 분석을 수행하여 RFP 대립유전자를 확인하고 대립유전자가 없는 새끼를 안락사시킵니다. 이 단계는 특히 TCA-RFP 신호가 약하고 2.2.7단계에서 확인하기 어려운 출생 후 두 번째 주에 이미징을 수행하는 경우 권장됩니다.
2. 두개골 창 수술
- 수술 전에 125 mM NaCl, 5 mM KCl, 10 mM 포도당, 10 mM HEPES, 2 mM CaCl2 및 2 mM MgSO4 in ddH2O (1 M NaOH로 7.4로 pH 조정) 12를 포함하는 피질 완충액을 준비합니다. 진공 필터를 사용하여 완충액을 멸균합니다.
참고: 버퍼는 최대 4개월 동안 3°C에서 유지할 수 있습니다. 필요한 부피는 강아지당 5-10mL입니다. - P3-12에서 다음 단계를 수행합니다. 또한 이 절차를 설명한 이전 보고서도 참조하십시오13,14.
- 50mg의 아가로스와 5mL의 피질 완충액을 혼합하고 가열하여 아가로스를 완전히 녹입니다. 용액의 일부를 1.5mL 튜브에 넣고 42°C에서 유지합니다.
- 일부 피질 완충액을 50mL 원뿔형 튜브에 넣고 실온에서 보관합니다. 약간의 식염수를 용기(예: 50mL 원뿔형 튜브의 뚜껑)에 넣고 실온에 보관합니다.
- 0.01mg/mL 부프레노르핀이 함유된 진통제를 준비합니다. 빛으로부터 보호하고 실온에 보관하십시오.
- 고압멸균으로 모든 수술 기구를 멸균합니다. 형광 실체 현미경을 70% 에탄올로 소독합니다.
- 이소플루란 기화기를 사용하여 이소플루란(공기 중 2.0%)으로 강아지의 마취를 유도합니다. 강아지에게 주의를 기울이고 호흡이 약간 느려지면 데리고 나갑니다.
알림: 마취가 길어지면 강아지의 호흡이 몇 초 동안 멈출 수 있습니다. 강아지의 호흡이 재개되더라도 장기간 마취하면 강아지의 뇌혈류가 감소하고 돌이킬 수 없는 뇌 손상이 발생할 수 있습니다. - 요오드 기반 스크럽과 70% 에탄올을 번갈아 가며 강아지 머리를 세 번 소독합니다. 형광 실체 현미경 아래의 가열 패드(35°C)에 강아지를 놓습니다. 항상 강아지를 이소플루란(공기 중 1.5%-2.5%)으로 마취하십시오.
- 두개골을 통한 형광을 관찰하여 TCA-RFP 및 GCaMP를 발현하는 새끼를 선택합니다. 둘 다 발현하지 않는 새끼를 안락사시키십시오.
- 출혈이 발생하지 않도록 대뇌 반구 위의 두피를 가능한 한 조심스럽게 제거하십시오. 멸균 식염수를 적신 면봉으로 두개골을 문질러 결합 조직을 제거합니다.
- 두개골이 건조된 후 절개한 두피 표면을 티슈 접착제로 두개골에 밀착시킵니다.
- 마취에서 회복하기 위해 강아지를 37°C 가열 패드에 옮깁니다. 접착제가 응고될 때까지 최소 15분 동안 기다립니다.
알림: 다음 단계로 이동하기 전에 최대 1시간 동안 일시 중지하십시오. 이 시간 동안 필요한 경우 비슷한 방식으로 다른 새끼를 준비하십시오. - 이소플루란으로 강아지를 마취하십시오. 마취된 상태에서(공기 중 37%-1.5% 이소플루란) 형광 실체 현미경 아래의 가열 패드(2.5°C)에 강아지를 놓습니다.
참고: 마취가 종료 시간(60분)보다 길어지면 이소플루란으로 마취하는 동안 목을 베어 강아지를 안락사시키십시오. - 두개골의 GCaMP 발현 위치를 멸균 영구 마커로 표시합니다. 위치에 피질 버퍼를 적용합니다.
- 면도날의 모서리를 두개골에 삽입합니다. 칼날을 천천히 밀어 두개골을 깎고 구멍을 뚫습니다. 금이 간 두개골을 핀셋으로 잘라내고 제거합니다.
- 구멍 속의 혈관을 관찰하여 두개골 구멍이 성공적으로 만들어졌는지 확인하십시오. 출혈이 발생하면 마이크로피펫을 사용하여 피질 완충액으로 구멍을 빠르게 헹굽니다. 출혈이 완전히 멈출 때까지 헹굼을 반복합니다.
- 두개골 구멍에 피질 완충액 한 방울을 바르고 구멍 위에 직경 3mm의 멸균 원형 커버글라스를 넣습니다. 부직포로 여분의 버퍼를 닦아내십시오. 유리 주변이 마를 때까지 기다리십시오.
- 마이크로피펫을 사용하여 유리 가장자리 주위에 따뜻한 아가로스 용액을 바릅니다. 아가로스가 너무 많으면 형광 신호가 감소할 수 있으므로 유리를 위에서 부드럽게 밀어 유리 아래에 있는 여분의 용액을 제거합니다.
- 핀셋을 사용하여 유리의 아가로스를 제거하거나 유리 가장자리에서 멀리 떨어뜨립니다. 바깥쪽 유리 둘레만 아가로스를 두십시오.
- 아가로스가 응고될 때까지 기다리십시오. 아가로스 수축으로 인해 유리 아래에 공간이 생기면 측면에서 아가로스 용액을 추가하여 전체 유리 가장자리를 덮습니다. 부직포로 두개골 표면의 액체를 제거합니다.
- 고무 용기에 아크릴 수지 분말과 액체를 섞습니다. 마이크로피펫으로 혼합물을 흡인하고 붓어 유리 가장자리를 둘러싼 아가로스를 수지로 덮습니다.
알림: 수지는 분말과 액체를 혼합한 직후 응고되기 때문에 적용하기 전에 반복적으로 혼합해야 합니다. 각 혼합에 필요한 양은 액체의 경우 ~500μL, 분말의 경우 ~0.15g입니다. - 반대쪽 반구에 수지가 있는 티타늄 바를 고정합니다. 바 각도를 커버 유리와 평행하게 유지하십시오. 두개골 표면 전체를 수지로 고정합니다.
- 진통제를 10μL/g의 체중으로(부프레노르핀은 0.1μg/g의 체중으로) 목 뒤의 피부 아래에 투여합니다. 마취 회복을 위해 강아지를 37°C 가열 패드로 되돌립니다. 이미징하기 전에 수지 응고를 위해 >60분 동안 기다립니다.
알림: 이미징하기 전에 1-5시간 동안 일시 중지하십시오. 이 기간 동안 비슷한 방식으로 다른 새끼에게 수술을 수행하십시오.
3. 이광자 칼슘 이미징
- 티타늄 플레이트가 있는 2축 고니오미터를 현미경 아래에 XY 위치가 있는 스테이지 플레이트에 부착합니다. 스테이지에 가열 패드(35°C)를 설정합니다.
- 다음 조건에서 스캔 소프트웨어를 켭니다 : 픽셀, 512 x 512; 양방향, ON; 평균화, 없음; 이미징 영역, 600 x 600 μm, 20x 대물렌즈. 스캔 속도가 1Hz보다 빠르도록 설정합니다.
- 히팅 패드에 강아지를 놓고 헤드 마운트 티타늄 바를 나사로 티타늄 플레이트에 고정합니다. 이소플루란(공기 중 1.5-2.0%)을 위한 튜브 포트를 배치하여 강아지를 마취 상태로 유지하십시오.
- 고니오미터로 창 각도를 수평으로 조정합니다. 백라이트를 켜고 5x 대물렌즈로 뇌 표면을 관찰하고 XY 포지셔닝으로 이미징 영역을 선택합니다.
- 두개골 창에 안약을 넣으십시오. 대물렌즈를 20x 수침 렌즈로 전환하십시오. 뇌 피질 표면을 관찰하여 뇌 표면에서 혈류가 보이는지 확인합니다.
- 백라이트를 끄고 단광자 모드를 사용하여 뇌 표면을 스캔합니다. 레이저 출력을 높여 유리와 뇌 표면의 녹색 자가형광을 볼 수 있도록 합니다.
- 이소플루란 농도를 1.0%-1.5%로 낮춥니다. 빛 누출을 방지하기 위해 현미경을 덮으십시오. 스캐닝 소프트웨어를 이광자 모드로 전환합니다.
- GCaMP 및 RFP 신호를 스캔하는 데 적합한 레이저 출력과 검출기 게인을 조정합니다. TCA-RFP 신호가 표시되는 깊이를 찾습니다. 깊이가 P6의 뇌 표면보다 ~300μm 낮은 레이어 4 인지 확인하십시오. GCaMP 발현 뉴런이 많이 보이는 이미징 영역을 선택합니다.
- GCaMP 및 RFP 신호의 타임랩스 이미징을 시작합니다. 2채널 동시 스캔을 적용할 수 없는 경우 이미징 전에 GCaMP 및 TCA-RFP 이미지를 캡처합니다.
- 마취를 약화시키기 위해 이소플루란을 중단하고 ~20분 동안 자발적인 활동을 관찰합니다. 적외선 카메라를 사용하여 이미징하는 동안 강아지의 움직임을 모니터링합니다. 고통을 나타내는 반응이 관찰되면 즉시 이소플루란 마취(공기 중 2%)를 재개하십시오.
- 강아지가 움직임을 멈춘 후 3.9단계부터 이미징을 반복합니다. 필요한 경우 이미징 영역을 변경합니다.
- 이소플루란을 과다 복용한 강아지를 안락사시키십시오. 식염수와 4% PFA의 심혈관 관류로 뇌를 고정한 다음 밤새 4% PFA에 사후 고정하여 접선 절편을 준비하고 면역조직화학을 수행합니다. 그렇지 않으면 마취제를 과다 투여한 후 목을 베어 강아지를 안락사시킵니다.
- 댐에 다른 새끼가 없으면 마취제를 과다 투여한 후 자궁경부 탈구를 하여 어미 쥐를 안락사시킵니다.
4. 분석
- MATLAB을 시작하고 EZcalcium toolbox15를 실행하여 그래픽 사용자 인터페이스(GUI) '초기 GUI'를 엽니다.
- 마우스 움직임 또는 다른 원인으로 인한 이미지 프레임 드리프트를 보정합니다.
- 초기 GUI에서 모션 보정 을 클릭하여 모션 보정 GUI를 엽니다. '파일 추가...'를 클릭하여 이미징 데이터의 TIF 파일을 로드합니다.
- 다음과 같이 설정을 지정합니다: Non-rigid Motion Correction, blank; 업샘플링 계수, 50; 최대 시프트, 15; 초기 배치 크기, 200; 빈 너비, 200. 'Run Motion Correction'을 클릭하여 보정을 실행합니다. 모션 보정된 이미징 데이터는 자동으로 저장됩니다.
참고: 이미징 데이터 속성에 맞게 설정을 조정해야 합니다. 비선형 프레임 왜곡 또는 깊이 방향으로의 피질 이동으로 인해 일부 프레임의 드리프트가 보정되지 않는 경우 ImageJ Fiji에서 보정 없이 원본 이미징 데이터를 열고 프레임을 제거한 다음 4.2단계를 다시 시작합니다.
- 뉴런을 감지하고 관심 영역(ROI)을 그립니다.
- 초기 GUI에서 Automated ROI Detection 을 클릭하여 ROI Detection GUI를 엽니다. 파일 추가... 를 클릭하여 모션 보정된 이미징 데이터를 로드합니다.
- 다음과 같이 설정을 지정합니다 : Initialization, Greedy; 검색 방법, 타원; 디콘볼루션, 제한된 FOOPSI-SPGL1; 자가회귀, 붕괴; 예상 ROI # 60(육안으로 감지된 숫자의 두 배 이상이 권장됨); 예상 ROI 폭, 17(~20μm); 병합 임계값, 0.95; 퍼지 계수, 0.95; 공간 다운샘플링, 1; 온도 다운샘플링, 1; 온도 반복, 5.
참고: 이미징 데이터 속성에 맞게 설정을 조정해야 합니다. - Run ROI Detection(ROI 검출 실행)을 클릭하여 검출을 실행합니다. ROI 데이터는 자동으로 저장됩니다.
- 초기 GUI에서 ROI Refinement 를 클릭하여 ROI Refinement GUI를 엽니다. 데이터 불러오 기를 클릭하여 ROI 데이터를 불러옵니다. 활동 빈도(<1Hz)가 낮거나, 두개골 아래에 있거나, 다른 뉴런의 신경돌기를 포함하는 ROI를 선택합니다. ROI 제외 를 클릭하여 분석에서 ROI를 제외합니다.
- 데이터 내보내기 형식을 XLSX로 선택하고 데이터 내보내기를 클릭하여 원시 dF/F 값이 있는 Excel 파일을 얻습니다. dF/F는 방정식 (1)을 사용하며, 여기서 F는 모든 프레임에 있는 픽셀의 평균 강도, F0는 기준선 신호 강도, Fb는 배경 형광입니다.
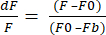 (1)
(1)
- ROI 간 dF/F의 Pearson의 상관 계수를 계산하고 상관 계수 행렬을 만듭니다. 마취가 약해지고 자발적인 활동이 발생하기 시작한 후(이소플루란을 중단한 후 ~10분) dF/F를 사용하십시오.
- Fiji를 사용하여 TCA-RFP 이미지에서 배럴 가장자리를 정의합니다. ROI를 각각의 배럴 또는 격막으로 분류합니다. 동일한 배럴 내의 쌍별 상관 관계와 다른 배럴 간의 쌍별 상관 관계를 비교합니다.
- ROI와 Ca2+ 추적 간의 대응을 무작위로 섞어 1,000개에서 10,000개의 대리 데이터를 생성합니다. 각 대리 데이터의 개별 배럴 내에서 평균 상관 계수를 계산하고 실제 데이터에서 상관 계수의 통계적 유의성을 평가합니다.
참고: 10,000개의 대리 값 중 하나가 실제 값보다 높은 값을 갖는 경우 통계적 유의성은 0.0001입니다. 단계 4.5 및 단계 4.6에서 기술된 분석은 다른 곳에서 수행된 바와 같이, 여러 동물로부터의 풀링된 데이터에 대해 수행될 수 있다 7,16.
Access restricted. Please log in or start a trial to view this content.
결과
그림 1은 본 프로토콜을 사용하여 시각화된 P6 새끼의 배럴 피질에서 레이어 4 뉴런 활동의 대표적인 결과를 보여줍니다. 녹색 채널(GCaMP)과 적색 채널(TCA-RFP)의 2광자 이미지를 시간적으로 평균화하여 그림 1A에 표시했습니다. TCA-RFP 형광은 GCaMP 형광보다 훨씬 약했기 때문에 GCaMP 신호가 적색 채널로 누출되었습니다(
Access restricted. Please log in or start a trial to view this content.
토론
자발적인 활동이 감각기관 또는 하부신경계에서 발생하여 성숙한신경계3와 동일한 경로를 통해 일차 감각 영역으로 이동한다는 점을 감안할 때, 주요 감각 영역과 해당 영역 내에서 이미지화된 뉴런의 위치를 정의하는 것이 중요하다. 이 프로토콜에서는 시상피질 축삭돌기(thalamocortical axons)와 GCaMP를 드문드문 발현하는 초신성 시스템(Supernova system)을 시...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 선언할 경쟁 재정적 이해관계가 없습니다.
감사의 말
이 연구는 일본 과학 진흥 협회(Japan Society for the Promotion of Science Grants-in-Aid for Transformative Research Areas (B))(22H05092, 22H05094) 및 과학 연구 보조금 20K06876, AMED(보조금 번호 21wm0525015), 다케다 과학 재단, 나이토 재단, 가토 기념 생명과학 재단, 고와 생명 과학 재단, NIG-JOINT(24A2021) (H.M.까지)의 지원을 받았습니다. 일본 과학 진흥 협회 과학 연구 보조금 19K06887 및 22K06446, 고다마 의학 연구 기념 기금, 우에하라 기념 재단, 가토 기념 생명 과학 재단 및 다케다 과학 재단 (N.N-T.). TCA-RFP 마우스에 대해 Takuji Iwasato 박사에게 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
참고문헌
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340(2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245(2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679(2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173(2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1(2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942(2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143(2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106(2018).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유