É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Visualização in vivo da atividade espontânea no córtex sensorial de camundongos neonatais com resolução de neurônio único
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
As áreas sensoriais primárias no neocórtex exibem atividades espontâneas únicas durante o desenvolvimento. Este artigo descreve como visualizar atividades de neurônios individuais e áreas sensoriais primárias para analisar atividades síncronas específicas de área em camundongos neonatais in vivo.
Resumo
O cérebro dos mamíferos sofre mudanças dinâmicas de desenvolvimento nos níveis celular e de circuito durante os períodos pré-natal e pós-natal. Após a descoberta de vários genes que contribuem para essas mudanças no desenvolvimento, sabe-se agora que a atividade neuronal também modula substancialmente esses processos. No córtex cerebral em desenvolvimento, os neurônios exibem padrões de atividade sincronizados que são especializados em cada área sensorial primária. Esses padrões diferem marcadamente daqueles observados no córtex maduro, enfatizando seu papel na regulação dos processos de desenvolvimento específicos da área. Deficiências na atividade neuronal durante o desenvolvimento podem levar a várias doenças cerebrais. Essas descobertas destacam a necessidade de examinar os mecanismos regulatórios subjacentes aos padrões de atividade no desenvolvimento neuronal. Este artigo resume uma série de protocolos para visualizar áreas sensoriais primárias e atividade neuronal em camundongos neonatais, para obter imagens da atividade de neurônios individuais dentro dos subcampos corticais usando microscopia de dois fótons in vivo e para analisar correlações de atividade relacionadas ao subcampo. Mostramos resultados representativos da atividade síncrona semelhante a uma colcha de retalhos dentro de barris individuais no córtex somatossensorial. Também discutimos várias aplicações potenciais e algumas limitações deste protocolo.
Introdução
O córtex cerebral contém várias áreas sensoriais com funções distintas. As áreas recebem informações provenientes de seus órgãos sensoriais correspondentes, principalmente transmitidas pela medula espinhal ou tronco encefálico e retransmitidas pelo tálamo 1,2. Notavelmente, os neurônios em cada área sensorial primária exibem atividade sincronizada de forma única durante os estágios iniciais de desenvolvimento, que também se originam de órgãos sensoriais ou dos centros nervosos inferiores, mas diferem essencialmente das atividades observadas no córtex maduro3.
Em roedores neonatais, por exemplo, a área visual primária (V1) exibe atividade ondulatória, que se origina na retina (onda retiniana) e se propaga por toda a via visual enquanto conserva a retinotopia4. A área auditiva primária (A1) exibe atividade síncrona organizada em sub-regiões em forma de banda que correspondem às bandas de isofrequência no cérebro maduro. A atividade emana das células ciliadas internas da cóclea 5,6. O córtex do barril na área somatossensorial primária (S1) mostra um padrão de atividade semelhante a uma colcha de retalhos no qual os neurônios da camada 4 dentro de barris individuais, ou seja, neurônios responsivos a bigodes individuais, são ativados de forma síncrona7. Embora se proponha que se origine do gânglio trigêmeo, a origem da atividade permanece desconhecida7. Consequentemente, os padrões de atividade neonatal são especializados tanto em cada área sensorial primária quanto em subcampos intra-aárea. A visualização simultânea da atividade neuronal e da estrutura das áreas sensoriais primárias pode facilitar uma investigação sobre a contribuição desses padrões de atividade para o desenvolvimento dos sistemas sensoriais.
Neste artigo, resumimos uma série de protocolos: (1) para visualizar atividades neuronais individuais usando marcação esparsa de GCaMP e áreas sensoriais primárias usando camundongos TCA-RFP que expressam proteína fluorescente vermelha em axônios tálamo-corticais7, (2) para visualizar a atividade em nível de célula única em camundongos neonatais usando microscopia de dois fótons in vivoe (3) analisar as correlações de atividade dentro do córtex de barril S1. Os resultados representativos mostram atividade sincronizada semelhante a uma colcha de retalhos dentro de barris individuais de um camundongo pós-natal (P) 6. Apesar de algumas limitações, essa técnica pode ser usada para imagens crônicas, imagens de campo amplo em várias áreas sensoriais e vários experimentos de manipulação. A análise multifacetada da atividade neuronal durante o desenvolvimento enriquecerá nossa compreensão dos mecanismos de formação do circuito cerebral.
Protocolo
Todos os experimentos foram conduzidos de acordo com as diretrizes para experimentação animal da Universidade de Kumamoto e do Instituto Nacional de Genética e aprovados pelos comitês de experimentação animal.
1. Eletroporação in utero (IUE)
- Acasalar camundongos TCA-RFP machos de fundo ICR com camundongos ICR fêmeas do tipo selvagem. Observe o tampão vaginal para verificar se há acasalamento na manhã do dia seguinte. Observe o abdômen para verificar se há gravidez 2 semanas depois.
- Preparar uma solução plasmidial contendo 5 ng/μL de TRE-nCre, 1 μg/μL de CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE e 0,02 % de azul de tripano em ddH2O para marcar esparsamente os neurónios por GCaMP utilizando o sistema Supernova8.
- Prepare uma solução analgésica contendo 0,5 mg/mL de carprofeno e 0,01 mg/ml de buprenorfina. Proteja-o da luz e mantenha-o em temperatura ambiente.
- No dia embrionário (E)14, realize a EIU da seguinte forma. Os métodos IUE são essencialmente os mesmos dos relatórios anteriores 9,10,11.
- Limpe a bancada do laboratório com etanol a 70% ou solução de glutaraldeído. Esterilize todos os instrumentos cirúrgicos em autoclavagem. Use uma máscara e um jaleco para reduzir o risco de infecção do camundongo.
- Prepare micropipetas de vidro usando um extrator de micropipetas. Leve a solução da mistura de plasmídeo para a micropipeta de vidro usando um tubo aspirador.
- Induzir anestesia aos camundongos prenhes em E14 usando isoflurano (2,0% no ar). Mantenha os camundongos anestesiados durante o procedimento com isoflurano (1,2% no ar). Aperte o dedo do pé para garantir que a anestesia seja profunda o suficiente. Use pomada oftálmica para evitar o ressecamento dos olhos.
- Desinfete a área abdominal pelo menos três vezes com rodadas alternadas de esfoliante à base de iodo e etanol a 70%. Coloque uma cortina estéril para cobrir a área cirúrgica. Faça uma incisão na linha média e exponha o útero na cortina.
- Repita pingando solução salina morna no útero para evitar que ele seque ou esfrie até o fechamento do abdômen (Etapa 1.4.8).
- Injectar a solução plasmidial num dos lados do ventrículo lateral dos embriões, um a um, utilizando uma micropipeta e um tubo de aspiração.
- Use um eletrodo do tipo fórceps para beliscar as cabeças do embrião e fornecer pulsos elétricos quadrados (40 V, 50 ms) cinco vezes em intervalos de 1 s usando um eletroporador.
- Retorne o útero para a cavidade abdominal. Aplique ~ 3 mL de solução salina morna na cavidade. Suturar a membrana peritoneal e a pele abdominal. Administre a solução analgésica a 10 μL / g de peso (carprofeno a 5 μg / g de peso e buprenorfina a 0,1 μg / g de peso) sob a pele na parte de trás do pescoço.
- Coloque o mouse em uma gaiola de recuperação em uma almofada de aquecimento (37 °C) para se recuperar da anestesia. Deite o rato de barriga para baixo para evitar que a língua e a saliva sufoquem a garganta. Mantenha o mouse separado de outros mouses e monitore-o até que ele se recupere para se mover normalmente. Retorne o mouse para a gaiola.
- Após o nascimento, realize a genotipagem para verificar o alelo RFP e eutanasiar os filhotes sem o alelo. Esta etapa é recomendada, especialmente se a imagem for feita durante a segunda semana pós-natal, quando o sinal TCA-RFP é fraco e difícil de verificar na etapa 2.2.7.
2. Cirurgia da janela craniana
- Prepare o tampão do córtex contendo 125 mM de NaCl, 5 mM de KCl, 10 mM de glicose, 10 mM de HEPES, 2 mM de CaCl2 e 2 mM de MgSO4 em ddH2O (pH ajustado para 7,4 com 1 M de NaOH)12 antes do dia da cirurgia. Estéril o tampão usando um filtro a vácuo.
NOTA: O tampão pode ser mantido a 4 °C por até 3 meses. O volume necessário é de 5 a 10 mL por filhote. - Execute as etapas a seguir em P3-12. Veja também os relatórios anteriores que descreveram este procedimento13,14.
- Misture 50 mg de agarose com 5 mL de tampão do córtex e dissolva completamente a agarose por aquecimento. Leve um pouco da solução para um tubo de 1,5 ml e mantenha-o a 42 °C.
- Leve um pouco de tampão de córtex para um tubo cônico de 50 mL e mantenha-o em temperatura ambiente. Leve um pouco de soro fisiológico para um recipiente (por exemplo, uma tampa de um tubo cônico de 50 mL) e mantenha-o em temperatura ambiente.
- Prepare uma solução analgésica contendo 0,01 mg/ml de buprenorfina. Proteja-o da luz e mantenha-o em temperatura ambiente.
- Esterilize todos os instrumentos cirúrgicos em autoclavagem. Desinfete o microscópio estéreo de fluorescência com etanol a 70%.
- Use um vaporizador de isoflurano para induzir anestesia no filhote com isoflurano (2,0% no ar). Preste atenção ao filhote e retire-o quando sua respiração diminuir um pouco.
NOTA: Se a anestesia for prolongada, a respiração do filhote pode cessar por alguns segundos. Mesmo que a respiração do filhote seja retomada, a anestesia prolongada pode diminuir o fluxo sanguíneo cerebral do filhote e causar danos cerebrais irreversíveis. - Desinfete a cabeça do filhote pelo menos três vezes com rodadas alternadas de esfoliante à base de iodo e etanol 70%. Coloque o filhote na almofada de aquecimento (35 °C) sob um microscópio estéreo de fluorescência. Sempre mantenha o filhote anestesiado com isoflurano (1,5%-2,5% no ar).
- Selecione os filhotes que expressam TCA-RFP e GCaMP observando a fluorescência através do crânio. Eutanasiar os filhotes que não expressam ambos.
- Remova o couro cabeludo acima dos hemisférios cerebrais o mais amplamente possível com cuidado para não causar sangramento. Esfregue o crânio com um cotonete estéril embebido em solução salina para remover o tecido conjuntivo.
- Depois que o crânio secar, cole a superfície do couro cabeludo incisada ao crânio com um adesivo de tecido.
- Transfira o filhote para uma almofada de aquecimento a 37 °C para se recuperar da anestesia. Aguarde pelo menos 15 minutos para que o adesivo solidifique.
NOTA: Faça uma pausa de até 1 h antes de passar para a próxima etapa. Prepare outros filhotes de maneira semelhante, se necessário, durante esse período. - Anestesie o filhote com isoflurano. Coloque o filhote na almofada de aquecimento (37 °C) sob um microscópio estéreo de fluorescência enquanto anestesiado (1,5%-2,5% de isoflurano no ar).
NOTA: Se a anestesia prolongar mais do que o tempo para o desfecho (60 min), eutanasiar o filhote por decapitação durante anestesiado com isoflurano. - Marque o local que expressa GCaMP no crânio com um marcador permanente estéril. Aplique o buffer do córtex no local.
- Insira o canto de uma lâmina de barbear no crânio. Empurre a lâmina lentamente para raspar o crânio e fazer um furo. Retire o crânio rachado com uma pinça e remova-o.
- Verifique se o orifício craniano foi feito com sucesso observando os vasos sanguíneos no orifício. Se ocorrer sangramento, enxágue rapidamente o orifício com tampão de córtex usando uma micropipeta. Repita o enxágue até que o sangramento pare completamente.
- Aplique uma gota de tampão de córtex no orifício craniano e coloque em uma lamínula redonda estéril de 3 mm de diâmetro sobre o orifício. Limpe o excesso de buffer com tecido não tecido. Espere até que a área ao redor do vidro seque.
- Aplique uma solução quente de agarose ao redor da borda do vidro usando uma micropipeta. Como muita agarose pode reduzir os sinais fluorescentes, remova o excesso de solução sob o vidro empurrando suavemente o vidro por cima.
- Remova a agarose no vidro ou distante da borda do vidro usando uma pinça. Deixe a agarose apenas ao redor do perímetro externo do vidro.
- Espere até que a agarose se solidifique. Se o encolhimento da agarose abrir espaço sob o vidro, adicione a solução de agarose do lado para cobrir toda a borda do vidro. Remova qualquer líquido da superfície do crânio com tecido não tecido.
- Misture o pó de resina acrílica e o líquido em um recipiente de borracha. Aspire a mistura com uma micropipeta e despeje para cobrir a agarose ao redor da borda do vidro com resina.
NOTA: Como a resina solidifica logo após a mistura do pó e do líquido, eles precisam ser misturados repetidamente antes de aplicar. As quantidades necessárias em cada mistura são ~500 μL para líquido e ~0,15 g para pó. - Fixe uma barra de titânio com resina no hemisfério contralateral. Mantenha o ângulo da barra paralelo à lamínula. Fixe toda a superfície do crânio com resina.
- Administre a solução analgésica a 10 μL / g de peso (buprenorfina a 0,1 μg / g de peso) sob a pele na parte de trás do pescoço. Retorne o filhote a uma almofada de aquecimento a 37 °C para recuperação da anestesia. Aguarde >60 min para solidificação da resina antes de fazer a imagem.
NOTA: Faça uma pausa de 1-5 h antes de fazer a imagem. Realize a cirurgia em outros filhotes de maneira semelhante durante esse período.
3. Imagem de cálcio de dois fótons
- Conecte um goniômetro de dois eixos com uma placa de titânio a uma placa de platina com posicionamento XY abaixo do microscópio. Coloque uma almofada de aquecimento (35 °C) no palco.
- Ligue o software de digitalização com as seguintes condições: Pixels, 512 x 512; Bidirecional, ON; Média, nenhuma; Área de imagem, 600 x 600 μm com objetiva de 20x. Defina as configurações para que a taxa de varredura seja superior a 1 Hz.
- Coloque o filhote na almofada de aquecimento e fixe a barra de titânio montada na cabeça na placa de titânio com parafusos. Mantenha o filhote anestesiado colocando uma porta de tubo para isoflurano (1,5-2,0% no ar).
- Ajuste o ângulo da janela horizontalmente pelo goniômetro. Ligue a luz de fundo e observe a superfície do cérebro com uma lente objetiva 5x e selecione a área de imagem pelo posicionamento XY.
- Coloque colírio na janela craniana. Mude a objetiva para uma lente de imersão em água de 20x. Observe a superfície cortical para confirmar que o fluxo sanguíneo é visto na superfície do cérebro.
- Desligue a luz de fundo e escaneie a superfície do cérebro usando o modo de um fóton. Aumente a potência do laser para tornar visível a autofluorescência verde do vidro e da superfície do cérebro.
- Abaixe a concentração de isoflurano para 1,0% -1,5%. Cubra o microscópio para evitar vazamentos de luz. Mude o software de digitalização para o modo de dois fótons.
- Ajuste a potência do laser e o ganho do detector apropriados para escanear sinais GCaMP e RFP. Encontre a profundidade onde os sinais TCA-RFP são vistos. Certifique-se de que a profundidade seja a camada 4, ~ 300 μm abaixo da superfície do cérebro em P6. Selecione a área de imagem onde muitos neurônios que expressam GCaMP são vistos.
- Inicie a geração de imagens de lapso de tempo de sinais GCaMP e RFP. Se a varredura simultânea de dois canais for inaplicável, capture imagens GCaMP e TCA-RFP antes da imagem.
- Interrompa o isoflurano para enfraquecer a anestesia e observe as atividades espontâneas por ~ 20 min. Monitore os movimentos do filhote durante a imagem usando uma câmera infravermelha. Retome a anestesia com isoflurano (2% no ar) imediatamente se for observada qualquer resposta indicando sofrimento.
- Depois que o filhote parar de se mover, repita a imagem da Etapa 3.9. Altere a área de imagem, se necessário.
- Eutanásia do filhote com uma overdose de isoflurano. Fixar o cérebro por perfusão transcárdica de solução salina e PFA a 4%, seguido de pós-fixação em PFA a 4% durante a noite para preparar fatias tangenciais e realizar imuno-histoquímica. Caso contrário, eutanasiar o filhote com uma overdose de anestésico seguida de decapitação.
- Se a mãe não tiver outros filhotes, sacrifique a mãe com uma overdose de anestésico seguida de luxação cervical.
4. Análise
- Inicie o MATLAB e execute o EZcalcium toolbox15 para abrir uma interface gráfica do usuário (GUI) 'GUI inicial'.
- Compense os desvios do quadro da imagem devido a movimentos do mouse ou outras causas.
- Clique em Correção de movimento na GUI inicial para abrir a GUI de correção de movimento. Clique em 'Adicionar arquivos...' para carregar um arquivo TIF dos dados de imagem.
- Defina as configurações da seguinte forma: Correção de movimento não rígida, em branco; Fator de aumento de amostragem, 50; Turno máximo, 15; Tamanho inicial do lote, 200; Largura do Bin, 200. Clique em 'Executar correção de movimento' para executar a correção. Os dados de imagem corrigidos por movimento serão salvos automaticamente.
NOTA: As configurações devem ser ajustadas às propriedades dos dados de imagem. Se os desvios de alguns quadros não forem compensados devido a distorções de quadros não lineares ou movimento do córtex na direção da profundidade, abra os dados de imagem originais sem correção no ImageJ Fiji e remova os quadros e reinicie a etapa 4.2.
- Detecte neurônios e desenhe regiões de interesse (ROIs).
- Clique em Detecção automatizada de ROI na GUI inicial para abrir a GUI de detecção de ROI. Clique em Adicionar arquivos... para carregar os dados de imagem com correção de movimento.
- Defina as configurações da seguinte forma: Inicialização, Ganancioso; Método de Busca, Elipse; Deconvolução Restrita FOOPSI-SPGL1; Auto-regressão, Decaimento; # estimado de ROIs, 60 (recomenda-se mais que o dobro do número detectado visualmente); Largura estimada do ROI, 17 (~20 μm); Limite de mesclagem, 0,95; Fator de correção, 0,95; Redução da Amostragem Espacial, 1; Temp. Downsampling, 1; Temp. Iterações, 5.
NOTA: As configurações devem ser ajustadas às propriedades dos dados de imagem. - Clique em Executar detecção de ROI para executar a detecção. Os dados de ROI serão salvos automaticamente.
- Clique em Refinamento de ROI na GUI inicial para abrir a GUI de refinamento de ROI. Clique em Carregar dados para carregar os dados de ROI. Selecione as ROIs que tinham baixa frequência de atividade (<1 Hz), localizadas sob o crânio ou continham neuritos de outros neurônios. Clique em Excluir ROI para excluir os ROIs da análise.
- Selecione o Formato de exportação de dados para XLSX e clique em Exportar dados para obter um arquivo do Excel com valores brutos de dF/F. O dF/F usa a equação (1), onde F é a intensidade média dos pixels em cada quadro, F0 é a intensidade do sinal de linha de base e Fb é a fluorescência de fundo.
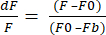 Características (1)
Características (1)
- Calcule o coeficiente de correlação de Pearson de dF/F entre ROIs e faça uma matriz de coeficiente de correlação. Use dF / F somente após a anestesia enfraquecer e a atividade espontânea começar a ocorrer (~ 10 minutos após a interrupção do isoflurano).
- Defina as bordas do barril a partir da imagem TCA-RFP usando Fiji. Categorize os ROIs para seus respectivos barris ou septos. Compare a correlação de pares dentro do mesmo cano e entre barris diferentes.
- Gere de 1.000 a 10.000 dados substitutos embaralhando aleatoriamente a correspondência entre ROI e traços de Ca2+ . Calcule o coeficiente de correlação médio dentro de barris individuais em cada dado substituto e avalie a significância estatística da correlação nos dados reais.
NOTA: Se uma das 10.000 substitutas tiver um valor maior que o valor real, a significância estatística é 0,0001. As análises descritas nas etapas 4.5 e 4.6 podem ser conduzidas para dados agrupados de vários animais, como realizado em outros lugares 7,16.
Resultados
A Figura 1 mostra os resultados representativos das atividades dos neurônios da camada 4 no córtex do barril de um filhote P6 visualizado usando o presente protocolo. Imagens de dois fótons do canal verde (GCaMP) e do canal vermelho (TCA-RFP) foram calculadas temporalmente e mostradas na Figura 1A. Como a fluorescência TCA-RFP era muito mais fraca do que a fluorescência GCaMP, o sinal GCaMP vazou para o canal vermelho (
Discussão
Dado que as atividades espontâneas emergem do órgão sensorial ou do sistema nervoso inferior e viajam para a área sensorial primária por meio de uma via equivalente à de um sistema nervoso maduro3, é crucial definir a área sensorial primária e a localização dos neurônios imageados dentro da área. Neste protocolo, abordamos esse requisito empregando camundongos transgênicos que visualizam axônios tálamo-corticais e o sistema Supernova que expressa G...
Divulgações
Os autores não têm interesses financeiros concorrentes a declarar.
Agradecimentos
Este trabalho foi apoiado pela Sociedade Japonesa para a Promoção de Bolsas de Ciência em Auxílio para Áreas de Pesquisa Transformativa (B) (22H05092, 22H05094) e para Bolsas de Pesquisa Científica 20K06876, AMED sob o número de concessão 21wm0525015, a Takeda Science Foundation, a Naito Foundation, a Kato Memorial Bioscience Foundation, a Kowa Life Science Foundation, NIG-JOINT (24A2021) (para HM); e Sociedade Japonesa para a Promoção de Bolsas de Ciência em Auxílio para Bolsas de Pesquisa Científica 19K06887 e 22K06446, o Fundo Memorial Kodama para Pesquisa Médica, a Fundação Memorial Uehara, a Fundação de Biociência Memorial Kato e a Fundação Científica Takeda (para NNT). Agradecemos ao Dr. Takuji Iwasato pelos camundongos TCA-RFP.
Materiais
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
Referências
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340 (2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245 (2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25 (2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679 (2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173 (2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -. C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1 (2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942 (2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143 (2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados