Method Article
生成用于转化生物医学研究的牛原代肠源二维单层培养系统
摘要
类肠正在成为研究组织生理学和病理生理学、药物开发和再生医学的新模型。在这里,我们描述了一种牛原代细胞 2D 肠源培养系统,该系统允许与相关组织细胞类型共培养。该模型为胃肠道研究建模提供了转化优势。
摘要
类器官细胞培养系统可以概括组织中观察到的复杂性,使其可用于研究宿主-病原体相互作用、评估药物疗效和毒性以及组织生物工程。但是,由于这些模型的三维 (3D) 性质,出于上述原因应用这些模型可能会受到限制。例如,由于肠腔及其分泌物质无法进入,因此使用 3D 肠培养系统研究消化系统疾病具有挑战性。事实上,用病原体刺激 3D 类器官需要管腔显微注射、3D 结构的机械破坏或产生顶端排出的类肠。此外,这些类器官不能与免疫细胞和基质细胞共培养,从而限制了对病理生理动力学的深入机理分析。为了规避这个问题,我们优化了牛原代细胞二维(2D)类肠衍生的单层培养系统,允许与其他相关细胞类型共培养。从健康成年牛中分离出的回肠隐窝被培养以产生 3D 类器官,这些类器官被冷冻保存以备将来使用。使用复活的 3D 类肠细胞创建 2D 单层细胞,这些类肠细胞被传代和破坏以产生单细胞,这些细胞被接种在基底膜提取物包被的 transwell 细胞培养插入物上,从而暴露其顶端表面。采用免疫荧光显微镜和测量跨上皮电阻表征肠道单层极性、细胞分化和屏障功能。单层顶端表面的刺激揭示了单层的预期功能,如顶端和基底隔室的细胞因子分泌所证明的那样。所描述的 2D 肠源单层模型在研究宿主-病原体相互作用和肠道生理学、药物开发和再生医学方面具有广阔的前景。
引言
研究中的动物模型在增强我们对疾病病理生理学和感染期间宿主免疫反应动态的理解方面发挥着至关重要的作用,并支持开发新的预防和治疗策略1,2,3,4。这些模型支持动物的研究发现和进步,是人类健康研究进展的关键。几十年来,啮齿动物模型一直支持人类疾病的免疫机制和基础生物学研究的进展3,5,6,7。虽然啮齿动物模型在筛选和早期开发研究中至关重要,但在早期发现和后期开发研究中,大型动物模型在研究人类疾病方面提供了更相关的比较,包括治疗效果和安全性测试1,3,4,5。与啮齿动物模型相比,牲畜具有明显的优势,可以更有效地翻译某些疾病的人类应用,包括隐孢子虫病、沙门氏菌病、结核病、呼吸道合胞病毒和布鲁氏菌病 1,7,8。事实上,这些疾病和其他疾病在牛中自发发展,它们与人类共享几种类似的疾病发病机制和免疫过程,并且作为一个近交种群,牛模仿影响人类免疫反应的遗传和环境异质性5,8,9,10 .通过首先采用复杂的培养系统,然后逐步实施体内研究,可以最大限度地发挥牛模型对传染病研究的好处。最初使用高度复杂的牛源性培养系统可以大大减少活体动物研究的数量,同时提高转化和应用研究的成功机会。培养模型应在器官水平上概括疾病过程,以获得最佳预测有效性,在空间和功能上保留天然组织微环境。
粘膜免疫应答是一个多方面的系统,由胃肠道肠细胞和位于粘膜表面以下的各种免疫细胞群形成的高效屏障组成11。这种高度复杂的系统在感染期间对于维持胃肠道稳态和启动针对肠道病原体的免疫防御至关重要11。肠细胞与潜在的先天免疫细胞之间的通讯启动了针对病原微生物的保护性免疫反应的发展。因此,复杂程度比较的培养系统对于最佳研究宿主-肠道病原体相互作用是必要的,并且在了解肠道生理学和药物发现和开发方面非常有效12,13。类器官是一种强大的培养系统,类似于起源组织的结构和功能14,15。这些模型的多细胞性允许研究不同细胞群的作用以及参与肠道健康和疾病的细胞相互作用12,14。然而,目前研究中的人源类器官模型受到难以获得足够数量和一致质量的人肠上皮细胞以及培养中细胞活力有限的限制。永生化细胞系可用于在这些模型中一致地获得高产量的同源培养物;然而,转化细胞本质上缺乏未转化上皮细胞的多样性和功能复杂性16,17。使用来自牛组织的培养物作为研究胃肠道疾病和生理学的模型的优点包括易于从健康供体获得组织样本,提高细胞活力,以及只有非永生化组织才能实现的更大细胞多样性。比较组织转录组学和肠道类器官的表征揭示了人类和牛之间保守的直系同源基因和细胞电位的相似性18。因此,牛类器官衍生的培养系统可能有利于研究人类肠道疾病,其研究结果很容易转化为人类医学。
本文描述的方案详细介绍了使用牛肠衍生的 2D 原代细胞培养系统评估宿主对肠道病原体或化合物的反应以及肠道生理学的有效平台。与 3D 类器官不同,transwell 插入物上生成的 2D 培养系统允许肠道细胞与免疫细胞或基质细胞进行双重培养,从而可以研究组织水平的动力学。随着在生物医学研究、药物开发和功效测试中的应用,这种生理相关的模型可以有益于牛和人类的健康和进步。
研究方案
所有协议均按照机构和国家动物福利指南和法规执行。
1.试剂制备
注:本研究中使用的试剂的原液和最终浓度列于 表1中。
- 准备样品采集缓冲液:混合 1 L 含有青霉素 (100 U/mL)、链霉素 (100 μg/mL)、庆大霉素 (25 μg/mL) 和卡泊芬净 (2.5 μg/mL) 的冰冷磷酸盐缓冲盐水 (PBS)。将储备溶液储存在4°C。
- 制备解离试剂 #1:混合 18.55 mL 样品采集缓冲液(如步骤 1.1 所述)、1.422 mL 乙二胺四乙酸(EDTA,0.422 M/pH 7.4)、20 μL 1 M 1,4-二硫苏糖醇 (DTT) 溶液、4 μL Y-27632 溶液 (5000x/50 mM)。将溶液储存在4°C。
- 制备解离试剂 #2:混合 18.57 mL 收集缓冲液(如步骤 1.1 所述)、1.422 mL EDTA (0.422 M/pH 7.4)、4 μL Y-27632 溶液 (5000x/50 mM)。将溶液储存在37°C。
- 制备肠生长培养基储备液:混合 9.875 mL 类器官生长培养基加补充剂、100 μL 青霉素 (100 U/mL)、链霉素 (100 μg/mL)、5 μL 庆大霉素 (25 μg/mL) 和 20 μL 卡泊芬净 (2.5 μg/mL)。将溶液储存在4°C。
- 制备肠样分化培养基储备液:混合 10 mL 类器官分化培养基和补充剂、100 μL 青霉素 (100 U/mL)、链霉素 (100 μg/mL)、5 μL 庆大霉素 (25 μg/mL) 和 20 μL 卡泊芬净 (2.5 μg/mL)。将溶液储存在-20°C。
- 准备洗涤介质:混合 48.45 mL DMEM/F-12 1.1 培养基(含 L-谷氨酰胺,不含 HEPES)、1 mL 不含维生素 A 的 B-27 添加剂(50x 原液)、500 μL 青霉素(100 U/mL)、链霉素(100 μg/mL)、25 μL 庆大霉素(50 mg/mL 原液)和 25 μL 卡泊芬净(5 mg/mL 原液)。将溶液储存在4°C。
- 准备包衣缓冲液:混合 25 mL DMEM:不含抑制剂的 F12 完全培养基和 25 mg 牛血清白蛋白 (BSA)。将溶液储存在4°C。
2.从整个组织中分离肠隐窝(图1)
注:牛小肠类肠是由当地牛肉加工厂的健康成年荷斯坦牛(>2岁)的回肠组织产生的。这一系列实验使用了一名供体。
- 肠道组织样本的制备
- 将收获的 ~10 英寸(25 厘米)肠道组织样品放入 ~400 mL 冰冷收集缓冲液(PBS + 抗生素/抗真菌剂)中,并放在冰上,以便运输到实验室。
- 使用手术剪刀(例如蛋黄酱剪刀)和镊子(例如艾德森镊子),从肠道组织样本中去除多余的脂肪和肠系膜。
- 将纸巾切成两等份。
- 用手术剪刀纵向打开组织,并在无菌PBS中冲洗组织。
- 使用无菌玻璃显微镜载玻片的侧面轻轻去除肠道样本的粘液层,并用新鲜的PBS冲洗组织。
注意:此步骤有助于去除绒毛,并有助于在后续步骤中提高隐窝部分的纯度。 - 对于每个 5 英寸(13 厘米)的碎片,将组织切成两个 2.5 英寸(6.5 厘米),然后将每个碎片切成 4 个大致相等的小块,以促进组织解离。
- 肠道组织的解离
- 在无菌的 50 mL 锥形管中制备 20 mL 体积的组织解离试剂 #1,并将小组织样品沉积到锥形管中,直到体积位移将半月面从 20 mL 标记移动到锥形管上的 35 mL 标记。
- 对剩余的小肠组织样品片重复上述步骤。
- 用石蜡膜密封锥形管,手动摇晃锥形管10次。
注意:在整个协议中,手动摇晃应以深思熟虑但轻柔的方式进行。 - 将锥形管水平放置在轨道振荡平台上的容器中的冰上。
- 在容器中的冰上以每分钟80转(rpm)摇晃锥形管30分钟。每 10 分钟手动摇晃锥形管。
- 在 50 mL 锥形管中制备 20 mL 体积的预热 (37 °C) 组织解离试剂 #2(如上配制,但不含 DTT)。将含有解离试剂 #1 的锥形管中的组织样品沉积到含有解离试剂 #2 的锥形管中。
- 用封口膜密封锥形管,手动摇晃锥形管10次。
- 将锥形管放入预热(37°C)振荡水浴中,以约60°C的角度倾斜,并以150rpm振荡10分钟,5分钟后手动振荡,在总孵育10分钟后再次振荡。
- 隔离地穴碎片
- 标记 10 个无菌锥形管 #1 - #10。向每个标记的锥形管中加入 20 mL 无菌冰冷 PBS。
- 将组织块从含有解离试剂 #2 的锥形管转移到含有冰冷 PBS #1 的新型无菌 50 mL 锥形管中。
- 手动摇晃锥形管 10 次。
- 用封口膜密封锥形管,并将它们水平放在冰上。在轨道振荡器上以80rpm摇动锥形管10分钟。10分钟后,手动摇晃锥形管#1 10次。这被认为是 Wash #1。
- 使用一对手术镊子将组织样本轻轻转移到锥形管 #2 中。
- 重复步骤 2.3.2 - 2.3.4,这被视为 Wash #2。
- 重复洗涤,直到洗涤 #10。
- 每次洗涤的上清液都含有将用于类肠生成的隐窝。将含有上清液的试管保持在4°C,直到所有10洗涤完成。
- 在第10洗 涤完成并弃去组织切片后,将锥形管#6-#10的上清液在4°C下以400× g 离心2分钟,以沉淀分离的隐窝。
注意:洗涤液 6-10 包含最干净的完整隐窝部分,碎片和单细胞有限。因此,建议仅将这些馏分用于类肠生成,并丢弃较早的洗涤液(#2-#5) - 弃去上清液,将 4 mL 新鲜冰冷的 PBS 加入隐窝中,无需重悬(这有助于在显微镜检查之前保持片段完整)。
- 通过显微镜检查每个锥形管#6-#10的解离隐窝的纯度。
- 向 384 孔板中加入 50 μL PBS。
- 向 PBS 中加入 10 μL 隐窝悬浮液,并使用 40 倍放大倍率物镜测定隐窝纯度、完整性和计数。
注意: 在板的底部画一个十字井可以使计数更容易。
3.牛回肠类肠的 离体 产生和传代(图2)
注意:来自具有最纯净、完整肠隐窝的锥形管的隐窝将用于下游测定。对于涉及隐窝和类肠的所有步骤,移液器吸头、细胞刮刀和试管必须预先涂有包衣缓冲液,并应避免气泡以防止隐窝丢失。除非另有说明,否则应使用 1000 μL 移液器吸头来防止隐窝碎片破裂。
- 从隐窝碎片生成类肠
- 将最纯净的隐窝部分(通常为#6-#10)组合成一个锥形管。
- 在4°C下以400× g 离心含有隐窝的锥形管2分钟。
- 用移液管吸出上清液,弃去上清液,并将隐窝沉淀重悬于洗涤介质中。
- 离心机如步骤3.1.2所示。倒出上清液,并向隐窝沉淀中加入 2 mL 洗涤培养基。
- 按照步骤 2.3.11.1 中所述计算密码的数量。
- 如步骤3.1.2中离心,沉淀隐窝,弃去上清液,并重悬于冰冷的100%还原生长因子基底膜细胞外基质(BME)中,以达到约400个隐窝/ 100μL的浓度。
注意:重要的是在4°C下正确解冻BME,因为温度变化会改变其稠度。使用冷却块和预冷的移液器吸头可以防止BME过早固化。- 在创建圆顶时,使用另一种基底膜基质配方可能需要稀释 BME。请参阅特定于所用 BME 的制造商说明。
- 上下移液以彻底悬浮 BME 中的隐窝。
- 通过将 50 μL 隐窝 BME 悬浮液缓慢移液到设置为 37 °C 且最多 8 个圆顶/孔的加热板上的 6 孔组织培养板上,制备隐窝 BME 圆顶。
注意:在铺覆圆顶之前,必须在37°C的培养箱中预热6孔板过夜。 - 将6孔板保持在加热板上1分钟,然后小心地将板移至37°C,5%CO2 培养箱中。
- 2分钟后,翻转6孔板,使盖子朝下,再孵育30分钟,使圆顶聚合。
- 30 分钟后,小心地将 3 mL 补充有 10 μM SB202190、0.5 μM LY2157299和 10 μM Y-27632 的室温 (RT) 类肠生长培养基加入含有圆顶的孔中。
- 在37°C,5%CO2孵育。
- 取出培养基,每 2-3 天更换一次补充有抑制剂的新鲜类肠生长培养基。
- 类肠的传代
- 7-10天后,确保隐窝已形成具有许多出芽结构的3D肠状体,如 图2E所示,并准备好通过。
- 从包含圆顶的孔中丢弃介质。
- 每孔每 4 个圆顶,向每个含有圆顶的孔中加入 1 mL 补充有 10 μM Y-27632 的冰冷非酶细胞解离溶液。
- 使用预包被的细胞刮刀,轻轻地将圆顶从组织培养板上取下。
- 在 15 mL 锥形管中收集类肠溶物,并通过上下移液 10 次进行研磨。
- 将含有碎裂肠样的锥形管在室温下以80rpm在轨道振荡器上孵育10分钟。
- 向类肠中加入 10 mL 含有 10 μM Y -27632 的冰冷洗涤培养基。
- 在室温下以300× g 离心锥形管5分钟。
- 弃去上清液,将沉淀重悬于10 mL新鲜洗涤培养基中,然后转移到新的15 mL锥形管中。
- 在室温下以300× g 离心锥形管5分钟。
- 弃去上清液,将沉淀重悬于1.5 mL微量离心管中的1 mL类肠生长培养基中。
- 在室温下以300× g 离心微量离心管5分钟,弃去上清液。
- 将肠样沉淀重悬于冰冷的100%BME中,并按照步骤3.1.6-3.1.13进行操作。
- 每 7 天重新传代一次肠样。扩增时间可能因出芽的密度、活力和程度而异。形成大肠样结构的多个出芽结构表明类肠需要传代。
- 类肠动物的冷冻保存
- 对于冷冻保存,确保类肠在培养物中的传代次数不超过五次。
注意:这尚未经过实验测试,并且基于作者的观察,即后来的段落降低了活力并产生了可变的结果。 - 要收获类肠,请使用步骤3.2.2-3.2.9中所述的解离缓冲液。
注意:使用 5 mL 移液管机械解离类肠溶液。 - 按照步骤2.3.11.1中所述计算类肠片段的数量。
- 在室温下以300× g 离心锥形管5分钟。
- 弃去上清液并将类肠片段重悬于补充有 10 μM Y-27632 的冻存培养基中,以达到 ~2000 个类肠片段/mL 的浓度,并将 1 mL 等分到预标记的冷冻管中。
- 将冻存管放入受控冷冻容器中,并在-80°C下储存过夜。
- 将冷冻管转移到气相液氮中进行长期储存。
- 对于冷冻保存,确保类肠在培养物中的传代次数不超过五次。
- 肠隐窝碎片的复苏
- 将 6 孔板放在培养箱内过夜。
- 用 5 mL 包衣介质预涂 5 mL 试管。
- 从液氮储存中取出冷冻管。
- 解冻后,立即将隐窝从冷冻管转移到预包被的 5 mL 管中。用洗涤介质冲洗出冷冻管,然后加入 5 mL 试管中。避免气泡。
- 用洗涤介质将体积提高到5mL,并在4°C下以400× g 离心5分钟。
- 在离心过程中,用包衣介质预涂 1.5 mL 试管。
- 离心后,倒出上清液,将沉淀重悬于管中剩余的培养基中,并转移到预包被的 1.5 mL 管中。用洗涤介质洗涤 5 mL 试管并将其转移到 1.5 mL 试管中。在4°C下以400× g 离心5分钟。
- 使用类肠生长培养基将体积增至 1.5 mL。
- 如上所述离心(步骤3.4.7),并小心吸气。
- 从4°C取BME并放在冰/冰块上。
- 将肠样沉淀重悬于冰冷的100%BME中,并按照步骤3.1.6-3.1.12进行操作。
- 每 2-3 天更换一次介质。
4. 从 3D 类肠生成和评估 2D 单层
注意:如上所述,对于涉及隐窝和类肠的所有步骤,移液器吸头、细胞刮刀和试管应预先涂有涂层缓冲液,并应避免气泡以防止隐窝丢失。
- 用于二维单层形成的transwell插入物的制备
- 将插入物放入 24 孔组织培养适配器板中,并在肠生长培养基中用 100 μL 1:15 稀释的 BME 预涂 1 μm PET 24 孔细胞培养插入物的顶端。在进行屏障完整性测量时,始终涂覆一个额外的插件,该插件将用作对照。
- 将包被的插入物放入培养箱中的24孔组织培养适配器板中。
注意:特定的适配器或伴随组织培养板必须与transwell插件一起使用。 - 将培养插入物在37°C,5%CO2 下孵育1小时以允许聚合。
注意:BME涂层的transwell可以用封口膜密封,如果不立即使用,可以在4°C下储存长达1周。 - 在孵育结束时,吸出3D肠培养基。
- 3D类肠溶解
- 从冻存的类肠片段中生成 2D 类肠单层,这些片段按照上述第 3.1 节所述进行复苏、铺板和培养以形成 3D 类肠。将解冻的类肠菌传代至少两次,最后一次传代至少培养 5 天,然后再处理以产生 2D 单层培养物。
- 通过向肠穹顶中加入补充有 10 μM Y-27632 的冰冷洗涤培养基来收获肠样(4 个穹顶使用约 1 mL 解离缓冲液)
- 用细胞刮刀拆下圆顶,并将其收集到 15 mL 锥形管中。
- 使用 1 mL 移液器吸头研磨 30 次以生成类肠片段。
- 用 200 μL 移液器吸头研磨 40 次,以进一步分解类肠碎片。
- 用冰冷的洗涤培养基将含有肠样碎片的 15 mL 锥形管的体积降至 10 mL。
- 在室温下以300× g 离心锥形管5分钟。
- 吸出上清液,包括BME层,注意不要干扰肠样沉淀。
注意:BME层将显示为颗粒上方的浑浊凝胶状层。 - 对于每 4 个圆顶,将沉淀重悬于补充有 10 μM Y-27632 的预热 TrypLE 表达酶的 1 mL 中。
- 将肠溶-TrypLE混合物加入24孔板中,并在37°C,5%CO2 孵育10分钟。
- 10分钟后,使用1mL移液管移取肠溶液-TrypLE混合物40次,以进一步碎裂肠溶液。
- 然后,用 200 μL 移液管将碎片碎片化 40 次,将碎片分解成单个细胞。
- 使用连接无菌 22-G 针头的 3 mL 或 5 mL 注射器,抽吸并分配细胞悬液 4 次,以获得单细胞悬浮液。
- 如步骤2.3.11.1所述,通过显微镜监测细胞解离,直到80%的类肠分解成单个细胞。
- 将细胞悬液收集到 15 mL 锥形管中,加入补充有 10% FBS 的 4 倍体积洗涤培养基,淬灭酶促反应。
- 通过预包被的 40 μm 细胞过滤器两次过滤肠道,进入 50 mL 锥形管中。
- 通过将锥形管以300× g 离心5分钟来沉淀单细胞。
- transwell 插入物上的 2D 单层接种。
- 倒出上清液,并将沉淀重悬于小体积(~600μL)类器官生长培养基中,并在室温下补充有20%胎牛血清(FBS)。
- 使用台盼蓝染料排阻法、血细胞计数器或自动细胞计数仪测定肠样细胞密度和活力。预计平均存活率为 75%。
- 在接种细胞之前,小心地从细胞培养插入物中除去步骤1.3中应用的多余包被溶液。
- 将单个细胞以 1 x 105 个细胞的体积接种在预包被的细胞培养插入物的顶端表面上,每个插入片段的体积为 200 μL。
- 向细胞培养插入页的基底外侧加入 700 μL 补充有 20% FBS 的完全培养基。
- 以数字 10 的形状操纵板 8 次,以使细胞均匀地分布在插入物上。
- 在生物安全柜中将板放在盘子上加热 10 分钟。
- 将板在37°C和5%CO2下孵育。
- 48小时后,用补充有20%FBS和抑制剂的新鲜肠生长培养基替换顶端和基底隔室上的培养基。
- 在第三天,从顶端和基底外侧隔室中取出培养基,用1x PBS仔细洗涤插入物,并用仅补充有抑制剂的肠分化培养基代替。
- 每 2-3 天更换一次两个隔间中的介质。
- 上皮屏障完整性和单层汇合度的定量测量
注意:可以通过使用上皮伏尔表测量跨上皮电阻 (TEER) 来评估屏障完整性。- 从培养箱中取出transwell培养板,使其在生物安全柜中在室温下平衡几分钟。
- 确保 STX2 电极已按照制造商的说明进行预处理并将伏赫表校准为 1000Ω。
- 将探针的长棒插入基底外侧隔室,将短端插入跨孔上皮细胞培养物的顶端隔室。注意不要破坏单层或损坏嵌件。
- 稳定后,记录每个跨孔插入点的 3 次 TEER 测量值,包括不带细胞的插入点。取每个刀片的平均测量值。
- 通过从实验孔的平均测量值中减去空白孔的平均测量值,然后将其乘以插入物的表面积以确定上皮屏障的阻力(TEER [Ω.cm 2] = [Rcell layer - Rblank] × Area)来计算校正后的 TEER 值。
结果
生成 2D 类肠衍生单层的第一步是准备收获的肠组织切片(图 1A)用于组织解离。这是通过从组织中去除附着的脂肪和肠系膜来完成的(图1B),然后纵向切割组织以暴露管腔表面,以便可以使用载玻片轻轻刮擦除肠道的粘液层。然后将收获的肠切片切成逐渐变小的组织切片(图1C),以增加解离的难易程度。然后使用一系列由螯合缓冲液(图1D,E)和PBS组成的洗涤液将隐窝从下面的粘膜下组织解离。然后将分离的肠隐窝(图1F)嵌入基底膜基质圆顶(图2A)中并培养数天以产生3D类肠。从 10 英寸的牛回肠切片中,可以分离出大约 900,000 个隐窝并用于肠样形成。在培养几个小时后,镀层隐窝开始伸长并发育成肠球(图2B)。2天后,可以观察到明确的管腔(图2C),早在培养物的第4天就注意到出芽结构(图2D)。到第7天,成熟的类肠已经发育(图2E)。7 日龄 3D 肠样动物的免疫荧光染色表明存在不同的细胞谱系。肠道样的共聚焦显微镜显示 DAPI 核染色、粘附连接处的 E-钙粘蛋白、显示肠内分泌细胞存在的嗜铬粒蛋白 A (Chr-A) 染色、显示帕氏细胞的溶菌酶 (LYZ) 和代表肠细胞细胞的细胞角蛋白-18 (CK-18) 在图 3 中。培养 7-10 天后,应将类肠排出,以允许进一步扩增并防止过度拥挤。肠道类化合物传代的最佳时间被确定为初始原代隐窝分离后 7-10 天,最终取决于培养物中类肠道的健康状况和生长速度。如图2E所示,实现所需肠类形态和活力的最佳接种密度为每穹顶400个隐窝。类肠可以很容易地冷冻保存,解冻的类肠片段在解冻后两次传代后完全恢复用于实验。值得注意的是,在冷冻保存之前,建议至少进行两次初级隐窝培养。
为了产生2D类肠衍生的单层,收获3D类肠,并通过一系列步骤,在解离溶液(图4A)存在下机械研磨成单细胞。然后,可以将这些单细胞接种在预涂有基底膜基质培养基溶液的transwell插入物上。平均而言,可以从四个 3D 肠状圆顶播种四个转孔。因此,处理的 3D 类肠的数量取决于实验所需的转孔数量。以 1 x 105 的接种密度接种单细胞并在 20% FBS 存在下初始培养它们(图 4B-D),可以在不到 1 周的时间内产生汇合的单层。可以使用光学显微镜监测培养物中2D单层的渐进汇合(图4E,F)。跨上皮电阻 (TEER) 测量可以确认汇合度并表征上皮屏障随时间和对实验刺激的响应的完整性(图 5A)。平均而言,在培养 7 天后,大约 100% 汇合的单层将具有相应的 TEER 值 ~1500 Ω·cm2。对 2D 肠单层 TEER 值的纵向评估表明,TEER 值在 7 天内稳步增加,达到最大平均值 1546 Ω·cm2,然后下降,第 12 天获得的最低值为 11.5 Ω·cm2(图 5B)。分化单层的免疫荧光标记表明使用该方案形成完整的,有组织的,极化的肠上皮片(图6)。染色的 2D 单层的共聚焦显微镜显示了 DAPI 核染色、E-钙粘蛋白和 F-肌动蛋白染色的定位(图 6A-D)。2D 单层的荧光显微镜显示分化的肠上皮细胞的标志,嗜铬粒蛋白 A (Chr-A) 染色显示存在肠内分泌细胞,溶菌酶 (LYZ) 显示潘氏细胞,细胞角蛋白 18 (CK-18) 显示肠细胞谱系(图 6E-L)。Z-stack建模显示了2D单层培养物的预期极化,其中F-肌动蛋白的特征沉积存在于覆盖分化肠细胞顶端的微绒毛和E-钙粘蛋白,E-钙粘蛋白是一种位于上皮细胞之间间隔的粘附连接处的蛋白质(图6M)。
单层的功能可以通过使用各种组分(包括 Toll 样受体 (TLR) 配体或病原体)的顶端刺激来评估,然后对从顶端和基底区室收获的细胞培养物上清液进行细胞因子定量。事实上,当在培养的第4天用TLR 1/2激动剂Pam3csk4刺激单层的顶端24小时时,与未处理的单层相比,观察到两个隔室中的细胞因子产生增加(图7A,B)。
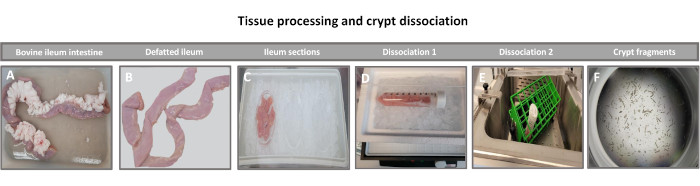
图1:从健康成年牛中分离出的牛肠隐窝。 图像显示了 (A) 整个成年牛回肠的组织处理,(B) 脱脂回肠,(C) 回肠在冰上的 PBS 中切成 2.5 英寸(6.3 厘米)块,(D) 回肠组织切片在 4 °C 下解离缓冲液 #1 中,和 (E) 解离缓冲液 2 在 37 °C 的振荡水浴中,以及 (F) 分离的回肠隐窝碎片。 请点击这里查看此图的较大版本.
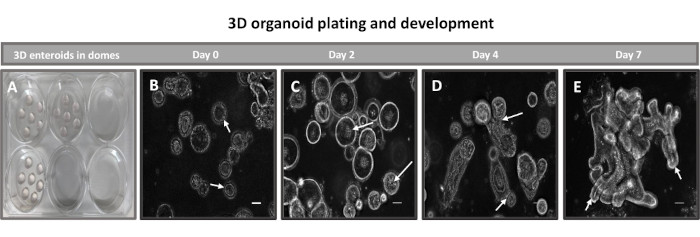
图 2:基底膜基质中牛原代 3D 回肠肠样发育。(A) 在 6 孔组织培养板中创建的 3D 肠样圆顶和 (B-E) 培养中第 0、2、4 和 7 天的 3D 类肠发育的代表性图像。比例尺 = 50 μm。 请点击这里查看此图的较大版本.
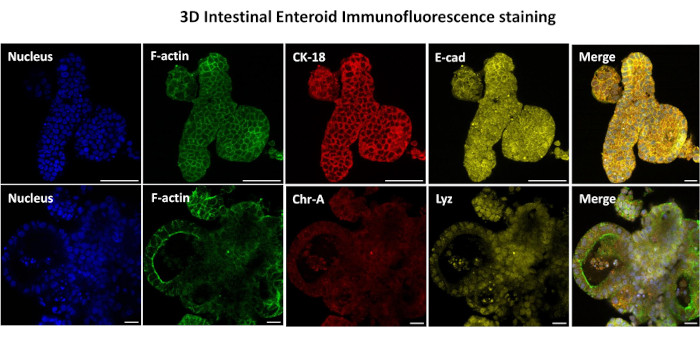
图 3:三维肠道样肠显示上皮细胞谱系染色。 培养 7 天后 3D 类肠的代表性图像显示存在核染色、F-肌动蛋白、细胞角蛋白-18 (CK-18)、嗜铬粒蛋白 A (Chr-A)、Ecadherin (E-cad)、溶菌酶 (Lyz) 和图像叠加 (Merge)。比例尺 50 μm. 请点击这里查看此图的较大版本.
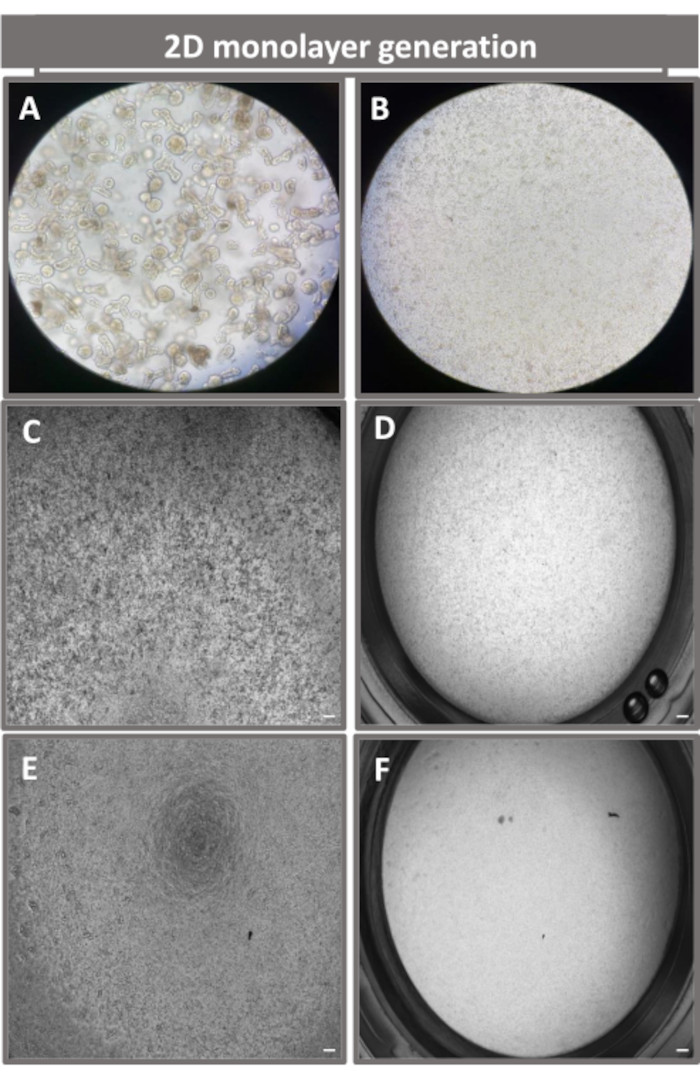
图 4:从回肠类肠中建立 2D 类肠衍生的单层。(A) 解离溶液中用于单层接种的 3D 类肠片段的代表性图像,在第 0 天使用 (B) 光、(C) 相差和 (D) 明场显微镜成像以 1 x 105 的接种密度在转孔插入物上接种单细胞的代表性图像,以及第 5 天使用 (E) 相差和 (F)明场显微镜。40 倍放大倍率和比例尺 = 50 μm。 请点击这里查看此图的较大版本.
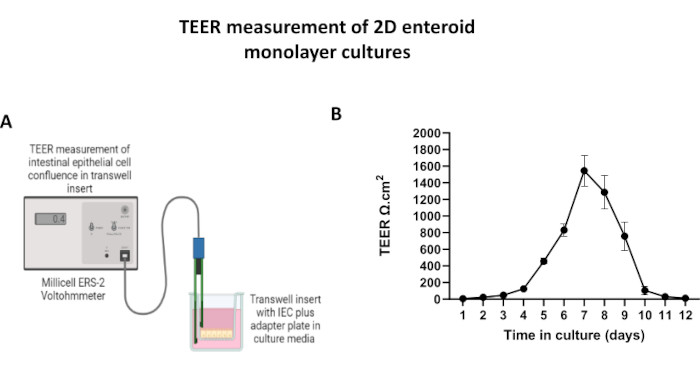
图 5:transwell 插入物上 2D 肠源单层的跨上皮电阻 (TEER) 测量。 (A) 如何使用伏欧表的 STX2 筷子电极获得 2D 肠上皮细胞 (IEC) 单层的 TEER 测量值的示意图, (B) 在细胞培养中纵向监测 12 天内的 2D 单层 TEER 测量值。每个数据点代表从两个技术重复中获得的平均 TEER 值和标准平均误差 (SEM)。 请点击这里查看此图的较大版本.
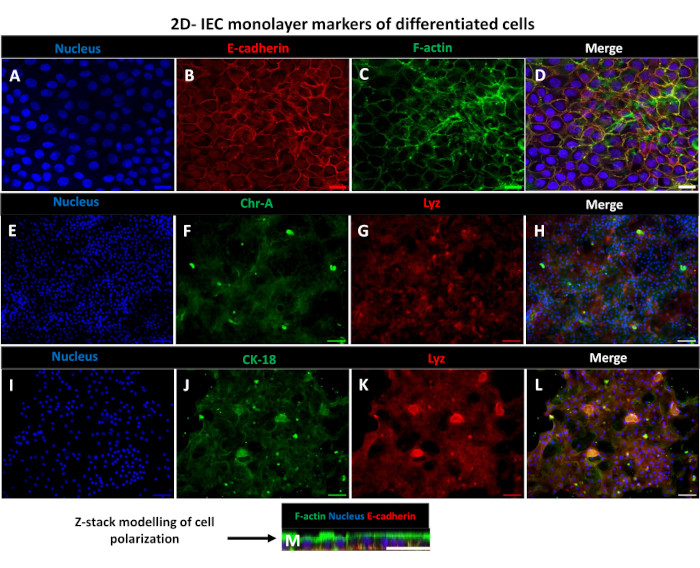
图 6:transwell 插入物上分化的 2D 肠源性单层发育成极化的肠上皮片。(上午)培养 5 天后,transwell 插入物上 2D 类肠衍生单层的代表性免疫荧光图像显示 (A) 细胞核(蓝色)、(B) E-钙粘蛋白(红色)、(C) F-肌动蛋白(绿色)和 (D) 3 个图像的叠加(合并)、(E,I) 核染色、(F) 嗜铬粒蛋白-A、(J) 细胞角蛋白-18、(G,K) 溶菌酶和 (H,L) 图像合并。(M) Z-stack 模型显示了 2D 单层片中相同上皮细胞标记蛋白的分布。图像是从 2 个生物重复中获得的。比例尺 = 50 μm。 请点击这里查看此图的较大版本.
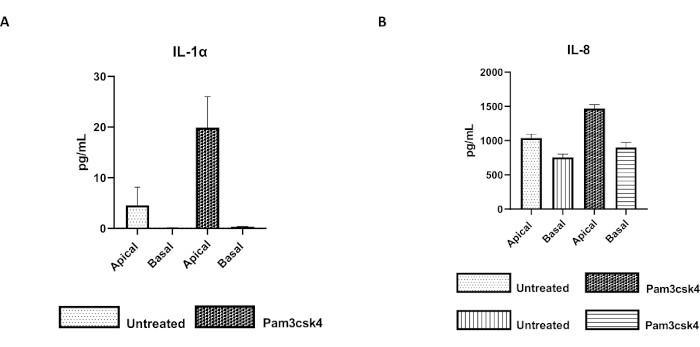
图 7:transwell 插入件上的牛原代 2D 类肠衍生单层具有功能活性。 在未经处理或用 Pam3csk4 刺激 24 小时的培养物中 5 天后,通过 transwell 插入物上的 2D 单层在 transwell 插入物上通过 2D 细胞培养物分泌 (A) IL-1α 和 (B) IL-8 的顶端和基础细胞培养上清液细胞因子。数据代表了来自一种动物和三个独立实验的冷冻隐窝库存的单层细胞因子水平和 SEM。根据制造商的说明,使用基于微球的多重检测(材料表)定量细胞因子,并在紧凑的多重单元(材料表)和免疫测定曲线拟合软件(材料表)上进行分析。 请点击这里查看此图的较大版本.
表1:试剂的储备量和最终浓度。 请按此下载表格。
讨论
这里介绍的方案描述了用于研究肠道生理学和肠道疾病的生理相关模型。几个研究小组描述了牛类肠培养物的产生,包括 2D 单层16、19、20、21、22、23、24。虽然单层生成在技术上并不具有挑战性,但几分钟的步骤对于持续开发成功的菌种至关重要。因此,对于类器官领域的研究人员新手来说,使用已发表文献中简要描述的方法对 2D 单层的可重复性可能具有挑战性。本文描述的方案改编自这些方案和其他物种中发表的方案,为在transwell插入物上生成单层提供了分步指南,该单层生成具有高度可重复性。
本文概述的方案可以很容易地修改,以适应实验设计的特定目标或试剂的可用性。事实上,按照该方案,可以通过在较低的细胞密度(例如,2.5×104)或没有FBS的情况下接种单层来实现成功的培养,如其他出版物所述24。然而,改变这些参数可能需要增加培养物以建立汇合单层。因此,如果研究设计中不可或缺的其他因素,包括与免疫细胞的共培养,决定了实验的特定时间过程,则可以根据需要改变接种密度。虽然可以替代其他基底膜配方来代替本协议中使用的配方以生成 3D 类肠和二维单层,但这些需要一些优化以确定最佳基底膜与培养基的比例。
与传统塑料器皿和 3D 肠样培养物上的单层生长相比,在所述方法中应用 transwell 插入物具有许多优势。与标准组织培养板相比,使用转孔进行单层培养可促进细胞分化和组织,同时保持与肠隐窝的相似性14,25。肠上皮屏障对于防止毒素和微生物转移到体内,同时促进营养吸收至关重要。因此,了解肠道的屏障完整性如何在健康中发挥作用,并在肠道疾病或对化合物的反应中如何改变至关重要。与3D类肠培养物不同,如本文14,25所示,在transwell上结合单层并测量TEER时,可以客观评估肠道屏障完整性。在转孔上生成 2D 单层细胞还允许使用相关细胞类型(如免疫细胞或基质细胞)进行双重培养。这使得肠道细胞和组织微环境细胞之间至关重要的串扰得以表征,这是 3D 培养无法实现的。暴露于单层的顶端表面不仅允许实验暴露于病原体和化合物以及收集管腔产物,而且还可以研究肠道生理学和疾病的其他方面,包括对肠道微生物群和分子吸收或运输生理学的研究13。与3D肠样模型相比,对顶端和基底肠表面的独立控制是一个明显的优势。
通过几次试验实验,我们确定了有助于该协议成功的关键步骤。虽然整个肠道组织样品可以冷藏过夜并在第二天处理,但必须立即执行组织解离和隐窝碎片分离步骤,以防止分离的隐窝部分崩解。完成 PBS 洗涤后,在洗涤介质中离心隐窝有助于防止隐窝破裂,详见步骤 2.3.10。当传代肠或收获它们以形成单层时,必须将肠类化合物与BME圆顶分开。洗涤介质必须是冰冷的,以帮助溶解 BME。相比之下,使用预热的 TrypLE 并将细胞悬液过滤两次有助于形成单层生成所需的单细胞。最后,手动操纵数字 8 形状的板有助于将单个细胞均匀地分散在跨孔插入物上。
该协议的一个重要局限性是,2D单层是由成熟的荷斯坦公牛(>2岁)产生的肠样库存生产的。犊牛胃肠道的成熟可能需要对所描述的方案进行微小的修改,以产生最佳结果。文献26 中描述了牛品种肠道生理学的品种特异性差异。虽然尚不清楚这些差异是否会影响类肠和随后的单层生成,但我们怀疑任何差异都只会导致我们的方案发生微小变化。此外,2D 培养模型也存在一些固有的缺点。与 3D 类肠模型相比,2D 培养物可能缺乏肠道组织结构和细胞多样性的某些方面,并产生与 2D 培养物繁殖相关的限制和挑战13。尽管如此,研究表明,一些单层可以模拟预期的隐窝组织27,其中一些限制甚至可以通过建立具有气液界面的2D培养物来克服。然而,应充分考虑该模型的局限性,以确定其应用是否适合所提出的实验问题。
该方案描述了一种优化的培养系统,该系统使用源自牛回肠的类肠来模拟牛胃肠道,以在transwell插入物上形成单层。从传染病研究到药物发现和再生医学,这种高通量培养系统具有广泛的应用,可以带来前所未有的预防和治疗策略的发展,从而对动物和人类健康互惠互利。
披露声明
作者声明,该研究是在没有任何可被解释为潜在利益冲突的商业或财务关系的情况下进行的。
致谢
我们承认使用中西部大学的细胞和分子核心设施。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
参考文献
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, Academic Press. 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972(2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73(2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272(2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225(2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43(2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54(2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33(2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115(2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606(2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42(2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15(2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114(2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。