Method Article
Translasyonel Biyomedikal Araştırma Uygulamaları için Sığır Primer Enteroid Türevli İki Boyutlu Tek Katmanlı Kültür Sisteminin Oluşturulması
Bu Makalede
Özet
Enteroidler, doku fizyolojisi ve patofizyolojisi, ilaç geliştirme ve rejeneratif tıp çalışmaları için yeni bir model olarak ortaya çıkmaktadır. Burada, ilgili doku hücresi tipleriyle ko-kültüre izin veren bir sığır birincil hücre 2D enteroid türevi kültür sistemini tanımlıyoruz. Bu model, gastrointestinal araştırma modellemesi için translasyonel bir avantaj sunar.
Özet
Organoid hücre kültürü sistemleri, dokularda gözlenen karmaşıklığı özetleyebilir, bu da onları konakçı-patojen etkileşimlerinin incelenmesinde, ilaç etkinliğinin ve toksisitesinin değerlendirilmesinde ve doku biyomühendisliğinde faydalı hale getirir. Ancak, bu modellerin açıklanan nedenlerle uygulanması, bu modellerin üç boyutlu (3B) doğası nedeniyle sınırlı olabilir. Örneğin, sindirim hastalıklarını incelemek için 3D enteroid kültür sistemlerini kullanmak, bağırsak lümeninin ve salgılanan maddelerin erişilememesi nedeniyle zordur. Gerçekten de, 3D organoidlerin patojenlerle uyarılması, luminal mikroenjeksiyon, 3D yapının mekanik olarak bozulması veya apikal enteroidlerin üretilmesini gerektirir. Ayrıca, bu organoidler immün ve stromal hücrelerle birlikte kültürlenemez, bu da derinlemesine mekanik analizi patofizyolojik dinamiklerle sınırlandırır. Bunu aşmak için, sığır birincil hücreli iki boyutlu (2D) enteroid türevli tek katmanlı kültür sistemini optimize ettik ve diğer ilgili hücre tipleriyle birlikte kültüre izin verdik. Sağlıklı yetişkin sığırlardan izole edilen ileal kriptler, ileride kullanılmak üzere dondurularak saklanan 3D organoidler üretmek için kültürlendi. Bazal membran özü kaplı transwell hücre kültürü eklerine ekilen ve böylece apikal yüzeylerini açığa çıkaran tek hücreler elde etmek için pasajlı ve bozulmuş yeniden canlandırılmış 3D enteroidler kullanılarak bir 2D tek tabaka oluşturuldu. Bağırsak tek tabaka polaritesi, hücresel farklılaşma ve bariyer fonksiyonu, immünofloresan mikroskobu kullanılarak ve transepitelyal elektrik direncinin ölçülmesiyle karakterize edildi. Tek tabakanın apikal yüzeyinin uyarılması, hem apikal hem de bazal bölmelerden sitokin sekresyonu ile gösterildiği gibi, tek tabakanın beklenen işlevselliğini ortaya çıkardı. Tanımlanan 2D enteroid türevli tek tabakalı model, konakçı-patojen etkileşimlerini ve bağırsak fizyolojisini, ilaç geliştirmeyi ve rejeneratif tıbbı araştırmada büyük umut vaat etmektedir.
Giriş
Araştırmadaki hayvan modelleri, hastalık patofizyolojisi ve enfeksiyon sırasında konakçı immün yanıtının dinamikleri hakkındaki anlayışımızı geliştirmede çok önemli bir rol oynamaktadır ve yeni önleyici ve terapötik stratejilerin geliştirilmesini desteklemektedir 1,2,3,4. Bu modeller, hayvanlarda araştırma, keşif ve ilerlemeyi destekler ve insan sağlığı araştırmalarının ilerlemesinin anahtarıdır. Onlarca yıldır, kemirgen modelleri, bağışıklık mekanizmalarındaki ilerlemeleri ve insan hastalıkları için temel biyoloji araştırmalarını desteklemiştir 3,5,6,7. Kemirgen modelleri tarama ve erken geliştirme araştırmalarında kritik öneme sahipken, büyük hayvan modelleri, terapötik etkinlik ve güvenlik testi 1,3,4,5 dahil olmak üzere hem erken keşif hem de daha sonraki geliştirme çalışmalarında insan hastalıklarının araştırılmasında daha uygun bir karşılaştırma sunar. Hayvancılık, kriptosporidiyoz, salmonelloz, tüberküloz, solunum sinsityal virüsü ve bruselloz 1,7,8 dahil olmak üzere bazı hastalıklar için insan uygulamaları için daha verimli çeviri için kemirgen modellerine kıyasla açık avantajlar sunar. Gerçekten de, bu hastalıklar ve diğerleri, insanlara benzer birkaç hastalık patogenezini ve bağışıklık sürecini paylaşan sığırlarda kendiliğinden gelişir ve soylu bir popülasyon olarak sığırlar, insan bağışıklık tepkilerini etkileyen genetik ve çevresel heterojenliği taklit eder 5,8,9,10 . Bulaşıcı hastalık araştırmaları için sığır modellerinin faydaları, önce sofistike bir kültür sistemi kullanılarak ve daha sonra adım adım in vivo çalışmalar uygulanarak en üst düzeye çıkarılabilir. Oldukça karmaşık bir sığır türevi kültür sisteminin ilk kullanımı, başarılı translasyonel ve uygulamalı araştırma şansını artırırken, canlı hayvan çalışmalarının sayısını önemli ölçüde azaltabilir. Kültür modelleri, doğal doku mikro çevresini mekansal ve işlevsel olarak koruyarak, optimal prediktif geçerlilik için hastalık süreçlerini organ düzeyinde özetlemelidir.
Mukozal immün yanıt, gastrointestinal enterositler ve mukozal yüzeyin altında bulunan çeşitli immün hücre popülasyonları tarafından oluşturulan yüksek verimli bir bariyerden oluşan çok yönlü bir sistemdir11. Bu son derece karmaşık sistem, enfeksiyon sırasında GI homeostazının korunmasında ve enterik patojenlere karşı bağışıklık savunmasının başlatılmasında kritik öneme sahiptir11. Enterositler ve altta yatan doğuştan gelen immün hücreler arasındaki iletişim, patojenik mikroorganizmalara karşı koruyucu immün yanıtların gelişimini başlatır. Bu nedenle, karmaşıklık düzeyleri bakımından karşılaştırmalı olan kültür sistemleri, konakçı-enterik patojen etkileşimlerinin optimal bir şekilde araştırılması için gereklidir ve enterik fizyolojiyi ve ilaç keşfi ve geliştirilmesini anlamada oldukça etkilidir 12,13. Organoidler, orijin dokunun mimarisine ve işlevine benzeyen sağlam bir kültür sistemidir14,15. Bu modellerin çok hücreliliği, çeşitli hücre popülasyonlarının rolünün ve enterik sağlık ve hastalıkta yer alan hücresel etkileşimlerin araştırılmasına izin verir12,14. Bununla birlikte, araştırmalardaki insan kaynaklı organoid modeller, şu anda insan bağırsak epitel hücrelerinin yeterli miktarda ve tutarlı kalitede elde edilmesinin zorluğu ve kültürde sınırlı hücre canlılığı ile sınırlıdır. Ölümsüzleştirilmiş hücre hatları, bu modellerde tutarlı bir şekilde yüksek homolog kültür verimleri elde etmek için kullanılabilir; Bununla birlikte, dönüştürülmüş hücreler, doğası gereği, dönüştürülmemiş epitel hücrelerinin çeşitliliğinden ve işlevsel karmaşıklığından yoksundur 16,17. Gastrointestinal hastalıkları ve fizyolojiyi araştırmak için bir model olarak sığır dokusundan elde edilen kültürlerin kullanılmasının avantajları arasında, doku örneklerinin sağlıklı donörlerden tutarlı bir şekilde elde edilebilme kolaylığı, gelişmiş hücre canlılığı ve yalnızca ölümsüzleştirilmemiş doku ile elde edilebilecek daha fazla hücresel çeşitlilik yer alır. Karşılaştırmalı doku transkriptomikleri ve bağırsak organoidlerinin karakterizasyonu, insanlar ve sığırlar arasındaki korunmuş ortolog genler ve hücresel potansiyeller açısından benzerlikler ortaya koymaktadır18. Bu nedenle, sığır organoidinden türetilmiş bir kültür sistemi, insan bağırsak hastalıklarının araştırılmasında avantajlı olabilir ve bulgular insan tıbbına kolayca çevrilebilir.
Burada açıklanan protokol, sığır enteroidinden türetilmiş bir 2D birincil hücre kültürü sistemi kullanarak enterik patojenlere veya bileşiklere ve bağırsak fizyolojisine konakçı yanıtlarını değerlendirmek için etkili bir platformu detaylandırmaktadır. 3D organoidlerin aksine, transwell insertleri üzerinde üretilen 2D kültür sistemleri, immün veya stromal hücrelere sahip bağırsak hücrelerinin ikili kültürüne izin vererek, doku düzeyinde dinamiklerin incelenmesine izin verir. Biyomedikal araştırma, ilaç geliştirme ve etkinlik testlerindeki uygulamalarla, fizyolojik olarak ilgili bu model, hem sığırların hem de insanların sağlığına ve ilerlemesine fayda sağlayabilir.
Protokol
Tüm protokoller, hayvan refahı için kurumsal ve ulusal yönergelere ve düzenlemelere uygun olarak gerçekleştirilmiştir.
1. Reaktif hazırlama
NOT: Bu çalışmada kullanılan reaktiflerin stok ve nihai konsantrasyonları Tablo 1'de listelenmiştir.
- Numune toplama tamponu hazırlayın: Penisilin (100 U/mL), streptomisin (100 μg/mL), gentamisin (25 μg/mL) ve kaspofungin (2,5 μg/mL) içeren 1 L buz gibi soğuk fosfat tamponlu salin (PBS) karıştırın. Stok çözeltisini 4 °C'de saklayın.
- Ayrışma Reaktifi #1'i Hazırlayın: 18.55 mL numune toplama tamponunu (adım 1.1'de açıklandığı gibi), 1.422 mL etilendiamintetraasetik asit (EDTA, 0.422 M/pH 7.4), 20 μL 1 M 1,4-Dithiothreitol (DTT) çözeltisini, 4 μL Y-27632 çözeltisini (5000x/50 mM) karıştırın. Çözeltiyi 4 °C'de saklayın.
- Ayrışma Reaktifi #2'yi hazırlayın: 18.57 mL toplama tamponu (adım 1.1'de açıklandığı gibi), 1.422 mL EDTA (0.422 M/pH 7.4), 4 μL Y-27632 çözeltisini (5000x/50 mM) karıştırın. Çözeltiyi 37 °C'de saklayın.
- Enteroid büyüme ortamı stoğu hazırlayın: 9.875 mL organoid büyüme ortamı artı takviyesi, 100 μL penisilin (100 U / mL), streptomisin (100 μg / mL), 5 μL gentamisin (25 μg / mL) ve 20 μL kaspofungin (2.5 μg / mL). Çözeltiyi 4 °C'de saklayın.
- Enteroid diferansiyasyon ortamı stoğu hazırlayın: 10 mL organoid farklılaşma ortamı artı takviyesi, 100 μL penisilin (100 U/mL), streptomisin (100 μg/mL), 5 μL gentamisin (25 μg/mL) ve 20 μL kaspofungin (2.5 μg/mL) karıştırın. Çözeltiyi -20 °C'de saklayın.
- Yıkama ortamı hazırlayın: 48.45 mL DMEM/ F-12 1.1 ortamı (L-glutaminli, HEPES olmadan), A vitamini içermeyen 1 mL B-27 takviyesi (50x stok), 500 μL penisilin (100 U/mL), streptomisin (100 μg/mL), 25 μL gentamisin (50 mg/mL stok) ve 25 μL kaspofungin (5 mg/mL stok). Çözeltiyi 4 °C'de saklayın.
- Kaplama tamponu hazırlayın: 25 mL DMEM: F12 tam besiyerini inhibitörsüz ve 25 mg sığır serum albüminini (BSA) karıştırın. Çözeltiyi 4 °C'de saklayın.
2. Tüm dokudan intestinal kriptlerin izolasyonu (Şekil 1)
NOT: Sığır ince bağırsak enteroidleri, yerel bir sığır eti işleme tesisinden sağlıklı yetişkin Holstein dümenlerinden (>2 yaş) elde edilen ileal dokudan üretilmiştir. Bu deney dizisi için bir donör kullanıldı.
- Bağırsak dokusu örneklerinin hazırlanması
- Hasat edilen ~ 10 inç (25 cm) bağırsak dokusu örneklerini ~ 400 mL buz gibi soğuk toplama tamponuna (PBS + antibiyotikler / antimikotikler) ve laboratuvara taşınmak üzere buz üzerine yerleştirin.
- Cerrahi makas (örn. mayonez makası) ve forseps (örn. adson forseps) kullanarak, bağırsak dokusu örneğinden fazla yağ ve mezenteri çıkarın.
- Dokuyu iki eşit parçaya kesin.
- Dokuyu cerrahi makasla uzunlamasına açın ve dokuyu steril PBS'de durulayın.
- Steril bir cam mikroskop lamının yan tarafını kullanarak bağırsak örneğinin mukus tabakasını nazikçe çıkarın ve dokuyu taze PBS ile durulayın.
NOT: Bu adım, villusun çıkarılmasına yardımcı olur ve sonraki adımlarda kript fraksiyonlarının saflığını artırmaya yardımcı olur. - Her 5 inç (13 cm) parça için, dokuyu iki adet 2,5 inç (6,5 cm) olacak şekilde kesin ve ardından doku ayrışmasını kolaylaştırmak için her parçayı yaklaşık 4 eşit küçük parçaya bölün.
- Bağırsak dokusunun ayrışması
- Steril 50 mL'lik bir konik tüpte 20 mL'lik bir doku ayrışma reaktifi #1 hacmi hazırlayın ve hacim yer değiştirmesi menisküsü 20 mL işaretinden konik tüp üzerindeki 35 mL işaretine hareket ettirene kadar küçük doku örneklerini konik tüpe yerleştirin.
- Kalan ince bağırsak dokusu örnek parçaları için yukarıdaki adımı tekrarlayın.
- Konik boruları parafilm ile kapatın ve konik boruyu manuel olarak 10 kez sallayın.
NOT: Protokol boyunca, elle sallama kasıtlı ama nazik bir şekilde yapılmalıdır. - Konik tüpleri, yörüngesel sallama platformundaki bir kapta buzun üzerine yatay olarak yerleştirin.
- Konik tüpleri kaptaki buz üzerinde dakikada 80 devirde (rpm) 30 dakika çalkalayın. Her 10 dakikada bir, konik boruyu manuel olarak sallayın.
- 50 mL'lik konik bir tüpte 20 mL hacimde önceden ısıtılmış (37 °C) doku Ayrışma Reaktifi #2 (yukarıdaki gibi formüle edilmiştir, ancak DTT olmadan) hazırlayın. Doku örneklerini Ayrışma Reaktifi #1 içeren konik tüplerden Ayrışma Reaktifi #2 içeren konik tüplere bırakın.
- Konik boruları parafilm ile kapatın ve konik boruları manuel olarak 10 kez sallayın.
- Konik tüpleri, yaklaşık 60 °C'lik bir açıyla eğilmiş, önceden ısıtılmış (37 °C) çalkalama su banyosuna yerleştirin ve 150 dakika boyunca 10 rpm'de çalkalayın, 5 dakika sonra manuel çalkalama ve toplam 10 dakika inkübasyondan sonra tekrar çalkalayın.
- Kript parçalarının izolasyonu
- 10 steril konik tüpü #1 - #10 olarak etiketleyin. Her etiketli konik tüpe 20 mL steril buz gibi PBS ekleyin.
- Doku parçalarını, ayrışma reaktifi #2 içeren konik tüplerden buz gibi soğuk PBS #1 içeren yeni bir steril 50 mL konik tüpe aktarın.
- Konik boruları manuel olarak 10 kez sallayın.
- Konik tüpleri parafilm ile kapatın ve yatay olarak buzun üzerine yerleştirin. Konik boruları bir orbital çalkalayıcı üzerinde 80 rpm'de 10 dakika sallayın. 10 dakika sonra, konik boru #1'i 10 kez manuel olarak sallayın. Bu, Yıkama #1 olarak kabul edilir.
- Bir çift cerrahi forseps kullanarak doku örneklerini konik tüp #2'ye nazikçe aktarın.
- 2.3.2 - 2.3.4 adımlarını tekrarlayın, bu Yıkama #2 olarak kabul edilir.
- #10 yıkamaya kadar yıkamaları tekrarlayın.
- Her yıkamadan elde edilen süpernatanlar, enteroid üretimi için kullanılacak kriptleri içerir. Süpernatanları içeren tüpleri 10 yıkamanın tamamı tamamlanana kadar 4 °C'de tutun.
- 10. yıkama tamamlandıktan ve doku bölümü atıldıktan sonra, izole edilmiş kriptleri peletlemek için konik tüplerin #6-#10'unu 400 x g'de 4 ° C'de 2 dakika santrifüjleyin.
NOT: 6-10 yıkamaları, sınırlı döküntü ve tek hücreli bozulmamış kriptlerin en temiz fraksiyonlarını içerir. Bu nedenle, enteroid üretimi için sadece bu fraksiyonların kullanılması ve daha önceki yıkamaların (# 2-# 5) atılması önerilir) - Süpernatanı atın ve yeniden süspanse etmeden kriptlere 4 mL taze, buz gibi soğuk PBS ekleyin (bu, fragmanların mikroskopiye kadar bozulmadan kalmasına yardımcı olur).
- Mikroskopi ile her konik tüp #6-#10 için ayrışmış kriptlerin saflığını değerlendirin.
- 384 oyuklu bir plakaya 50 μL PBS ekleyin.
- PBS'ye 10 μL kript süspansiyonu ekleyin ve kript saflığını, bütünlüğünü ve sayısını belirlemek için 40x büyütme objektif lensi kullanın.
NOT: Plakanın altına bir çarpı işareti çizmek saymayı kolaylaştırır.
3. Ex vivo sığır ileal enteroidlerinin oluşumu ve geçişi (Şekil 2)
NOT: En saf, bozulmamış bağırsak kriptlerine sahip konik tüplerden gelen kriptler, aşağı akış tahlilleri için kullanılacaktır. Kriptleri ve enteroidleri içeren tüm adımlar için, pipet uçları, hücre sıyırıcılar ve tüpler kaplama tamponu ile önceden kaplanmalı ve kript kaybını önlemek için kabarcıklardan kaçınılmalıdır. Aksi belirtilmedikçe, kript parçalarının parçalanmasını önlemek için 1000 μL'lik bir pipet ucu kullanılmalıdır.
- Kript parçalarından enteroidler üretme
- En saf kript fraksiyonlarını (genellikle # 6- # 10) tek bir konik tüpte birleştirin.
- Kriptleri içeren konik tüpü 400 x g'da 4 °C'de 2 dakika santrifüjleyin.
- Süpernatanı bir pipetle aspire ederek atın ve kript peletini Yıkama Ortamında yeniden süspanse edin.
- Adım 3.1.2'deki gibi santrifüjleyin. Süpernatanı boşaltın ve kript peletine 2 mL Yıkama Ortamı ekleyin.
- Adım 2.3.11.1'de açıklandığı gibi kripto sayısını sayın.
- Yaklaşık 400 kript/100 μL'lik bir konsantrasyon elde etmek için kriptleri peletlemek, süpernatanı atmak ve buz gibi soğukta %100 azaltılmış büyüme faktörü bazal membran hücre dışı matrisinde (BME) yeniden süspanse etmek için adım 3.1.2'deki gibi santrifüjleyin.
NOT: Sıcaklıktaki değişiklikler kıvamını değiştirdiği için BME'yi 4 °C'de uygun şekilde çözmek önemlidir. BME'nin bir soğutma bloğu ve önceden soğutulmuş pipet uçları kullanılarak zamanından önce katılaşması önlenebilir.- Başka bir bazal membran matris formülasyonunun kullanılması, kubbeler oluşturulurken BME'nin seyreltilmesini gerektirebilir. Kullanılan BME'ye özel üretici talimatlarına bakın.
- BME'deki kriptleri iyice askıya almak için yukarı ve aşağı pipetleyin.
- 50 μL kript-BME süspansiyonunu, 8 kubbe/kuyucuk ile 37 °C'ye ayarlanmış bir ısıtma plakası üzerinde 6 oyuklu bir doku kültürü plakasına yavaşça pipetleyerek kript-BME kubbeleri yapın.
NOT: 6 oyuklu plaka, kubbelerin kaplanmasından önce gece boyunca 37 °C'de bir inkübatörde önceden ısıtılmalıdır. - Plakayı dikkatlice 37 °C,% 5CO2 inkübatöre taşımadan önce 6 oyuklu plakayı 1 dakika ısıtma plakasında tutun.
- 2 dakika sonra, 6 oyuklu plakayı kapak aşağı bakacak şekilde çevirin ve kubbelerin polimerize olmasını sağlamak için 30 dakika daha inkübe edin.
- 30 dakika sonra, kubbe içeren kuyucuklara 10 μM SB202190, 0.5 μM LY2157299 ve 10 μM Y-27632 ile desteklenmiş 3 mL oda sıcaklığında (RT) Enteroid Büyüme Ortamını dikkatlice ekleyin.
- 37 °C'de inkübe edin,% 5 CO2.
- Ortamı çıkarın ve her 2-3 günde bir inhibitörlerle desteklenmiş taze Enteroid Büyüme ortamı ile değiştirin.
- Enteroidlerin pasajı
- 7-10 gün sonra, kriptlerin Şekil 2E'deki gibi birçok tomurcuklanan yapıya sahip 3D enteroidler oluşturduğundan ve geçişe hazır olduğundan emin olun.
- Ortamı kubbe içeren kuyulardan atın.
- Oyuk başına her 4 kubbe için, kubbe içeren her bir oyuğa 10 μM Y-27632 ile desteklenmiş 1 mL buz gibi soğuk Enzimatik Olmayan Hücre Ayrışma Çözeltisi ekleyin.
- Önceden kaplanmış bir hücre kazıyıcı kullanarak, kubbeyi doku kültürü plakasından yavaşça ayırın.
- Enteroidleri 15 mL'lik konik bir tüpte toplayın ve 10 kez yukarı ve aşağı pipetleyerek ezin.
- RT'de parçalanmış enteroidleri içeren konik tüpü 80 rpm'de bir orbital çalkalayıcı üzerinde 10 dakika inkübe edin.
- Enteroidlere 10 μM Y -27632 ile 10 mL buz gibi soğuk Yıkama Ortamı ekleyin.
- Konik tüpü RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı atın ve peleti 10 mL taze Yıkama Ortamında yeniden süspanse edin ve 15 mL'lik yeni bir konik tüpe aktarın.
- Konik tüpü RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı atın ve peleti 1.5 mL mikrosantrifüj tüpünde 1 mL Enteroid Büyüme Ortamında yeniden süspanse edin.
- Mikrosantrifüj tüpünü RT'de 5 dakika boyunca 300 x g'da santrifüjleyin ve süpernatanı atın.
- Enteroid peletini buz gibi %100 BME'de yeniden süspanse edin ve 3.1.6-3.1.13 adımlarını izleyin.
- Her 7 günde bir repassage enteroidleri. Genleşme süreleri, tomurcuklanmanın yoğunluğuna, canlılığına ve derecesine bağlı olarak değişebilir. Büyük enteroid yapılar oluşturan çoklu tomurcuklanma yapıları, enteroidlerin geçmesi gerektiğinin göstergesidir.
- Enteroidlerin dondurularak saklanması
- Kriyoprezervasyon için, enteroidlerin kültürde en fazla beş kez geçtiğinden emin olun.
NOT: Bu deneysel olarak test edilmemiştir ve yazarların daha sonraki pasajların uygulanabilirliği azalttığı ve değişken sonuçlar verdiği yönündeki gözlemlerine dayanmaktadır. - Enteroidleri toplamak için, 3.2.2-3.2.9 adımlarında açıklandığı gibi ayrışma tamponunu kullanın.
NOT: 5 mL'lik bir pipet kullanarak enteroidleri mekanik olarak ayırın. - Adım 2.3.11.1'de açıklandığı gibi enteroid fragmanlarının sayısını sayın.
- Konik tüpü RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı atın ve ~2000 enteroid fragman/mL konsantrasyon elde etmek için 10 μM Y-27632 ile takviye edilmiş kriyoprezervasyon ortamında enteroid fragmanları yeniden süspanse edin ve önceden etiketlenmiş kriyoviyallere 1 mL alikot edin.
- Kriyovialleri kontrollü bir dondurma kabına koyun ve gece boyunca -80 °C'de saklayın.
- Kriyoviyalleri uzun süreli depolama için buhar fazındaki sıvı nitrojene aktarın.
- Kriyoprezervasyon için, enteroidlerin kültürde en fazla beş kez geçtiğinden emin olun.
- Bağırsak kript parçalarının resüsitasyonu
- İnkübatörün içine gece boyunca 6 oyuklu bir plaka yerleştirin.
- 5 mL'lik bir tüpü 5 mL kaplama ortamıyla önceden kaplayın.
- Kriyoviyalleri sıvı nitrojen deposundan çıkarın.
- Hemen, çözüldükten sonra, kriptleri kriyoviyalden önceden kaplanmış 5 mL'lik tüpe aktarın. Cryovial'ı Yıkama Ortamı ile durulayın ve 5 mL'lik tüpe ekleyin. Baloncuklardan kaçının.
- Yıkama Ortamı ile hacmi 5 mL'ye getirin ve 4 °C'de 5 dakika boyunca 400 x g'da santrifüjleyin.
- Santrifüjleme sırasında, 1,5 mL'lik bir tüpü kaplama ortamıyla önceden kaplayın.
- Santrifüjlemeden sonra, süpernatanı dökün, tüpte kalan ortamdaki peleti yeniden süspanse edin ve önceden kaplanmış 1.5 mL tüpe aktarın. 5 mL'lik tüpü Yıkama Ortamı ile yıkayın ve 1,5 mL'lik bir tüpe aktarın. 400 °C'de 5 dakika boyunca 4 x g'da santrifüjleyin.
- Enteroid Growth Media ile hacmi 1,5 mL'ye getirin.
- Yukarıdaki gibi santrifüjleyin (adım 3.4.7) ve dikkatlice aspire edin.
- BME'yi 4 °C'den alın ve buz/buz bloğu üzerine yerleştirin.
- Enteroid peletini buz gibi %100 BME'de yeniden süspanse edin ve 3.1.6-3.1.12 adımlarını izleyin.
- Medyayı 2-3 günde bir değiştirin.
4. 3D enteroidlerden 2D tek tabakaların üretilmesi ve değerlendirilmesi
NOT: Yukarıdaki gibi, kriptleri ve enteroidleri içeren tüm adımlar için, pipet uçları, hücre sıyırıcılar ve tüpler Kaplama Tamponu ile önceden kaplanmalı ve kript kaybını önlemek için kabarcıklardan kaçınılmalıdır.
- 2D tek tabaka oluşumu için transwell eklerinin hazırlanması
- Ekleri 24 oyuklu bir doku kültürü adaptör plakasına yerleştirin ve 1 μm PET 24 oyuklu hücre kültürü eklerinin apikal tarafını Enteroid Büyüme Ortamında 100 μL 1:15 BME seyreltmesi ile ön kaplama. Bariyer bütünlüğü ölçümleri alırken her zaman kontrol olarak kullanılacak ekstra bir ek parça kaplayın.
- Kaplanmış eki inkübatörde 24 oyuklu bir doku kültürü adaptör plakasına yerleştirin.
NOT: Transwell ekleri ile özel bir adaptör veya eşlik eden doku kültürü plakası kullanılmalıdır. - Polimerizasyona izin vermek için kültür eklerini 37 °C, %5CO2'de 1 saat inkübe edin.
NOT: BME kaplı transwell'ler parafilm ile kapatılabilir ve hemen kullanılmazsa 4 °C'de 1 haftaya kadar saklanabilir. - İnkübasyonun sonunda, 3D enteroid kültür ortamını aspire edin.
- 3D enteroidlerin ayrışması
- 3D enteroidler oluşturmak için yukarıda bölüm 3.1'de açıklandığı gibi resüsitasyon, kaplama ve kültürlenme ile resüsitasyona tabi tutulmuş, kaplanmış ve kültürlenmiş dondurularak saklanmış enteroid fragmanlarından 2D enteroid tek tabakaları oluşturun. Çözülmüş enteroidleri en az iki kez pasaj edin, son pasaj 2D tek katmanlı kültürler oluşturmak için işlenmeden önce en az 5 gün kültürlendi.
- Enteroid kubbelere 10 μM Y-27632 ile takviye edilmiş buz gibi soğuk Yıkama Ortamı ekleyerek enteroidleri hasat edin (4 kubbe için yaklaşık 1 mL ayrışma tamponu kullanın)
- Kubbeleri bir hücre kazıyıcı ile ayırın ve 15 mL'lik konik bir tüpte toplayın.
- Enteroid fragmanları oluşturmak için 1 mL'lik bir pipet ucu kullanarak 30 kez tritüre edin.
- Enteroid fragmanları daha da parçalamak için 200 μL'lik bir pipet ucuyla 40 kez tritüre edin.
- Enteroid fragmanları olan 15 mL'lik konik tüpün hacmini buz gibi soğuk Yıkama Ortamı ile 10 mL'ye getirin.
- Konik tüpü RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Enteroid peleti rahatsız etmemeye dikkat ederek BME tabakası da dahil olmak üzere süpernatanı aspire edin.
NOT: BME katmanı, peletin hemen üzerinde bulanık jelatinimsi bir katman olarak görünecektir. - Her 4 kubbe için, peleti 10 μM Y-27632 ile desteklenmiş 1 mL önceden ısıtılmış TrypLE ekspresyon enziminde yeniden süspanse edin.
- 24 oyuklu bir plakaya enteroid-TripLE karışımı ekleyin ve 37 ° C'de,% 5 CO2 'de 10 dakika inkübe edin.
- 10 dakika sonra, enteroidleri daha fazla parçalamak için enteroid-TrypLE karışımını 1 mL'lik bir pipet kullanarak 40 kez pipetleyin.
- Ardından, parçaları tek hücrelere ayırmak için parçaları 200 μL'lik bir pipetle 40 kez pipetleyin.
- Steril 22-G iğne takılı 3 mL veya 5 mL'lik bir şırınga kullanarak, tek hücreli süspansiyon elde etmek için hücre süspansiyonunu 4 kez aspire edin ve dağıtın.
- Enteroidlerin% 80'i tek hücrelere ayrılana kadar, adım 2.3.11.1'de açıklandığı gibi mikroskopi ile hücre ayrışmasını izleyin.
- Hücre süspansiyonunu 15 mL'lik konik bir tüpte toplayın ve %10 FBS ile desteklenmiş 4x hacimde Yıkama Ortamı ekleyerek enzimatik reaksiyonu söndürün.
- Enteroidleri önceden kaplanmış 40 μm hücre süzgecinden iki kez 50 mL'lik konik bir tüpe süzün.
- Konik tüpü 5 dakika boyunca 300 x g'da santrifüjleyerek tek hücreleri peletleyin.
- Transwell kesici uçlarda 2D tek katmanlı tohumlama.
- Süpernatanı boşaltın ve peleti, RT'de% 20 fetal sığır serumu (FBS) ile desteklenmiş küçük hacimli (~ 600 μL) organoid büyüme ortamında yeniden süspanse edin.
- Tripan Blue boya dışlama yöntemini, hemasitometreyi veya otomatik hücre sayacını kullanarak enteroid hücre yoğunluğunu ve canlılığını belirleyin. Ortalama %75'lik bir canlılık bekleniyor.
- Hücreleri tohumlamadan hemen önce adım 1.3'te uygulanan fazla kaplama solüsyonunu hücre kültürü ekinden dikkatlice çıkarın.
- Tek hücreleri, önceden kaplanmış bir hücre kültürü ekinin apikal yüzeyinde uç başına 200 μL'lik bir hacimde 1 x 105 hücrede tohumlayın.
- Hücre kültürü ekinin bazolateral tarafına% 20 FBS ile desteklenmiş 700 μL tam ortam ekleyin.
- Hücrelerin ek üzerine eşit şekilde yayılmasını sağlamak için plakayı 8 numara şeklinde 10 kez hareket ettirin.
- Plakayı biyogüvenlik kabininde 10 dakika boyunca plaka ısıtıcısında tutun.
- Plakayı 37 °C ve %5 CO2'de inkübe edin.
- 48 saat sonra, apikal ve bazal bölmelerdeki medyayı% 20 FBS ve inhibitörlerle desteklenmiş taze Enteroid Büyüme Ortamı ile değiştirin.
- Üçüncü günde, ortamı apikal ve bazolateral bölmelerden çıkarın, eki 1x PBS ile dikkatlice yıkayın ve yalnızca inhibitörlerle desteklenmiş Enteroid Diferansiyasyon ortamı ile değiştirin.
- Her iki bölmedeki ortamı 2-3 günde bir değiştirin.
- Epitelyal bariyer bütünlüğünün ve tek tabaka birleşmesinin kantitatif ölçümü
NOT: Bariyer bütünlüğü, transepitelyal elektrik direncini (TEER) ölçmek için bir epitelyal voltohmmetre kullanılarak değerlendirilebilir.- Transwell kültür plakasını inkübatörden çıkarın ve biyogüvenlik kabininde birkaç dakika RT'de dengelenmesine izin verin.
- STX2 elektrotlarının önceden koşullandırıldığından ve voltohmmetrenin üreticinin talimatlarına göre 1000Ω'a kalibre edildiğinden emin olun.
- Probun uzun çubuğunu bazolateral bölmeye ve kısa ucunu transwell epitel hücre kültürünün apikal bölmesine yerleştirin. Tek katmanı bozmamaya veya ek parçaya zarar vermemeye dikkat edin.
- Stabil hale geldikten sonra, hücresiz kesici uç da dahil olmak üzere, transwell kesici uç başına 3 TEER ölçümü kaydedin. Her kesici uç için ölçümlerin ortalamasını alın.
- Düzeltilmiş TEER değerini, boş kuyunun ortalama ölçümünü deney kuyucuklarının ortalama ölçümlerinden çıkararak ve ardından epitel bariyerinin direncini belirlemek için kesici ucun yüzey alanıyla çarparak hesaplayın (TEER [Ω.cm2] = [Rcell katmanı - Rblank] × Alanı).
Sonuçlar
2D enteroid türevli tek tabakalar oluşturmanın ilk adımı, doku ayrışması için hasat edilen bağırsak dokusu kesitini (Şekil 1A) hazırlamaktır. Bu, bağlı yağın ve mezenterin dokudan çıkarılmasıyla yapılır (Şekil 1B), ardından lümen yüzeyini ortaya çıkarmak için doku uzunlamasına kesilir, böylece bağırsağın mukus tabakası bir cam slayt kullanılarak hafifçe kazınarak çıkarılabilir. Hasat edilen bağırsak bölümü daha sonra ayrışma kolaylığını artırmak için giderek daha küçük doku bölümlerine kesilir (Şekil 1C). Kriptler daha sonra şelasyon tamponları (Şekil 1D, E) ve PBS'den oluşan bir dizi yıkama kullanılarak alttaki sub-mukozal dokudan ayrılır. İzole edilmiş bağırsak kriptleri (Şekil 1F) daha sonra bazal membran matris kubbelerine (Şekil 2A) gömülür ve 3D enteroidler oluşturmak için birkaç gün kültürlenir. Sığır ileumunun 10 inçlik bir bölümünden, yaklaşık 900.000 kript izole edilebilir ve enteroid oluşumu için kullanılabilir. Kültürde sadece birkaç saat sonra, kaplanmış kriptler uzamaya ve enterosferlere dönüşmeye başlar (Şekil 2B). 2 gün sonra, iyi tanımlanmış bir lümen gözlemlenebilir (Şekil 2C), kültürde 4. gün kadar erken bir tarihte tomurcuklanan yapılar kaydedilmiştir (Şekil 2D). 7. günde, olgun enteroidler gelişmiştir (Şekil 2E). 7 günlük 3D enteroidin immünofloresan boyaması, farklı hücre soylarının varlığını gösterir. Enteroidlerin konfokal mikroskobu, DAPI nükleer boyasının lokalizasyonunu, adherens bileşkesinde E-kaderin proteinini, enteroendokrin hücrelerin varlığını gösteren Kromogranin-A (Chr-A) boyamasını, Paneth hücrelerini gösteren Lizozim (LYZ) ve enterosit hücrelerini temsil eden Sitokeratin-18'i (CK-18) göstermektedir. Kültürde 7-10 gün sonra, daha fazla genişlemeye izin vermek ve aşırı kalabalıklaşmayı önlemek için enteroidler geçirilmelidir. Enteroidleri geçmek için en uygun zaman, ilk primer kript izolasyonundan 7-10 gün sonra olarak belirlendi ve sonuçta kültürdeki enteroidlerin sağlığına ve büyüme hızına bağlıydı. Şekil 2E'de gösterildiği gibi, istenen enteroid morfolojisini ve canlılığını elde etmek için optimum tohumlama yoğunluğu, kubbe başına 400 kripttir. Enteroidler kolayca kriyoprezervasyon yapılabilir ve çözülen enteroid fragmanları, çözülme sonrası iki geçişten sonra deneysel kullanım için tamamen iyileşir. Özellikle, kriyoprezervasyondan önce birincil kript kültürünün en az iki geçişi önerilir.
2D enteroid türevi bir tek tabaka üretmek için, 3D enteroidler hasat edilir ve bir dizi adımdan sonra, bir ayrışma çözeltisi (Şekil 4A) varlığında tek hücrelere mekanik olarak ezilir. Bu tek hücreler daha sonra bir bazal membran matris-kültür ortamı çözeltisi ile önceden kaplanmış bir transwell eki üzerine ekilebilir. Ortalama olarak, dört adet 3D enteroid kubbeden dört transwell tohumlanabilir. Bu nedenle, işlenen 3D enteroidlerin sayısı, deney için gereken transwell sayısına bağlıdır. Tek hücrelerin 1 x 105 tohumlama yoğunluğunda kaplanması ve başlangıçta %20 FBS varlığında kültürlenmesi (Şekil 4B-D), 1 haftadan daha kısa bir sürede birleşik bir tek tabaka oluşturabilir. Kültürde 2D tek tabakanın ilerleyici birleşimi, ışık mikroskobu kullanılarak zaman içinde izlenebilir (Şekil 4E, F). Transepitelyal elektriksel direnç (TEER) ölçümleri, zaman içinde ve deneysel stimülasyona yanıt olarak birleşmeyi doğrulayabilir ve epitel bariyer bütünlüğünü karakterize edebilir (Şekil 5A). Ortalama olarak, kültürde yedi gün sonra, kabaca %100 birleşik bir tek katman, ~1500 Ω ·cm2'lik karşılık gelen bir TEER değerine sahip olacaktır. 2D enteroid tek tabakalı TEER değerlerinin uzunlamasına bir değerlendirmesi, yedi gün boyunca TEER değerlerinde sabit bir artış gösterir ve on iki günde elde edilen en düşük değer olan 11.5 Ω ·cm2 ile düşmeden önce maksimum ortalama 1546 Ωcm2 değerine ulaşır (Şekil 5B). Farklılaşmış tek tabakaların immünofloresan etiketlemesi, bu protokol kullanılarak sağlam, organize, polarize bağırsak epitel tabakalarının oluşturulduğunu gösterir (Şekil 6). Boyanmış 2D tek tabakanın konfokal mikroskobu, DAPI nükleer boyası, E-kaderin ve F-aktin boyamasının lokalizasyonunu gösterir (Şekil 6A-D). 2D tek tabakanın floresan mikroskobu, enteroendokrin hücrelerin varlığını gösteren Kromogranin-A (Chr-A) boyaması, Paneth hücrelerini gösteren Lizozim (LYZ) ve enterosit hücre soylarını gösteren Sitokeratin-18 (CK-18) ile farklılaşmış bağırsak epitel hücrelerinin ayırt edici özelliklerini gösterir (Şekil 6E-L). Z-yığını modellemesi, farklılaşmış enterositlerin apikal yönünü kaplayan mikrovilluslarda bulunan F-aktin ve epitel hücreleri arasında aralıklı adherens bağlantılarında bulunan bir protein olan E-kaderin'in karakteristik birikimi ile 2D tek katmanlı kültürün beklenen polarizasyonunu gösterir (Şekil 6M).
Tek tabakanın işlevselliği, Toll benzeri reseptör (TLR) ligandları veya patojenler dahil olmak üzere çeşitli bileşenlerle apikal stimülasyon ve ardından apikal ve bazal bölmelerden hasat edilen hücre kültürleri süpernatantlarının sitokin miktar tayini ile değerlendirilebilir. Gerçekten de, kültürün 4. gününde TLR 1/2 agonisti Pam3csk4 ile tek tabakanın apikal yönü 24 saat boyunca uyarıldığında, tedavi edilmemiş tek tabakalara kıyasla her iki bölmede de artmış sitokin üretimi gözlenir (Şekil 7A, B).
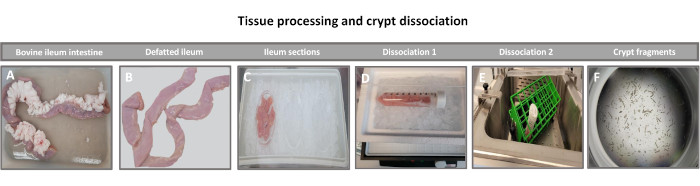
Şekil 1: Sağlıklı yetişkin sığırlardan sığır bağırsağı kript izolasyonu. (A) bütün yetişkin sığır ileumunun, (B) yağı alınmış ileumun, (C) buz üzerinde PBS'de 2,5 inçlik (6,3 cm) parçalara ayrılmış ileumun, (D) 4 °C'de ayrışma tamponu #1'de ileal doku kesitlerinin ve (E) 37 °C'de çalkalama suyu banyosunda ayrışma tamponu 2'de ve (F) izole edilmiş ileal kript parçalarının doku işlemesini gösteren görüntüler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
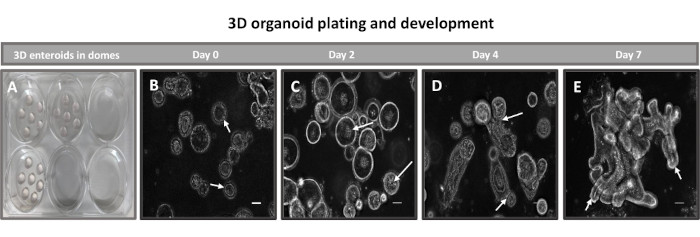
Şekil 2: Bazal membran matriksinde sığır primer 3D ileal enteroid gelişimi. 6 oyuklu bir doku kültürü plakasında oluşturulan (A) 3D enteroid kubbelerin ve kültürde 0, 2, 4 ve 7. günlerden itibaren (BE) 3D enteroid gelişiminin temsili görüntüleri. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
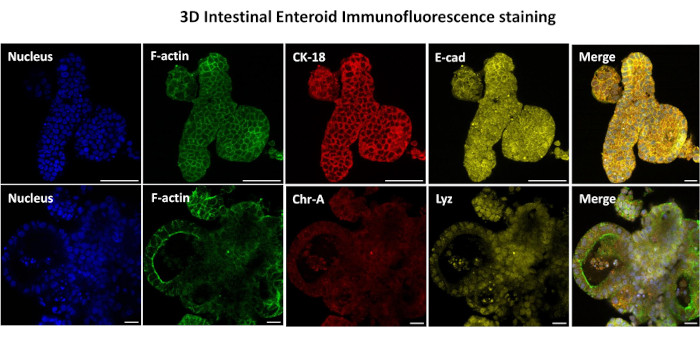
Şekil 3: Üç boyutlu bağırsak enteroidleri, epitel hücre soy boyamasını gösterir. Kültürde 7 gün sonra 3D enteroidlerin temsili görüntüleri, nükleer leke, F-aktin, sitokeratin-18 (CK-18), Kromogranin-A (Chr-A), Ecadherin (E-cad), Lizozim (Lyz) ve görüntülerin üst üste binmesini (Birleştirme) gösterir. Ölçek çubuğu 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
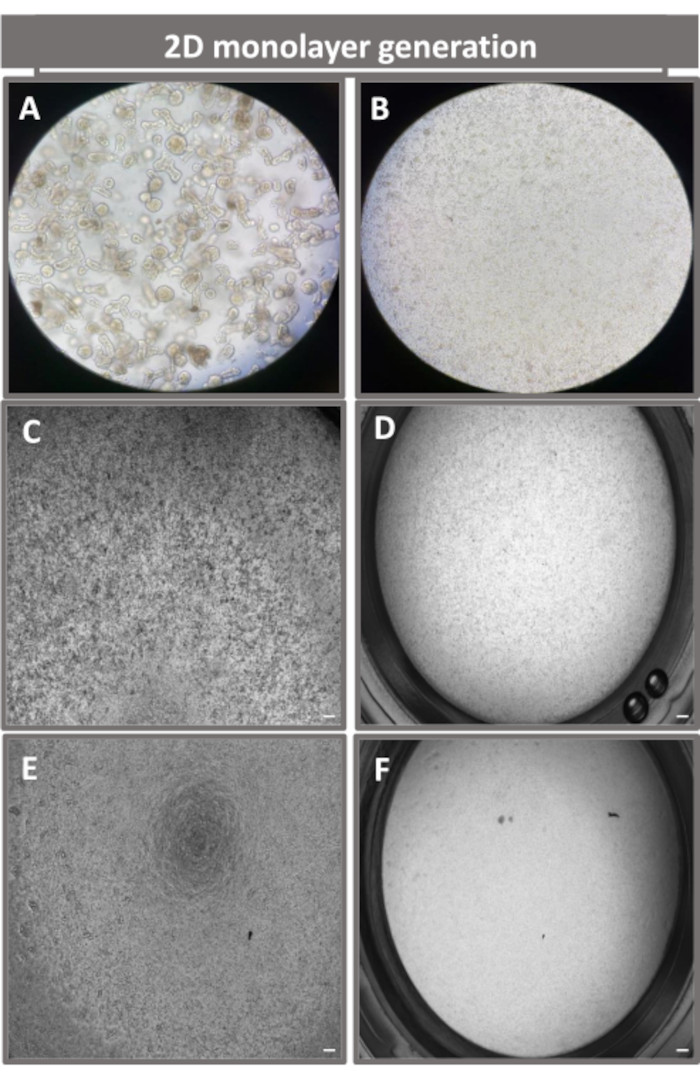
Şekil 4: İleal enteroidlerden 2D enteroid türevli tek tabakanın oluşturulması. (A) tek tabakalı tohumlamaya hazırlanırken ayrışma çözeltisindeki 3D enteroid fragmanlarının, 1 x 10 tohumlama yoğunluğunda bir transwell eki üzerine kaplanmış tek hücrelerintemsili görüntüleri 5 (B) ışık, (C) faz kontrastı ve (D) parlak alan mikroskobu kullanılarak 0. günde görüntülendi ve (E) faz kontrastı ve (F) kullanılarak beşinci günde görüntülenen transwell eklerinde tek tabaka gelişimi) parlak alan mikroskobu. 40x büyütme ve ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
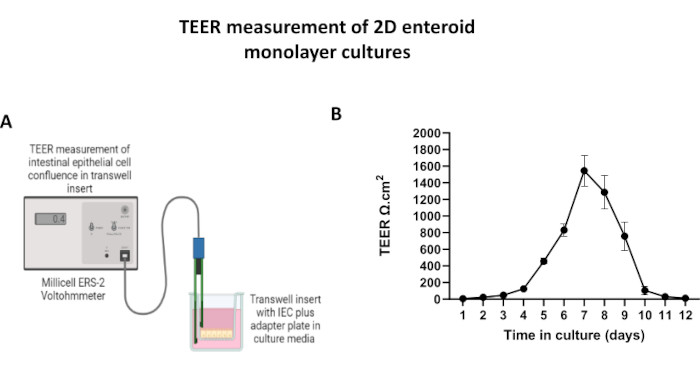
Şekil 5: Transwell ekler üzerinde 2D enteroid türevli tek tabakanın transepitelyal elektrik direnci (TEER) ölçümleri. (A) Bir voltohmmetrenin STX2 çubuk elektrotları kullanılarak 2D bağırsak epitel hücresi (IEC) tek tabakasının TEER ölçümlerinin nasıl elde edildiğinin şematik diyagramı, (B) Hücre kültüründe 12 gün boyunca 2D tek katmanlı TEER ölçümlerinin uzunlamasına izlenmesi. Her veri noktası, iki teknik kopyadan elde edilen ortalama bir TEER değerini ve standart ortalama hatasını (SEM) temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
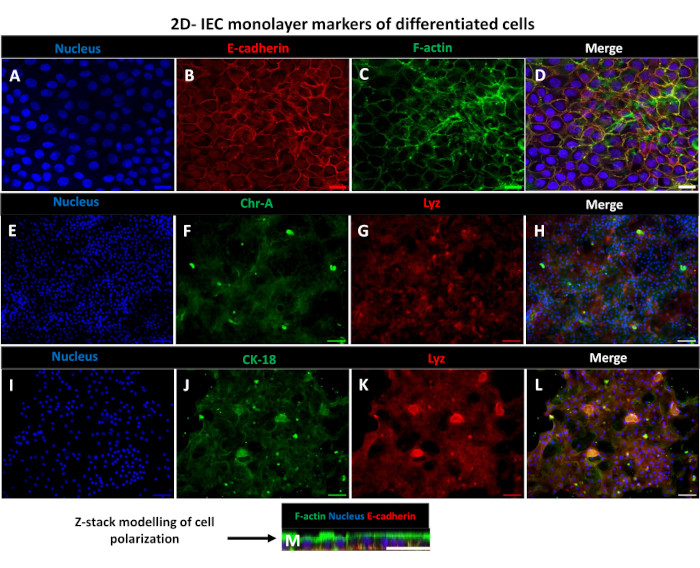
Şekil 6: Transwell ekleri üzerindeki farklılaşmış 2D enteroid türevli tek tabakalar, polarize bağırsak epitel tabakalarına dönüşür. (A-M) (A) çekirdeği (mavi), (B) E-kaderin (Kırmızı), (C) F-aktin (yeşil) ve (D) 3 görüntünün (birleştirme), (E, I) Nükleer boya, (F) Kromogranin-A, (J) Sitokeratin-18, (G, K) Lizozim ve (H, L) Görüntülerin birleştirilmesini gösteren kültürde 5 gün sonra transwell insert üzerinde 2D enteroid türevli tek tabakanın temsili immünofloresan görüntüleri. (M) 2D tek katmanlı tabakanın aynı epitel hücresi işaretleyici proteinlerinin dağılımını gösteren Z-yığını modellemesi. Görüntüler 2 biyolojik kopyadan elde edildi. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
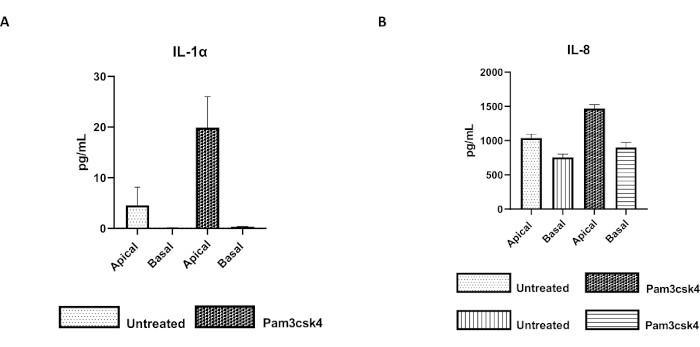
Şekil 7: Transwell ekleri üzerindeki sığır primer 2D enteroid türevli tek tabakalar fonksiyonel olarak aktiftir. 24 saat boyunca Pam3csk4 ile tedavi edilmeyen veya uyarılan kültürde 5 gün sonra transwell ekler üzerinde (A) IL-1α ve (B) IL-8'in apikal ve bazal hücre kültürü süpernatan sitokin sekresyonu. Veriler, bir hayvandan ve üç bağımsız deneyden elde edilen donmuş kript stoklarından elde edilen tek katmanlardan elde edilen ortalama sitokin seviyelerini ve SEM'i temsil eder. Sitokinler, üreticinin talimatlarına göre boncuk bazlı multipleks testi (Malzeme Tablosu) kullanılarak ölçüldü ve kompakt bir çoğullama ünitesi (Malzeme Tablosu) ve immünolojik test eğrisi uydurma yazılımı (Malzeme Tablosu) üzerinde analiz edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Reaktiflerin stoğu ve nihai konsantrasyonları. Tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Burada sunulan protokol, bağırsak fizyolojisi ve enterik bozuklukların araştırılması için fizyolojik olarak ilgili bir modeli açıklamaktadır. Birkaç araştırma grubu, 2D tek tabakalar 16,19,20,21,22,23,24 dahil olmak üzere sığır enteroid kültürlerinin oluşumunu tanımlamıştır. Tek katmanlı üretim teknik olarak açıkça zorlayıcı olmasa da, başarılı kültürleri tutarlı bir şekilde geliştirmek için birkaç dakikalık adımlar kritik öneme sahiptir. Bu nedenle, yayınlanmış literatürde kısaca açıklanan yöntemleri kullanarak 2D tek katmanların tekrarlanabilirliği, organoidler alanında acemi bir araştırmacı için zor olabilir. Burada açıklanan protokol, bu protokollerden ve diğer türlerde yayınlananlardan uyarlanmıştır ve yüksek oranda tekrarlanabilir transwell ekler üzerinde tek katmanlı üretim için adım adım bir kılavuz sağlar.
Burada özetlenen protokol, deneysel tasarımın belirli hedeflerine veya reaktiflerin mevcudiyetine uyacak şekilde kolayca değiştirilebilir. Gerçekten de, bu protokolü takiben, diğer yayınlarda24 açıklandığı gibi, daha düşük bir hücre yoğunluğunda (örneğin, 2.5 x 104) veya FBS'nin yokluğunda tek tabakaların tohumlanmasıyla başarılı kültürler elde edilebilir. Bununla birlikte, bu parametrelerin değiştirilmesi, birleşik bir tek tabaka oluşturmak için artan bir kültür gerektirebilir. Bu nedenle, bağışıklık hücreleri ile ko-kültür de dahil olmak üzere çalışma tasarımının ayrılmaz bir parçası olan diğer faktörler, deney için belirli bir zaman seyrini belirlerse, tohumlama yoğunluğu gerektiği gibi değiştirilebilir. 3D enteroidler ve 2D tek katmanlar oluşturmak için bu protokolde kullanılanın yerine diğer bazal membran formülasyonları ikame edilebilirken, bunlar optimum bazal membran-ortam oranını belirlemek için bazı optimizasyonlar gerektirecektir.
Tarif edilen metodolojide transwell eklerinin uygulanması, geleneksel plastik eşyalar ve 3D enteroid kültürler üzerinde tek katmanlı büyümeye göre birçok faydaya sahiptir. Standart doku kültürü plakaları ile karşılaştırıldığında, tek katmanlı kültürler için transwell'lerin kullanılması, bağırsak kriptlerinebenzerliği koruyacak şekilde hücresel farklılaşmayı ve organizasyonu teşvik eder 14,25. Bağırsak epitel bariyeri, toksinlerin ve mikroorganizmaların vücuda taşınmasını önlemede hayati önem taşırken aynı zamanda besin emilimini kolaylaştırır. Bu nedenle, bağırsağın bariyer bütünlüğünün sağlıklı bir şekilde nasıl çalıştığını ve bağırsak bozuklukları sırasında veya bileşiklere yanıt olarak nasıl değiştiğini anlamak çok önemlidir. 3D enteroid kültürlerden farklı olarak, burada gösterildiği gibi, transwell'lerde tek tabakaları birleştirirken ve TEER'i ölçerken bağırsak bariyer bütünlüğünün objektif değerlendirmesi mümkündür14,25. Transwell'lerde 2D tek tabakaların oluşturulması, immün veya stromal hücreler gibi ilgili hücre tipleriyle ikili kültüre de izin verir. Bu, bağırsak hücreleri ile doku mikro çevresinin hücreleri arasında kritik öneme sahip karışmanın karakterize edilmesini sağlar, bu da 3D kültürlerle elde edilemez. Tek tabakanın apikal yüzeyinin maruz kalması, yalnızca patojenlere ve bileşiklere deneysel maruziyete ve luminal ürünlerin toplanmasına izin vermekle kalmaz, aynı zamanda bağırsak mikrobiyotası ve moleküler absorpsiyon veya taşıma fizyolojisinin araştırılması da dahil olmak üzere bağırsak fizyolojisi ve hastalığının diğer yönlerine yönelik çalışmalara da olanak tanır13. Apikal ve bazal bağırsak yüzeyleri üzerinde bağımsız kontrol, 3D enteroid modellere göre belirgin bir avantajdır.
Birkaç deneme deneyi sayesinde, protokolün başarısına katkıda bulunan temel adımları belirledik. Tüm bağırsak dokusu örnekleri gece boyunca soğutulabilir ve ertesi gün işlenebilirken, izole edilen kript fraksiyonlarının parçalanmasını önlemek için doku ayrışması ve kript fragmanı adımlarının izolasyonu derhal gerçekleştirilmelidir. PBS yıkamalarını tamamladıktan sonra, kriptleri Yıkama Ortamında santrifüjlemek, adım 2.3.10'da ayrıntılı olarak açıklandığı gibi, kriptlerin bozulmasını önlemeye yardımcı olabilir. Enteroidleri geçirirken veya tek tabaka oluşumu için toplarken, enteroidleri BME kubbelerinden ayırmak esastır. BME'nin çözülmesine yardımcı olmak için Yıkama Ortamı buz gibi soğuk olmalıdır. Buna karşılık, önceden ısıtılmış TripLE kullanmak ve hücre süspansiyonunu iki kez filtrelemek, tek tabaka üretimi için gereken tek hücrelerin oluşturulmasına yardımcı olabilir. Son olarak, plakayı 8 numara şeklinde manuel olarak manevra yapmak, tek hücrelerin transwell eki üzerinde eşit şekilde dağılmasına yardımcı olabilir.
Bu protokolün önemli bir sınırlaması, 2D tek katmanların olgun bir Holstein dümeninden (>2 yaş) üretilen enteroid stoklardan üretilmesidir. Buzağılarda olgunlaşan gastrointestinal sistem, en iyi sonuçları elde etmek için tarif edilen protokolde küçük değişiklikler gerektirebilir. Sığır ırklarının bağırsak fizyolojisinde ırka özgü farklılıklar literatürde tanımlanmıştır26. Bu farklılıkların enteroid ve müteakip tek tabaka oluşumunu etkileyip etkilemeyeceği bilinmemekle birlikte, herhangi bir farklılığın protokolümüzde sadece küçük değişikliklere yol açacağından şüpheleniyoruz. Ek olarak, 2B kültür modelinin bazı doğal dezavantajları vardır. 3D enteroid modellerle karşılaştırıldığında, 2D kültürler bağırsak dokusu mimarisinin ve hücresel çeşitliliğin bazı yönlerinden yoksun olabilir ve 2D kültürün yayılmasıyla ilişkili kısıtlamalar ve zorluklar yaratabilir13. Yine de çalışmalar, bazı tek katmanların beklenen kript organizasyonu27'yi taklit edebileceğini ve bu sınırlamaların bazılarının hava-sıvı arayüzüne sahip 2D kültürler oluşturularak bile aşılabileceğini göstermektedir. Bununla birlikte, uygulamasının sorulan deneysel soru için uygun olup olmadığını belirlemek için bu modelin sınırlamaları tam olarak dikkate alınmalıdır.
Bu protokol, transwell ekleri üzerinde tek tabakalar oluşturmak için sığır ileumundan türetilen enteroidleri kullanarak sığır gastrointestinal sistemini modelleyen optimize edilmiş bir kültür sistemini tanımlar. Bulaşıcı hastalık araştırmalarından ilaç keşfine ve rejeneratif tıbba kadar geniş bir uygulama yelpazesiyle, bu yüksek verimli kültür sistemi, hayvan ve insan sağlığına karşılıklı olarak faydalı olabilecek önleyici ve terapötik stratejilerin benzeri görülmemiş bir şekilde geliştirilmesine yol açabilir.
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yürütüldüğünü beyan ederler.
Teşekkürler
Midwestern Üniversitesi'ndeki Hücresel ve Moleküler Çekirdek Tesisinin kullanımını kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
Referanslar
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, Academic Press. 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972(2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73(2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272(2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225(2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43(2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54(2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33(2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115(2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606(2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42(2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15(2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114(2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır