Method Article
중개 생물의학 연구에 응용하기 위한 소 1차 장내염 유래 2차원 단층 배양 시스템 생성
요약
엔테로이드는 조직 생리학 및 병태생리학, 약물 개발 및 재생 의학을 연구하기 위한 새로운 모델로 부상하고 있습니다. 여기서는 관련 조직 세포 유형과의 공동 배양을 허용하는 소 일차 세포 2D 장내 유래 배양 시스템에 대해 설명합니다. 이 모델은 위장 연구 모델링을 위한 중개적 이점을 제공합니다.
초록
오가노이드 세포 배양 시스템은 조직에서 관찰되는 복잡성을 재현할 수 있으므로 숙주-병원체 상호 작용 연구, 약물 효능 및 독성 평가, 조직 생명 공학에 유용합니다. 그러나, 설명된 이유로 이러한 모델들을 적용하는 것은 이들 모델들의 3차원(3D) 특성으로 인해 제한될 수 있다. 예를 들어, 소화기 질환을 연구하기 위해 3D 장내 배양 시스템을 사용하는 것은 장 내강과 분비 물질에 접근할 수 없기 때문에 어렵습니다. 실제로 병원균이 있는 3D 오가노이드를 자극하려면 루미날 미세주입, 3D 구조의 기계적 파괴 또는 apical-out 엔테로이드 생성이 필요합니다. 또한 이러한 오가노이드는 면역 세포 및 기질 세포와 공동 배양할 수 없어 병태생리학적 역학에 대한 심층적인 기계론적 분석이 제한됩니다. 이를 피하기 위해 소 1차 세포 2차원(2D) 장내형 단층 배양 시스템을 최적화하여 다른 관련 세포 유형과의 공동 배양을 가능하게 했습니다. 건강한 성체 소에서 분리한 회장 크립트를 배양하여 향후 사용을 위해 냉동 보존된 3D 오가노이드를 생성했습니다. 2D 단층은 단일 세포를 생성하기 위해 통과 및 파괴된 되살아난 3D 장내체를 사용하여 생성되었으며, 이 세포는 기저막 추출물 코팅 트랜스웰 세포 배양 삽입물에 파종되어 정점 표면을 노출시켰습니다. 장 단층 극성, 세포 분화 및 장벽 기능은 면역형광 현미경을 사용하고 경상피 전기 저항을 측정하여 특성화했습니다. 단층의 정점 표면의 자극은 정점 구획과 기저 구획 모두에서 사이토카인 분비에 의해 입증된 바와 같이 단층의 예상 기능을 드러냈습니다. 설명된 2D 장내 유래 단층 모델은 숙주-병원체 상호 작용 및 장 생리학, 약물 개발 및 재생 의학을 조사하는 데 큰 가능성을 가지고 있습니다.
서문
연구에서 동물 모델은 질병 병태생리학과 감염 중 숙주 면역 반응의 역학에 대한 이해를 높이는 데 중요한 역할을 하며 새로운 예방 및 치료 전략의 개발을 지원합니다 1,2,3,4. 이러한 모델은 동물의 연구 발견 및 발전을 지원하며 인간 건강 연구 발전의 핵심입니다. 수십 년 동안 설치류 모델은 인간 질병에 대한 면역 메커니즘과 기초 생물학 연구의 발전을 뒷받침해 왔습니다 3,5,6,7. 설치류 모델은 스크리닝 및 초기 개발 연구에서 중요하지만, 대형 동물 모델은 치료 효능 및 안전성 테스트를 포함하여 초기 발견 및 후기 개발 연구 모두에서 인간 질병을 연구하는 데 더 적절한 비교를 제공합니다 1,3,4,5. 가축은 크립토스포리디움증, 살모넬라증, 결핵, 호흡기 세포융합 바이러스 및 브루셀라병을 포함한 일부 질병에 대한 인간 응용 프로그램의 보다 효율적인 번역을 위해 설치류 모델에 비해 분명한 이점을 제공합니다 1,7,8. 실제로, 이러한 질병 및 기타 질병은 인간과 유사한 질병 발병 기전 및 면역 과정을 공유하는 소에서 자연 발생하며, 근친 개체군으로서 소는 인간의 면역 반응에 영향을 미치는 유전적 및 환경적 이질성을 모방합니다 5,8,9,10 . 감염병 연구를 위한 소 모델의 이점은 먼저 정교한 배양 시스템을 사용한 다음 in vivo 연구를 단계적으로 구현함으로써 극대화할 수 있습니다. 매우 복잡한 소 유래 배양 시스템을 초기에 사용하면 살아있는 동물 연구의 수를 크게 줄이면서 성공적인 중개 및 응용 연구의 가능성을 높일 수 있습니다. 배양 모델은 최적의 예측 타당성을 위해 장기 수준에서 질병 과정을 재현해야 하며, 공간적으로나 기능적으로 네이티브 조직 미세환경을 유지해야 합니다.
점막 면역 반응은 위장 장세포와 점막 표면 아래에 위치한 다양한 면역 세포 집단에 의해 형성된 매우 효율적인 장벽으로 구성된 다면적 시스템이다(11). 이 매우 복잡한 시스템은 감염 중에 위장 항상성을 유지하고 장 병원체에 대한 면역 방어를 시작하는 데 매우 중요합니다11. 장세포와 기저 선천성 면역 세포 간의 통신은 병원성 미생물에 대한 보호 면역 반응의 발달을 시작합니다. 따라서 복잡성 수준이 비교적 높은 배양 시스템은 숙주-장 병원체 상호 작용에 대한 최적의 조사에 필요하며 장 생리학과 약물 발견 및 개발을 이해하는 데 매우 효과적입니다12,13. 오가노이드는 기원 조직의 구조와 기능을 유사한 강력한 배양 시스템입니다14,15. 이러한 모델의 다세포성은 다양한 세포 집단의 역할과 장 건강 및 질병과 관련된 세포 상호 작용에 대한 조사를 가능하게 합니다12,14. 그러나 현재 연구에서 인간 유래 오가노이드 모델은 인간 장 상피 세포의 충분한 양과 일관된 품질을 얻기 어렵고 배양 시 세포 생존력이 제한되어 있습니다. 불멸화된 세포주는 이러한 모델에서 일관되게 높은 수율의 상동 배양을 얻는 데 사용할 수 있습니다. 그러나, 형질전환된 세포는 본질적으로 비형질전환된 상피세포의 다양성과 기능적 복잡성이 결여되어있다 16,17. 위장 질환 및 생리학을 조사하기 위한 모델로 소 조직에서 유래한 배양액을 사용하는 것의 장점에는 건강한 기증자로부터 조직 샘플을 일관되게 얻을 수 있는 용이성, 향상된 세포 생존율, 불멸화되지 않은 조직에서만 달성할 수 있는 더 큰 세포 다양성 등이 포함됩니다. 비교 조직 전사체학 및 장내 오가노이드의 특성 분석은 인간과 소 간의 보존된 상동 유전자 및 세포 전위의 유사성을 보여줍니다18. 따라서 소 오가노이드 유래 배양 시스템은 인간 장 질환을 조사하는 데 유리할 수 있으며, 그 결과는 인간 의학으로 쉽게 번역될 수 있습니다.
본 명세서에 기술된 프로토콜은 장 병원체 또는 화합물에 대한 숙주 반응 및 소 장내 유래 2D 1차 세포 배양 시스템을 사용하여 장 생리학을 평가하기 위한 효과적인 플랫폼을 상세히 기술한다. 3D 오가노이드와 달리 트랜스웰 인서트에서 생성된 2D 배양 시스템은 면역 세포 또는 기질 세포가 있는 장 세포의 이중 배양을 허용하여 조직 수준의 역학을 연구할 수 있습니다. 생물 의학 연구, 제약 개발 및 효능 테스트에 응용되는 이 생리학적으로 관련된 모델은 소와 사람 모두의 건강과 발전에 도움이 될 수 있습니다.
프로토콜
모든 프로토콜은 동물 복지에 대한 기관 및 국가 지침과 규정을 준수하여 수행되었습니다.
1. 시약 준비
참고: 이 연구에 사용된 시약의 원료 및 최종 농도는 표 1에 나와 있습니다.
- 시료 채취 완충액 준비: 페니실린(100U/mL), 스트렙토마이신(100μg/mL), 겐타마이신(25μg/mL) 및 카스포풍긴(2.5μg/mL)을 함유한 얼음처럼 차가운 인산염 완충 식염수(PBS) 1L를 혼합합니다. 원액을 4 °C에서 보관하십시오.
- 해리 시약 #1 준비: 18.55mL의 샘플 수집 완충액(1.1단계에서 설명됨), 1.422mL의 에틸렌디아민테트라아세트산(EDTA, 0.422M/pH 7.4), 1M 1,4-디티오트레이톨(DTT) 용액 20μL, Y-27632 용액 4μL(5000x/50mM)를 혼합합니다. 용액을 4°C에서 보관합니다.
- 해리 시약 #2 준비: 18.57mL의 수집 완충액(1.1단계에서 설명됨), 1.422mL의 EDTA(0.422M/pH 7.4), 4μL의 Y-27632 용액(5000x/50mM)을 혼합합니다. 용액을 37°C에서 보관합니다.
- 장내 성장 배지 스톡 준비: 오가노이드 성장 배지 9.875mL와 보충제, 페니실린 100μL(100U/mL), 스트렙토마이신(100μg/mL), 겐타마이신 5μL(25μg/mL) 및 카스포푼진 20μL(2.5μg/mL)를 혼합합니다. 용액을 4°C에서 보관합니다.
- 장내 분화 배지 스톡 준비: 오가노이드 분화 배지 10mL와 보충제, 페니실린 100μL(100U/mL), 스트렙토마이신(100μg/mL), 겐타마이신 5μL(25μg/mL) 및 카스포푼진 20μL(2.5μg/mL)를 혼합합니다. 용액을 -20 °C에서 보관하십시오.
- 세척 배지 준비: DMEM/F-12 1.1 배지 48.45mL(L-글루타민 포함, HEPES 제외), 비타민 A 미함유 B-27 보충제 1mL(50x 스톡), 페니실린 500μL(100U/mL), 스트렙토마이신(100μg/mL), 겐타마이신 25μL(50mg/mL 스톡), 카스포푼진 25μL(5mg/mL 스톡)를 혼합합니다. 용액을 4°C에서 보관합니다.
- 코팅 완충액 준비: 억제제가 없는 DMEM: F12 complete 배지 25mL와 소 혈청 알부민(BSA) 25mg을 혼합합니다. 용액을 4°C에서 보관합니다.
2. 전체 조직에서 장낭 분리(그림 1)
참고: 소 소장 장내염은 현지 소고기 가공 공장에서 생산된 건강한 성인 홀스타인 수송아지(>2세)에서 얻은 회장 조직에서 생성되었습니다. 이 일련의 실험에는 한 명의 기증자가 사용되었습니다.
- 장 조직 샘플 준비
- 채취한 ~10인치(25cm)의 장 조직 샘플을 ~400mL의 얼음 냉장 수집 완충액(PBS+ 항생제/항진균제)에 넣고 실험실로 운송하기 위해 얼음 위에 놓습니다.
- 수술용 가위(예: 마요네즈 가위)와 겸자(예: 애드슨 집게)를 사용하여 장 조직 샘플에서 과도한 지방과 장간막을 제거합니다.
- 티슈를 두 개의 동일한 조각으로 자릅니다.
- 수술용 가위로 조직을 세로로 열고 멸균 PBS에서 조직을 헹굽니다.
- 멸균 유리 현미경 슬라이드의 측면을 사용하여 장 샘플의 점액층을 부드럽게 제거하고 신선한 PBS로 조직을 헹굽니다.
참고: 이 단계는 융모를 제거하는 데 도움이 되며 후속 단계에서 크립트 분획의 순도를 높이는 데 도움이 됩니다. - 각 5인치(13cm) 조각에 대해 조직을 2.5인치(6.5cm) 두 개로 자른 다음 각 조각을 거의 동일한 4개의 작은 조각으로 잘라 조직 해리를 용이하게 합니다.
- 장 조직의 해리
- 멸균된 50mL 코니컬 튜브에 20mL 부피의 조직 해리 시약 #1을 준비하고 부피 변위로 인해 반월상 연골이 원뿔형 튜브의 20mL 표시에서 35mL 표시로 이동할 때까지 작은 조직 샘플을 원뿔형 튜브에 증착합니다.
- 나머지 소장 조직 샘플 조각에 대해 위의 단계를 반복합니다.
- 파라필름으로 원추형 튜브를 밀봉하고 원뿔형 튜브를 수동으로 10회 흔듭니다.
알림: 프로토콜 전반에 걸쳐 수동 흔들기는 의도적이지만 부드러운 방식으로 수행되어야 합니다. - 원뿔형 튜브를 궤도 흔들림 플랫폼의 용기에 있는 얼음 위에 수평으로 놓습니다.
- 분당 회전수(rpm) 30회(80분)로 용기의 얼음 위에서 원뿔형 튜브를 흔듭니다. 10분마다 원뿔형 튜브를 수동으로 흔듭니다.
- 50mL 코니컬 튜브에 20mL 부피의 예열된(37°C) 조직 해리 시약 #2(위와 같이 제형화되었지만 DTT는 없음)를 준비합니다. 해리 시약 #1이 들어 있는 원추형 튜브의 조직 샘플을 해리 시약 #2가 들어 있는 원뿔형 튜브에 증착합니다.
- 파라필름으로 원추형 튜브를 밀봉하고 원뿔형 튜브를 수동으로 10회 흔듭니다.
- 원뿔형 튜브를 예열된(37°C) 진탕 수조에 넣고 약 60°C 각도로 기울이고 150rpm에서 10분 동안 흔들고 5분 후 수동으로 흔들고 총 10분 배양 후 다시 흔들어 줍니다.
- crypt 조각의 격리
- 라벨 10 멸균 원뿔형 튜브 #1 - #10. 라벨이 부착된 각 원뿔형 튜브에 20mL의 멸균 얼음처럼 차가운 PBS를 추가합니다.
- 해리 시약 #2가 들어 있는 원추형 튜브의 조직 조각을 얼음처럼 차가운 PBS #1이 들어 있는 새로운 멸균 50mL 원뿔형 튜브로 옮깁니다.
- 원추형 튜브를 수동으로 10번 흔듭니다.
- 원뿔형 튜브를 파라필름으로 밀봉하고 얼음 위에 수평으로 놓습니다. 궤도 셰이커의 원뿔형 튜브를 80rpm에서 10분 동안 흔듭니다. 10분 후 원뿔형 튜브 #1을 수동으로 10회 흔듭니다. 이것은 세척 #1로 간주됩니다.
- 한 쌍의 수술용 집게를 사용하여 조직 샘플을 원추형 튜브 #2로 부드럽게 옮깁니다.
- 2.3.2 - 2.3.4 단계를 반복하면 세척 #2로 간주됩니다.
- 세탁 #10까지 세탁을 반복합니다.
- 각 세척의 상층액에는 장내 생성에 사용될 크립트가 포함되어 있습니다. 10회 세척이 모두 완료될 때까지 상층액이 포함된 튜브를 4°C로 유지합니다.
- 10차 세척이 완료되고 조직 절편을 폐기한 후, 원뿔형 튜브 #6-#10의 상층액을 400 x g에서 400 x g 에서 2분 동안 원심분리하여 분리된 크립트를 펠릿화합니다.
알림: 세척 6-10에는 제한된 파편과 단일 세포가 있는 온전한 크립트의 가장 깨끗한 부분이 포함되어 있습니다. 따라서 이러한 분획물만 엔테로이드 생성에 사용하고 이전 세척(#2-#5)은 폐기하는 것이 좋습니다 - 상층액을 버리고 4mL의 신선하고 얼음처럼 차가운 PBS를 재현탁 없이 크립트에 추가합니다(이렇게 하면 현미경 검사까지 조각을 손상되지 않은 상태로 유지하는 데 도움이 됩니다).
- 현미경으로 각 원뿔형 튜브 #6-#10에 대한 해리된 크립트의 순도를 평가합니다.
- 50 μL의 PBS를 384웰 플레이트에 추가합니다.
- PBS에 10μL의 크립트 현탁액을 추가하고 40x 배율 대물 렌즈를 사용하여 크립트 순도, 무결성 및 계수를 측정합니다.
알림: 접시 바닥에 십자가를 잘 그리면 계산이 더 쉬워집니다.
3. 소 회장 장내염의 생체 외 생성 및 통과(그림 2)
참고: 가장 순수하고 온전한 장 크립트가 있는 원추형 튜브의 크립트는 다운스트림 분석에 사용됩니다. 크립트 및 엔테로이드와 관련된 모든 단계에서 피펫 팁, 셀 스크레이퍼 및 튜브는 코팅 버퍼로 사전 코팅되어야 하며 크립트의 손실을 방지하기 위해 기포를 피해야 합니다. 달리 명시되지 않는 한, 1000μL 피펫 팁을 사용하여 크립트 조각이 부서지는 것을 방지해야 합니다.
- 크립트 조각에서 장내염 생성
- 가장 순수한 crypt 분획(보통 #6-#10)을 하나의 원뿔형 튜브로 결합합니다.
- 크립트가 들어 있는 원뿔형 튜브를 400 x g 에서 4°C에서 2분 동안 원심분리합니다.
- 피펫으로 흡입하여 상층액을 버리고 크립트 펠릿을 Wash Media에 재현탁합니다.
- 3.1.2 단계에서와 같이 원심 분리기. 상층액을 디캔팅하고 2mL의 세척액을 크립트 펠릿에 추가합니다.
- 2.3.11.1단계에 설명된 대로 crypt 수를 계산합니다.
- 3.1.2단계에서와 같이 원심분리하여 크립트를 펠릿화하고, 상층액을 버리고, 얼음처럼 차가운 100% 감소된 성장 인자 기저막 세포외 기질(BME)에 재현탁하여 약 400 crypts/100 μL의 농도를 달성합니다.
알림: 온도 변화가 일관성을 변화시키므로 BME를 4°C에서 적절하게 해동하는 것이 중요합니다. BME는 냉각 블록과 사전 냉각된 피펫 팁을 사용하여 조기에 응고되는 것을 방지할 수 있습니다.- 다른 기저막 매트릭스 제형을 사용하면 돔을 생성할 때 BME를 희석해야 할 수 있습니다. 사용 중인 BME와 관련된 제조업체 지침을 참조하십시오.
- BME의 지하실을 완전히 매달기 위해 위아래로 피펫을 사용합니다.
- 최대 8개의 돔/웰을 사용하여 37°C로 설정된 온난화 플레이트에서 50μL의 crypt-BME 현탁액을 6웰 조직 배양 플레이트에 천천히 피펫팅하여 crypt-BME 돔을 만듭니다.
참고: 6웰 플레이트는 돔을 도금하기 전에 밤새 37°C의 인큐베이터에서 예열해야 합니다. - 6-웰 플레이트를 1분 동안 온난화 플레이트에 유지한 후 플레이트를 37°C, 5% CO2 인큐베이터로 조심스럽게 옮깁니다.
- 2분 후 뚜껑이 아래를 향하도록 6웰 플레이트를 뒤집고 돔이 중합될 수 있도록 추가로 30분 동안 배양합니다.
- 30분 후 10μM SB202190, 0.5μM LY2157299 및 10μM Y-27632가 보충된 실온(RT) 장내 성장 배지 3mL를 돔이 들어 있는 웰에 조심스럽게 추가합니다.
- 37 °C, 5 % CO2 에서 배양합니다.
- 배지를 제거하고 2-3일마다 억제제가 보충된 새로운 장내 성장 배지로 교체하십시오.
- 장내 노이의 통과
- 7-10일 후, 크립트가 그림 2E와 같이 많은 싹트는 구조를 가진 3D 장내를 형성하고 통과할 준비가 되었는지 확인합니다.
- 돔이 들어있는 우물에서 매체를 버리십시오.
- 웰당 4개의 돔마다 10μM Y-27632가 보충된 얼음처럼 차가운 비효소 세포 해리 용액 1mL를 돔이 포함된 각 웰에 추가합니다.
- 사전 코팅된 세포 스크레이퍼를 사용하여 조직 배양 플레이트에서 돔을 부드럽게 분리합니다.
- 15mL 원뿔형 튜브에 장내항체를 수집하고 위아래로 10회 피펫팅하여 삼중합니다.
- 조각난 장염체가 들어 있는 원뿔형 튜브를 RT에서 80rpm의 궤도 셰이커에서 10분 동안 배양합니다.
- 장내류에 10μM Y -27632의 얼음처럼 차가운 세척 배지 10mL를 추가합니다.
- 원뿔형 튜브를 300 x g 에서 RT에서 5분 동안 원심분리합니다.
- 상층액을 버리고 펠릿을 10mL의 새 세척 배지에 재현탁시킨 다음 새 15mL 코니컬 튜브로 옮깁니다.
- 원뿔형 튜브를 300 x g 에서 RT에서 5분 동안 원심분리합니다.
- 상층액을 버리고 펠릿을 1.5mL 미세 원심분리 튜브의 엔테로이드 성장 배지 1mL에 재현탁시킵니다.
- 마이크로 원심분리기 튜브를 300 x g 에서 RT에서 5분 동안 원심분리하고 상층액을 버립니다.
- 장내 펠릿을 얼음처럼 차가운 100% BME에 재현탁시키고 3.1.6-3.1.13 단계를 따릅니다.
- 7일마다 장내구 재통과. 확장 시간은 밀도, 생존 가능성 및 발아 정도에 따라 달라질 수 있습니다. 큰 장내형 구조를 만드는 여러 개의 싹트는 구조는 장내골이 통과해야 함을 나타냅니다.
- 장내 냉동 보존
- 냉동 보존의 경우 장내세포가 배양에서 5회 이상 통과하지 않도록 합니다.
참고: 이것은 실험적으로 테스트되지 않았으며 이후 구절이 실행 가능성을 감소시키고 다양한 결과를 산출한다는 저자의 관찰을 기반으로 합니다. - 엔테로이드를 수확하려면 3.2.2-3.2.9 단계에 설명된 대로 해리 완충액을 사용하십시오.
참고: 5mL 피펫을 사용하여 장내염체를 기계적으로 해리합니다. - 2.3.11.1단계에서 설명한 대로 장내 단편의 수를 계산합니다.
- 원뿔형 튜브를 300 x g 에서 RT에서 5분 동안 원심분리합니다.
- 상층액을 버리고 10μM Y-27632가 보충된 동결 보존 배지에 장내 단편을 재현탁시켜 ~2000 장내 단편/mL의 농도를 달성하고 사전 라벨링된 극저온 추출에 1mL를 분취합니다.
- 극저온 냉결 용기에 넣고 -80°C에서 밤새 보관합니다.
- 장기 보관을 위해 극저온을 증기상 액체 질소로 옮깁니다.
- 냉동 보존의 경우 장내세포가 배양에서 5회 이상 통과하지 않도록 합니다.
- 장낭 조각의 소생술
- 인큐베이터 내부에 밤새 6웰 플레이트를 놓습니다.
- 5mL 튜브에 5mL의 코팅 배지를 사전 코팅합니다.
- 액체 질소 저장소에서 극저온을 제거합니다.
- 해동된 후 즉시 크립트를 극저온 저온에서 사전 코팅된 5mL 튜브로 옮깁니다. 세척 배지로 냉동 공기를 헹구고 5mL 튜브에 넣습니다. 거품을 피하십시오.
- 세척 배지를 사용하여 부피를 5mL까지 올리고 400 x g 에서 4°C에서 5분 동안 원심분리합니다.
- 원심분리 중에 1.5mL 튜브를 코팅 배지로 사전 코팅합니다.
- 원심분리 후 상층액을 붓고 튜브에 남아 있는 배지에 펠릿을 재현탁시킨 다음 사전 코팅된 1.5mL 튜브로 옮깁니다. 세척 배지로 5mL 튜브를 세척하고 1.5mL 튜브로 옮깁니다. 400 x g 에서 4 °C에서 5분 동안 원심분리합니다.
- 장내 성장 배지로 부피를 1.5mL까지 끌어올립니다.
- 위와 같이 원심분리기(3.4.7단계)하고 조심스럽게 흡입합니다.
- 4 °C에서 BME를 가져 와서 얼음 / 얼음 블록 위에 놓습니다.
- 장내 펠릿을 얼음처럼 차가운 100% BME에 재현탁시키고 3.1.6-3.1.12 단계를 따릅니다.
- 2-3일마다 미디어를 교체하십시오.
4. 3D 장내체에서 2D 단층의 생성 및 평가
참고: 위와 같이 크립트 및 엔테로이드와 관련된 모든 단계에서 피펫 팁, 셀 스크레이퍼 및 튜브는 코팅 버퍼로 사전 코팅되어야 하며 크립트의 손실을 방지하기 위해 기포를 피해야 합니다.
- 2D 단층 형성을 위한 트랜스웰 인서트 준비
- 인서트를 24웰 조직 배양 어댑터 플레이트에 넣고 1μm PET 24웰 세포 배양 인서트의 정점 쪽을 장내 성장 배지에 1:15 희석한 100μL의 BME로 사전 코팅합니다. 배리어 무결성 측정을 수행할 때 컨트롤로 사용할 추가 인서트를 항상 코팅하십시오.
- 코팅된 인서트를 인큐베이터의 24웰 조직 배양 어댑터 플레이트에 놓습니다.
알림: 특정 어댑터 또는 동반 조직 배양 플레이트는 트랜스웰 삽입물과 함께 사용해야 합니다. - 배양 삽입물을 37°C, 5%CO2 에서 1시간 동안 배양하여 중합을 허용합니다.
참고: BME 코팅 트랜스웰은 파라필름으로 밀봉할 수 있으며 즉시 사용하지 않을 경우 최대 1주일 동안 4°C에서 보관할 수 있습니다. - 배양이 끝나면 3D 장내배양 배지를 흡인합니다.
- 3D 장내염체의 해리
- 위의 섹션 3.1에서 설명한 대로 소생, 도금 및 배양된 냉동 보존된 장내 단편으로부터 2D 장내형 단층을 생성하여 3D 장내류를 형성합니다. 해동된 장내유체를 최소 2회 통과시키고, 마지막 절개는 2D 단층 배양을 생성하기 위해 처리하기 전에 최소 5일 동안 배양합니다.
- 장형 돔에 10μM Y-27632가 보충된 얼음처럼 차가운 세척 배지를 첨가하여 장류를 수확합니다(4개의 돔에 약 1mL의 해리 완충액 사용).
- 셀 스크레이퍼로 돔을 분리하고 15mL 코니컬 튜브에 모읍니다.
- 1mL 피펫 팁을 사용하여 30회 Triturate하여 장내 절편을 생성합니다.
- 200μL 피펫 팁으로 40회 트라이튜레이트하여 장내 절편을 추가로 분해합니다.
- 장내 절편이 있는 15mL 원뿔형 튜브의 부피를 얼음처럼 차가운 세척 배지를 사용하여 10mL로 가져옵니다.
- 원뿔형 튜브를 300 x g 에서 RT에서 5분 동안 원심분리합니다.
- BME 층을 포함한 상층액을 흡입하여 장내 펠릿을 방해하지 않도록 주의합니다.
알림: BME 층은 펠릿 바로 위에 흐린 젤라틴 층으로 나타납니다. - 4개의 돔마다 10μM의 Y-27632가 보충된 예열된 TrypLE 급효소 1mL에 펠릿을 재현탁시킵니다.
- 장내 TrypLE 혼합물을 24웰 플레이트에 넣고 37°C, 5%CO2 에서 10분 동안 배양합니다.
- 10분 후 1mL 피펫을 사용하여 장내-TrypLE 혼합물을 40회 피펫하여 장내이드를 추가로 조각화합니다.
- 그런 다음 피펫 단편을 200μL 피펫으로 40회 분할하여 단편을 단일 세포로 분해합니다.
- 멸균 22G 바늘이 부착된 3mL 또는 5mL 주사기를 사용하여 세포 현탁액을 4회 흡입 및 분주하여 단일 세포 현탁액을 얻습니다.
- 2.3.11.1단계에서 설명한 대로 장세포의 80%가 단일 세포로 분해될 때까지 현미경으로 세포 해리를 모니터링합니다.
- 세포 현탁액을 15mL 원뿔형 튜브에 모으고 10% FBS가 보충된 세척 배지 4배를 추가하여 효소 반응을 소멸시킵니다.
- 사전 코팅된 40μm 셀 스트레이너를 통해 엔테로이드를 50mL 코니컬 튜브에 두 번 여과합니다.
- 원뿔형 튜브를 300 x g 에서 5분 동안 원심분리하여 단일 세포를 펠렛화합니다.
- 트랜스웰 인서트의 2D 단층 파종.
- 상층액을 디캔팅하고 RT에서 20% 소 태아 혈청(FBS)이 보충된 소량(~600μL)의 오가노이드 성장 배지에 펠릿을 재현탁시킵니다.
- Trypan Blue 염료 배제 방법, 혈구계 또는 자동 세포 카운터를 사용하여 장내 세포 밀도 및 생존율을 측정합니다. 평균 75%의 생존율이 예상됩니다.
- 세포를 파종하기 직전에 세포 배양 삽입물에서 1.3단계에서 적용된 여분의 코팅 용액을 조심스럽게 제거합니다.
- 사전 코팅된 세포 배양 인서트의 정점 표면에 삽입물당 200μL의 부피로 1 x 105 개 세포로 단일 세포를 파종합니다.
- 20% FBS가 보충된 700μL의 완전한 배지를 세포 배양 삽입물의 기저측에 추가합니다.
- 플레이트를 숫자 10 모양으로 8회 조작하여 셀이 인서트 위로 고르게 퍼질 수 있도록 합니다.
- 생물 안전 캐비닛에서 10분 동안 접시 위의 접시를 예열하십시오.
- 플레이트를 37 °C 및 5 % CO2 에서 배양합니다.
- 48시간 후, 정점 및 기저 구획의 배지를 20% FBS 및 억제제가 보충된 새로운 장내 성장 배지로 교체합니다.
- 셋째 날에는 정점 및 기저측 구획에서 배지를 제거하고 1x PBS로 삽입물을 조심스럽게 세척한 다음 억제제만 보충된 장내 분화 배지로 교체합니다.
- 2-3일마다 두 구획의 미디어를 교체하십시오.
- 상피 장벽 무결성 및 단층 밀도의 정량적 측정
알림: 장벽 무결성은 상피 전압계를 사용하여 경상피 전기 저항(TEER)을 측정하여 평가할 수 있습니다.- 인큐베이터에서 트랜스웰 배양 플레이트를 제거하고 생물 안전 캐비닛에서 몇 분 동안 RT에서 평형을 이루도록 합니다.
- STX2 전극이 사전 컨디셔닝되고 전압계가 제조업체의 지침에 따라 1000Ω으로 보정되었는지 확인하십시오.
- 프로브의 긴 스틱을 기저외측 구획에 삽입하고 짧은 끝을 transwell 상피 세포 배양의 정점 구획에 삽입합니다. 단층을 방해하거나 인서트를 손상시키지 않도록 주의하십시오.
- 안정되면 셀이 없는 인서트를 포함하여 트랜스웰 인서트당 3개의 TEER 측정값을 기록합니다. 각 인서트에 대한 측정값의 평균을 구합니다.
- 실험 웰의 평균 측정값에서 블랭크 웰의 평균 측정값을 뺀 다음 삽입물의 표면적을 곱하여 상피 장벽의 저항을 결정하여 보정된 TEER 값을 계산합니다(TEER [Ω.cm2] = [Rcell 레이어 - Rblank] × 면적).
결과
2D 장내 유래 단층을 생성하는 첫 번째 단계는 조직 해리를 위해 채취한 장 조직 절편(그림 1A)을 준비하는 것입니다. 이것은 조직에서 부착된 지방과 장간막을 제거하고(그림 1B) 조직을 세로로 절단하여 내강 표면을 노출시켜 유리 슬라이드를 사용하여 장의 점액층을 부드럽게 긁어낼 수 있도록 합니다. 그런 다음 채취한 장 절편을 점진적으로 더 작은 조직 절편으로 절단하여 해리를 용이하게 합니다(그림 1C). 그런 다음 크립트는 킬레이트 완충액(그림 1D,E) 및 PBS로 구성된 일련의 세척을 사용하여 하부 점막 조직에서 해리됩니다. 그런 다음 분리된 장 크립트(그림 1F)를 기저막 매트릭스 돔(그림 2A)에 매립하고 며칠 동안 배양하여 3D 장내류를 생성합니다. 소 회장의 10인치 절편에서 약 900,000개의 크립트를 분리하여 장내 형성에 사용할 수 있습니다. 배양에서 단 몇 시간 후, 도금된 크립트는 길어지기 시작하고 장권으로 발달합니다(그림 2B). 2일 후, 잘 정의된 내강을 관찰할 수 있으며(그림 2C), 배양 4일째에 발아 구조가 관찰됩니다(그림 2D). 7일째가 되면 성숙한 장내이드가 발달합니다(그림 2E). 7일 된 3D 장내형의 면역형광 염색은 다양한 세포 계통의 존재를 보여줍니다. 장낭생물의 공초점 현미경 검사는 DAPI 핵 염색, 부착 접합부의 E-cadherin 단백질, 장내분비 세포의 존재를 보여주는 Chromogranin-A(Chr-A) 염색, Paneth 세포를 보여주는 Lysozyme(LYZ) 및 장 세포 세포를 나타내는 Cytokeratin-18(CK-18)의 국소화를 보여줍니다. 7-10일 동안 배양한 후 장내염은 더 확장되고 과밀을 방지하기 위해 통과해야 합니다. 장내염체가 통과하는 최적의 시간은 초기 1차 소낭골 분리 후 7-10일로 결정되었으며 궁극적으로 배양 내 장내골의 건강 및 성장 속도에 따라 달라집니다. 그림 2E에 표시된 바와 같이 원하는 장내 형태 및 생존력을 달성하기 위한 최적의 파종 밀도는 돔당 400개의 크립트입니다. 장류는 쉽게 동결 보존할 수 있으며, 해동된 장내 조각은 해동 후 두 번의 통과 후에 실험용으로 완전히 회복됩니다. 특히, 냉동 보존 전에 1차 토박 배양의 최소 두 구절이 권장됩니다.
2D 장내 유래 단층을 생성하기 위해 3D 장내류를 채취하고 일련의 단계를 거쳐 해리 용액(그림 4A)이 있는 상태에서 기계적으로 단일 세포로 분쇄합니다. 그런 다음 이러한 단일 세포를 기저막 매트릭스 배양 배지 용액으로 사전 코팅된 트랜스웰 삽입물에 파종할 수 있습니다. 평균적으로 4개의 3D 장내형 돔에서 4개의 트랜스웰을 파종할 수 있습니다. 따라서 처리된 3D 장내류의 수는 실험에 필요한 트랜스웰의 수에 따라 달라집니다. 1 x 105의 파종 밀도로 단일 세포를 도금하고 20% FBS(그림 4B-D)의 존재 하에서 초기에 배양하면 1주일 이내에 합류 단층을 생성할 수 있습니다. 배양에서 2D 단층의 점진적 합류는 광학 현미경을 사용하여 시간이 지남에 따라 모니터링할 수 있습니다(그림 4E,F). 경상피 전기 저항(TEER) 측정은 시간 경과에 따른 실험 자극에 대한 반응으로 상피 장벽 무결성을 확인하고 밀도를 확인할 수 있습니다(그림 5A). 평균적으로, 배양 후 약 100 % 합류 단층은 ~ 1500 Ω·cm2의 해당 TEER 값을 갖게됩니다. 2D 장내 단층 TEER 값의 종단 평가는 TEER 값이 7일 동안 꾸준히 증가하여 최대 평균값 1546 Ω·cm2에 도달한 후 12일째에 얻은 최저 값인 11.5 Ω·cm2로 감소하는 것을 보여줍니다(그림 5B). 분화된 단층의 면역형광 표지는 이 프로토콜을 사용하여 온전하고 조직화된 분극화된 장 상피 시트가 형성됨을 나타냅니다(그림 6). 염색된 2D 단층의 공초점 현미경은 DAPI 핵 염색, E-cadherin 및 F-actin 염색의 국소화를 보여줍니다(그림 6A-D). 2D 단층의 형광 현미경 검사는 장내분비 세포의 존재를 보여주는 Chromogranin-A(Chr-A) 염색, Paneth 세포를 보여주는 Lysozyme(LYZ) 및 장세포 세포 계통을 나타내는 Cytokeratin-18(CK-18)을 통해 분화된 장 상피 세포의 특징을 보여줍니다(그림 6E-L). Z-스택 모델링은 분화된 장세포의 정점 측면을 덮는 미세융모에서 발견되는 F-액틴과 상피 세포 사이에 이격된 부착 접합부에 위치한 단백질인 E-cadherin의 특징적인 증착과 함께 2D 단층 배양의 예상 분극을 보여줍니다(그림 6M).
단층의 기능은 TLR(Toll-like receptor) 리간드 또는 병원체를 포함한 다양한 구성 요소를 사용한 정점 자극에 의해 평가될 수 있으며, 정점 및 기저 구획에서 채취한 세포 배양 상층액의 사이토카인 정량화에 의해 평가될 수 있습니다. 실제로, 배양 4일차에 TLR 1/2 작용제 Pam3csk4를 사용하여 단층의 정점 측면을 24시간 동안 자극하면 처리되지 않은 단층에 비해 두 구획에서 사이토카인 생성이 증가된 것이 관찰됩니다(그림 7A,B).
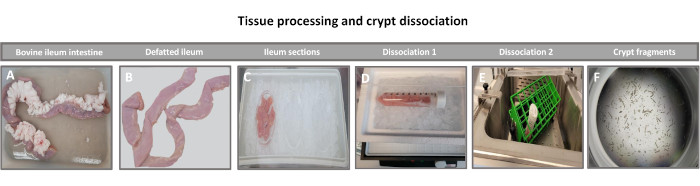
그림 1: 건강한 성체 소의 소 장낭 분리. (A) 전체 성체 소 회장, (B) 탈지 회장, (C) 얼음 위의 PBS에서 2.5인치(6.3cm) 조각으로 절단된 회장, (D) 4°C에서 해리 완충액 #1의 회장 조직 절편, (E) 37°C의 흔들리는 수조에서 해리 완충액 2, (F) 분리된 회장 토박 조각의 조직 처리를 보여주는 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
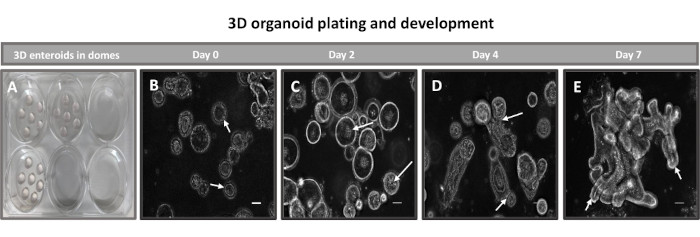
그림 2: 기저막 기질에서의 소 1차 3D 회장 장내 발달. 배양에서 0, 2, 4, 7일째의 (A) 6웰 조직 배양 플레이트에서 생성된 3D 장형 돔 및 (B-E) 3D 장내 발달의 대표 이미지. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
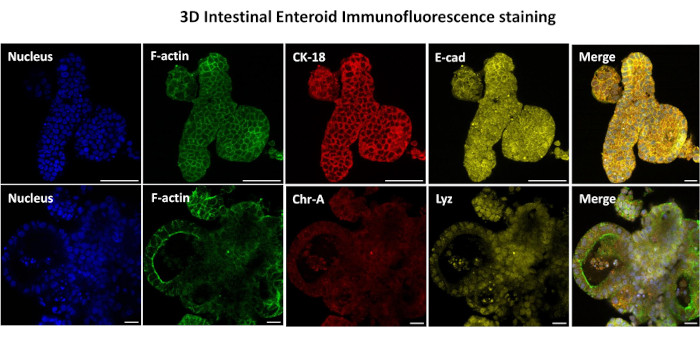
그림 3: 3차원 장 장내형은 상피 세포 계통 염색을 보여줍니다. 배양 7일 후 3D 장내염체의 대표 이미지는 핵 염색, F-액틴, 사이토케라틴-18(CK-18), 크로모그라닌-A(Chr-A), 에카데린(E-cad), 라이소자임(Lyz) 및 이미지 오버레이(병합)의 존재를 보여줍니다. 눈금 막대 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
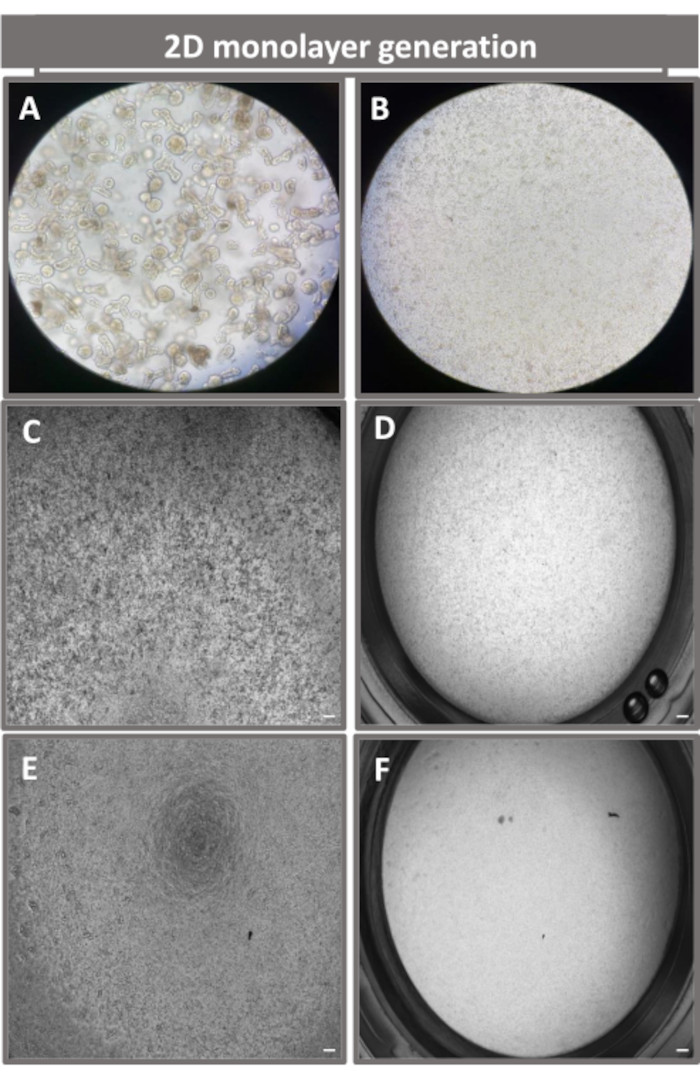
그림 4: 회장 장류에서 2D 장류 유래 단층의 확립. 단층 파종을 준비하기 위한 해리 용액 내 (A) 3D 장내성 단편의 대표 이미지, (B) 빛, (C) 위상차 및 (D) 명시야 현미경을 사용하여 0일째에 이미징된 파종 밀도 1 x 105의 트랜스웰 인서트에 도금된 단일 셀, (E) 위상차 및 (F)를 사용하여 5일째에 이미징된 트랜스웰 인서트의 단층 현상) 명시야 현미경 검사. 40x 배율 및 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
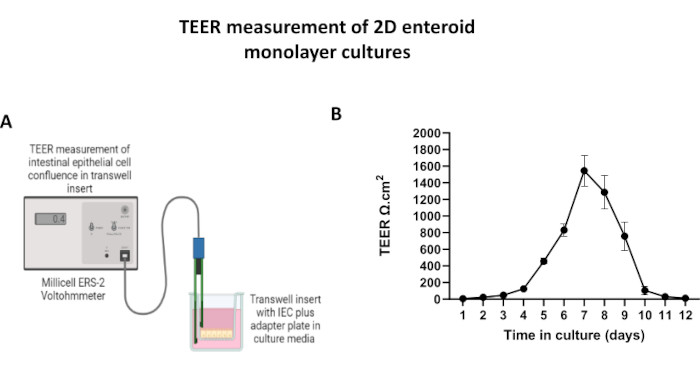
그림 5: 트랜스웰 인서트에서 2D 장유래 단층의 경상피 전기 저항(TEER) 측정. (A) 전압계의 STX2 젓가락 전극을 사용하여 2D 장 상피 세포(IEC) 단층의 TEER 측정을 얻는 방법에 대한 개략도, (B) 세포 배양에서 12일 동안 2D 단층 TEER 측정의 종단 모니터링. 각 데이터 포인트는 두 번의 기술 반복실험에서 얻은 평균 TEER 값과 평균 표준 오차(SEM)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
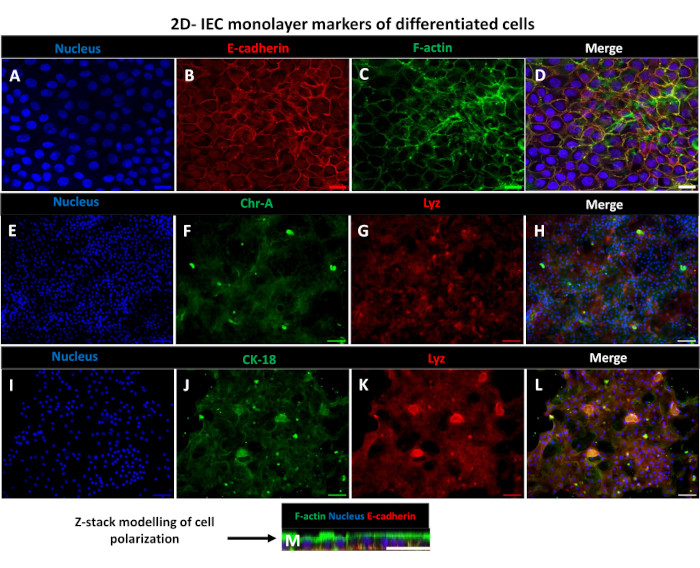
그림 6: 트랜스웰 삽입물에서 분화된 2D 장내 유래 단층은 편광된 장 상피 시트로 발전합니다. (오전-남) 배양에서 5일 후 트랜스웰 삽입물에서 2D 장내 유래 단층의 대표적인 면역형광 이미지는 (A) 핵(파란색), (B) E-cadherin(빨간색), (C) F-액틴(녹색) 및 (D) 3개의 이미지(병합), (E,I) 핵 염색, (F) 크로모그라닌-A, (J) 사이토케라틴-18, (G,K) 라이소자임 및 (H,L) 이미지의 병합을 보여줍니다. (M) 2D 단층 시트의 동일한 상피 세포 마커 단백질의 분포를 보여주는 Z-스택 모델링. 이미지는 2개의 생물학적 복제물로부터 얻었다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
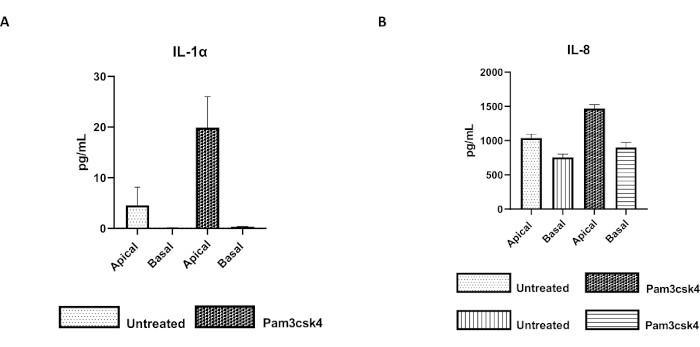
그림 7: 트랜스웰 인서트의 소 1차 2D 장환자 유래 단층은 기능적으로 활성화되어 있습니다. 24시간 동안 Pam3csk4로 처리하거나 자극한 배양에서 5일 후 트랜스웰 삽입물에서 2D 단층에 의한 (A) IL-1α 및 (B) IL-8의 정점 및 기저 세포 배양 상층액 사이토카인 분비. 데이터는 1마리의 동물과 3개의 독립적인 실험에서 얻은 냉동 크립트 재고에서 파생된 단층의 평균 사이토카인 수치와 SEM을 대표합니다. 사이토카인은 제조업체의 지침에 따라 bead-based multiplex assay(Table of Materials)를 사용하여 정량화하고, 소형 multiplexing unit(Table of Materials) 및 immunoassay curve fitting 소프트웨어(Table of Materials)에서 분석하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 시약의 재고 및 최종 농도. 표를 다운로드하려면 여기를 클릭하십시오.
토론
여기에 제시된 프로토콜은 장 생리학 및 장 질환을 조사하기 위한 생리학적으로 관련된 모델을 설명합니다. 몇몇 연구 그룹은 2D 단층 16,19,20,21,22,23,24를 포함한 소 장낭 배양물의 생성을 설명했습니다. 단층 생성이 기술적으로 크게 어려운 것은 아니지만, 성공적인 배양을 지속적으로 개발하기 위해서는 몇 가지 단계를 거치는 것이 중요합니다. 따라서 출판된 문헌에 간략하게 설명된 방법을 사용한 2D 단층의 재현성은 오가노이드 분야의 초보 연구자가 수행하기 어려울 수 있습니다. 본원에 기술된 프로토콜은 이러한 프로토콜과 다른 종에 발표된 프로토콜에서 채택된 것으로, 재현성이 높은 트랜스웰 삽입물에서의 단층 생성에 대한 단계별 가이드를 제공합니다.
본 명세서에 요약된 프로토콜은 실험 설계의 특정 목표 또는 시약의 가용성에 맞게 쉽게 수정할 수 있습니다. 실제로, 이러한 프로토콜에 따라, 성공적인 배양은 다른 간행물24에 기술된 바와 같이, 더 낮은 세포 밀도(예를 들어, 2.5 x 104)에서 또는 FBS가 없는 상태에서 단층을 파종함으로써 달성될 수 있다. 그러나 이러한 매개 변수를 변경하려면 합류 단층을 설정하기 위해 증가된 배양이 필요할 수 있습니다. 따라서 면역 세포와의 공동 배양을 포함하여 연구 설계에 필수적인 다른 요인이 실험의 특정 시간 경과를 지시하는 경우 필요에 따라 파종 밀도를 변경할 수 있습니다. 3D 장류 및 2D 단층을 생성하기 위해 이 프로토콜에 사용된 것 대신 다른 기저막 제형을 대체할 수 있지만, 최적의 기저막 대 매체 비율을 결정하기 위해서는 약간의 최적화가 필요합니다.
설명된 방법론에서 트랜스웰 인서트를 적용하면 기존 플라스틱 용기 및 3D 장내형 배양에서 단층 성장에 비해 많은 이점이 있습니다. 표준 조직 배양 플레이트와 비교하여, 단층 배양에 트랜스웰을 사용하면 장 분화와 유사한 방식으로 세포 분화 및 조직을 촉진할 수 있습니다14,25. 장 상피 장벽은 독소와 미생물이 체내로 전위되는 것을 방지하는 동시에 영양소 흡수를 촉진하는 데 매우 중요합니다. 따라서 장의 장벽 무결성이 건강하게 기능하고 장 질환 또는 화합물에 대한 반응으로 어떻게 변화하는지 이해하는 것이 중요합니다. 3D 장내형 배양과 달리, 본 명세서14,25에 입증된 바와 같이, 트랜스웰 상의 단층을 결합하고 TEER을 측정할 때 장 장벽 무결성에 대한 객관적인 평가가 가능하다. 트랜스웰(transwell)에 2D 단층을 생성하면 면역 세포 또는 기질 세포와 같은 관련 세포 유형과의 이중 배양도 가능합니다. 이를 통해 장 세포와 조직 미세환경 세포 간의 매우 중요한 누화를 특성화할 수 있으며, 이는 3D 배양으로는 달성할 수 없습니다. 단층의 정점 표면의 노출은 병원균 및 화합물에 대한 실험적 노출과 발광 산물의 수집을 가능하게 할 뿐만 아니라 장내 미생물총(intestinal microbiota) 및 분자 흡수 또는 수송 생리학(transport physiology)에 대한 조사를 포함하여 장 생리학 및 질병의 다른 측면에 대한 연구도 가능하게 한다13. 정점 및 기저 장 표면에 대한 독립적인 제어는 3D 장내형 모델에 비해 뚜렷한 이점입니다.
몇 가지 시험 실험을 통해 프로토콜의 성공에 기여한 주요 단계를 확인했습니다. 전체 장 조직 샘플은 하룻밤 동안 냉장 보관하고 다음날 처리할 수 있지만, 분리된 크립트 분획물의 붕괴를 방지하기 위해 크립트 분절의 조직 해리 및 분리 단계를 즉시 수행해야 합니다. PBS 세척을 완료한 후 세척 매체에서 크립트를 원심분리하면 2.3.10단계에 설명된 대로 크립트 고장을 방지하는 데 도움이 될 수 있습니다. 엔테로이드를 패시징하거나 단층 형성을 위해 수확할 때 BME 돔에서 엔테로이드를 분리하는 것이 필수적입니다. 세척 매체는 BME를 용해하는 데 도움이 되도록 얼음처럼 차가워야 합니다. 대조적으로, 예열된 TrypLE를 사용하고 세포 현탁액을 두 번 여과하면 단층 생성에 필요한 단일 세포를 형성하는 데 도움이 될 수 있습니다. 마지막으로, 숫자 8 모양으로 플레이트를 수동으로 조작하면 단일 셀을 트랜스웰 인서트 위에 고르게 분산시키는 데 도움이 될 수 있습니다.
이 프로토콜의 중요한 한계는 2D 단층이 성숙한 홀스타인 스티어(>2세)에서 생성된 장내 스톡으로부터 생성되었다는 것입니다. 송아지의 성숙한 위장관은 최적의 결과를 얻기 위해 설명된 프로토콜에 대한 약간의 수정을 필요로 할 수 있습니다. 소 품종의 장 생리학에 대한 품종별 차이는 문헌26에 기술되어 있다. 이러한 차이가 장내 및 후속 단층 생성에 영향을 미칠 수 있는지는 알 수 없지만, 차이가 있으면 프로토콜에 약간의 변경만 있을 것으로 예상됩니다. 또한 2D 배양 모델에는 몇 가지 고유한 단점이 있습니다. 3D 장내형 모델과 비교했을 때, 2D 배양은 장 조직 구조 및 세포 다양성의 일부 측면이 부족할 수 있으며, 2D 배양 증식과 관련된 제한 및 문제를 야기할 수 있다13. 여전히, 연구들은 일부 단층들이 예상되는 크립트 조직(27)을 모방할 수 있다는 것을 보여주며, 이러한 한계들 중 일부는 공기-액체 계면으로 2D 배양을 확립함으로써 극복될 수도 있다. 그럼에도 불구하고 이 모델의 적용이 실험적 질문에 적합한지 여부를 결정하기 위해 이 모델의 한계를 충분히 고려해야 합니다.
이 프로토콜은 소 회장에서 유래한 장내를 사용하여 소의 위장관을 모델링하여 트랜스웰 삽입물에 단층을 형성하는 최적화된 배양 시스템을 설명합니다. 전염병 연구에서 약물 발견 및 재생 의학에 이르기까지 광범위한 응용 분야를 갖춘 이 고처리량 배양 시스템은 동물과 인간의 건강에 상호 이익이 될 수 있는 예방 및 치료 전략의 전례 없는 개발로 이어질 수 있습니다.
공개
저자는 이 연구가 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었음을 선언합니다.
감사의 말
우리는 Midwestern University의 Cellular and Molecular Core Facility의 사용을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
참고문헌
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유