Method Article
יצירת מערכת תרבית חד-שכבתית דו-ממדית ראשונית שמקורה באנטרואיד בקר ליישומים במחקר ביו-רפואי תרגומי
In This Article
Summary
אנטרואידים מתגלים כמודל חדשני לחקר פיזיולוגיה ופתופיזיולוגיה של רקמות, פיתוח תרופות ורפואה רגנרטיבית. כאן, אנו מתארים מערכת תרבית דו-ממדית ממקור אנטרואידים של תאים ראשוניים בקר, המאפשרת תרבית משותפת עם סוגי תאי רקמה רלוונטיים. מודל זה מציע יתרון תרגומי למודלים של מחקר במערכת העיכול.
Abstract
מערכות תרבית תאים אורגנואידים יכולות לשחזר את המורכבות שנצפתה ברקמות, מה שהופך אותן לשימושיות בחקר אינטראקציות בין פונדקאי לפתוגן, הערכת יעילות ורעילות של תרופות וביו-הנדסה של רקמות. עם זאת, יישום מודלים אלה מהסיבות המתוארות עשוי להיות מוגבל בגלל האופי התלת-ממדי (3D) של מודלים אלה. לדוגמה, שימוש במערכות תרבית אנטרואידים תלת-ממדיות לחקר מחלות עיכול הוא מאתגר בשל חוסר הנגישות של לומן המעי והחומרים המופרשים שלו. ואכן, גירוי של אורגנואידים תלת-ממדיים עם פתוגנים דורש מיקרו-הזרקה לומינלית, הפרעה מכנית של המבנה התלת-ממדי, או יצירת אנטרואידים אפיקליים. יתר על כן, אורגנואידים אלה אינם ניתנים לתרבית משותפת עם תאי מערכת החיסון ותאי סטרומה, מה שמגביל ניתוח מכניסטי מעמיק לדינמיקה פתופיזיולוגית. כדי לעקוף זאת, ביצענו אופטימיזציה של מערכת תרבית חד-שכבתית דו-ממדית (2D) של תא ראשוני בקר, המאפשרת תרבית משותפת עם סוגי תאים רלוונטיים אחרים. קריפטים איליאליים שבודדו מבקר בוגר בריא תורבתו כדי ליצור אורגנואידים תלת-ממדיים שנשמרו בהקפאה לשימוש עתידי. חד-שכבה דו-ממדית נוצרה באמצעות אנטרואידים תלת-ממדיים שקמו לתחייה ועברו ושיבשו כדי להניב תאים בודדים, שנזרעו על תוספות תרבית תאי טרנסוול מצופות קרום מרתף, ובכך חשפו את פני השטח האפי שלהם. הקוטביות החד-שכבתית של המעי, התמיינות התא ותפקוד המחסום אופיינו באמצעות מיקרוסקופ אימונופלואורסצנטי ומדידת התנגדות חשמלית טרנסאפיתליאלית. גירוי של פני השטח האפיקליים של המונושכבה חשף את הפונקציונליות הצפויה של החד-שכבתי, כפי שהודגם על ידי הפרשת ציטוקינים הן מהתאים האפיקליים והן ממדורי הבסיס. המודל החד-שכבתי הדו-ממדי שמקורו באנטרואידים טומן בחובו הבטחה גדולה בחקירת אינטראקציות פונדקאי-פתוגן ופיזיולוגיה של המעי, פיתוח תרופות ורפואה רגנרטיבית.
Introduction
מודלים של בעלי חיים במחקר ממלאים תפקיד מכריע בשיפור ההבנה שלנו של פתופיזיולוגיה של מחלות והדינמיקה של התגובה החיסונית של המאכסן במהלך זיהום ותומכים בפיתוח אסטרטגיות מניעה וטיפול חדשניות 1,2,3,4. מודלים אלה תומכים בגילוי וקידום מחקרים בבעלי חיים והם המפתח להתקדמות המחקר בתחום בריאות האדם. במשך עשרות שנים, מודלים של מכרסמים עמדו בבסיס התקדמות במנגנוני החיסון ומחקר ביולוגי בסיסי למחלות אנושיות 3,5,6,7. בעוד מודלים של מכרסמים הם קריטיים בסינון ובמחקר התפתחות מוקדמת, מודלים של בעלי חיים גדולים מציעים השוואה רלוונטית יותר בחקר מחלות אנושיות הן בגילוי מוקדם והן במחקרי התפתחות מאוחרים יותר, כולל יעילות טיפולית ובדיקות בטיחות 1,3,4,5. משק החי מציע יתרונות ברורים בהשוואה למודלים של מכרסמים לתרגום יעיל יותר עבור יישומים אנושיים עבור מחלות מסוימות, כולל קריפטוספורידיוזיס, סלמונלוזיס, שחפת, וירוס סינסיטיאלי נשימתי וברוצלוזיס 1,7,8. ואכן, מחלות אלה ואחרות מתפתחות באופן ספונטני בבקר, החולק מספר פתוגנזה של מחלות ותהליכים חיסוניים מקבילים לבני אדם, וכאוכלוסייה מוחצנת, הבקר מחקה את ההטרוגניות הגנטית והסביבתית המשפיעה על תגובות החיסון האנושיות 5,8,9,10 . ניתן למקסם את היתרונות של מודלים של בקר לחקר מחלות זיהומיות על ידי שימוש תחילה במערכת תרביות מתוחכמת ולאחר מכן יישום מחקרי in vivo בהדרגה. השימוש הראשוני במערכת מורכבת ביותר של תרביות בקר יכול להפחית באופן משמעותי את מספר המחקרים בבעלי חיים תוך שיפור הסיכויים למחקר תרגומי ויישומי מוצלח. מודלים של תרבית צריכים לשחזר את תהליכי המחלה ברמת האיבר לקבלת תוקף ניבוי אופטימלי, תוך שמירה על מיקרו-סביבה טבעית של הרקמה מבחינה מרחבית ותפקודית.
התגובה החיסונית הרירית היא מערכת רבת פנים המורכבת ממחסום יעיל ביותר שנוצר על ידי אנטרוציטים במערכת העיכול ואוכלוסיות מגוונות של תאי חיסון הממוקמים מתחת לפני השטח של הרירית11. מערכת מורכבת זו היא קריטית במהלך זיהום בשמירה על הומאוסטזיס במערכת העיכול והפעלת הגנה חיסונית נגד פתוגנים אנטריים11. תקשורת בין אנטרוציטים לבין תאי מערכת החיסון המולדת הבסיסית יוזמת התפתחות של תגובות חיסוניות מגינות מפני מיקרואורגניזמים פתוגניים. לפיכך, מערכות תרבית שהן השוואתיות ברמת המורכבות שלהן נחוצות לחקירה אופטימלית של אינטראקציות פתוגן מארח-אנטרי והן יעילות ביותר בהבנת הפיזיולוגיה האנטרית וגילוי ופיתוח תרופות12,13. אורגנואידים הם מערכת תרבית חזקה הדומה לארכיטקטורה ולתפקוד של רקמת המקור14,15. הרב-תאיות של מודלים אלה מאפשרת לחקור את תפקידן של אוכלוסיות תאים מגוונות ואת האינטראקציות התאיות המעורבות בבריאות אנטרית ובמחלות12,14. עם זאת, מודלים אורגנואידים שמקורם בבני אדם במחקר מוגבלים כיום על ידי הקושי להשיג כמות מספקת ואיכות עקבית של תאי אפיתל מעיים אנושיים ויכולת קיום מוגבלת של תאים בתרבית. קווי תאים אימורטליים יכולים לשמש להשגת תפוקות גבוהות של תרביות הומולוגיות במודלים אלה באופן עקבי; עם זאת, תאים מותמרים מטבעם חסרים את המגוון ואת המורכבות התפקודית של תאי אפיתל שאינם מותמרים 16,17. היתרונות של שימוש בתרביות שמקורן ברקמת בקר כמודל לחקר מחלות ופיזיולוגיה של מערכת העיכול כוללים את הקלות שבה ניתן לקבל דגימות רקמה באופן עקבי מתורמים בריאים, שיפור יכולת הקיום של התא ומגוון תאי גדול יותר שניתן להשיג רק עם רקמה שאינה בת אלמוות. שעתוק רקמות השוואתי ואפיון אורגנואידים במעי חושפים דמיון בגנים אורתולוגיים שמורים ובפוטנציאלים תאיים בין בני אדם לבקר18. לכן, מערכת תרבית שמקורה באורגנואידים של בקר עשויה להיות מועילה בחקירת מחלות מעיים אנושיות, עם ממצאים הניתנים לתרגום בקלות לרפואה אנושית.
הפרוטוקול המתואר כאן מפרט פלטפורמה יעילה להערכת תגובות המארח לפתוגנים או תרכובות אנטריות ולפיזיולוגיה של המעי באמצעות מערכת תרבית תאים ראשונית דו-ממדית שמקורה באנטרואיד בקר. שלא כמו אורגנואידים תלת-ממדיים, מערכות תרבית דו-ממדיות הנוצרות על תוספות טרנסוול מאפשרות תרבית כפולה של תאי מעיים עם תאי חיסון או סטרומה, ומאפשרות לחקור את הדינמיקה ברמת הרקמה. עם יישומים במחקר ביו-רפואי, פיתוח תרופות ובדיקות יעילות, מודל פיזיולוגי רלוונטי זה יכול להועיל לבריאות ולקידום של בקר ובני אדם כאחד.
Protocol
כל הפרוטוקולים בוצעו בהתאם להנחיות ולתקנות מוסדיות ולאומיות לרווחת בעלי חיים.
1. הכנת מגיב
הערה: המלאי והריכוזים הסופיים של הריאגנטים ששימשו במחקר זה מפורטים בטבלה 1.
- הכינו מאגר איסוף דגימה: ערבבו 1 ליטר של מלח חוצץ פוספט קר כקרח (PBS) המכיל פניצילין (100 U/mL), סטרפטומיצין (100 מיקרוגרם/מ"ל), גנטמיצין (25 מיקרוגרם/מ"ל) וקספופונגין (2.5 מיקרוגרם/מ"ל). יש לאחסן את תמיסת המלאי בטמפרטורה של 4°C.
- הכינו מגיב דיסוציאציה #1: ערבבו 18.55 מ"ל של מאגר איסוף דגימות (כמתואר בשלב 1.1), 1.422 מ"ל של חומצה אתילאנדיאמיןטטראצטית (EDTA, 0.422 M/pH 7.4), 20 μL של 1 M 1,4-Dithiothreitol (DTT) פתרון, 4 μL של תמיסת Y-27632 (5000x/50 mM). אחסנו את התמיסה בטמפרטורה של 4°C.
- הכן מגיב דיסוציאציה #2: ערבב 18.57 מ"ל של מאגר איסוף (כמתואר בשלב 1.1), 1.422 מ"ל של EDTA (0.422 M/pH 7.4), 4 μL של תמיסת Y-27632 (5000x/50 mM). אחסנו את התמיסה בטמפרטורה של 37°C.
- הכינו מלאי מדיה לגדילה אנטרואידית: ערבבו 9.875 מ"ל של מדיום גידול אורגנואידי בתוספת תוספת, 100 מיקרוליטר פניצילין (100 U/mL), סטרפטומיצין (100 מיקרוגרם/מ"ל), 5 מיקרוליטר גנטמיצין (25 מיקרוגרם/מ"ל) ו-20 מיקרוליטר קספופונגין (2.5 מיקרוגרם/מ"ל). אחסנו את התמיסה בטמפרטורה של 4°C.
- הכינו מלאי מדיה להתמיינות אנטרואידית: ערבבו 10 מ"ל של מדיום התמיינות אורגנואידים בתוספת תוספת, 100 מיקרוליטר פניצילין (100 U/mL), סטרפטומיצין (100 מיקרוגרם/מ"ל), 5 מיקרוליטר גנטמיצין (25 מיקרוגרם/מ"ל) ו-20 מיקרוליטר קספופונגין (2.5 מיקרוגרם/מ"ל). יש לאחסן את התמיסה בטמפרטורה של -20°C.
- הכנת אמצעי שטיפה: מערבבים 48.45 מ"ל DMEM/ F-12 1.1 בינוני (עם L-גלוטמין, ללא HEPES), 1 מ"ל של תוסף B-27 ללא ויטמין A (50x מלאי), 500 מיקרוליטר פניצילין (100 U/mL), סטרפטומיצין (100 מיקרוגרם / מ"ל), 25 μL של גנטמיצין (50 מ"ג / מ"ל מלאי), ו 25 μL של caspofungin (5 מ"ג / מ"ל מלאי). אחסנו את התמיסה בטמפרטורה של 4°C.
- הכנת חיץ ציפוי: ערבבו 25 מ"ל DMEM: F12 מדיה שלמה ללא מעכבים ו-25 מ"ג אלבומין בסרום בקר (BSA). אחסנו את התמיסה בטמפרטורה של 4°C.
2. בידוד של קריפטים במעיים מרקמה שלמה (איור 1)
הערה: אנטרואידים של מעי דק בקר נוצרו מרקמת איליאה שהושגה מנווטי הולשטיין בוגרים בריאים (>בני שנתיים) ממפעל מקומי לעיבוד בשר בקר. תורם אחד שימש לסדרת ניסויים זו.
- הכנת דגימות רקמת מעיים
- הניחו את דגימות רקמת המעי שנקטפו ~ 10 אינץ '(25 ס"מ) ב~ 400 מ"ל של חיץ איסוף קר כקרח (PBS+ אנטיביוטיקה / אנטימיקוטיקה) ועל קרח להובלה למעבדה.
- באמצעות מספריים כירורגיים (למשל, מספריים של מיונז) ומלקחיים (למשל, מלקחיים אדסון), הסירו את עודפי השומן והמזנטריה מדגימת רקמת המעי.
- חותכים את הרקמה לשני חלקים שווים.
- פתחו את הרקמה לאורכה בעזרת מספריים כירורגיים ושטפו את הרקמה ב-PBS סטרילי.
- הסירו בעדינות את שכבת הריר של דגימת המעי באמצעות הצד של מגלשת מיקרוסקופ זכוכית סטרילית ושטפו את הרקמה עם PBS טרי.
הערה: שלב זה מסייע להסיר את הווילי ומסייע להגביר את טוהר שברי הקריפטה בשלבים הבאים. - עבור כל חתיכה בגודל 5 אינץ' (13 ס"מ), חתכו את הרקמה לשתי חתיכות בגודל 2.5 אינץ' (6.5 ס"מ) ולאחר מכן חתכו כל חתיכה ל-4 חתיכות קטנות שוות בקירוב כדי להקל על ניתוק הרקמות.
- דיסוציאציה של רקמת המעי
- הכינו נפח של 20 מ"ל של מגיב הדיסוציאציה של הרקמה #1 בצינור חרוטי סטרילי של 50 מ"ל והפקידו את דגימות הרקמה הקטנות לתוך הצינור החרוטי עד שתזוזת הנפח מעבירה את המניסקוס מסימן 20 מ"ל לסימן 35 מ"ל על הצינור החרוט.
- חזור על השלב לעיל עבור חתיכות הדגימה הנותרות של רקמת המעי הדק.
- אוטמים את הצינורות החרוטיים עם פרפילם ומנערים ידנית את הצינור החרוטי 10 פעמים.
הערה: לאורך כל הפרוטוקול, ניעור ידני צריך להיעשות באופן מכוון אך עדין. - הניחו את הצינורות החרוטיים בצורה אופקית על קרח במיכל על פלטפורמת ניעור מסלולית.
- נערו את הצינורות החרוטיים על קרח במיכל למשך 30 דקות במהירות של 80 סיבובים לדקה (סל"ד). כל 10 דקות, לנער ידנית את הצינור החרוט.
- הכן נפח 20 מ"ל של רקמה מחוממת מראש (37 ° C) מגיב דיסוציאציה #2 (נוסחה לעיל, אך ללא DTT) בצינור חרוטי 50 מ"ל. הפקידו את דגימות הרקמה מהצינורות החרוטיים המכילים את מגיב הדיסוציאציה #1 לתוך הצינורות החרוטיים המכילים את מגיב הדיסוציאציה #2.
- אוטמים את הצינורות החרוטיים עם פרפילם ומנערים ידנית את הצינורות החרוטיים 10 פעמים.
- הכניסו את הצינורות החרוטיים לאמבט מים מטלטל שחומם מראש (37°C), מוטים בזווית של כ-60°C, ונערו במהירות 150 סל"ד למשך 10 דקות, עם טלטול ידני לאחר 5 דקות ושוב לאחר הדגירה הכוללת של 10 דקות.
- בידוד של שברי קריפטה
- תווית 10 צינורות חרוטיים סטריליים #1 - #10. הוסף 20 מ"ל של PBS סטרילי קר כקרח לכל צינור חרוטי מסומן.
- העבר את חתיכות הרקמה מהצינורות החרוטיים המכילים את מגיב הדיסוציאציה #2 לתוך צינור חרוטי סטרילי חדש של 50 מ"ל המכיל PBS קר כקרח #1.
- נערו ידנית את הצינורות החרוטיים 10 פעמים.
- אוטמים את הצינורות החרוטיים עם פרפילם ומניחים אותם אופקית על קרח. נערו צינורות חרוטיים על שייקר מסלולי למשך 10 דקות ב-80 סל"ד. לאחר 10 דקות, לנער ידנית צינור חרוטי #1 10 פעמים. זה נחשב לשטוף #1.
- העבירו בעדינות דגימות רקמה באמצעות זוג מלקחיים כירורגיים לצינור חרוטי #2.
- חזור על שלבים 2.3.2 - 2.3.4, זה נחשב לשטוף #2.
- חזור על הכביסה עד לכביסה #10.
- הסופרנאטנטים מכל שטיפה מכילים את הקריפטות שישמשו לייצור אנטרואידים. שמרו את הצינורות המכילים את הסופרנאטנטים בטמפרטורה של 4°C עד להשלמת כל 10 השטיפות.
- לאחר שהשטיפההעשירית הושלמה וקטע הרקמה הושלך לפח, צנטריפוגו את הסופרנאטנטים של צינורות חרוטיים #6-#10 ב 400 x גרם במשך 2 דקות ב 4 °C כדי לגלול את הקריפטים המבודדים.
הערה: שטיפות 6-10 מכילות את השברים הנקיים ביותר של קריפטים שלמים עם פסולת מוגבלת ותאים בודדים. לכן, מומלץ כי רק שברים אלה משמשים לייצור enteroid ואת washes מוקדם יותר (#2-#5) מושלכים) - השליכו את הסופרנאטנט והוסיפו 4 מ"ל של PBS טרי וקר כקרח לקריפטות ללא השהיה מחדש (זה עוזר לשמור על השברים שלמים עד למיקרוסקופיה).
- הערך את טוהר הקריפטות המנותקות עבור כל צינור חרוטי #6-#10 על ידי מיקרוסקופיה.
- הוסף 50 μL של PBS לצלחת 384 בארות.
- הוסף 10 μL של מתלה קריפטה ל- PBS והשתמש בעדשה אובייקטיבית להגדלה של 40x כדי לקבוע את טוהר הקריפטה, שלמותה וספירתה.
הערה: ציור צלב בתחתית הצלחת היטב מקל על הספירה.
3. יצירה ומעבר של אנטרואידים איליאליים של בקר (איור 2)
הערה: הקריפטות מהצינורות החרוטיים עם קריפטי המעי הטהורים והשלמים ביותר ישמשו לבדיקות במורד הזרם. עבור כל השלבים הכוללים crypts ו enteroids, קצות פיפטה, מגרדי תאים, צינורות חייב להיות מצופה מראש עם חיץ הציפוי, בועות יש להימנע כדי למנוע אובדן של crypts. אלא אם כן צוין אחרת, יש להשתמש בקצה פיפט של 1000 μL כדי למנוע פירוק שברי קריפטה.
- יצירת אנטרואידים משברי קריפטה
- שלב את שברי הקריפטה הטהורים ביותר (בדרך כלל #6-#10) לצינור חרוטי אחד.
- צנטריפוגה הצינור החרוטי המכיל את הקריפטות ב 400 x גרם במשך 2 דקות ב 4 ° C.
- השליכו את הסופרנאטנט על ידי שאיפתו עם פיפטה והשעו מחדש את גלולת הקריפטה ב-Wash Media.
- צנטריפוגה כמו בשלב 3.1.2. דקרו את הסופרנאטנט והוסיפו 2 מ"ל של מדיית שטיפה לגלולת הקריפטה.
- ספור את מספר הקריפטות כמתואר בשלב 2.3.11.1.
- צנטריפוגה כמו בשלב 3.1.2 כדי לגרש את הקריפטות, להשליך סופרנטנט, ולהשהות מחדש בקור קרח 100% מופחת גורם גדילה ממברנה מרתף מטריצה תאית (BME) כדי להשיג ריכוז של כ 400 crypts / 100 μL.
הערה: חשוב להפשיר כראוי BME ב 4 °C כמו שינויים בטמפרטורה לשנות את העקביות שלה. ניתן למנוע מה-BME להתמצק בטרם עת באמצעות בלוק קירור וקצות פיפט מקוררים מראש.- שימוש בניסוח אחר של מטריצת קרום מרתף עשוי לדרוש דילול של ה- BME בעת יצירת כיפות. עיין בהוראות היצרן הספציפיות ל- BME הנמצא בשימוש.
- Pipet למעלה ולמטה כדי להשעות ביסודיות את הקריפטים ב- BME.
- צור כיפות crypt-BME על ידי פיפטציה איטית של 50 μL של תרחיף crypt-BME על צלחת תרבית רקמות 6 בארות על צלחת חימום המוגדרת ל 37 ° C עם עד 8 כיפות / באר.
הערה: יש לחמם מראש את צלחת 6 הבארות באינקובטור ב 37 מעלות צלזיוס לילה לפני ציפוי הכיפות. - שמרו את צלחת 6 הבארות על צלחת החימום למשך דקה אחת לפני שתזיזו בזהירות את הצלחת לאינקובטור של 37°C, 5% CO2 .
- לאחר 2 דקות, הופכים את צלחת 6 הבארות כך שהמכסה פונה כלפי מטה ודגרו במשך 30 דקות נוספות כדי לאפשר לכיפות להתפלמר.
- לאחר 30 דקות, יש להוסיף בזהירות 3 מ"ל של מדיית גידול אנטרואידית בטמפרטורת החדר בתוספת 10 מיקרומטר SB202190, 0.5 מיקרומטר LY2157299 ו-10 מיקרומטר Y-27632 לבארות המכילות כיפות.
- יש לדגור ב-37°C, 5% CO2.
- הסר מדיה והחלף במדיה טרייה Enteroid Growth בתוספת מעכבים כל 2-3 ימים.
- מעבר של אנטרואידים
- לאחר 7-10 ימים, ודאו שהקריפטות יצרו אנטרואידים תלת-ממדיים עם מבנים ניצנים רבים, כמו באיור 2E, והם מוכנים למעבר.
- השליכו את המדיה מהבארות המכילות כיפות.
- עבור כל 4 כיפות בכל באר, יש להוסיף 1 מ"ל של תמיסת דיסוציאציה של תאים לא אנזימטיים קרים כקרח בתוספת 10 מיקרומטר Y-27632 לכל באר המכילה כיפות.
- בעזרת מגרד תאים מצופה מראש, נתקו בעדינות את הכיפה מצלחת תרבית הרקמה.
- לאסוף enteroids בצינור חרוטי 15 מ"ל ו triturate על ידי pipetting למעלה ולמטה 10 פעמים.
- דגרו על הצינור החרוטי המכיל את האנטרואידים המפוצלים ב-RT על שייקר אורביטלי ב-80 סל"ד למשך 10 דקות.
- הוסף 10 מ"ל של Wash Media קר כקרח עם 10 μM Y -27632 לאנטרואידים.
- צנטריפוגה את הצינור החרוטי ב 300 x גרם במשך 5 דקות ב RT.
- יש להשליך את הסופרנאטנט ולתלות מחדש את הגלולה ב-10 מ"ל של מדיית שטיפה טרייה ולהעביר לצינור חרוטי חדש בנפח 15 מ"ל.
- צנטריפוגה את הצינור החרוטי ב 300 x גרם במשך 5 דקות ב RT.
- יש להשליך את הסופרנאטנט ולהשהות מחדש את הגלולה ב-1 מ"ל של Enteroid Growth Media בצינור מיקרוצנטריפוגה של 1.5 מ"ל.
- צנטריפוגה את צינור המיקרוצנטריפוגה ב 300 x גרם במשך 5 דקות ב RT ולהשליך את supernatant.
- להשעות מחדש את גלולת אנטרואיד קר כקרח 100% BME ובצע את השלבים 3.1.6-3.1.13.
- אחזור enteroids כל 7 ימים. זמני ההתפשטות עשויים להשתנות בהתאם לצפיפות, הכדאיות והיקף הניצנים. מבנים ניצנים מרובים היוצרים מבנים אנטרואידים גדולים מעידים על הצורך לעבור את האנטרואידים.
- שימור בהקפאה של אנטרואידים
- לשימור בהקפאה, ודא כי enteroids הם עברו לא יותר מחמש פעמים בתרבית.
הערה: זה לא נבדק בניסוי והוא מבוסס על תצפית המחברים כי קטעים מאוחרים יותר הפחיתו את הכדאיות והניבו תוצאות משתנות. - כדי לקצור את האנטרואידים, השתמש במאגר הדיסוציאציה כמתואר בשלבים 3.2.2-3.2.9.
הערה: נתק מכנית את האנטרואידים באמצעות פיפט 5 מ"ל. - ספור את מספר המקטעים האנטרואידים כמתואר בשלב 2.3.11.1.
- צנטריפוגה את הצינור החרוטי ב 300 x גרם במשך 5 דקות ב RT.
- השליכו את הסופרנאטנט והשהו מחדש את המקטעים האנטרואידים באמצעי שימור בהקפאה בתוספת 10 מיקרומטר Y-27632 כדי להשיג ריכוז של ~2000 שברים אנטרואידים / מ"ל ואליקוט 1 מ"ל לקריוביאלים מסומנים מראש.
- הניחו את הקריובלים במיכל הקפאה מבוקר ואחסנו בטמפרטורה של -80°C למשך הלילה.
- העבר את הקריובלים לחנקן נוזלי בשלב אדים לאחסון לטווח ארוך.
- לשימור בהקפאה, ודא כי enteroids הם עברו לא יותר מחמש פעמים בתרבית.
- החייאה של שברי קריפטים במעי
- מניחים צלחת 6 בארות לילה בתוך האינקובטור.
- ציפוי מראש צינור 5 מ"ל עם 5 מ"ל של אמצעי ציפוי.
- הסר את הקריובלים מאחסון חנקן נוזלי.
- מיד, לאחר הפשרה, להעביר crypts מן cryovial אל צינור מצופה מראש 5 מ"ל. שטפו את הקריוביאל עם Wash Media והוסיפו לצינור 5 מ"ל. הימנעו מבועות.
- הבא את עוצמת הקול עד 5 מ"ל עם מדיית שטיפה וצנטריפוגה ב 400 x גרם למשך 5 דקות ב 4 ° C .
- במהלך הצנטריפוגה, מראש לצפות צינור 1.5 מ"ל עם ציפוי מדיה.
- לאחר הצנטריפוגה, יוצקים את הסופרנטנט, משעים מחדש את הגלולה במדיה שנותרה בצינור, ומעבירים לצינור 1.5 מ"ל המצופה מראש. שטפו את הצינור 5 מ"ל עם Wash Media והעבירו אותו לצינור 1.5 מ"ל. צנטריפוגה ב 400 x גרם במשך 5 דקות ב 4 ° C.
- הבא את עוצמת הקול עד 1.5 מ"ל עם Enteroid Growth Media.
- צנטריפוגה כנ"ל (שלב 3.4.7), ולשאוף בזהירות.
- יש ליטול BME מ-4°C ולהניח על גוש קרח/קרח.
- השהה מחדש את גלולת האנטרואיד ב- 100% BME קר כקרח ובצע את השלבים 3.1.6- 3.1.12.
- שנה את המדיה כל 2-3 ימים.
4. יצירה והערכה של monolayers 2D מ אנטרואידים 3D
הערה: כאמור לעיל, עבור כל השלבים הכוללים קריפטות ואנטרואידים, יש לצפות מראש קצות פיפטה, מגרדי תאים וצינורות במאגר הציפוי, ולהימנע מבועות כדי למנוע אובדן של קריפטות.
- הכנת תוספות טרנסוול להיווצרות חד-שכבתית דו-ממדית
- יש להכניס לצלחת מתאם תרבית רקמה של 24 בארות ולצפות מראש את הצד האפי של 1 מיקרומטר PET 24-well תרבית תאים תוספות עם 100 μL של דילול 1:15 של BME ב Enteroid Growth Media. צפה תמיד תוספת שתשמש כבקרה בעת ביצוע מדידות שלמות המחסום.
- מניחים את התוספת המצופה בצלחת מתאם תרבית רקמה 24 בארות באינקובטור.
הערה: יש להשתמש במתאם ספציפי או בלוח תרבית רקמות נלווה עם תוספות הטרנסוול. - לדגור על תרבית מוסיף ב 37 ° C, 5% CO2 במשך 1 שעה כדי לאפשר פילמור.
הערה: ניתן לאטום טרנסוולים מצופים BME עם פרפילם ולאחסן בטמפרטורה של 4°C למשך עד שבוע אם לא משתמשים בהם מיד. - בסוף הדגירה, שואפים את מדיום תרבית אנטרואידים 3D.
- דיסוציאציה של אנטרואידים תלת ממדיים
- צור מונושכבות אנטרואידים דו-ממדיות מקטעים אנטרואידים שמורים בהחייאה, מצופים ומתורבתים כמתואר לעיל בסעיף 3.1 ליצירת אנטרואידים תלת-ממדיים. עברו את האנטרואידים המופשרים לפחות פעמיים, כאשר המעבר האחרון תורבת במשך 5 ימים לפחות לפני העיבוד כדי ליצור תרביות חד-שכבתיות דו-ממדיות.
- קצרו את האנטרואידים על ידי הוספת מדיית שטיפה קרה כקרח בתוספת 10 מיקרומטר Y-27632 לכיפות אנטרואידים (השתמשו בכ-1 מ"ל של חיץ דיסוציאציה עבור 4 כיפות)
- נתקו את הכיפות בעזרת מגרד תאים ואספו אותן לצינור חרוטי בנפח 15 מ"ל.
- Triturate 30 פעמים באמצעות קצה פיפטה 1 מ"ל כדי ליצור שברים enteroid .
- Triturate 40 פעמים עם קצה פיפטה 200 μL כדי לפרק עוד יותר את שברי enteroid .
- הבא את נפח הצינור החרוטי 15 מ"ל עם שברים אנטרואידים ל -10 מ"ל עם מדיית שטיפה קרה כקרח.
- צנטריפוגה את הצינור החרוטי ב 300 x גרם במשך 5 דקות ב RT.
- לשאוף את supernatant, כולל שכבת BME, בזהירות לא להפריע גלולה enteroid .
הערה: שכבת ה-BME תופיע כשכבה ג'לטינית עכורה ממש מעל הכדורית. - עבור כל 4 כיפות, יש להשהות מחדש את הגלולה ב-1 מ"ל של אנזים TrypLE express שחומם מראש בתוספת 10 מיקרומטר של Y-27632.
- מוסיפים את תערובת אנטרואיד-טריפל לצלחת של 24 בארות ודגרים בטמפרטורה של 37°C, 5% CO2 למשך 10 דקות.
- לאחר 10 דקות, מזלפים את תערובת enteroid-TrypLE 40 פעמים באמצעות פיפטה 1 מ"ל כדי לשבור עוד יותר את enteroids.
- לאחר מכן, פיפט שברים 40 פעמים עם פיפטה 200 μL כדי לשבור את השברים לתאים בודדים.
- באמצעות מזרק 3 מ"ל או 5 מ"ל עם מחט סטרילית 22-G מחוברת, שואפים ומחלקים את תרחיף התא 4 פעמים כדי להשיג השעיה של תא בודד.
- עקוב אחר דיסוציאציה של תאים באמצעות מיקרוסקופיה כמתואר בשלב 2.3.11.1, עד ש-80% מהאנטרואידים מתפרקים לתאים בודדים.
- אספו את תרחיף התאים לתוך צינור חרוטי בנפח 15 מ"ל והרוו את התגובה האנזימטית על ידי הוספת נפח פי 4 של Wash Media בתוספת FBS של 10%.
- סננו את האנטרואידים דרך מסננת תאים 40 מיקרומטר מצופה מראש פעמיים לתוך צינור חרוטי של 50 מ"ל.
- גלולה את התאים הבודדים על ידי צנטריפוגה צינור חרוטי ב 300 x גרם במשך 5 דקות.
- זריעה חד-שכבתית דו-ממדית על תוספות טרנסוול.
- דקרו את הסופרנאטנט והשעו מחדש את הגלולה בנפח קטן (~ 600 μL) של מצע גדילה אורגנואידי בתוספת 20% נסיוב בקר עוברי (FBS) ב- RT.
- קבע את צפיפות התא האנטרואידי ואת הכדאיות באמצעות שיטת אי הכללת צבע כחול טריפאן, hemacytometer, או מונה תאים אוטומטי. צפויה כדאיות ממוצעת של 75%.
- הסר בזהירות את תמיסת הציפוי העודפת שנמרחה בשלב 1.3 מתרבית התאים ממש לפני זריעת התאים.
- זרעו את התאים הבודדים בגודל 1 x 105 תאים בנפח של 200 μL לכל תוספת על פני השטח האפי של תוספת תרבית תאים מצופה מראש.
- הוסף 700 μL של מדיה שלמה בתוספת 20% FBS לצד הבזולטרלי של תוספת תרבית התא.
- תמרנו את הצלחת 10 פעמים בצורת הספרה 8 כדי לאפשר לתאים להתפזר באופן שווה על פני העלון.
- שמרו את הצלחת על הצלחת חמה יותר למשך 10 דקות בארון הבטיחות הביולוגית.
- לדגור על הצלחת ב 37 ° C ו 5% CO2.
- לאחר 48 שעות, החלף את המדיה בתאים האפיקליים והבזאליים במדיית צמיחה אנטרואידית טרייה בתוספת 20% FBS ומעכבים.
- ביום השלישי, הסר את המדיה מהתאים האפיקליים והבזולטרליים, שטוף בזהירות את העלון עם PBS 1x, והחלף אותו במדיה Enteroid Differentiation בתוספת מעכבים בלבד.
- החליפו את המדיה בשני התאים כל 2-3 ימים.
- מדידה כמותית של שלמות מחסום אפיתל ומפגש חד-שכבתי
הערה: ניתן להעריך את שלמות המחסום באמצעות מד מתח אפיתל למדידת התנגדות חשמלית טרנסאפיתל (TEER).- הסר את צלחת תרבית הטרנסוול מהאינקובטור ואפשר לה להתאזן ב- RT למשך מספר דקות בארון הבטיחות הביולוגית.
- ודא שהאלקטרודות STX2 מותנות מראש ומכוילות את מד המתח ל-1000Ω בהתאם להוראות היצרן.
- הכנס את המקל הארוך של הגשושית לתא הבזולטרלי ואת הקצה הקצר לתא האפי של תרבית תאי האפיתל הטרנסוול. יש להקפיד שלא לשבש את השכבה החד-שכבתית או לפגוע בעלון.
- לאחר היציבות, רשום 3 מדידות TEER לכל תוספת טרנסוול, כולל ההוספה ללא תאים. קח ממוצע של המידות עבור כל תוספת.
- חשב את ערך TEER המתוקן על ידי הפחתת המדידה הממוצעת של הבאר הריקה מהמדידות הממוצעות של בארות הניסוי ולאחר מכן הכפלתה בשטח הפנים של התוספת כדי לקבוע את התנגדות מחסום האפיתל (TEER [Ω.cm2] = [שכבת Rcell - Rblank] × שטח).
תוצאות
הצעד הראשון ביצירת חד-שכבות דו-ממדיות שמקורן באנטרואידים הוא להכין את החלק של רקמת המעי שנקצר (איור 1A) לדיסוציאציה של רקמות. זה נעשה על-ידי הסרת השומן המחובר והמזנטריה מהרקמה (איור 1B), ולאחר מכן חיתוך אורכי של הרקמה כדי לחשוף את פני השטח של לומן, כך שניתן יהיה להסיר את שכבת הריר של המעי על-ידי גירוד עדין באמצעות מגלשת זכוכית. לאחר מכן חותכים את מקטע המעי שנקטף לחלקי רקמה קטנים יותר ויותר (איור 1C) כדי להגביר את קלות הדיסוציאציה. לאחר מכן מנתקים את הקריפטים מהרקמה התת-רירית הבסיסית באמצעות סדרה של שטיפות המורכבות ממאגרי קלציה (איור 1D,E) ו-PBS. קריפטים של מעי מבודדים (איור 1F) מוטמעים לאחר מכן בכיפות מטריצת קרום מרתף (איור 2A) ומתורבתים במשך כמה ימים כדי ליצור אנטרואידים תלת-ממדיים. מקטע של 10 אינץ' של אילאום בקר, ניתן לבודד כ-900,000 קריפטות ולהשתמש בהן ליצירת אנטרואידים. אחרי רק כמה שעות בתרבית, הקריפטות המצופות מתחילות להתארך ולהתפתח לאנטרוספירות (איור 2B). לאחר יומיים אפשר לראות לומן מוגדר היטב (איור 2C), עם ניצנים שזוהו כבר ביום ה-4 בתרבית (איור 2D). ביום השביעי התפתחו אנטרואידים בוגרים (איור 2E). צביעת immunofluorescence של enteroid 3D בן 7 ימים מדגים את נוכחותן של שושלות תאים שונות. מיקרוסקופ קונפוקלי של אנטרואידים מדגים לוקליזציה של כתם גרעיני DAPI, חלבון E-cadherin בצומת adherens, צביעת כרומוגרנין-A (Chr-A) המראה נוכחות של תאים אנטרואנדוקריניים, Lysozyme (LYZ) המדגים תאי Paneth, וציטוקרטין-18 (CK-18) המייצג תאי אנטרוציט באיור 3. לאחר 7-10 ימים בתרבית, יש לעבור את האנטרואידים כדי לאפשר התרחבות נוספת ולמנוע צפיפות. הזמן האופטימלי למעבר אנטרואידים נקבע להיות 7-10 ימים לאחר בידוד הקריפטה הראשוני הראשוני והוא תלוי בסופו של דבר בבריאות ובקצב הצמיחה של אנטרואידים בתרבית. צפיפות הזריעה האופטימלית להשגת המורפולוגיה והכדאיות האנטרואידים הרצויות, כפי שמתואר באיור 2E, היא 400 קריפטים לכיפה. ניתן לשמר אנטרואידים בקלות בהקפאה, ושברי האנטרואידים המופשרים מתאוששים במלואם לשימוש ניסיוני לאחר שני מעברים לאחר ההפשרה. יש לציין כי לפחות שני קטעים של תרבית הקריפטה הראשונית מומלצים לפני שימור בהקפאה.
כדי לייצר חד-שכבה דו-ממדית שמקורה באנטרואידים, האנטרואידים התלת-ממדיים נקצרים, ולאורך סדרה של שלבים, עוברים טריטוציה מכנית בנוכחות תמיסת דיסוציאציה (איור 4A) לתאים בודדים. לאחר מכן ניתן לזרוע תאים בודדים אלה על תוספת טרנסוול שצופתה מראש בתמיסת מדיה של ממברנת מרתף. בממוצע, ניתן לזרוע ארבעה טרנסוולים מארבע כיפות אנטרואידים תלת-ממדיות. מספר האנטרואידים התלת-ממדיים המעובדים תלוי אפוא במספר הטרנסוולים הדרושים לניסוי. ציפוי תאים בודדים בצפיפות זריעה של 1 x 105 וטיפוחם בתחילה בנוכחות 20% FBS (איור 4B-D) יכול ליצור חד-שכבה מתמזגת תוך פחות משבוע אחד. ניתן לנטר את המפגש המתקדם של החד-שכבה הדו-ממדית בתרבית לאורך זמן באמצעות מיקרוסקופ אור (איור 4E,F). מדידות של התנגדות חשמלית טרנסאפיתל (TEER) יכולות לאשר את המפגש ולאפיין את שלמות מחסום האפיתל לאורך זמן ובתגובה לגירוי ניסיוני (איור 5A). בממוצע, לאחר שבעה ימים בתרבית, לחד-שכבה מתמזגת בערך 100% יהיה ערך TEER מתאים של ~1500 Ω·cm2. הערכת אורך של ערכי TEER חד-שכבתיים אנטרואידים דו-ממדיים מראה עלייה מתמדת בערכי TEER במשך שבעה ימים, ומגיעה לערך ממוצע מרבי של 1546 Ω·cm2 לפני ירידה עם הערך הנמוך ביותר של 11.5 Ω·cm2 שהתקבל ביום השנים-עשר (איור 5B). תיוג אימונופלואורסצנטי של חד-שכבות מובחנות מצביע על כך שגיליונות אפיתל מעיים שלמים, מאורגנים ומקוטבים נוצרים באמצעות פרוטוקול זה (איור 6). מיקרוסקופ קונפוקלי של החד-שכבה הדו-ממדית המוכתמת מדגים לוקליזציה של כתמים גרעיניים DAPI, E-cadherin ו-F-actin (איור 6A-D). מיקרוסקופ פלואורסצנטי של החד-שכבה הדו-ממדית מראה סימני היכר של תאי אפיתל מעי ממוינים עם צביעת כרומוגרנין-A (Chr-A) המראה נוכחות של תאים אנטרואנדוקריניים, ליזוזים (LYZ) המדגים תאי פאנת, וציטוקרטין-18 (CK-18) המציין שושלות תאים אנטרוציטיים (איור 6E-L). מידול Z-stack מראה את הקיטוב הצפוי של תרבית חד-שכבתית דו-ממדית עם שיקוע אופייני של F-actin שנמצא במיקרוווילי המכסה את ההיבט האפי של האנטרוציטים המתמיינים ו-E-cadherin, חלבון הממוקם בצמתים הנצמדים בין תאי אפיתל (איור 6M).
ניתן להעריך את הפונקציונליות של החד-שכבה על ידי גירוי אפיקלי עם רכיבים שונים, כולל ליגנדות או פתוגנים של קולטן דמוי אגרה (TLR), ולאחר מכן כימות ציטוקינים של תרביות תאים סופרנאטנטים שנקצרו מהתאים האפיקליים והבזאליים. ואכן, כאשר האספקט האפי של המונושכבה מגורה במשך 24 שעות עם אגוניסט TLR 1/2 Pam3csk4 ביום הרביעי של התרבית, נצפה ייצור ציטוקינים מוגבר בשני התאים בהשוואה למונושכבות שלא טופלו (איור 7A,B).
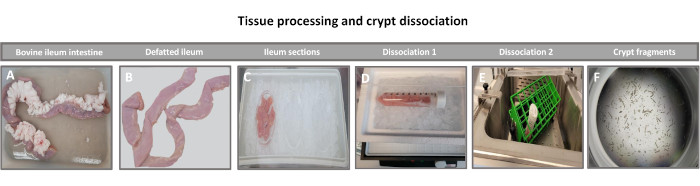
איור 1: בידוד קריפטת מעיים של בקר מבקר בוגר בריא. תמונות הממחישות את עיבוד הרקמה של (A) אילאום בקר בוגר שלם, (B) אילאום נטול שומן, (C) אילאום מחולק לחתיכות בגודל 2.5 אינץ' (6.3 ס"מ) ב-PBS על קרח, (D) קטעי רקמה איליאלית בחיץ דיסוציאציה #1 ב-4°C, ו-(E) בחיץ דיסוציאציה 2 באמבט מים רועדים ב-37°C, ו-(F) שברי קריפטה איליאליים מבודדים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
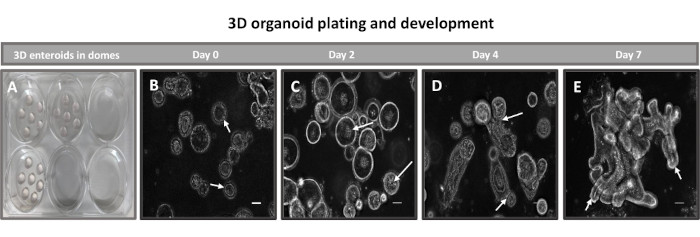
איור 2: התפתחות אנטרואידית תלת-ממדית ראשונית של בקר בממברנת מרתף. תמונות מייצגות של (A) כיפות אנטרואידיות תלת-ממדיות שנוצרו בצלחת תרבית רקמה בעלת 6 בארות והתפתחות אנטרואידית תלת-ממדית (B-E) מימים 0, 2, 4 ו-7 בתרבית. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
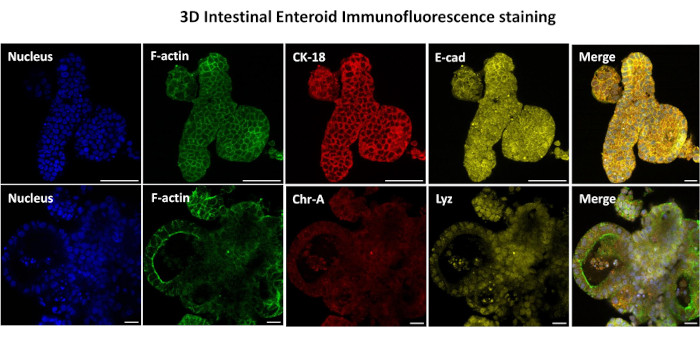
איור 3: אנטרואידים תלת-ממדיים של מעיים מראים צביעה של שושלת תאי אפיתל. תמונות מייצגות של אנטרואידים תלת-ממדיים לאחר 7 ימים בתרבית מדגימות נוכחות של כתם גרעיני, F-אקטין , ציטוקרטין-18 (CK-18), כרומוגרנין-A (Chr-A), אקאדהרין (E-cad), ליזוזים (Lyz) ושכבת על של תמונות (מיזוג). סרגל קנה מידה 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
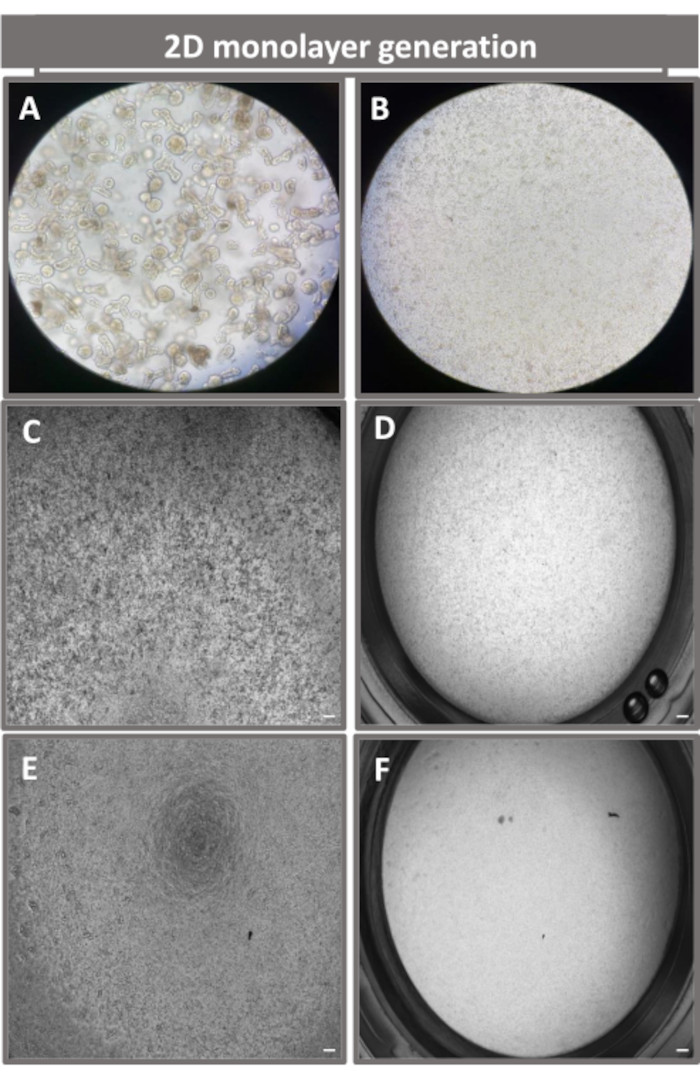
איור 4: התבססות של חד-שכבה דו-ממדית שמקורה באנטרואידים מאנטרואידים איליאליים. תמונות מייצגות של (A) מקטעים אנטרואידים תלת-ממדיים בתמיסת דיסוציאציה כהכנה לזריעה חד-שכבתית, תאים בודדים המצופים על תוספת טרנסוול בצפיפות זריעה של 1 x 105 שצולמו ביום 0 באמצעות (B) אור, (C) ניגודיות פאזה, ו-(D) מיקרוסקופ שדה בהיר, ופיתוח חד-שכבתי על תוספות טרנסוול שצולמו ביום החמישי באמצעות (E) ניגודיות פאזה ו-(F) מיקרוסקופ שדה בהיר. הגדלה וסרגל קנה מידה פי 40 = 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
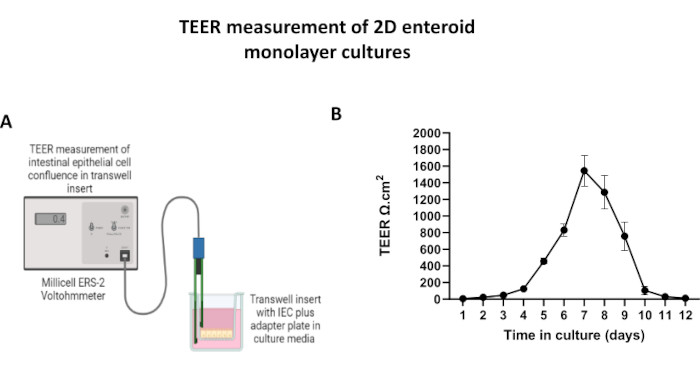
איור 5: מדידות התנגדות חשמלית טרנסאפיתליאלית (TEER) של חד-שכבה דו-ממדית שמקורה באנטרואיד על תוספות טרנסוול. (A) דיאגרמה סכמטית של האופן שבו מדידות TEER של חד-שכבה דו-ממדית של תאי אפיתל המעי (IEC) מתקבלות באמצעות אלקטרודות STX2 של וולטומטר, (B) ניטור אורכי של מדידות TEER חד-שכבתיות דו-ממדיות במשך 12 יום בתרבית תאים. כל נקודת נתונים מייצגת ערך TEER ממוצע ושגיאת תקן של ממוצע (SEM) המתקבלים משני עותקים משוכפלים טכניים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
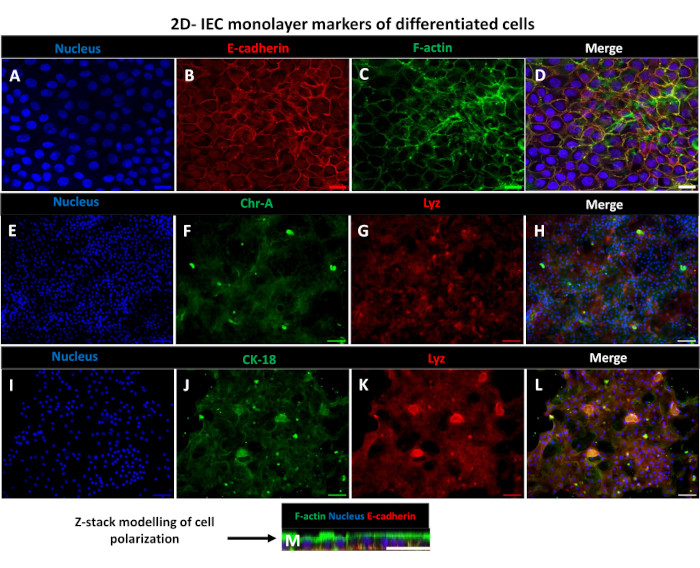
איור 6: חד-שכבות דו-ממדיות מובחנות שמקורן באנטרואידים על תוספות טרנסוול מתפתחות ליריעות אפיתל מעי מקוטבות. (א-מ) תמונות אימונופלואורסצנטיות מייצגות של שכבה חד-שכבתית דו-ממדית שמקורה באנטרואיד על גבי החדרת טרנסוול לאחר 5 ימים בתרבית המציגות את הגרעין (A) (כחול), (B) E-cadherin (אדום), (C) F-actin (ירוק) ו-(D) שכבת העל של 3 התמונות (מיזוג), (E,I) כתם גרעיני, (F) כרומוגרנין-A, (J) ציטוקרטין-18, (G,K) ליזוזים ו-(H,L) מיזוג תמונות. (M) מידול Z-stack המראה את ההתפלגות של אותם חלבוני סמן תאי אפיתל של גיליון חד-שכבתי דו-ממדי. התמונות התקבלו משני שכפולים ביולוגיים. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
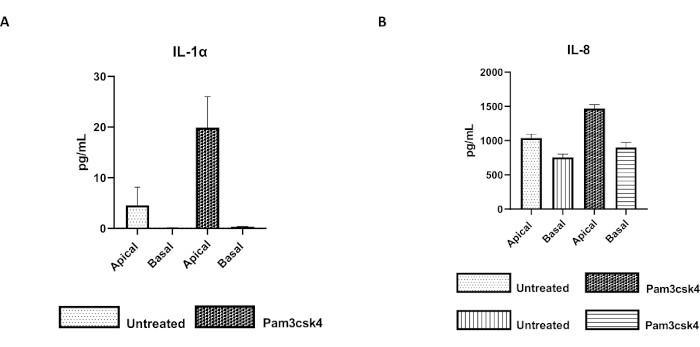
איור 7: חד-שכבות דו-ממדיות ראשוניות של בקר שמקורן באנטרואידים על תוספות טרנסוול פעילות מבחינה פונקציונלית. הפרשת ציטוקינים סופרנאטנטיים בתרבית תאים אפית ובזאלית של (A) IL-1α, ו-(B) IL-8 על ידי מונושכבות דו-ממדיות על תוספות טרנסוול לאחר 5 ימים בתרבית שלא טופלו או עוררו עם Pam3csk4 במשך 24 שעות. הנתונים מייצגים את רמות הציטוקינים הממוצעות ואת SEM מחד-שכבות שמקורן במלאי קפוא של קריפטות מחיה אחת ומשלושה ניסויים עצמאיים. הציטוקינים כומתו באמצעות בדיקת מולטיפלקס מבוססת חרוזים (Table of Materials) על פי הוראות היצרן ונותחו על יחידת ריבוב קומפקטית (Table of Materials) ותוכנה להתאמת עקומת אימונואסאי (Table of Materials). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: המלאי והריכוזים הסופיים של הריאגנטים. אנא לחץ כאן כדי להוריד את הטבלה.
Discussion
הפרוטוקול המוצג כאן מתאר מודל פיזיולוגי רלוונטי לחקירת פיזיולוגיה של המעי והפרעות אנטריות. מספר קבוצות מחקר תיארו את הדור של תרביות אנטרואידים של בקר, כולל חד-שכבות דו-ממדיות 16,19,20,21,22,23,24. בעוד שיצירת חד-שכבות אינה מאתגרת מבחינה טכנית באופן גלוי, כמה צעדים זעירים הם קריטיים בפיתוח תרבויות מוצלחות באופן עקבי. ככזה, יכולת השחזור של חד-שכבות דו-ממדיות באמצעות השיטות המתוארות בקצרה בספרות שפורסמה יכולה להיות מאתגרת עבור חוקר טירון בתחום האורגנואידים. הפרוטוקול המתואר כאן מותאם מפרוטוקולים אלה ומאלו שפורסמו במינים אחרים, ומספק מדריך שלב אחר שלב ליצירת חד-שכבות על תוספות טרנסוול הניתנות לשחזור ברמה גבוהה.
ניתן לשנות בקלות את הפרוטוקול המתואר כאן כך שיתאים למטרות הספציפיות של תכנון הניסוי או לזמינותם של ריאגנטים. ואכן, בעקבות פרוטוקול זה, תרביות מוצלחות יכולות להיות מושגות על ידי זריעת חד-שכבות בצפיפות תאים נמוכה יותר (למשל, 2.5 x 104) או בהיעדר FBS, כפי שמתואר בפרסומים אחרים24. עם זאת, שינוי פרמטרים אלה עשוי לדרוש תרבות מוגברת כדי ליצור monolayer confluent. לפיכך, אם גורמים אחרים המהווים חלק בלתי נפרד מתכנון המחקר, כולל תרבית משותפת עם תאי מערכת החיסון, מכתיבים מסלול זמן מסוים לניסוי, ניתן לשנות את צפיפות הזריעה לפי הצורך. בעוד שפורמולציות אחרות של קרום מרתף יכולות להיות מוחלפות במקום זו המשמשת בפרוטוקול זה ליצירת אנטרואידים תלת-ממדיים וחד-שכבות דו-ממדיות, אלה ידרשו אופטימיזציה מסוימת כדי לקבוע את היחס האופטימלי בין קרום המרתף למדיה.
ליישום של תוספות טרנסוול במתודולוגיה המתוארת יש יתרונות רבים על פני גידול monolayer על כלי פלסטיק קונבנציונאלי תרביות אנטרואידים 3D. בהשוואה ללוחות תרבית רקמה סטנדרטיים, שימוש בטרנסוולים לתרביות חד-שכבתיות מקדם התמיינות וארגון תאים באופן השומר על מראית עין של קריפטים במעיים14,25. מחסום אפיתל המעי חיוני במניעת טרנסלוקציה של רעלים ומיקרואורגניזמים לגוף ובו זמנית להקל על ספיגת חומרים מזינים. לכן, חשוב להבין כיצד שלמות המחסום של המעי מתפקדת במצב בריא ומשתנה במהלך הפרעות מעיים או בתגובה לתרכובות. שלא כמו תרביות אנטרואידים תלת-ממדיות, הערכה אובייקטיבית של שלמות מחסום המעי אפשרית כאשר משלבים חד-שכבות על טרנסוולים ומודדים TEER, כפי שמוצג כאן14,25. יצירת חד-שכבות דו-ממדיות על טרנסוולים מאפשרת גם תרבית כפולה עם סוגי תאים רלוונטיים כגון תאי חיסון או סטרומה. זה מאפשר לאפיין יחסי גומלין בעלי חשיבות קריטית בין תאי המעי לבין תאי המיקרו-סביבה של הרקמה, דבר שלא ניתן להשיג באמצעות תרביות תלת-ממדיות. חשיפת פני השטח האפיקליים של החד-שכבה לא רק מאפשרת חשיפה ניסיונית לפתוגנים ולתרכובות ואיסוף תוצרים לומינליים, אלא גם מאפשרת מחקרים על היבטים אחרים של פיזיולוגיה ומחלות של המעי, כולל חקירת מיקרוביוטה של המעי ופיזיולוגיה מולקולרית של ספיגה או הובלה13. שליטה עצמאית על משטחי המעי האפי והבסיסי היא יתרון מובהק על פני מודלים אנטרואידים תלת ממדיים.
באמצעות מספר ניסויים, זיהינו שלבים מרכזיים שתרמו להצלחת הפרוטוקול. בעוד דגימות רקמת מעי שלמות ניתן לשמור בקירור במשך הלילה ולעבד למחרת, דיסוציאציה רקמות ובידוד של שלבי מקטע קריפטה חייב להתבצע מיד כדי למנוע את ההתפוררות של שברי הקריפטה המבודדים. לאחר השלמת שטיפות PBS, צנטריפוגה של הקריפטות ב-Wash Media יכולה לסייע במניעת התמוטטות הקריפטה, כמפורט בשלב 2.3.10. כאשר עוברים את האנטרואידים או קוצרים אותם להיווצרות monolayer, חיוני להפריד את enteroids מן הכיפות BME. מדיית הכביסה חייבת להיות קרה כקרח כדי לסייע בהמסת ה-BME. לעומת זאת, שימוש ב-TrypLE שחומם מראש וסינון תרחיף התא פעמיים יכולים לעזור ליצור את התאים הבודדים הדרושים ליצירת חד-שכבתיות. לבסוף, תמרון ידני של הצלחת בצורת הספרה 8 יכול לעזור לפזר באופן שווה את התאים הבודדים על פני החדרת הטרנסוול.
מגבלה חשובה של פרוטוקול זה היא שהחד-שכבות הדו-ממדיות הופקו ממלאי אנטרואידים שנוצרו מהגה הולשטיין בוגר (>2 שנים). הבשלת מערכת העיכול בשוקיים עשויה לדרוש שינויים קלים בפרוטוקול המתואר כדי להניב תוצאות מיטביות. הבדלים ספציפיים לגזע בפיזיולוגיה של המעי של גזעי בקר תוארו בספרות26. אמנם לא ידוע אם הבדלים אלה יכולים להשפיע על אנטרואידים ועל יצירת מונושכבות לאחר מכן, אך אנו חושדים שכל הבדל יגרום לשינויים קלים בלבד בפרוטוקול שלנו. בנוסף, למודל התרבות הדו-ממדית יש כמה חסרונות מובנים. בהשוואה למודלים אנטרואידים תלת-ממדיים, תרביות דו-ממדיות עשויות להיות חסרות היבטים מסוימים של ארכיטקטורת רקמת המעי והמגוון התאי וליצור מגבלות ואתגרים הקשורים להתפשטות תרבית דו-ממדית13. עם זאת, מחקרים מראים כי חלק מהחד-שכבות יכולות לחקות את ארגון הקריפטההצפוי 27, ועל חלק מהמגבלות הללו ניתן אפילו להתגבר על ידי הקמת תרבויות דו-ממדיות עם ממשק אוויר-נוזל. עם זאת, יש לשקול במלואן את מגבלותיו של מודל זה כדי לקבוע אם יישומו מתאים לשאלה הניסויית הנשאלת.
פרוטוקול זה מתאר מערכת תרבית אופטימלית המדמה את מערכת העיכול של בקר באמצעות אנטרואידים שמקורם באילאום הבקר ליצירת מונושכבות על תוספות טרנסוול. עם מגוון רחב של יישומים, החל ממחקר מחלות זיהומיות ועד גילוי תרופות ורפואה רגנרטיבית, מערכת תרביות בעלת תפוקה גבוהה זו יכולה להוביל לפיתוח חסר תקדים של אסטרטגיות מניעה וטיפול שיכולות להועיל הדדית לבריאות בעלי חיים ובני אדם.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים שיכולים להתפרש כניגוד עניינים פוטנציאלי.
Acknowledgements
אנו מכירים בשימוש במתקן הליבה התאית והמולקולרית באוניברסיטת מידווסטרן.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
References
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, Academic Press. 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972(2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73(2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272(2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225(2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43(2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54(2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33(2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115(2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606(2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42(2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15(2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114(2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved