Method Article
トランスレーショナルバイオメディカル研究への応用を目指したウシ一次エンテロイド由来2次元単層培養系の作製
要約
エンテロイドは、組織生理学や病態生理学、医薬品開発、再生医療を研究するための新しいモデルとして浮上しています。ここでは、関連する組織細胞タイプとの共培養を可能にするウシ初代細胞2Dエンテロイド由来培養システムについて説明します。このモデルは、消化器研究のモデリングにトランスレーショナルな利点をもたらします。
要約
オルガノイド細胞培養システムは、組織で観察される複雑さを再現できるため、宿主と病原体の相互作用の研究、薬効と毒性の評価、および組織のバイオエンジニアリングに役立ちます。ただし、これらのモデルの 3 次元 (3D) 特性のために、説明された理由でこれらのモデルを適用することは制限される場合があります。例えば、消化器疾患の研究に3D腸内膜培養システムを使用することは、腸管腔とその分泌物質にアクセスできないため、困難です。実際、病原体による3Dオルガノイドの刺激には、管腔マイクロインジェクション、3D構造の機械的破壊、または頂端アウトエンテロイドの生成のいずれかが必要です。さらに、これらのオルガノイドは免疫細胞や間質細胞と共培養することができないため、病態生理学的動態に関する詳細な機構解析は限られています。これを回避するために、ウシ初代細胞の2次元(2D)エンテロイド由来単層培養システムを最適化し、他の関連する細胞タイプとの共培養を可能にしました。健康な成牛から分離された回腸陰窩を培養して3Dオルガノイドを生成し、将来の使用のために凍結保存しました。蘇生した3Dエンテロイドを継代して破壊し、単一細胞を作製し、基底膜抽出物でコーティングしたトランズウェル細胞培養インサートに播種し、それによって頂端表面を露出させました。腸管単層極性、細胞分化、およびバリア機能は、免疫蛍光顕微鏡法および経上皮電気抵抗の測定を用いて特徴付けた。単分子膜の頂端表面を刺激すると、頂端区画と基底区画の両方からのサイトカイン分泌によって実証されたように、単分子膜の期待される機能が明らかになりました。今回紹介した2次元エンテロイド由来単層モデルは、宿主と病原体の相互作用や腸管生理学、創薬、再生医療の研究に大きな期待が寄せられています。
概要
研究における動物モデルは、疾患の病態生理学と感染中の宿主免疫応答の動態の理解を深める上で重要な役割を果たし、新しい予防および治療戦略の開発をサポートします1,2,3,4。これらのモデルは、動物の研究の発見と進歩を支え、人間の健康研究の進歩の鍵となります。何十年にもわたって、げっ歯類モデルは、ヒト疾患の免疫メカニズムと基礎生物学研究の進歩を支えてきました3,5,6,7。げっ歯類モデルはスクリーニングと初期開発研究において重要ですが、大型動物モデルは、治療効果と安全性試験を含む、早期発見と後期開発研究の両方でヒトの疾患を研究する上でより適切な比較を提供します1,3,4,5。家畜はげっ歯類モデルと比較して、クリプトスポリジウム症、サルモネラ症、結核、呼吸器合胞体ウイルス、ブルセラ症などの一部の疾患のヒト応用において、より効率的な翻訳を行うという明確な利点があります1,7,8。実際、これらの病気やその他の病気は、ヒトといくつかの類似した病気の病因と免疫プロセスを共有する牛で自然に発症し、近親交配集団として、牛は人間の免疫応答に影響を与える遺伝的および環境的不均一性を模倣します5,8,9,10.感染症研究におけるウシモデルの利点は、まず高度な培養システムを採用し、次にin vivo研究を段階的に実施することで最大限に活用できます。非常に複雑なウシ由来の培養システムを最初に使用することで、トランスレーショナル研究や応用研究の成功の可能性を高めながら、生きた動物実験の数を大幅に減らすことができます。培養モデルは、最適な予測妥当性を得るために臓器レベルで疾患プロセスを再現し、天然組織の微小環境を空間的および機能的に保持する必要があります。
粘膜免疫応答は、消化管腸細胞と粘膜表面下に位置する免疫細胞の多様な集団によって形成される高効率のバリアで構成される多面的なシステムである11。この非常に複雑なシステムは、感染時に消化管の恒常性を維持し、腸内病原体に対する免疫防御を開始する上で重要です11。腸細胞と根底にある自然免疫細胞との間のコミュニケーションは、病原性微生物に対する防御免疫応答の発達を開始します。そのため、宿主と腸内病原体の相互作用を最適に調査するためには、複雑さのレベルが比較的高い培養システムが必要であり、腸内生理学と創薬および開発を理解する上で非常に効果的です12,13。オルガノイドは、起源組織の構造と機能に似た堅牢な培養システムです14,15。これらのモデルの多細胞性は、多様な細胞集団の役割と、腸管の健康と疾患に関与する細胞相互作用の研究を可能にします12,14。しかし、ヒト由来のオルガノイドモデルは、ヒト腸上皮細胞の十分な量と一貫した品質を得ることが困難であり、培養における細胞生存率が限られているため、現在のところ限界があります。不死化細胞株は、これらのモデルで相同培養を一貫して高収量にするために使用できます。しかし、形質転換細胞は本質的に、形質転換されていない上皮細胞の多様性と機能的複雑さを欠いています16,17。消化器疾患や生理学を調査するためのモデルとしてウシ組織由来の培養物を使用する利点には、健康なドナーから組織サンプルを一貫して入手することが容易であること、細胞生存率の向上、および不死化されていない組織でのみ達成可能な細胞の多様性の向上が含まれます。腸管オルガノイドの比較組織トランスクリプトミクスと特性評価により、ヒトとウシの間で保存されたオルソロゴス遺伝子と細胞電位の類似性が明らかになりました18。したがって、ウシオルガノイド由来の培養系は、ヒトの腸疾患の調査に有利であり、その結果はヒトの医学に容易に変換できる可能性があります。
本明細書に記載のプロトコルは、ウシ腸内細菌由来の2D初代細胞培養システムを用いて、腸内病原体または化合物および腸生理学に対する宿主の応答を評価するための効果的なプラットフォームを詳述する。3Dオルガノイドとは異なり、トランズウェルインサートで生成された2D培養システムは、腸細胞と免疫細胞または間質細胞の二重培養を可能にし、組織レベルのダイナミクスの研究を可能にします。生物医学研究、医薬品開発、有効性試験への応用により、この生理学的に適切なモデルは、牛と人間の健康と進歩の両方に利益をもたらすことができます。
プロトコル
すべてのプロトコルは、動物福祉のための制度的および国のガイドラインと規制に準拠して実施されました。
1. 試薬調製
注:この研究で使用した試薬の在庫と最終濃度を 表1に示します。
- サンプル採取バッファーの調製:ペニシリン(100 U/mL)、ストレプトマイシン(100 μg/mL)、ゲンタマイシン(25 μg/mL)、カスポファンギン(2.5 μg/mL)を含む氷冷リン酸緩衝生理食塩水(PBS)1 Lを混合します。原液は4°Cで保存してください。
- 解離試薬#1の調製:18.55 mLのサンプル採取バッファー(ステップ1.1で説明)、1.422 mLのエチレンジアミン四酢酸(EDTA、0.422 M/pH 7.4)、20 μLの1 M 1,4-ジチオスレイトール(DTT)溶液、4 μLのY-27632溶液(5000x/50 mM)を混合します。溶液を4°Cで保存します。
- 解離試薬#2の調製:18.57 mLの回収バッファー(ステップ1.1で説明)、1.422 mLのEDTA(0.422 M/pH 7.4)、4 μLのY-27632溶液(5000x/50 mM)を混合します。溶液を37°Cで保存します。
- 腸内増殖培地ストックの調製:オルガノイド増殖培地9.875 mLとサプリメント、100 μLのペニシリン(100 U/mL)、ストレプトマイシン(100 μg/mL)、5 μLのゲンタマイシン(25 μg/mL)、および20 μLのカスポファンギン(2.5 μg/mL)を混合します。溶液を4°Cで保存します。
- 腸内分化培地ストックの調製:オルガノイド分化培地10 mLとサプリメント、ペニシリン100 μL(100 U/mL)、ストレプトマイシン(100 μg/mL)、ゲンタマイシン5 μL(25 μg/mL)、カスポファンギン20 μL(2.5 μg/mL)を混合します。溶液は-20°Cで保存してください。
- 洗浄培地の準備:48.45 mLのDMEM/F-12 1.1培地(L-グルタミンを含む、HEPESを含まない)、ビタミンAを含まないB-27サプリメント1 mL(50倍ストック)、500 μLのペニシリン(100 U/mL)、ストレプトマイシン(100 μg/mL)、25 μLのゲンタマイシン(50 mg/mLストック)、および25 μLのカスポファンギン(5 mg/mLストック)を混合します。溶液を4°Cで保存します。
- コーティングバッファーの調製:25 mLのDMEM:F12インヒビターなし培地と25 mgのウシ血清アルブミン(BSA)を混合します。溶液を4°Cで保存します。
2. 全組織からの腸陰窩の単離(図1)
注:ウシ小腸エンテロイドは、地元の牛肉加工工場から健康な成体のホルスタイン去勢牛(>2歳)から得られた回腸組織から生成されました。この一連の実験には1人のドナーが用いられた。
- 腸組織サンプルの調製
- 採取した~10インチ(25cm)の腸組織サンプルを~400 mLの氷冷採取バッファー(PBS+抗生物質/抗真菌薬)に入れ、氷上に載せて実験室に輸送します。
- 外科用ハサミ(メイヨーハサミなど)と鉗子(アドソン鉗子など)を使用して、腸組織サンプルから余分な脂肪と腸間膜を取り除きます。
- ティッシュを2等分に切ります。
- 手術用ハサミで組織を縦方向に開き、滅菌PBSで組織をすすぎます。
- 滅菌ガラス顕微鏡スライドの側面を使用して腸サンプルの粘液層を静かに除去し、新鮮なPBSで組織をすすぎます。
注:このステップは、絨毛を除去するのに役立ち、後続のステップで陰窩画分の純度を高めるのに役立ちます。 - 5インチ(13 cm)の部分ごとに、組織を2つの2.5インチ(6.5 cm)に切断し、次に各部分を4つのほぼ等しい小片に切断して、組織の解離を促進します。
- 腸組織の解離
- 滅菌済みの50 mLコニカルチューブに20 mLの組織解離試薬#1を調製し、容量の変位によってメニスカスがコニカルチューブの20 mLマークから35 mLマークに移動するまで、小さな組織サンプルをコニカルチューブに堆積させます。
- 残りの小腸組織サンプル片について、上記の手順を繰り返します。
- 円錐形チューブをパラフィルムで密封し、円錐形チューブを手動で10回振とうします。
注意: プロトコル全体を通して、手動振とうは意図的かつ穏やかな方法で行う必要があります。 - 円錐形のチューブを、軌道振とうプラットフォーム上の容器の氷の上に水平に置きます。
- 容器内の氷の上で円錐形のチューブを毎分80回転(rpm)で30分間振とうします。10分ごとに、円錐形のチューブを手動で振ってください。
- 50 mLのコニカルチューブに、20 mLのプレウォーム(37°C)組織解離試薬#2(上記のように調製、ただしDTTなし)を調製します。解離試薬#1を含む円錐管から解離試薬#2を含む円錐管に組織サンプルを堆積させます。
- 円錐形のチューブをパラフィルムで密封し、手動で円錐形のチューブを10回振ってください。
- コニカルチューブを予め温めた(37°C)振とう水浴に入れ、約60°Cの角度で傾け、150rpmで10分間振とうし、5分後に手動で振とうし、合計10分のインキュベーション後に再度振とうします。
- クリプトフラグメントの分離
- 10個の滅菌円錐形チューブ#1-#10にラベルを付けます。20 mLの滅菌氷冷PBSを各標識コニカルチューブに加えます。
- 解離試薬#2を含むコニカルチューブから、氷冷PBS #1を含む新しい滅菌50 mLコニカルチューブに組織片を移します。
- 円錐形のチューブを手動で10回振ってください。
- 円錐形のチューブをパラフィルムで密封し、氷の上に水平に置きます。オービタルシェーカーで円錐形のチューブを80rpmで10分間振とうします。10分後、コニカルチューブ#1を手動で10回振とうします。これはウォッシュ#1と見なされます。
- 一対の外科用鉗子を使用して組織サンプルを円錐形チューブ#2に静かに移します。
- 手順2.3.2〜2.3.4を繰り返します、これはウォッシュ#2と見なされます。
- 洗浄#10まで洗浄を繰り返します。
- 各洗浄液の上清には、エンテロイド生成に使用される陰窩が含まれています。上清の入ったチューブを、10回の洗浄がすべて完了するまで4°Cに保ちます。
- 10回目の 洗浄が完了し、組織切片を廃棄した後、コニカルチューブ#6-#10の上清を400 x g で4°Cで2分間遠心分離し、単離された陰窩をペレット化します。
注:洗浄6〜10には、破片や単一細胞が限られている無傷の陰窩の最もきれいな画分が含まれています。そのため、これらの画分のみをエンテロイド生成に使用し、以前の洗浄(#2-#5)は破棄することをお勧めします - 上清を廃棄し、再懸濁せずに4 mLの新鮮で氷冷したPBSを陰窩に加えます(これにより、顕微鏡検査まで断片を無傷に保つことができます)。
- 各円錐形チューブ#6-#10の解離陰窩の純度を顕微鏡で評価します。
- 50 μL の PBS を 384 ウェルプレートに添加します。
- PBSに10 μLの陰窩懸濁液を加え、倍率40倍の対物レンズを使用して陰窩の純度、完全性、および数を決定します。
注意: プレートウェルの底に十字を描くと、カウントが簡単になります。
3. ウシ回腸エンテロイドの ex vivo 生成と継代(図2)
注:最も純粋で無傷の腸陰窩を持つ円錐形チューブからの陰窩は、下流のアッセイに使用されます。陰窩とエンテロイドを含むすべてのステップでは、ピペットチップ、細胞スクレーパー、およびチューブをコーティングバッファーで事前にコーティングし、陰窩の損失を防ぐために気泡を避ける必要があります。特に断りのない限り、1000 μLのピペットチップを使用して、クリプトフラグメントの破砕を防ぐ必要があります。
- 陰窩の断片からエンテロイドを生成する
- 最も純粋な陰窩画分(通常は#6-#10)を1つの円錐形のチューブに結合します。
- 陰窩を含むコニカルチューブを400 x g で4°Cで2分間遠心分離します。
- 上清をピペットで吸引して廃棄し、クリプトペレットをウォッシュメディアに再懸濁します。
- ステップ3.1.2のように遠心分離します。上清をデカントし、2 mLのウォッシュメディアをクリプトペレットに加えます。
- 手順2.3.11.1の説明に従って、クリプトの数を数えます。
- ステップ3.1.2と同様に遠心分離して陰窩をペレット化し、上清を廃棄し、氷冷した100%還元成長因子基底膜細胞外マトリックス(BME)に再懸濁して、約400クリプト/100μLの濃度にします。
注:BMEは、温度変化によって粘稠度が変化するため、4°Cで適切に融解することが重要です。BMEは、冷却ブロックと事前に冷却されたピペットチップを使用して、早期に固化するのを防ぐことができます。- 別の基底膜マトリックス組成物を使用すると、ドームを作成する際にBMEの希釈が必要になる場合があります。使用しているBMEに固有の製造元の指示を参照してください。
- ピペットを上下に動かして、BMEの陰窩を完全に吊り下げます。
- crypt-BME懸濁液50 μLを、37°Cに設定した加温プレート上の6ウェル組織培養プレートに、最大8個のドーム/ウェルでゆっくりとピペッティングすることにより、crypt-BMEドームを作製します。
注:6ウェルプレートは、ドームのメッキの前に、インキュベーターで37°Cで一晩予熱する必要があります。 - 6ウェルプレートを加温プレート上に1分間置いてから、プレートを37°C、5%CO2 インキュベーターに慎重に移動させます。
- 2分後、蓋が下を向くように6ウェルプレートを裏返し、さらに30分間インキュベートしてドームを重合させます。
- 30分後、10 μMのSB202190、0.5 μMのLY2157299、および10 μMのY-27632を添加した3 mLの室温(RT)エンテロイド増殖培地を、ドームを含むウェルに慎重に加えます。
- 37°C、5%CO2でインキュベートします。
- 培地を取り除き、2〜3日ごとに阻害剤を添加した新しい腸内増殖培地と交換します。
- エンテロイドの継代
- 7〜10日後、陰窩が 図2Eのように多くの出芽構造を持つ3Dエンテロイドを形成し、継代する準備ができていることを確認します。
- ドームを含むウェルから培地を捨てます。
- ウェルあたり4つのドームごとに、10 μM Y-27632を添加した氷冷非酵素細胞解離溶液1 mLをドームを含む各ウェルに加えます。
- プレコートされた細胞スクレーパーを使用して、ドームを組織培養プレートから静かに取り外します。
- エンテロイドを15 mLのコニカルチューブに集め、ピペッティングで10回上下させて粉砕します。
- 断片化したエンテロイドを含むコニカルチューブを、80rpmのオービタルシェーカーで10分間室温でインキュベートします。
- 10 mLの氷冷洗浄培地を10 μM Y -27632のエンテロイドに加えます。
- コニカルチューブを 300 x g で 5 分間遠心分離します。
- 上清を廃棄し、ペレットを10 mLの新鮮な洗浄液に再懸濁し、新しい15 mLコニカルチューブに移します。
- コニカルチューブを 300 x g で 5 分間遠心分離します。
- 上清を廃棄し、ペレットを1.5 mL微量遠心チューブ中の1 mLの腸内増殖培地に再懸濁します。
- 微量遠心チューブを300 x g で5分間室温で遠心分離し、上清を廃棄します。
- エンテロイドペレットを氷冷100%BMEに再懸濁し、手順3.1.6-3.1.13に従います。
- 7日ごとの再通過エンテロイド。増殖時間は、出芽の密度、生存率、および程度によって異なる場合があります。大きなエンテロイド構造を形成する複数の出芽構造は、エントロイドを継代する必要があることを示しています。
- エンテロイドの凍結保存
- 凍結保存のために、エンテロイドが培養中に5回以上継代されていないことを確認してください。
注:これは実験的にテストされておらず、後のパッセージが生存率を低下させ、さまざまな結果をもたらすという著者の観察に基づいています。 - エンテロイドを回収するには、ステップ3.2.2-3.2.9で説明したように解離バッファーを使用します。
注:5 mLピペットを使用してエンテロイドを機械的に解離します。 - ステップ2.3.11.1の説明に従って、エンテロイドフラグメントの数をカウントします。
- コニカルチューブを 300 x g で 5 分間遠心分離します。
- 上清を廃棄し、10 μM Y-27632 を添加した凍結保存培地にエンテロイド断片を再懸濁して、濃度を ~2000 エンテロイド断片/mL とし、1 mL をあらかじめ標識したクライオバイアルに分注します。
- クライオバイアルを管理された凍結容器に入れ、-80°Cで一晩保存します。
- クライオバイアルを気相液体窒素に移し、長期保存します。
- 凍結保存のために、エンテロイドが培養中に5回以上継代されていないことを確認してください。
- 腸陰窩断片の蘇生
- インキュベーター内に6ウェルプレートを一晩置きます。
- 5 mLのチューブに5 mLのコーティング剤をプレコートします。
- 液体窒素貯蔵庫からクライオバイアルを取り出します。
- 解凍したらすぐに、クリオバイアルからプレコートされた5 mLチューブに陰窩を移します。クライオバイアルをウォッシュメディアで洗い流し、5 mLチューブに加えます。気泡を避けてください。
- ウォッシュメディアで容量を5 mLまで上げ、400 x g で4°Cで5分間遠心分離します。
- 遠心分離中に、1.5 mLチューブにコーティング剤をプレコートします。
- 遠心分離後、上清を流し出し、チューブ内に残っている培地にペレットを再懸濁し、プレコートした1.5mLチューブに移します。5 mL チューブを洗浄培地で洗浄し、1.5 mL チューブに移します。400 x g で4°Cで5分間遠心分離します。
- Enteroid Growth Mediaで容量を1.5 mLまで増やします。
- 上記のように遠心分離し(ステップ3.4.7)、慎重に吸引します。
- BMEを4°Cから採取し、氷/氷の塊の上に置きます。
- エンテロイドペレットを氷冷100%BMEに再懸濁し、手順3.1.6〜3.1.12に従います。
- 2〜3日ごとにメディアを交換してください。
4. 3次元エンテロイドからの2次元単分子膜の作製と評価
注:上記のように、陰窩とエンテロイドを含むすべてのステップでは、ピペットチップ、セルスクレーパー、およびチューブをコーティングバッファーで事前にコーティングし、陰窩の損失を防ぐために気泡を避ける必要があります。
- 2D単分子膜形成のためのトランズウェルインサートの作製
- インサートを 24 ウェル組織培養アダプタープレートにセットし、1 μm PET 24 ウェル細胞培養インサートの頂端側を、100 μL の 1:15 希釈混合 BME をエンテロイド増殖培地にプレコートします。バリアの完全性測定を行う際のコントロールとして使用される追加のインサートを必ずコーティングしてください。
- コーティングされたインサートをインキュベーター内の24ウェル組織培養アダプタープレートに入れます。
注:トランズウェルインサートには、特定のアダプターまたはコンパニオン組織培養プレートを使用する必要があります。 - 培養インサートを37°C、5%CO2 で1時間インキュベートし、重合させます。
注:BMEコーティングされたトランズウェルは、パラフィルムで密封し、すぐに使用しない場合は最大1週間4°Cで保存できます。 - インキュベーションの最後に、3Dエンテロイド培地を吸引します。
- 3Dエンテロイドの解離
- 上記のセクション3.1で説明したように蘇生、播種、培養した凍結保存された腸内膜断片から2Dエンテロイド単層を生成し、3Dエンテロイドを形成します。融解したエンテロイドを少なくとも2回継代し、最後の継代を最低5日間培養してから処理し、2D単層培養物を生成します。
- 10 μM Y-27632 を添加した氷冷ウォッシュ培地をエンテロイドドームに添加してエンテロイドを回収します(4 ドームに約 1 mL の解離バッファーを使用)
- セルスクレーパーでドームを取り外し、15 mLのコニカルチューブに集めます。
- 1 mLのピペットチップを使用して30回トリチュレートし、エンテロイドフラグメントを生成します。
- 200 μLのピペットチップで40回トリチュレートし、エンテロイド断片をさらに分解します。
- エンテロイド断片を含む 15 mL コニカルチューブの容量を氷冷洗浄培地で 10 mL にします。
- コニカルチューブを 300 x g で 5 分間遠心分離します。
- BME層を含む上清を、エンテロイドペレットを乱さないように注意しながら吸引する。
注:BME層は、ペレットのすぐ上に曇ったゼラチン状の層として表示されます。 - 4ドームごとに、10 μMのY-27632を添加した1 mLの予熱済みTrypLE発現酵素にペレットを再懸濁します。
- エンテロイドとTrypLEの混合物を24ウェルプレートに添加し、37°C、5% CO2 で10分間インキュベートします。
- 10分後、1 mLピペットを使用してエンテロイド-TrypLE混合物を40回ピペットし、エンテロイドをさらに断片化します。
- 次に、200 μLのピペットで断片を40回ピペットで移し、断片を単一細胞に分解します。
- 滅菌済み 22-G ニードルを取り付けた 3 mL または 5 mL シリンジを使用して、細胞懸濁液を 4 回吸引および分注し、単一細胞懸濁液を実現します。
- ステップ2.3.11.1で説明したように、エンテロイドの80%が単一細胞に分解されるまで、顕微鏡で細胞の解離を監視します。
- 細胞懸濁液を 15 mL のコニカルチューブに集め、10% FBS を添加した 4 倍の量の Wash Media を添加して酵素反応をクエンチします。
- エンテロイドをプレコートされた40 μmセルストレーナーで50 mLのコニカルチューブに2回ろ過します。
- コニカルチューブを300 x g で5分間遠心分離することにより、単一細胞をペレット化します。
- トランズウェルインサートの2D単層シーディング。
- 上清をデカントし、20%ウシ胎児血清(FBS)を添加した少量(~600 μL)のオルガノイド増殖培地にペレットを室温で再懸濁します。
- 腸内細胞の密度と生存率を、トリパンブルー色素排除法、血球計算盤、または自動セルカウンターを用いて測定します。平均生存率は75%と予想されます。
- 細胞を播種する直前に、ステップ1.3で塗布した余分なコーティング溶液を細胞培養インサートから慎重に取り除きます。
- プレコートされた細胞培養インサートの頂端表面に、インサートあたり200 μLの容量で1 x 105 細胞を播種します。
- 20% FBSを添加した700 μLの完全培地を細胞培養インサートの基底側に加えます。
- プレートを番号8の形に10回操作して、細胞がインサート全体に均等に広がるようにします。
- プレートをプレートウォーマーの上にバイオセーフティキャビネットで10分間保管します。
- プレートを37°C、5%CO2でインキュベートします。
- 48時間後、頂端および基底コンパートメントの培地を、20%FBSおよび阻害剤を添加した新鮮な腸内増殖培地と交換します。
- 3日目に、頂端および基底外側コンパートメントから培地を取り除き、インサートを1x PBSで慎重に洗浄し、阻害剤のみを添加した腸内分化培地と交換します。
- 両方のコンパートメントのメディアを2〜3日ごとに交換します。
- 上皮バリアの完全性と単層コンフルエントの定量的測定
注:バリアの完全性は、上皮ボルトオーム計を使用して経上皮電気抵抗(TEER)を測定することで評価できます。- トランズウェル培養プレートをインキュベーターから取り出し、バイオセーフティキャビネット内で室温で数分間平衡化させます。
- STX2電極が事前に調整され、電圧抵抗計が製造元の指示に従って1000Ωに校正されていることを確認してください。
- プローブの長いスティックを基底外側コンパートメントに挿入し、短い方の端をトランズウェル上皮細胞培養の頂端コンパートメントに挿入します。単層を破壊したり、インサートを損傷したりしないように注意してください。
- 安定したら、トランズウェルインサートごとに3つのTEER測定値を記録します(セルなしのインサートを含む)。各チップの測定値の平均を取ります。
- 実験ウェルの平均測定値からブランクウェルの平均測定値を差し引き、それにインサートの表面積を掛けて上皮バリアの抵抗を決定することにより、補正されたTEER値を計算します(TEER [Ω.cm2] = [Rcell層-Rblank]×面積)。
結果
2Dエンテロイド由来単分子膜を作製する最初のステップは、組織解離のために採取した腸組織の切片(図1A)を準備することです。これは、付着した脂肪と腸間膜を組織から除去することによって行われ(図1B)、続いて組織を縦方向に切断して内腔表面を露出させ、スライドガラスを使用して穏やかにこすり落とすことによって腸の粘液層を除去できるようにします。次に、採取された腸切片を徐々に小さな組織切片に切断し(図1C)、解離の容易さを高めます。次に、陰窩は、キレートバッファー(図1D、E)とPBSからなる一連の洗浄を使用して、下にある粘膜下組織から解離されます。次に、単離された腸陰窩(図1F)を基底膜マトリックスドーム(図2A)に埋め込み、数日間培養して3Dエンテロイドを生成します。ウシ回腸の10インチの切片から、約900,000の陰窩を分離し、腸内形成に使用することができます。培養でわずか数時間後、メッキされた陰窩は伸び始め、腸圏に発達します(図2B)。2日後、明確に定義された内腔が観察され(図2C)、培養4日目には早くも出芽構造が認められます(図2D)。7日目までに、成熟したエンテロイドが発達しました(図2E)。7日齢の3Dエンテロイドの免疫蛍光染色により、異なる細胞系統の存在が実証されます。エンテロイドの共焦点顕微鏡検査では、DAPI核染色、接着接合部のE-カドヘリンタンパク質、腸内分泌細胞の存在を示すクロモグラニンA(Chr-A)染色、パネート細胞を示すリゾチーム(LYZ)、腸細胞を表すサイトケラチン-18(CK-18)の局在が図 3に示されています。培養で7〜10日後、エンテロイドを継代して、さらなる増殖を可能にし、過密状態を防ぐ必要があります。エンテロイドが通過する最適な時間は、最初の一次陰窩の分離から7〜10日後であると決定され、最終的には培養中のエンテロイドの健康と成長率に依存します。 図2Eに示されているように、所望の腸内形態および生存率を達成するための最適な播種密度は、ドームあたり400クリプトである。エンテロイドは簡単に凍結保存でき、融解したエンテロイド断片は、融解後2回の継代後に完全に回復して実験用になります。特に、凍結保存の前に、一次陰窩培養の少なくとも2つの継代が推奨されます。
2Dエンテロイド由来の単分子膜を作製するために、3Dエンテロイドを回収し、一連のステップを経て、解離溶液(図4A)の存在下で機械的に粉砕して単一細胞にします。次に、これらの単一細胞を、基底膜マトリックス培養培地溶液でプレコートされたトランズウェルインサートに播種することができます。平均して、4つの3Dエンテロイドドームから4つのトランズウェルを播種することができます。したがって、処理される3Dエンテロイドの数は、実験に必要なトランズウェルの数に依存します。単一細胞を1 x 105の播種密度でプレーティングし、最初に20%FBSの存在下で培養すると(図4B-D)、1週間未満でコンフルエント単層を生成できます。培養中の2D単分子膜の進行性コンフルエンスは、光学顕微鏡を用いて経時的にモニタリングできます(図4E、F)。経上皮電気抵抗(TEER)測定により、コンフルエント性を確認し、経時的および実験刺激に応答して上皮バリアの完全性を特徴付けることができます(図5A)。平均して、培養7日後、ほぼ100%コンフルエント単分子膜は、対応するTEER値~1500 Ω·cm2を有する。2D腸内単層TEER値の縦断的評価は、7日間にわたってTEER値が着実に増加し、最大平均値1546 Ω・cm2に達した後、12日目に得られた最低値11.5 Ω・cm2で低下したことを示しました(図5B)。分化した単分子膜の免疫蛍光標識は、このプロトコルを使用して、無傷で組織化された分極された腸上皮シートが形成されることを示しています(図6)。染色した2D単分子膜の共焦点顕微鏡検査により、DAPI核染色、E-カドヘリン、およびF-アクチン染色の局在が実証されます(図6A-D)。2D単分子膜の蛍光顕微鏡検査では、腸内分泌細胞の存在を示すクロモグラニンA(Chr-A)染色、パネート細胞を示すリゾチーム(LYZ)、腸細胞系列を示すサイトケラチン-18(CK-18)など、分化した腸上皮細胞の特徴が見られます(図6E-L)。Zスタックモデリングは、分化した腸細胞の頂端面を覆う微絨毛に見られるF-アクチンと、上皮細胞間に間隔をあけた接着接合部に位置するタンパク質であるE-カドヘリンの特徴的な沈着を伴う2D単層培養の予想される分極を示しています(図6M)。
単層の機能性は、Toll様受容体(TLR)リガンドや病原体などのさまざまな成分による頂端刺激と、それに続く頂端および基底コンパートメントから採取された細胞培養上清のサイトカイン定量によって評価できます。実際、培養4日目にTLR 1/2アゴニストPam3csk4で単分子膜の頂端面を24時間刺激すると、未処理の単層と比較して、両方の区画でサイトカイン産生の増加が観察されます(図7A、B)。
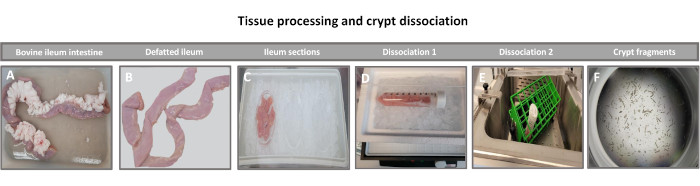
図1:健康な成牛からのウシ腸陰窩の分離。 (A)成牛の回腸全体、(B)脱脂回腸、(C)氷上のPBSで2.5インチ(6.3 cm)の回腸、(D)4°Cの解離バッファー#1で回腸組織切片、(E)37°Cの振とう水浴中での解離バッファー2、および(F)単離された回腸陰窩断片の組織処理を示す画像。 この図の拡大版をご覧になるには、ここをクリックしてください。
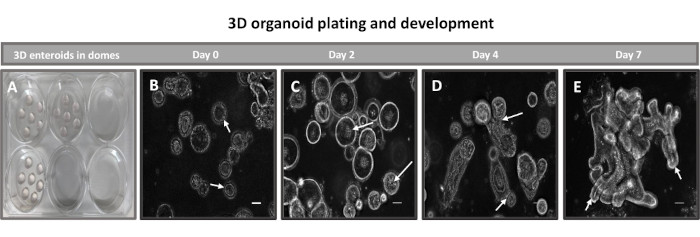
図2:基底膜マトリックスにおけるウシの初代3D回腸内核発生。(A)6ウェル組織培養プレートで作製した3Dエンテロイドドームと、(B-E)培養0日目、2日目、4日目、7日目の3Dエンテロイド発生の代表画像。スケールバー = 50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
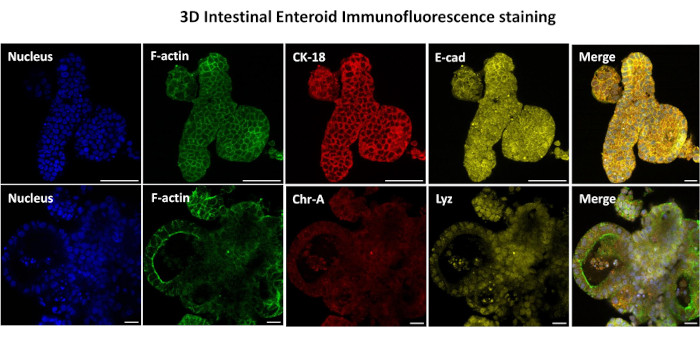
図3:腸管のエンテロイドの3次元は、上皮細胞系統の染色を示しています。 培養7日後の3Dエンテロイドの代表的な画像は、核染色、F-アクチン、サイトケラチン-18(CK-18)、クロモグラニン-A(Chr-A)、エカドヘリン(E-cad)、リゾチーム(Lyz)、および画像のオーバーレイ(Merge)の存在を示しています。スケールバー 50 μm. この図の拡大版をご覧になるには、ここをクリックしてください。
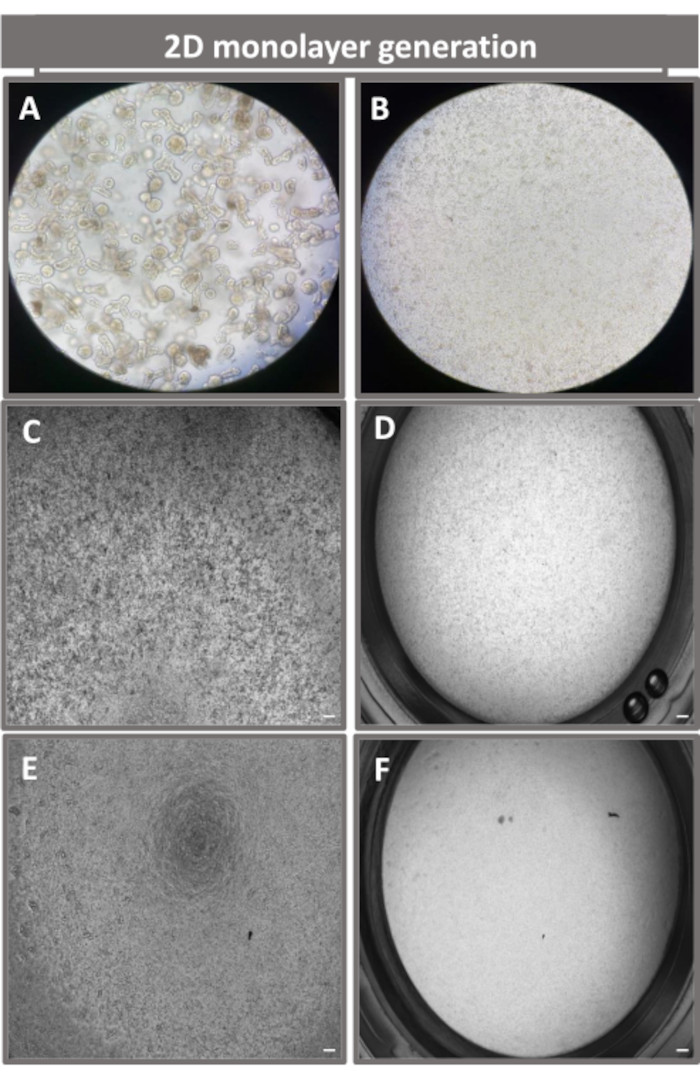
図4:回腸エンテロイドからの2次元エンテロイド由来単分子膜の樹立。(A)単層播種の準備における解離溶液中の3Dエンテロイド断片の代表的な画像、播種密度1 x 10 5のトランズウェルインサートにプレーティングした単一細胞を0日目に(B)光、(C)位相差、および(D)明視野顕微鏡法を用いてイメージングし、(E)位相差および(F)明視野顕微鏡。40倍の倍率とスケールバー = 50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
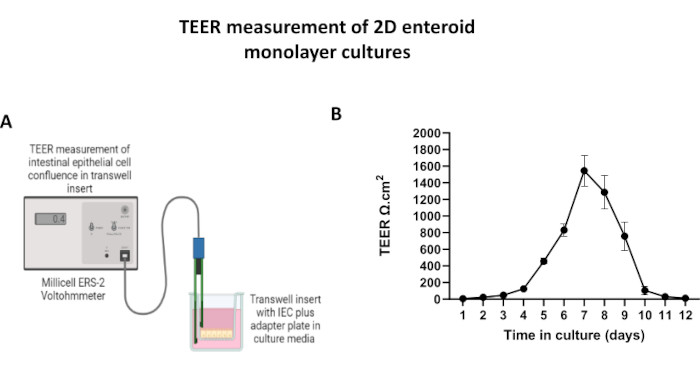
図5:トランズウェルインサート上の2Dエンテロイド由来単分子膜の経上皮電気抵抗(TEER)測定。 (A)ボルトオームメーターのSTX2箸電極を使用して、2D腸管上皮細胞(IEC)単分子膜のTEER測定がどのように得られるかの模式図、(B)細胞培養における12日間にわたる2D単層TEER測定の縦断的モニタリング。各データポイントは、2つのテクニカルレプリケートから得られた平均TEER値と標準平均誤差(SEM)を表します。 この図の拡大版をご覧になるには、ここをクリックしてください。
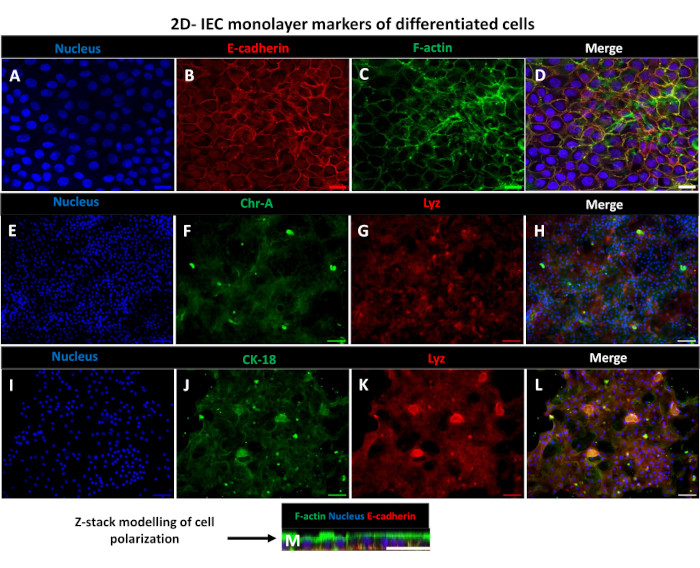
図6:トランズウェルインサート上の分化した2次元エンテロイド由来単層は、偏光した腸管上皮シートに発達する。(A-M)培養5日後のトランズウェルインサート上の2Dエンテロイド由来単分子膜の代表的な免疫蛍光画像で、(A)核(青)、(B)E-カドヘリン(赤)、(C)F-アクチン(緑)、(D)3枚の画像の重ね合わせ(マージ)、(E,I)核染色、(F)クロモグラニン-A、(J)サイトケラチン-18、(G,K)リゾチーム、(H,L)画像のマージを示しています。(M)2D単層シートの同一上皮細胞マーカータンパク質の分布を示すZスタックモデリング。画像は 2 つの生物学的複製から取得しました。スケールバー = 50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
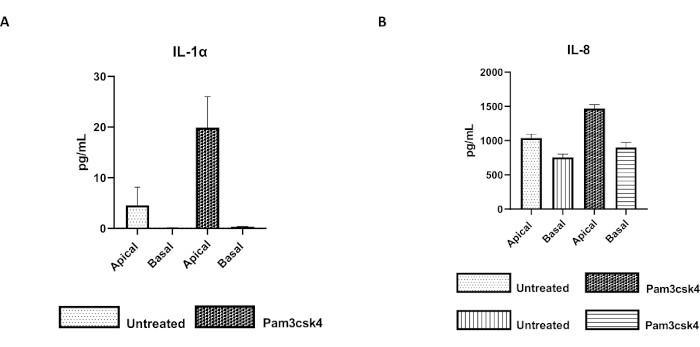
図7:トランズウェルインサート上のウシ一次2Dエンテロイド由来単層は機能的に活性がある。 (A)IL-1α、および(B)IL-8の頂端および基底細胞培養上清サイトカイン分泌は、未処理またはPam3csk4で24時間刺激された培養5日後のトランズウェルインサート上の2D単層による。データは、1匹の動物と3つの独立した実験の陰窩の凍結ストックに由来する単層からの平均サイトカインレベルとSEMを代表するものです。サイトカインは、メーカーの指示に従ってビーズベースのマルチプレックスアッセイ(Table of Materials)を使用して定量し、コンパクトなマルチプレックスユニット(Table of Materials)およびイムノアッセイカーブフィッティングソフトウェア(Table of Materials)で分析しました。 この図の拡大版をご覧になるには、ここをクリックしてください。
表1:試薬のストック濃度と最終濃度。 表をダウンロードするには、ここをクリックしてください。
ディスカッション
ここで紹介するプロトコルは、腸の生理学と腸疾患を調査するための生理学的に関連するモデルを説明しています。いくつかの研究グループは、2D単層16、19、20、21、22、23、24を含むウシエントロイド培養の生成について報告しています。単層の生成は技術的にそれほど難しいものではありませんが、成功する培養を一貫して発展させるためには、数分のステップが重要です。そのため、公表された文献で簡潔に説明されている方法を用いた2D単分子膜の再現性は、オルガノイド分野の初心者の研究者にとって困難な場合があります。本明細書に記載のプロトコールは、これらのプロトコールおよび他の種で公表されたプロトコールから採用されたものであり、再現性の高いトランズウェルインサート上の単分子膜生成のステップバイステップガイドを提供する。
本明細書で概説するプロトコールは、実験デザインまたは試薬の入手可能性の特定の目標に適合するように容易に変更することができる。実際、このプロトコルに従えば、他の出版物24に記載されているように、より低い細胞密度(例えば、2.5 x 104)で、またはFBSの非存在下で単層を播種することによって、成功した培養を達成することができる。ただし、これらのパラメータを変更すると、コンフルエント単分子膜を確立するために培養を増やす必要がある場合があります。そのため、免疫細胞との共培養など、研究デザインに不可欠な他の要因によって実験の特定の時間経過が決まる場合は、必要に応じて播種密度を変更することができます。3Dエンテロイドおよび2D単層を生成するためにこのプロトコルで使用されているものの代わりに、他の基底膜製剤を代用することができますが、これらには、最適な基底膜と媒体の比率を決定するためにいくつかの最適化が必要です。
上記の方法論におけるトランズウェルインサートの適用は、従来のプラスチック製品や3Dエンテロイド培養での単層成長よりも多くの利点があります。標準的な組織培養プレートと比較して、単層培養にトランズウェルを使用すると、腸陰窩に似た方法で細胞の分化と組織化が促進されます14,25。腸管上皮バリアは、毒素や微生物の体内への移動を防ぐと同時に、栄養素の吸収を促進するために不可欠です。そのため、腸のバリア完全性が健康な状態でどのように機能し、腸の障害中または化合物に反応して変化するかを理解することが重要です。3Dエンテロイド培養とは異なり、本明細書14,25で実証されているように、トランズウェル上の単層を結合し、TEERを測定すると、腸管バリアの完全性の客観的な評価が可能です。トランズウェル上に2D単分子膜を生成することで、免疫細胞や間質細胞などの適切な細胞タイプとの二重培養も可能になります。これにより、腸管細胞と組織微小環境の細胞との間の非常に重要なクロストークを特徴付けることができますが、これは3D培養では達成できません。単分子膜の頂端表面の曝露は、病原体や化合物への実験的曝露や管腔生成物の収集を可能にするだけでなく、腸内細菌叢や分子吸収または輸送生理学の調査など、腸の生理学や疾患の他の側面の研究も可能にします13。頂端と基底の腸表面を独立して制御できることは、3D腸内モデルに対する明確な利点です。
いくつかの試行錯誤を通じて、プロトコルの成功に貢献した重要なステップを特定しました。全腸組織サンプルは一晩冷蔵して翌日処理することができますが、組織解離と陰窩断片の分離ステップは、単離された陰窩画分の崩壊を防ぐために迅速に実行する必要があります。PBS洗浄が完了したら、洗浄培地でクリプトを遠心分離することで、ステップ2.3.10で詳述されているように、クリプトの故障を防ぐことができます。エンテロイドを継代したり、単層形成のために採取したりする場合は、エンテロイドをBMEドームから分離することが不可欠です。洗浄培地は、BMEの溶解を助けるために氷のように冷たくなければなりません。対照的に、予め温めたTrypLEを使用し、細胞懸濁液を2回ろ過することで、単層生成に必要な単一細胞を形成することができます。最後に、プレートを8の形に手動で操作すると、トランズウェルインサート上に単一セルを均一に分散させることができます。
このプロトコルの重要な制限は、2D単層が成熟したホルスタイン去勢牛(>2歳)から生成された腸内ストックから製造されたことです。子牛の成熟した消化管は、最適な結果を得るために、説明されているプロトコルにわずかな変更を必要とする場合があります。.牛の品種の腸生理機能における品種固有の違いは、文献26に記載されている。これらの違いがエンテロイドとその後の単層生成に影響を与えるかどうかは不明ですが、どのような違いがあったとしても、プロトコルにわずかな変更しかもたらさないと思われます。さらに、2D 培養モデルには固有の欠点がいくつかあります。3Dエンテロイドモデルと比較して、2D培養は腸組織構造と細胞の多様性のいくつかの側面を欠いている可能性があり、2D培養の伝播に関連する制限と課題を生み出す可能性があります13。それでも、研究は、いくつかの単層が予想される陰窩組織を模倣できることを示しており27、これらの制限のいくつかは、気液界面を持つ2D培養を確立することによって克服される可能性さえあります。それにもかかわらず、このモデルの限界を十分に考慮して、その適用が尋ねられている実験的問題に適しているかどうかを判断する必要があります。
このプロトコルはtranswellの挿入物の単層を形作るために牛のような回腸から得られるenteroidsを使用して牛のような胃腸管を模倣する最大限に活用された培養システムを記述する。このハイスループット培養システムは、感染症研究から創薬、再生医療まで幅広い用途があり、動物と人間の健康に相互に有益な予防・治療戦略の前例のない開発につながる可能性があります。
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言しています。
謝辞
私たちは、ミッドウェスタン大学の細胞分子コア施設の使用を認めます。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
参考文献
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, Academic Press. 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972(2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73(2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272(2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225(2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43(2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54(2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33(2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115(2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606(2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42(2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15(2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114(2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved