Method Article
Génération d’un système de culture monocouche bidimensionnelle primaire dérivé d’entéroïdes bovins pour des applications dans la recherche biomédicale translationnelle
Dans cet article
Résumé
Les entéroïdes sont en train de devenir un nouveau modèle pour l’étude de la physiologie et de la physiopathologie des tissus, le développement de médicaments et la médecine régénérative. Ici, nous décrivons un système de culture dérivé d’entéroïdes 2D de cellules primaires bovines qui permet la co-culture avec des types de cellules tissulaires pertinents. Ce modèle offre un avantage translationnel pour la modélisation de la recherche gastro-intestinale.
Résumé
Les systèmes de culture de cellules organoïdes peuvent récapituler la complexité observée dans les tissus, ce qui les rend utiles pour étudier les interactions hôte-pathogène, évaluer l’efficacité et la toxicité des médicaments et la bio-ingénierie tissulaire. Cependant, l’application de ces modèles pour les raisons décrites peut être limitée en raison de la nature tridimensionnelle (3D) de ces modèles. Par exemple, l’utilisation de systèmes de culture entéroïde 3D pour étudier les maladies digestives est difficile en raison de l’inaccessibilité de la lumière intestinale et de ses substances sécrétées. En effet, la stimulation d’organoïdes 3D avec des pathogènes nécessite soit une micro-injection luminale, soit une perturbation mécanique de la structure 3D, soit la génération d’entéroïdes apicaux. De plus, ces organoïdes ne peuvent pas être co-cultivés avec des cellules immunitaires et stromales, ce qui limite l’analyse mécanistique approfondie à la dynamique physiopathologique. Pour contourner ce problème, nous avons optimisé un système de culture monocouche dérivée d’entéroïdes bidimensionnels (2D) de cellules primaires bovines, permettant la co-culture avec d’autres types de cellules pertinentes. Des cryptes iléales isolées de bovins adultes en bonne santé ont été cultivées pour générer des organoïdes 3D qui ont été cryoconservés pour une utilisation future. Une monocouche 2D a été créée à l’aide d’entéroïdes 3D ressuscités qui ont été passés et perturbés pour produire des cellules uniques, qui ont été ensemencées sur des inserts de culture cellulaire transwell enrobés d’extrait de membrane basale, exposant ainsi leur surface apicale. La polarité de la monocouche intestinale, la différenciation cellulaire et la fonction barrière ont été caractérisées à l’aide de la microscopie d’immunofluorescence et de la mesure de la résistance électrique transépithéliale. La stimulation de la surface apicale de la monocouche a révélé la fonctionnalité attendue de la monocouche, comme le démontre la sécrétion de cytokines à partir des compartiments apical et basal. Le modèle 2D de monocouche dérivé d’entéroïdes décrit est très prometteur pour l’étude des interactions hôte-pathogène et de la physiologie intestinale, du développement de médicaments et de la médecine régénérative.
Introduction
Les modèles animaux dans la recherche jouent un rôle crucial dans l’amélioration de notre compréhension de la physiopathologie de la maladie et de la dynamique de la réponse immunitaire de l’hôte pendant l’infection et soutiennent le développement de nouvelles stratégies préventives et thérapeutiques 1,2,3,4. Ces modèles soutiennent la recherche, la découverte et l’avancement chez les animaux et sont essentiels à l’avancement de la recherche en santé humaine. Pendant des décennies, les modèles de rongeurs ont soutenu les progrès des mécanismes immunitaires et la recherche en biologie fondamentale pour les maladies humaines 3,5,6,7. Alors que les modèles de rongeurs sont essentiels dans la recherche sur le dépistage et le développement précoce, les modèles animaux de grande taille offrent une comparaison plus pertinente dans la recherche sur les maladies humaines dans les études de découverte précoce et de développement ultérieur, y compris les tests d’efficacité thérapeutique et d’innocuité 1,3,4,5. L’élevage offre des avantages évidents par rapport aux modèles de rongeurs pour une traduction plus efficace pour les applications humaines de certaines maladies, notamment la cryptosporidiose, la salmonellose, la tuberculose, le virus respiratoire syncytial et la brucellose 1,7,8. En effet, ces maladies et d’autres se développent spontanément chez les bovins, qui partagent plusieurs pathogènes et processus immunitaires analogues à ceux de l’homme, et en tant que population consanguine, les bovins imitent l’hétérogénéité génétique et environnementale influençant les réponses immunitaires humaines 5,8,9,10 . Les avantages des modèles bovins pour la recherche sur les maladies infectieuses peuvent être maximisés en utilisant d’abord un système de culture sophistiqué, puis en mettant en œuvre des études in vivo par étapes. L’utilisation initiale d’un système d’élevage bovin très complexe peut réduire considérablement le nombre d’études sur des animaux vivants tout en améliorant les chances de succès de la recherche translationnelle et appliquée. Les modèles de culture doivent récapituler les processus de la maladie au niveau de l’organe pour une validité prédictive optimale, en conservant le microenvironnement tissulaire natif dans l’espace et sur le plan fonctionnel.
La réponse immunitaire muqueuse est un système à multiples facettes composé d’une barrière très efficace formée d’entérocytes gastro-intestinaux et de diverses populations de cellules immunitaires situées sous la surface de la muqueuse11. Ce système très complexe est essentiel pendant l’infection pour maintenir l’homéostasie gastro-intestinale et initier les défenses immunitaires contre les agents pathogènes entériques11. La communication entre les entérocytes et les cellules immunitaires innées sous-jacentes initie le développement de réponses immunitaires protectrices contre les micro-organismes pathogènes. À ce titre, des systèmes de culture dont le niveau de complexité est comparable sont nécessaires pour une étude optimale des interactions hôte-pathogène entérique et sont très efficaces pour comprendre la physiologie entérique et la découverte et le développement de médicaments12,13. Les organoïdes sont un système de culture robuste qui ressemble à l’architecture et à la fonction du tissu d’origine14,15. La multicellularité de ces modèles permet d’étudier le rôle de diverses populations cellulaires et les interactions cellulaires impliquées dans la santé et la maladie entériques12,14. Cependant, les modèles d’organoïdes d’origine humaine dans la recherche sont actuellement limités par la difficulté d’obtenir une quantité suffisante et une qualité constante de cellules épithéliales intestinales humaines et la viabilité cellulaire limitée en culture. Les lignées cellulaires immortalisées peuvent être utilisées pour obtenir des rendements élevés de cultures homologues dans ces modèles de manière cohérente ; Cependant, les cellules transformées n’ont pas la diversité et la complexité fonctionnelle des cellules épithéliales non transformées16,17. Les avantages de l’utilisation de cultures dérivées de tissus bovins comme modèle pour l’étude des maladies gastro-intestinales et de la physiologie comprennent la facilité avec laquelle des échantillons de tissus peuvent être obtenus de manière cohérente à partir de donneurs sains, l’amélioration de la viabilité cellulaire et une plus grande diversité cellulaire qui ne peut être obtenue qu’avec des tissus non immortalisés. La transcriptomique comparative des tissus et la caractérisation des organoïdes intestinaux révèlent des similitudes dans les gènes orthologues conservés et les potentiels cellulaires entre les humains et les bovins18. Par conséquent, un système de culture dérivé d’organoïdes bovins peut être avantageux dans l’étude des maladies intestinales humaines, avec des résultats facilement transposables à la médecine humaine.
Le protocole décrit ici détaille une plate-forme efficace pour évaluer les réponses de l’hôte aux agents pathogènes ou aux composés entériques et la physiologie intestinale à l’aide d’un système de culture de cellules primaires 2D dérivé d’entéroïdes bovins. Contrairement aux organoïdes 3D, les systèmes de culture 2D générés sur des inserts transwell permettent une double culture de cellules intestinales avec des cellules immunitaires ou stromales, ce qui permet d’étudier la dynamique au niveau des tissus. Avec des applications dans la recherche biomédicale, le développement pharmaceutique et les tests d’efficacité, ce modèle physiologiquement pertinent peut être bénéfique pour la santé et l’avancement des bovins et des humains.
Protocole
Tous les protocoles ont été mis en œuvre conformément aux directives et réglementations institutionnelles et nationales en matière de bien-être animal.
1. Préparation des réactifs
NOTA : Le stock et les concentrations finales des réactifs utilisés dans cette étude sont indiqués dans le tableau 1.
- Préparer le tampon de prélèvement de l’échantillon : Mélanger 1 L de solution saline tamponnée au phosphate (PBS) glacée contenant de la pénicilline (100 U/mL), de la streptomycine (100 μg/mL), de la gentamicine (25 μg/mL) et de la caspofungine (2,5 μg/mL). Conserver la solution mère à 4 °C.
- Préparer le réactif de dissociation #1 : Mélanger 18,55 mL de tampon de prélèvement d’échantillon (comme décrit à l’étape 1.1), 1,422 mL d’acide éthylènediaminetétraacétique (EDTA, 0,422 M/pH 7,4), 20 μL de solution de 1,4-dithiothréitol (DTT) à 1 M, 4 μL de solution Y-27632 (5000x/50 mM). Conserver la solution à 4 °C.
- Préparer le réactif de dissociation #2 : Mélanger 18,57 mL de tampon de collecte (comme décrit à l’étape 1.1), 1,422 mL d’EDTA (0,422 M/pH 7,4), 4 μL de solution Y-27632 (5000x/50 mM). Conserver la solution à 37 °C.
- Préparer le substrat de croissance entéroïde : Mélanger 9,875 mL de milieu de croissance organoïde et un supplément, 100 μL de pénicilline (100 U/mL), de streptomycine (100 μg/mL), 5 μL de gentamicine (25 μg/mL) et 20 μL de caspofungine (2,5 μg/mL). Conserver la solution à 4 °C.
- Préparer le milieu de différenciation entéroïde : Mélanger 10 mL de milieu de différenciation organoïde et supplément, 100 μL de pénicilline (100 U/mL), de streptomycine (100 μg/mL), 5 μL de gentamicine (25 μg/mL) et 20 μL de caspofungine (2,5 μg/mL). Conserver la solution à -20 °C.
- Préparer le produit de lavage : Mélanger 48,45 mL de DMEM/F-12 1,1 moyen (avec de la L-glutamine, sans HEPES), 1 mL de supplément B-27 sans vitamine A (50x stock), 500 μL de pénicilline (100 U/mL), de streptomycine (100 μg/mL), 25 μL de gentamicine (50 mg/mL de bouillon) et 25 μL de caspofungine (5 mg/mL de bouillon). Conserver la solution à 4 °C.
- Préparer le tampon d’enrobage : Mélanger 25 mL de DMEM : milieu complet F12 sans inhibiteurs et 25 mg d’albumine sérique bovine (BSA). Conserver la solution à 4 °C.
2. Isolement des cryptes intestinales à partir de tissus entiers (Figure 1)
NOTA : Les entéroïdes de l’intestin grêle bovin ont été générés à partir de tissu iléal obtenu à partir de bouvillons Holstein adultes en bonne santé (âgés de >2 ans) provenant d’une usine locale de transformation du bœuf. Un donneur a été utilisé pour cette série d’expériences.
- Préparation d’échantillons de tissus intestinaux
- Placer les échantillons de tissus intestinaux prélevés de ~10 pouces (25 cm) dans ~400 mL de tampon de collecte glacé (antibiotiques/antimycosiques PBS+) et sur de la glace pour le transport au laboratoire.
- À l’aide de ciseaux chirurgicaux (p. ex., ciseaux mayonnaise) et de pinces (p. ex., pinces adson), retirez l’excès de graisse et le mésentère de l’échantillon de tissu intestinal.
- Coupez le tissu en deux morceaux égaux.
- Ouvrez le tissu longitudinalement avec des ciseaux chirurgicaux et rincez-le dans du PBS stérile.
- Retirez délicatement la couche de mucus de l’échantillon intestinal à l’aide du côté d’une lame de microscope en verre stérile et rincez le tissu avec du PBS frais.
REMARQUE : Cette étape permet d’éliminer les villosités et d’augmenter la pureté des fractions de la crypte dans les étapes suivantes. - Pour chaque morceau de 5 pouces (13 cm), coupez le tissu en deux morceaux de 2,5 pouces (6,5 cm), puis coupez chaque morceau en 4 petits morceaux à peu près égaux pour faciliter la dissociation des tissus.
- Dissociation du tissu intestinal
- Préparez un volume de 20 mL du réactif de dissociation tissulaire #1 dans un tube conique stérile de 50 mL et déposez les petits échantillons de tissu dans le tube conique jusqu’à ce que le déplacement de volume déplace le ménisque de la marque de 20 mL à la marque de 35 mL sur le tube conique.
- Répétez l’étape ci-dessus pour les échantillons de tissu de l’intestin grêle restants.
- Scellez les tubes coniques avec du parafilm et secouez manuellement le tube conique 10 fois.
REMARQUE : Tout au long du protocole, l’agitation manuelle doit être effectuée de manière délibérée mais douce. - Placez les tubes coniques horizontalement sur de la glace dans un récipient sur une plate-forme vibrante orbitale.
- Agiter les tubes coniques sur de la glace dans le récipient pendant 30 min à 80 tours par minute (tr/min). Toutes les 10 minutes, secouez manuellement le tube conique.
- Préparer un volume de 20 mL de réactif de dissociation tissulaire préchauffé (37 °C) #2 (formulé comme ci-dessus, mais sans DTT) dans un tube conique de 50 mL. Déposez les échantillons de tissus des tubes coniques contenant le réactif de dissociation #1 dans les tubes coniques contenant le réactif de dissociation #2.
- Scellez les tubes coniques avec du parafilm et secouez manuellement les tubes coniques 10 fois.
- Placer les tubes coniques dans un bain-marie préchauffé (37 °C), incliné à un angle d’environ 60 °C, et agiter à 150 tr/min pendant 10 min, avec agitation manuelle après 5 min et à nouveau après l’incubation totale de 10 min.
- Isolement de fragments de crypte
- Étiqueter 10 tubes coniques stériles #1 - #10. Ajouter 20 mL de PBS stérile glacé dans chaque tube conique étiqueté.
- Transférez les morceaux de tissu des tubes coniques contenant le réactif de dissociation #2 dans un nouveau tube conique stérile de 50 ml contenant du PBS #1 glacé.
- Secouez manuellement les tubes coniques 10 fois.
- Scellez les tubes coniques avec du parafilm et placez-les horizontalement sur de la glace. Agiter les tubes coniques sur un agitateur orbital pendant 10 min à 80 tr/min. Après 10 min, agiter manuellement le tube conique #1 10 fois. Ceci est considéré comme Wash #1.
- Transférez délicatement les échantillons de tissu à l’aide d’une paire de pinces chirurgicales dans le tube conique #2.
- Répétez les étapes 2.3.2 à 2.3.4, c’est considéré comme le lavage #2.
- Répétez les lavages jusqu’au lavage #10.
- Les surnageants de chaque lavage contiennent les cryptes qui seront utilisées pour la génération d’entéroïdes. Conservez les tubes contenant les surnageants à 4 °C jusqu’à ce que les 10 lavages soient terminés.
- Une fois le 10elavage terminé et la section de tissu jetée, centrifuger les surnageants des tubes coniques #6-#10 à 400 x g pendant 2 min à 4 °C pour granuler les cryptes isolées.
REMARQUE : Les lavages 6 à 10 contiennent les fractions les plus propres des cryptes intactes avec un nombre limité de débris et de cellules individuelles. En tant que tel, il est recommandé que seules ces fractions soient utilisées pour la génération d’entéroïdes, et que les lavages antérieurs (#2-#5) soient ignorés) - Jeter le surnageant et ajouter 4 mL de PBS frais et glacé dans les cryptes sans remise en suspension (cela aide à garder les fragments intacts jusqu’à la microscopie).
- Évaluer la pureté des cryptes dissociées pour chaque tube conique #6-#10 par microscopie.
- Ajouter 50 μL de PBS à une plaque de 384 puits.
- Ajoutez 10 μL de suspension de crypte au PBS et utilisez une lentille d’objectif à grossissement de 40x pour déterminer la pureté, l’intégrité et le nombre de cryptes.
REMARQUE : Dessiner une croix sur le fond de la plaque facilite le comptage.
3. Génération ex vivo et passage des entéroïdes iléaux bovins (Figure 2)
REMARQUE : Les cryptes des tubes coniques avec les cryptes intestinales les plus pures et intactes seront utilisées pour les essais en aval. Pour toutes les étapes qui impliquent des cryptes et des entéroïdes, les pointes de pipette, les grattoirs de cellules et les tubes doivent être pré-enduits avec le tampon de revêtement, et les bulles doivent être évitées pour éviter la perte de cryptes. Sauf indication contraire, une pointe de pipette de 1000 μL doit être utilisée pour éviter de briser les fragments de crypte.
- Génération d’entéroïdes à partir de fragments de crypte
- Combinez les fractions de crypte les plus pures (généralement #6-#10) dans un tube conique.
- Centrifuger le tube conique contenant les cryptes à 400 x g pendant 2 min à 4 °C.
- Éliminez le surnageant en l’aspirant à l’aide d’une pipette et remettez en suspension la pastille de crypte dans un milieu de lavage.
- Centrifugeuse comme à l’étape 3.1.2. Décanter le surnageant et ajouter 2 mL de Wash Media à la pastille de crypte.
- Comptez le nombre de cryptes comme décrit à l’étape 2.3.11.1.
- Centrifuger comme à l’étape 3.1.2 pour granuler les cryptes, éliminer le surnageant et remettre en suspension dans une matrice extracellulaire (BME) de membrane basale à facteur de croissance réduit à 100 % pour obtenir une concentration d’environ 400 cryptes/100 μL.
REMARQUE : il est important de décongeler correctement le BME à 4 °C car les changements de température altèrent sa consistance. Le BME peut être empêché de se solidifier prématurément à l’aide d’un bloc de refroidissement et d’embouts de pipette pré-refroidis.- L’utilisation d’une autre formulation de matrice de membrane basale peut nécessiter une dilution du BME lors de la création de dômes. Reportez-vous aux instructions du fabricant spécifiques au BME utilisé.
- Pipetez de haut en bas pour bien suspendre les cryptes dans le BME.
- Fabriquez des dômes crypte-BME en pipetant lentement 50 μL de suspension crypte-BME sur une plaque de culture tissulaire à 6 puits sur une plaque chauffante réglée à 37 °C avec jusqu’à 8 dômes/puits.
REMARQUE : La plaque à 6 puits doit être préchauffée dans un incubateur à 37 °C pendant la nuit avant le placage des dômes. - Conservez la plaque à 6 puits sur la plaque chauffante pendant 1 minute avant de la déplacer avec précaution dans un incubateur à 37 °C, 5 % de CO2 .
- Après 2 minutes, retournez la plaque à 6 puits de manière à ce que le couvercle soit orienté vers le bas et incubez pendant 30 minutes supplémentaires pour permettre aux dômes de polymériser.
- Après 30 minutes, ajouter délicatement 3 mL de milieu de croissance entéroïde à température ambiante (RT) complété par 10 μM SB202190, 0,5 μM LY2157299 et 10 μM Y-27632 dans les puits contenant des dômes.
- Incuber à 37 °C, 5 % de CO2.
- Retirez le milieu et remplacez-le par un milieu de croissance entéroïde frais complété par des inhibiteurs tous les 2 à 3 jours.
- Passage d’entéroïdes
- Après 7 à 10 jours, assurez-vous que les cryptes ont formé des entéroïdes 3D avec de nombreuses structures bourgeonnantes, comme dans la figure 2E, et qu’elles sont prêtes à être traversées.
- Jetez les milieux des puits contenant des dômes.
- Pour chaque tranche de 4 dômes par puits, ajouter 1 mL de solution glacée de dissociation cellulaire non enzymatique additionnée de 10 μM Y-27632 à chaque dôme contenant un puits.
- À l’aide d’un grattoir cellulaire pré-enduit, détachez délicatement le dôme de la plaque de culture tissulaire.
- Prélever les entéroïdes dans un tube conique de 15 mL et triturer en pipetant 10 fois de haut en bas.
- Incuber le tube conique contenant les entéroïdes fragmentés à RT sur un agitateur orbital à 80 tr/min pendant 10 min.
- Ajouter 10 mL de média de lavage glacé avec 10 μM Y -27632 aux entéroïdes.
- Centrifuger le tube conique à 300 x g pendant 5 min à RT.
- Jeter le surnageant et remettre la pastille en suspension dans 10 mL de média de lavage frais et transférer dans un nouveau tube conique de 15 mL.
- Centrifuger le tube conique à 300 x g pendant 5 min à RT.
- Jeter le surnageant et remettre la pastille en suspension dans 1 mL de milieu de croissance entéroïde dans un tube de microcentrifugation de 1,5 mL.
- Centrifuger le tube de microcentrifugation à 300 x g pendant 5 min à RT et jeter le surnageant.
- Remettre la pastille entéroïde en suspension dans du BME 100 % glacé et suivre les étapes 3.1.6 à 3.1.13.
- Entéroïdes de repassage tous les 7 jours. Les temps d’expansion peuvent varier en raison de la densité, de la viabilité et de l’étendue du bourgeonnement. De multiples structures bourgeonnantes créant de grandes structures entéroïdes indiquent que les entéroïdes doivent être traversés.
- Cryoconservation des entéroïdes
- Pour la cryoconservation, assurez-vous que les entéroïdes ne sont pas passés plus de cinq fois en culture.
NOTE : Cela n’a pas été testé expérimentalement et est basé sur l’observation des auteurs que les passages ultérieurs ont réduit la viabilité et donnent des résultats variables. - Pour récolter les entéroïdes, utilisez le tampon de dissociation comme décrit aux étapes 3.2.2 à 3.2.9.
REMARQUE : Dissocier mécaniquement les entéroïdes à l’aide d’une pipette de 5 ml. - Comptez le nombre de fragments d’entéroïdes comme décrit à l’étape 2.3.11.1.
- Centrifuger le tube conique à 300 x g pendant 5 min à RT.
- Jeter le surnageant et remettre en suspension les fragments entéroïdes dans des milieux de cryoconservation complétés par 10 μM Y-27632 pour obtenir une concentration de ~2000 fragments entéroïdes/mL et aliquote 1 mL dans des flacons cryogéniques pré-marqués.
- Placez les cryoflacons dans un récipient de congélation contrôlée et conservez-les à -80 °C pendant la nuit.
- Transférez les cryoflacons dans de l’azote liquide en phase vapeur pour un stockage à long terme.
- Pour la cryoconservation, assurez-vous que les entéroïdes ne sont pas passés plus de cinq fois en culture.
- Réanimation de fragments de cryptes intestinales
- Placez une plaque à 6 puits pendant la nuit à l’intérieur de l’incubateur.
- Enduire un tube de 5 mL avec 5 mL de média de revêtement.
- Retirez les cryoflacons du stockage de l’azote liquide.
- Immédiatement, une fois décongelés, transférer les cryptes du cryoflacon au tube pré-enrobé de 5 ml. Rincez le cryoflacon avec un média de lavage et ajoutez-le dans le tube de 5 ml. Évitez les bulles.
- Porter le volume jusqu’à 5 mL avec le produit de lavage et centrifuger à 400 x g pendant 5 min à 4 °C.
- Pendant la centrifugation, pré-enduire un tube de 1,5 mL d’un média de revêtement.
- Après la centrifugation, videz le surnageant, remettez la pastille en suspension dans le milieu restant dans le tube et transférez-la dans le tube pré-enrobé de 1,5 ml. Lavez le tube de 5 ml avec un média de lavage et transférez-le dans un tube de 1,5 ml. Centrifuger à 400 x g pendant 5 min à 4 °C.
- Porter le volume à 1,5 mL avec un milieu de croissance entéroïde.
- Centrifugez comme ci-dessus (étape 3.4.7) et aspirez avec précaution.
- Prendre du BME à partir de 4 °C et le placer sur de la glace/bloc de glace.
- Remettre la pastille entéroïde en suspension dans un BME 100 % glacé et suivre les étapes 3.1.6 à 3.1.12.
- Changez le support tous les 2-3 jours.
4. Génération et évaluation de monocouches 2D à partir d’entéroïdes 3D
REMARQUE : Comme ci-dessus, pour toutes les étapes impliquant des cryptes et des entéroïdes, les pointes de pipette, les grattoirs de cellules et les tubes doivent être pré-enduits avec le tampon de revêtement, et les bulles doivent être évitées pour éviter la perte de cryptes.
- Préparation d’inserts transwell pour la formation de monocouches 2D
- Placer les inserts dans une plaque adaptatrice de culture tissulaire à 24 puits et pré-enduire la face apicale des inserts de culture cellulaire PET à 24 puits de 1 μm avec 100 μL de dilution de 1 :15 de BME dans un milieu de croissance entéroïde. Enduisez toujours un insert supplémentaire qui servira de contrôle lors de la prise de mesures de l’intégrité de la barrière.
- Placez l’insert enrobé dans une plaque d’adaptation de culture tissulaire à 24 puits dans l’incubateur.
REMARQUE : Un adaptateur spécifique ou une plaque de culture tissulaire d’accompagnement doit être utilisé avec les inserts transwell. - Incuber les inserts de culture à 37 °C, 5% CO2 pendant 1 h pour permettre la polymérisation.
REMARQUE : Les transgogues revêtues de BME peuvent être scellées avec du parafilm et stockées à 4 °C jusqu’à 1 semaine si elles ne sont pas utilisées immédiatement. - À la fin de l’incubation, aspirer le milieu de culture entéroïde 3D.
- Dissociation des entéroïdes 3D
- Générer des monocouches d’entéroïdes 2D à partir de fragments d’entéroïdes cryoconservés qui ont été ressuscités, plaqués et cultivés comme décrit ci-dessus dans la section 3.1 pour former des entéroïdes 3D. Faire passer les entéroïdes décongelés au moins deux fois, le dernier passage étant cultivé pendant au moins 5 jours avant d’être traité pour générer des cultures monocouches 2D.
- Récolter les entéroïdes en ajoutant un milieu de lavage glacé additionné de 10 μM Y-27632 aux dômes entéroïdes (utiliser environ 1 mL de tampon de dissociation pour 4 dômes)
- Détachez les dômes à l’aide d’un racleur à cellules et collectez-les dans un tube conique de 15 ml.
- Triturer 30 fois à l’aide d’une pointe de pipette de 1 mL pour générer des fragments entéroïdes.
- Triturer 40 fois avec une pointe de pipette de 200 μL pour briser davantage les fragments entéroïdes.
- Porter le volume du tube conique de 15 mL contenant des fragments entéroïdes à 10 mL avec un média de lavage glacé.
- Centrifuger le tube conique à 300 x g pendant 5 min à RT.
- Aspirer le surnageant, y compris la couche BME, en prenant soin de ne pas perturber la pastille entéroïde.
REMARQUE : La couche BME apparaîtra comme une couche gélatineuse trouble juste au-dessus de la pastille. - Tous les 4 dômes, remettre la pastille en suspension dans 1 mL d’enzyme TrypLE express préchauffée complétée par 10 μM de Y-27632.
- Ajouter le mélange entéroïde-trypLE dans une plaque à 24 puits et incuber à 37 °C, 5 % de CO2 pendant 10 min.
- Après 10 minutes, pipeter le mélange entéroïde-trypLE 40 fois à l’aide d’une pipette de 1 mL pour fragmenter davantage les entéroïdes.
- Ensuite, pipetez les fragments 40 fois avec une pipette de 200 μL pour les diviser en cellules individuelles.
- À l’aide d’une seringue de 3 ml ou de 5 ml munie d’une aiguille stérile de 22 g, aspirez et distribuez la suspension cellulaire 4 fois pour obtenir une suspension unicellulaire.
- Surveiller la dissociation cellulaire par microscopie comme décrit à l’étape 2.3.11.1, jusqu’à ce que 80 % des entéroïdes soient décomposés en cellules individuelles.
- Recueillir la suspension cellulaire dans un tube conique de 15 ml et éteindre la réaction enzymatique en ajoutant 4 fois le volume de Wash Media complété par 10 % de FBS.
- Filtrer deux fois les entéroïdes à travers une crépine de cellules pré-enrobée de 40 μm dans un tube conique de 50 ml.
- Granuler les cellules individuelles en centrifugeant le tube conique à 300 x g pendant 5 min.
- Semis monocouche 2D sur inserts transwell.
- Décanter le surnageant et remettre la pastille en suspension dans un petit volume (~600 μL) de milieu de croissance organoïde complété par 20 % de sérum de veau fœtal (FBS) à RT.
- Déterminez la densité et la viabilité des cellules entéroïdes à l’aide de la méthode d’exclusion du colorant bleu trypan, de l’hémacytomètre ou du compteur cellulaire automatisé. Une viabilité moyenne de 75 % est attendue.
- Retirez soigneusement l’excès de solution d’enrobage appliquée à l’étape 1.3 de l’insert de culture cellulaire juste avant l’ensemencement des cellules.
- Ensemencer les cellules individuelles à raison de 1 x 105 cellules dans un volume de 200 μL par insert sur la surface apicale d’un insert de culture cellulaire pré-enrobé.
- Ajouter 700 μL de milieu complet complété par 20 % de FBS sur le côté basolatéral de l’insert de culture cellulaire.
- Manœuvrez la plaque 10 fois en forme de chiffre 8 pour permettre aux cellules de se répartir uniformément sur l’insert.
- Conservez la plaque sur le chauffe-assiette pendant 10 minutes dans l’enceinte de sécurité biologique.
- Incuber la plaque à 37 °C et 5% de CO2.
- Après 48 h, remplacer les milieux des compartiments apical et basal par des milieux de croissance entéroïdes frais supplémentés en FBS à 20 % et en inhibiteurs.
- Le troisième jour, retirez le milieu des compartiments apical et basolatéral, lavez soigneusement l’insert avec 1x PBS et remplacez-le par un milieu de différenciation entéroïde complété par des inhibiteurs uniquement.
- Changez le support dans les deux compartiments tous les 2-3 jours.
- Mesure quantitative de l’intégrité de la barrière épithéliale et de la confluence des monocouches
REMARQUE : L’intégrité de la barrière peut être évaluée à l’aide d’un voltohmmètre épithélial pour mesurer la résistance électrique transépithéliale (TEER).- Retirez la plaque de culture transwell de l’incubateur et laissez-la s’équilibrer à RT pendant quelques minutes dans l’enceinte de sécurité biologique.
- Assurez-vous que les électrodes STX2 ont été pré-conditionnées et que le voltohmmètre a été calibré à 1000Ω selon les instructions du fabricant.
- Insérez le long bâton de la sonde dans le compartiment basolatéral et l’extrémité courte dans le compartiment apical de la culture de cellules épithéliales transwell. Veillez à ne pas perturber la monocouche ou à ne pas endommager l’insert.
- Une fois la stabilité établie, consigner 3 mesures TEER par insert de transwell, y compris l’insert sans cellules. Faites la moyenne des mesures pour chaque insert.
- Calculer la valeur corrigée de l’ETER en soustrayant la mesure moyenne du puits blanc des mesures moyennes des puits expérimentaux, puis en la multipliant par la surface de l’insert pour déterminer la résistance de la barrière épithéliale (TEER [Ω,cm2] = [couche Rcell - Rblank] × Aire).
Résultats
La première étape de la génération de monocouches dérivées d’entéroïdes 2D consiste à préparer la section de tissu intestinal prélevée (Figure 1A) pour la dissociation tissulaire. Pour ce faire, on enlève la graisse attachée et le mésentère du tissu (Figure 1B), puis on coupe le tissu longitudinalement pour exposer la surface de la lumière afin que la couche de mucus de l’intestin puisse être éliminée par un grattage doux à l’aide d’une lame de verre. La section intestinale prélevée est ensuite découpée en sections de tissu de plus en plus petites (Figure 1C) pour faciliter la dissociation. Les cryptes sont ensuite dissociées du tissu sous-muqueux sous-jacent à l’aide d’une série de lavages constitués de tampons de chélation (Figure 1D, E) et de PBS. Les cryptes intestinales isolées (Figure 1F) sont ensuite intégrées dans des dômes de matrice membranaire basale (Figure 2A) et cultivées pendant plusieurs jours pour générer des entéroïdes 3D. À partir d’une section de 10 pouces d’iléon bovin, environ 900 000 cryptes peuvent être isolées et utilisées pour la formation d’entéroïdes. Après seulement quelques heures de culture, les cryptes plaquées commencent à s’allonger et à se développer en entérosphères (figure 2B). Après 2 jours, une lumière bien définie peut être observée (Figure 2C), avec des structures bourgeonnantes notées dès le jour 4 en culture (Figure 2D). Au jour 7, des entéroïdes matures se sont développés (figure 2E). La coloration par immunofluorescence d’un entéroïde 3D âgé de 7 jours démontre la présence de différentes lignées cellulaires. La microscopie confocale des entéroïdes montre la localisation de la coloration nucléaire DAPI, de la protéine E-cadhérine à la jonction adhérente, de la coloration de la chromogranine-A (Chr-A) montrant la présence de cellules entéroendocrines, du lysozyme (LYZ) démontrant des cellules de Paneth et de la cytokératine-18 (CK-18) représentant les cellules entérocytaires dans la figure 3. Après 7 à 10 jours de culture, les entéroïdes doivent être passés pour permettre une expansion supplémentaire et éviter la surpopulation. Le temps optimal pour le passage des entéroïdes a été déterminé comme étant de 7 à 10 jours après l’isolement initial de la crypte primaire et dépend en fin de compte de la santé et du taux de croissance des entéroïdes en culture. La densité de semis optimale pour obtenir la morphologie et la viabilité des entéroïdes souhaitées, comme le montre la figure 2E, est de 400 cryptes par dôme. Les entéroïdes peuvent facilement être cryoconservés, et les fragments d’entéroïdes décongelés se rétablissent complètement pour une utilisation expérimentale après deux passages après la décongélation. Notamment, au moins deux passages de la culture primaire de la crypte sont recommandés avant la cryoconservation.
Afin de produire une monocouche dérivée d’entéroïdes 2D, les entéroïdes 3D sont récoltés et, au cours d’une série d’étapes, sont triturés mécaniquement en présence d’une solution de dissociation (Figure 4A) en cellules individuelles. Ces cellules individuelles peuvent ensuite être ensemencées sur un insert transwell qui a été pré-enrobé d’une solution de milieu de culture matricielle à membrane basale. En moyenne, quatre puits peuvent être ensemencés à partir de quatre dômes entéroïdes 3D. Le nombre d’entéroïdes 3D traités dépend donc du nombre de transpuits nécessaires à l’expérience. Le placage de cellules individuelles à une densité de semis de 1 x 105 et leur culture initiale en présence de 20 % de FBS (Figure 4B-D) peuvent générer une monocouche confluente en moins d’une semaine. La confluence progressive de la monocouche 2D en culture peut être surveillée au fil du temps à l’aide de la microscopie optique (Figure 4E,F). Les mesures de la résistance électrique transépithéliale (TEER) peuvent confirmer la confluence et caractériser l’intégrité de la barrière épithéliale au fil du temps et en réponse à une stimulation expérimentale (Figure 5A). En moyenne, après sept jours de culture, une monocouche confluente à environ 100 % aura une valeur TEER correspondante de ~1500 Ω·cm2. Une évaluation longitudinale des valeurs TEER monocouches entéroïdes 2D montre une augmentation constante des valeurs TEER sur sept jours, atteignant une valeur moyenne maximale de 1546 Ω·cm2 avant de diminuer avec la valeur la plus basse de 11,5 Ω·cm2 obtenue au douzième jour (Figure 5B). Le marquage immunofluorescent des monocouches différenciées indique que des feuillets épithéliaux intestinaux intacts, organisés et polarisés sont formés à l’aide de ce protocole (Figure 6). La microscopie confocale de la monocouche 2D colorée montre la localisation de la coloration nucléaire DAPI, de l’E-cadhérine et de la F-actine (Figure 6A-D). La microscopie à fluorescence de la monocouche 2D montre des caractéristiques de cellules épithéliales intestinales différenciées avec une coloration à la chromogranine-A (Chr-A) montrant la présence de cellules entéroendocrines, de lysozyme (LYZ) démontrant des cellules de Paneth et de cytokératine-18 (CK-18) indiquant des lignées de cellules entérocytes (Figure 6E-L). La modélisation de la pile Z montre la polarisation attendue de la culture monocouche 2D avec dépôt caractéristique de F-actine que l’on retrouve dans les microvillosités recouvrant la face apicale des entérocytes différenciés et de l’E-cadhérine, une protéine située au niveau des jonctions adhérentes intercalées entre les cellules épithéliales (Figure 6M).
La fonctionnalité de la monocouche peut être évaluée par stimulation apicale avec divers composants, y compris des ligands ou des agents pathogènes du récepteur de type Toll (TLR), suivie d’une quantification cytokinique des surnageants de cultures cellulaires récoltés dans les compartiments apical et basal. En effet, lorsque l’aspect apical de la monocouche est stimulé pendant 24 h avec l’agoniste TLR 1/2 Pam3csk4 au jour 4 de culture, une augmentation de la production de cytokines dans les deux compartiments est observée par rapport aux monocouches non traitées (Figure 7A,B).
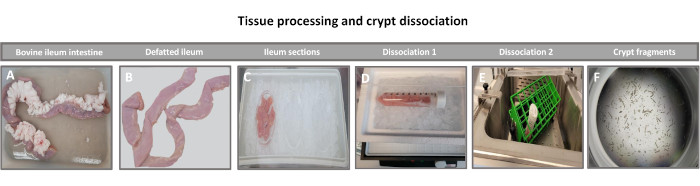
Figure 1 : Isolement d’une crypte intestinale bovine à partir de bovins adultes en bonne santé. Images illustrant le traitement tissulaire de (A) l’iléon entier de bovins adultes, (B) l’iléon dégraissé, (C) l’iléon sectionné en morceaux de 2,5 pouces (6,3 cm) dans le PBS sur glace, (D) les coupes de tissu iléal dans le tampon de dissociation #1 à 4 °C, et (E) dans le tampon de dissociation 2 dans un bain-marie agité à 37 °C, et (F) les fragments isolés de la crypte iléale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
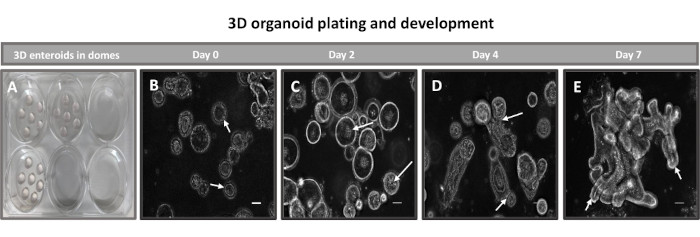
Figure 2 : Développement de l’entéroïde iléal 3D primaire bovin dans la matrice membranaire basale. Images représentatives des dômes entéroïdes 3D (A) créés dans une plaque de culture tissulaire à 6 puits et du développement des entéroïdes 3D (B-E) des jours 0, 2, 4 et 7 en culture. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
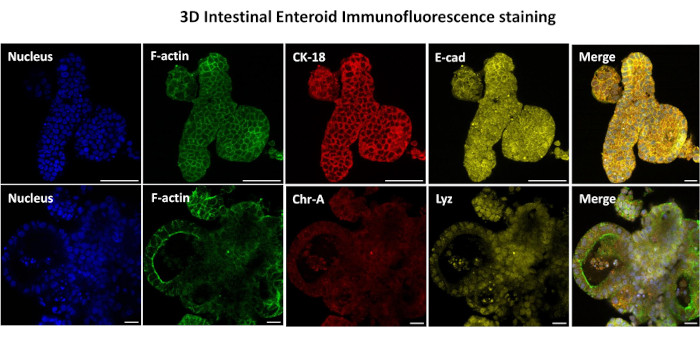
Figure 3 : Les entéroïdes intestinaux tridimensionnels montrent la coloration de la lignée cellulaire épithéliale. Des images représentatives d’entéroïdes 3D après 7 jours de culture démontrent la présence de colorants nucléaires, de F-actine, de cytokératine-18 (CK-18), de chromogranine-A (Chr-A), d’écadhérine (E-cad), de lysozyme (Lyz) et de superposition d’images (Merge). Barre d’échelle 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
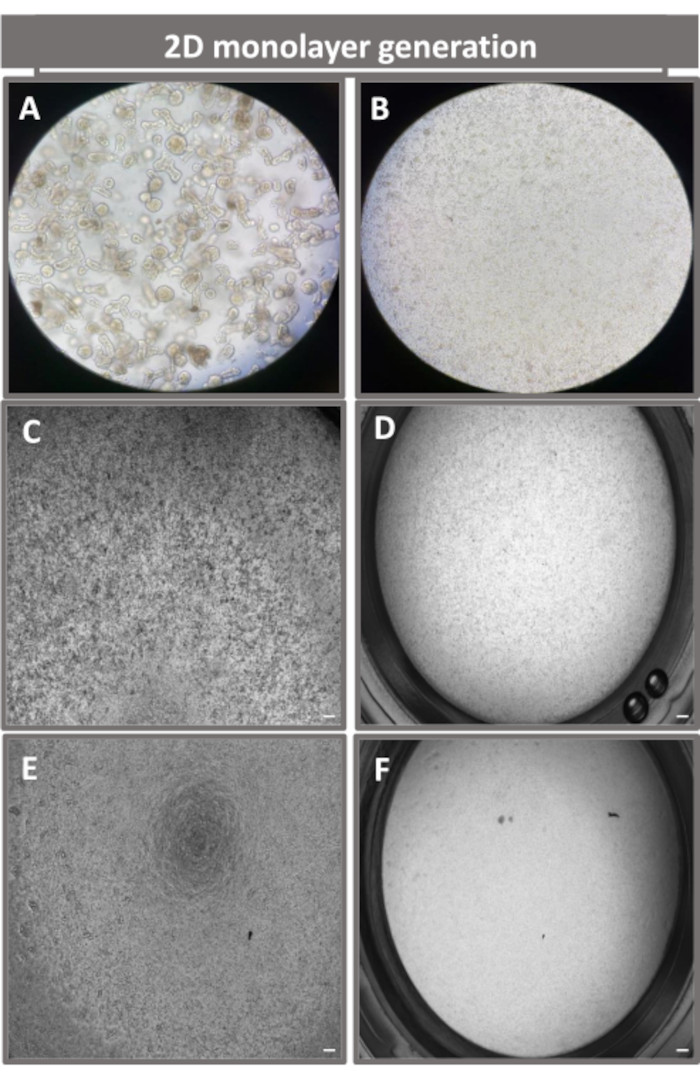
Figure 4 : Mise en place d’une monocouche dérivée d’entéroïdes 2D à partir d’entéroïdes iléaux. Images représentatives de (A) fragments d’entéroïdes 3D en solution de dissociation en vue de l’ensemencement monocouche, de cellules uniques plaquées sur un insert de transwell à une densité de semis de 1 x 105 imagées le jour 0 à l’aide de la lumière (B), (C) du contraste de phase et (D) de la microscopie à fond clair, et du développement de monocouches sur des inserts de transwell imagés le cinquième jour à l’aide d’un contraste de phase (E) et d’un contraste de phase (F) microscopie à fond clair. Grossissement 40x et barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
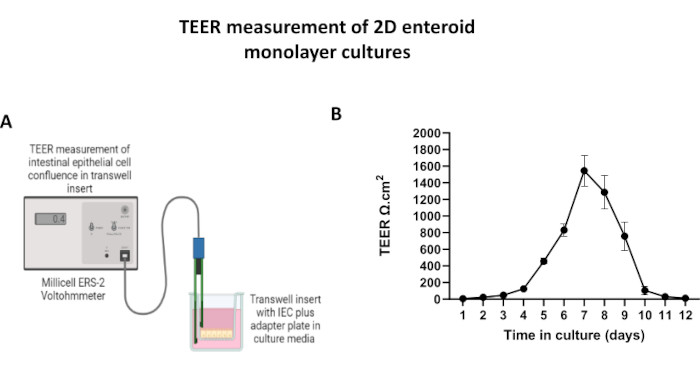
Figure 5 : Mesures de la résistance électrique transépithéliale (TEER) de la monocouche dérivée d’entéroïdes 2D sur des inserts transwell. (A) Diagramme schématique de la façon dont les mesures TEER de la monocouche de cellules épithéliales intestinales (CEI) 2D sont obtenues à l’aide des électrodes à baguette STX2 d’un voltohmmètre, (B) Suivi longitudinal des mesures TEER monocouches 2D sur 12 jours en culture cellulaire. Chaque point de données représente une valeur TEER moyenne et une erreur-type de la moyenne (SEM) obtenues à partir de deux répétitions techniques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
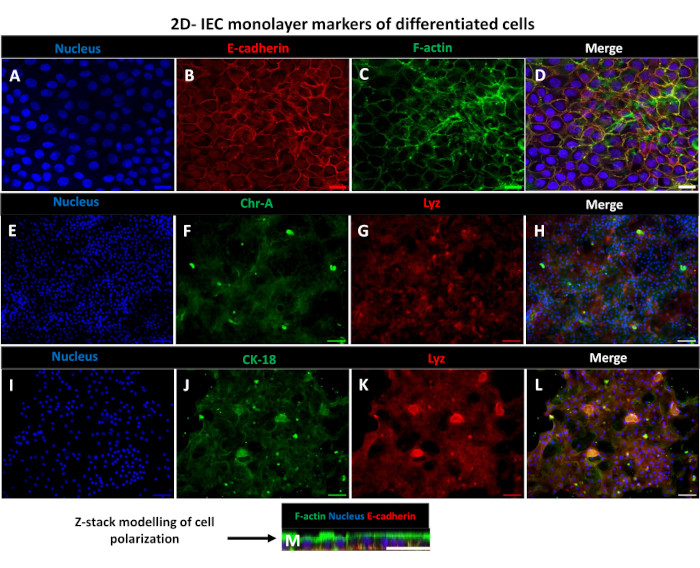
Figure 6 : Des monocouches dérivées d’entéroïdes 2D différenciés sur des inserts transwell se développent en feuillets épithéliaux intestinaux polarisés. (A-M) Images immunofluorescentes représentatives d’une monocouche dérivée d’un entéroïde 2D sur un insert transwell après 5 jours de culture montrant le noyau (A) (bleu), (B) l’E-cadhérine (rouge), (C) la F-actine (vert) et (D) la superposition des 3 images (fusion), (E,I) la coloration nucléaire, (F) la chromogranine-A, (J) la cytokératine-18, (G,K) le lysozyme et (H,L) la fusion d’images. (M) Modélisation de la pile Z montrant la distribution des mêmes protéines marqueurs des cellules épithéliales de la feuille monocouche 2D. Les images ont été obtenues à partir de 2 répétitions biologiques. Barre d’échelle = 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
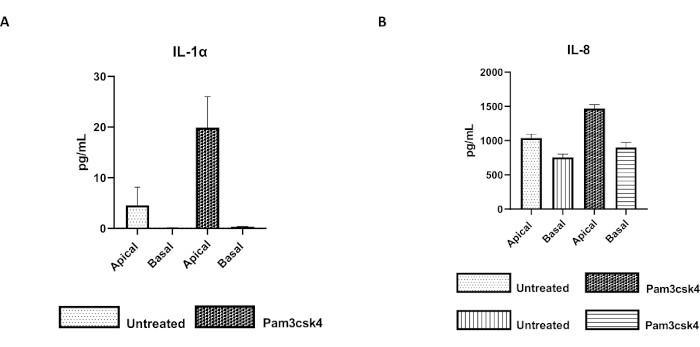
Figure 7 : Les monocouches primaires bovines dérivées d’entéroïdes 2D sur les inserts transwell sont fonctionnellement actives. Sécrétion de cytokines surnageantes de culture cellulaire apicale et basale de (A) IL-1α et (B) IL-8 par des monocouches 2D sur des inserts transwell après 5 jours de culture non traités ou stimulés avec Pam3csk4 pendant 24 h. Les données sont représentatives des niveaux moyens de cytokines et du MEB des monocouches dérivées de stocks congelés de cryptes provenant d’un animal et de trois expériences indépendantes. Les cytokines ont été quantifiées à l’aide du test multiplex à base de billes (Table of Materials) selon les instructions du fabricant et analysées sur une unité de multiplexage compacte (Table of Materials) et un logiciel d’ajustement de courbe d’immunodosage (Table of Materials). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Le stock et les concentrations finales des réactifs. Veuillez cliquer ici pour télécharger le tableau.
Discussion
Le protocole présenté ici décrit un modèle physiologiquement pertinent pour l’étude de la physiologie intestinale et des troubles entériques. Plusieurs groupes de recherche ont décrit la génération de cultures entéroïdes bovines, y compris les monocouches 2D 16,19,20,21,22,23,24. Bien que la génération de monocouches ne soit pas ouvertement difficile sur le plan technique, des étapes de plusieurs minutes sont essentielles pour développer des cultures réussies de manière cohérente. En tant que tel, la reproductibilité des monocouches 2D à l’aide des méthodes brièvement décrites dans la littérature publiée peut être difficile à entreprendre pour un chercheur novice dans le domaine des organoïdes. Le protocole décrit ici est adapté de ces protocoles et de ceux publiés chez d’autres espèces, fournissant un guide étape par étape pour la génération de monocouches sur des inserts transwell qui est hautement reproductible.
Le protocole décrit ici peut facilement être modifié pour s’adapter aux objectifs spécifiques de la conception expérimentale ou à la disponibilité des réactifs. En effet, en suivant ce protocole, des cultures réussies peuvent être obtenues en ensemençant des monocouches à une densité cellulaire plus faible (par exemple, 2,5 x 104) ou en l’absence de FBS, comme décrit par d’autres publications24. Cependant, la modification de ces paramètres peut nécessiter une culture accrue pour établir une monocouche confluente. Ainsi, si d’autres facteurs faisant partie intégrante de la conception de l’étude, y compris la co-culture avec des cellules immunitaires, dictent un déroulement précis de l’expérience, la densité d’ensemencement peut être modifiée au besoin. Bien que d’autres formulations de membranes basales puissent être substituées à celle utilisée dans ce protocole pour générer des entéroïdes 3D et des monocouches 2D, celles-ci nécessiteront une certaine optimisation pour déterminer le rapport optimal entre la membrane basale et le média.
L’application d’inserts transwell dans la méthodologie décrite présente de nombreux avantages par rapport à la croissance monocouche sur les cultures d’entéroïdes et d’objets plastiques conventionnels et 3D. Par rapport aux plaques de culture tissulaire standard, l’utilisation de transpuits pour les cultures monocouches favorise la différenciation et l’organisation cellulaires d’une manière qui conserve l’apparence des cryptes intestinales14,25. La barrière épithéliale intestinale est essentielle pour empêcher la translocation des toxines et des micro-organismes dans l’organisme tout en facilitant l’absorption des nutriments. En tant que tel, il est essentiel de comprendre comment l’intégrité de la barrière de l’intestin fonctionne en bonne santé et est altérée lors de troubles intestinaux ou en réponse à des composés. Contrairement aux cultures d’entéroïdes 3D, il est possible d’évaluer objectivement l’intégrité de la barrière intestinale en combinant des monocouches sur des puits de transeau et en mesurant l’EER, comme le montre le présentdocument 14,25. La génération de monocouches 2D sur des transpuits permet également une double culture avec des types de cellules pertinents tels que des cellules immunitaires ou stromales. Cela permet de caractériser la diaphonie d’une importance cruciale entre les cellules intestinales et les cellules du microenvironnement tissulaire, ce qui ne peut pas être réalisé avec des cultures 3D. L’exposition de la surface apicale de la monocouche permet non seulement une exposition expérimentale à des agents pathogènes et à des composés et la collecte de produits luminaux, mais permet également d’étudier d’autres aspects de la physiologie et des maladies intestinales, y compris l’étude du microbiote intestinal et de la physiologie moléculaire de l’absorption ou du transport13. Le contrôle indépendant des surfaces apicales et basales de l’intestin est un avantage distinct par rapport aux modèles 3D entéroïdes.
Grâce à plusieurs essais, nous avons identifié les étapes clés qui ont contribué au succès du protocole. Alors que les échantillons de tissus intestinaux entiers peuvent être réfrigérés pendant la nuit et traités le lendemain, les étapes de dissociation tissulaire et d’isolement des fragments de crypte doivent être effectuées rapidement pour éviter la désintégration des fractions de crypte isolées. Une fois les lavages PBS terminés, la centrifugation des cryptes dans le support de lavage peut aider à prévenir la panne des cryptes, comme indiqué à l’étape 2.3.10. Lors du passage des entéroïdes ou de leur récolte pour la formation de monocouches, il est essentiel de séparer les entéroïdes des dômes BME. Le support de lavage doit être glacé pour aider à dissoudre le BME. En revanche, l’utilisation de TrypLE préchauffé et le filtrage de la suspension cellulaire deux fois peuvent aider à former les cellules uniques nécessaires à la génération de monocouches. Enfin, manœuvrer manuellement la plaque en forme de chiffre 8 peut aider à disperser uniformément les cellules individuelles sur l’insert transwell.
Une limite importante de ce protocole est que les monocouches 2D ont été produites à partir de stocks d’entéroïdes générés à partir d’un bouvillon Holstein mature (>2 ans). La maturation du tractus gastro-intestinal chez les veaux peut nécessiter des modifications mineures au protocole décrit pour donner des résultats optimaux. Des différences spécifiques à la race dans la physiologie intestinale des races bovines ont été décrites dans la littérature26. Bien que l’on ne sache pas si ces différences pourraient avoir un impact sur l’entéroïde et la génération subséquente de monocouches, nous soupçonnons que toute différence n’entraînerait que des changements mineurs à notre protocole. De plus, le modèle de culture 2D présente certains inconvénients inhérents. Par rapport aux modèles d’entéroïdes 3D, les cultures 2D peuvent manquer certains aspects de l’architecture du tissu intestinal et de la diversité cellulaire et créer des restrictions et des défis associés à la propagation de la culture 2D13. Pourtant, des études démontrent que certaines monocouches peuvent émuler l’organisation de crypte attendue27, et certaines de ces limitations peuvent même être surmontées en établissant des cultures 2D avec une interface air-liquide. Néanmoins, les limites de ce modèle doivent être pleinement prises en compte pour déterminer si son application est adaptée à la question expérimentale posée.
Ce protocole décrit un système de culture optimisé qui modélise le tractus gastro-intestinal bovin à l’aide d’entéroïdes dérivés de l’iléon bovin pour former des monocouches sur des inserts transwell. Avec un large éventail d’applications allant de la recherche sur les maladies infectieuses à la découverte de médicaments et à la médecine régénérative, ce système de culture à haut débit pourrait conduire au développement sans précédent de stratégies préventives et thérapeutiques qui pourraient être mutuellement bénéfiques pour la santé animale et humaine.
Déclarations de divulgation
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous reconnaissons l’utilisation de l’installation de base cellulaire et moléculaire de l’Université Midwestern.
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
Références
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon