Method Article
Geração de um Sistema de Cultura Bidimensional Monocamada Derivada de Enteróides Bovinos Primários para Aplicações em Pesquisa Biomédica Translacional
Neste Artigo
Resumo
Os enteróides estão emergindo como um novo modelo para o estudo da fisiologia e fisiopatologia tecidual, desenvolvimento de drogas e medicina regenerativa. Aqui, descrevemos um sistema de cultura 2D derivado de enteróides de células primárias bovinas que permite o co-cultivo com tipos de células teciduais relevantes. Este modelo oferece uma vantagem translacional para a modelagem de pesquisa gastrointestinal.
Resumo
Sistemas de cultura de células organoides podem recapitular a complexidade observada nos tecidos, tornando-os úteis no estudo das interações patógeno-hospedeiro, avaliação da eficácia e toxicidade de fármacos e bioengenharia tecidual. No entanto, a aplicação desses modelos pelas razões descritas pode ser limitada devido à natureza tridimensional (3D) desses modelos. Por exemplo, o uso de sistemas de cultura enteróide 3D para estudar doenças digestivas é um desafio devido à inacessibilidade do lúmen intestinal e suas substâncias secretadas. De fato, a estimulação de organoides 3D com patógenos requer microinjeção luminal, ruptura mecânica da estrutura 3D ou geração de enteroides apical-out. Além disso, esses organoides não podem ser co-cultivados com células imunes e estromais, limitando a análise mecanicista aprofundada da dinâmica fisiopatológica. Para contornar isso, otimizamos um sistema de cultura de monocamada derivada de enteróides bovinos bidimensionais (2D), permitindo o co-cultivo com outros tipos celulares relevantes. Criptas ileais isoladas de bovinos adultos saudáveis foram cultivadas para gerar organoides 3D que foram criopreservados para uso futuro. Uma monocamada 2D foi criada usando enteróides 3D revividos que foram passados e interrompidos para produzir células únicas, que foram semeadas em inserções de cultura de células transwell revestidas com extrato de membrana basal, expondo assim sua superfície apical. A polaridade da monocamada intestinal, a diferenciação celular e a função de barreira foram caracterizadas por microscopia de imunofluorescência e mensuração da resistência elétrica transepitelial. A estimulação da superfície apical da monocamada revelou a funcionalidade esperada da monocamada, demonstrada pela secreção de citocinas dos compartimentos apical e basal. O modelo de monocamada 2D derivado de enteróides descrito é uma grande promessa na investigação de interações patógeno-hospedeiro e fisiologia intestinal, desenvolvimento de drogas e medicina regenerativa.
Introdução
Modelos animais em pesquisa desempenham um papel crucial em melhorar nossa compreensão da fisiopatologia da doença e da dinâmica da resposta imune do hospedeiro durante a infecção e apoiar o desenvolvimento de novas estratégias preventivas e terapêuticas 1,2,3,4. Esses modelos apoiam a descoberta e o avanço da pesquisa em animais e são fundamentais para o progresso da pesquisa em saúde humana. Durante décadas, modelos de roedores têm sustentado avanços nos mecanismos imunológicos e na pesquisa biológica fundamental para doenças humanas 3,5,6,7. Enquanto os modelos de roedores são críticos na triagem e na pesquisa de desenvolvimento inicial, os modelos animais de grande porte oferecem uma comparação mais relevante na pesquisa de doenças humanas tanto em estudos de descoberta precoce quanto em estudos de desenvolvimento posteriores, incluindo testes de eficácia terapêutica e segurança 1,3,4,5. A pecuária oferece vantagens claras em relação aos modelos de roedores para uma tradução mais eficiente para aplicações humanas em algumas doenças, incluindo criptosporidiose, salmonelose, tuberculose, vírus sincicial respiratório e brucelose 1,7,8. De fato, essas e outras doenças se desenvolvem espontaneamente em bovinos, que compartilham várias patogêneses e processos imunológicos análogos à humana, e como uma população extrovertida, os bovinos mimetizam a heterogeneidade genética e ambiental que influencia as respostas imunes humanas 5,8,9,10 . Os benefícios dos modelos bovinos para a pesquisa de doenças infecciosas podem ser maximizados empregando-se primeiro um sofisticado sistema de cultura e, em seguida, implementando estudos in vivo em etapas. O uso inicial de um sistema de cultura derivado de bovinos altamente complexo pode reduzir consideravelmente o número de estudos com animais vivos, ao mesmo tempo em que melhora as chances de sucesso da pesquisa translacional e aplicada. Modelos de cultura devem recapitular os processos patológicos em nível de órgão para uma validade preditiva ótima, retendo o microambiente do tecido nativo espacial e funcionalmente.
A resposta imune mucosa é um sistema multifacetado composto por uma barreira altamente eficiente formada por enterócitos gastrintestinais e diversas populações de células imunes localizadas abaixo da superfíciemucosa11. Esse sistema altamente complexo é crítico durante a infecção para manter a homeostase gastrointestinal e iniciar defesas imunológicas contra patógenos entéricos11. A comunicação entre enterócitos e células imunes inatas subjacentes inicia o desenvolvimento de respostas imunes protetoras contra microrganismos patogênicos. Assim, sistemas de cultura que são comparativos em seu nível de complexidade são necessários para uma investigação ótima das interações patógenos entérico-hospedeiro e são altamente eficazes na compreensão da fisiologia entérica e na descoberta e desenvolvimento de fármacos12,13. Os organoides são um sistema de cultura robusto que se assemelha à arquitetura e função do tecido de origem14,15. A multicelularidade desses modelos permite investigar o papel de diversas populações celulares e as interações celulares envolvidas na saúde e doença entérica12,14. No entanto, modelos organoides derivados de humanos em pesquisa são atualmente limitados pela dificuldade de se obter uma quantidade suficiente e qualidade consistente de células epiteliais intestinais humanas e limitada viabilidade celular em cultura. Linhagens celulares imortalizadas podem ser usadas para obter altos rendimentos de culturas homólogas nesses modelos de forma consistente; no entanto, as células transformadas carecem inerentemente da diversidade e complexidade funcional das células epiteliais não transformadas16,17. As vantagens do uso de culturas derivadas de tecido bovino como modelo para investigação de doenças e fisiologia gastrintestinal incluem a facilidade com que amostras de tecido podem ser consistentemente obtidas de doadores saudáveis, melhor viabilidade celular e maior diversidade celular alcançável apenas com tecidos não imortalizados. A transcriptômica tecidual comparativa e a caracterização de organoides intestinais revelam semelhanças em genes ortólogos conservados e potenciais celulares entre humanos e bovinos18. Portanto, um sistema de cultura derivado de organoides bovinos pode ser vantajoso na investigação de doenças intestinais humanas, com achados facilmente traduzíveis para a medicina humana.
O protocolo aqui descrito detalha uma plataforma eficaz para avaliar as respostas do hospedeiro a patógenos ou compostos entéricos e a fisiologia intestinal usando um sistema de cultura de células primárias 2D derivado de enteróides bovinos. Ao contrário dos organoides 3D, os sistemas de cultura 2D gerados em inserções transwell permitem uma cultura dupla de células intestinais com células imunes ou estromais, permitindo o estudo da dinâmica em nível de tecido. Com aplicações em pesquisa biomédica, desenvolvimento farmacêutico e testes de eficácia, esse modelo fisiologicamente relevante pode beneficiar a saúde e o avanço tanto do gado quanto das pessoas.
Protocolo
Todos os protocolos foram realizados de acordo com as diretrizes e normas institucionais e nacionais de bem-estar animal.
1. Preparação dos reagentes
OBS: Os estoques e as concentrações finais dos reagentes utilizados neste estudo estão listados na Tabela 1.
- Preparar tampão de coleta de amostras: Misturar 1 L de solução salina tamponada com fosfato (PBS) gelada contendo penicilina (100 U/mL), estreptomicina (100 μg/mL), gentamicina (25 μg/mL) e caspofungina (2,5 μg/mL). Conservar a solução-mãe a 4 °C.
- Preparar o Reagente de Dissociação #1: Misturar 18,55 ml de tampão de recolha de amostras (conforme descrito no passo 1.1), 1,422 ml de ácido etilenodiaminotetracético (EDTA, 0,422 M/pH 7,4), 20 μL de solução 1,4-Ditiotreitol (DTT) 1 M, 4 μL de solução Y-27632 (5000x/50 mM). Conservar a solução a 4 °C.
- Preparar o Reagente de Dissociação #2: Misturar 18,57 ml de tampão de recolha (conforme descrito no passo 1.1), 1,422 ml de EDTA (0,422 M/pH 7,4), 4 μL de solução de Y-27632 (5000x/50 mM). Conservar a solução a 37 °C.
- Preparar estoque de meio de crescimento enteróide: Misturar 9,875 mL de meio de crescimento organoide mais suplemento, 100 μL de penicilina (100 U/mL), estreptomicina (100 μg/mL), 5 μL de gentamicina (25 μg/mL) e 20 μL de caspofungina (2,5 μg/mL). Conservar a solução a 4 °C.
- Preparar estoque de meios de diferenciação enteróide: Misturar 10 mL de meio de diferenciação organoide mais suplemento, 100 μL de penicilina (100 U/mL), estreptomicina (100 μg/mL), 5 μL de gentamicina (25 μg/mL) e 20 μL de caspofungina (2,5 μg/mL). Conservar a solução a -20 °C.
- Preparar meios de lavagem: Misturar 48,45 mL de meio DMEM/F-12 1,1 (com L-glutamina, sem HEPES), 1 mL de suplemento B-27 sem vitamina A (50x estoque), 500 μL de penicilina (100 U/mL), estreptomicina (100 μg/mL), 25 μL de gentamicina (50 mg/mL de estoque) e 25 μL de caspofungina (5 mg/mL de estoque). Conservar a solução a 4 °C.
- Preparar tampão de revestimento: Misturar 25 mL de DMEM: meio completo F12 sem inibidores e 25 mg de albumina de soro bovino (BSA). Conservar a solução a 4 °C.
2. Isolamento das criptas intestinais de todo o tecido (Figura 1)
NOTA: Enteróides do intestino delgado bovino foram gerados a partir de tecido ileal obtido de novilhos adultos saudáveis da raça Holandesa (>2 anos de idade) de uma planta de processamento de carne bovina local. Um doador foi utilizado para esta série de experimentos.
- Preparação de amostras de tecido intestinal
- Coloque as amostras colhidas de ~10 polegadas (25 cm) de tecido intestinal em ~400 mL de tampão de coleta gelado (antibióticos/antimicóticos PBS+) e em gelo para transporte ao laboratório.
- Usando tesouras cirúrgicas (por exemplo, tesoura de maionese) e pinças (por exemplo, pinça de adson), remova o excesso de gordura e mesentério da amostra de tecido intestinal.
- Corte o tecido em dois pedaços iguais.
- Abra o tecido longitudinalmente com tesoura cirúrgica e lave o tecido em PBS estéril.
- Remova suavemente a camada de muco da amostra intestinal usando o lado de uma lâmina de microscópio de vidro estéril e lave o tecido com PBS fresco.
NOTA: Esta etapa ajuda a remover as vilosidades e ajuda a aumentar a pureza das frações de cripta nas etapas subsequentes. - Para cada peça de 5 polegadas (13 cm), corte o tecido em duas peças de 2,5 polegadas (6,5 cm) e, em seguida, corte cada peça em 4 pedaços pequenos aproximadamente iguais para facilitar a dissociação do tecido.
- Dissociação do tecido intestinal
- Preparar um volume de 20 mL do Reagente de Dissociação de tecido #1 em um tubo cônico estéril de 50 mL e depositar as pequenas amostras de tecido no tubo cônico até que o deslocamento de volume mova o menisco da marca de 20 mL para a marca de 35 mL no tubo cônico.
- Repita o passo acima para os pedaços de amostra de tecido do intestino delgado restantes.
- Sele os tubos cônicos com parafilme e agite manualmente o tubo cônico 10 vezes.
NOTA: Durante todo o protocolo, o tremor manual deve ser feito de forma deliberada, mas suave. - Coloque os tubos cônicos horizontalmente sobre o gelo em um recipiente em uma plataforma de agitação orbital.
- Agite os tubos cônicos sobre gelo no recipiente por 30 min a 80 rotações por minuto (rpm). A cada 10 min, agite manualmente o tubo cônico.
- Preparar um volume de 20 mL de Reagente de Dissociação de tecido pré-aquecido (37 °C) #2 (formulado como acima, mas sem TDT) em um tubo cônico de 50 mL. Depositar as amostras de tecido dos tubos cônicos contendo o Reagente de Dissociação #1 nos tubos cônicos contendo o Reagente de Dissociação #2.
- Selar os tubos cônicos com parafilme e agitar manualmente os tubos cônicos 10 vezes.
- Colocar os tubos cônicos em banho-maria de agitação pré-aquecido (37 °C), inclinado em um ângulo de aproximadamente 60 °C, e agitar a 150 rpm por 10 min, com agitação manual após 5 min e novamente após o total de 10 min de incubação.
- Isolamento de fragmentos de cripta
- Rotule 10 tubos cônicos estéreis #1 - #10. Adicionar 20 mL de PBS estéril gelado a cada tubo cônico marcado.
- Transfira as peças de tecido dos tubos cônicos contendo o reagente de dissociação #2 para um novo tubo cônico estéril de 50 mL contendo PBS #1 gelado.
- Agite manualmente os tubos cônicos 10 vezes.
- Sele os tubos cônicos com parafilme e coloque-os horizontalmente sobre gelo. Agite os tubos cônicos em um agitador orbital por 10 min a 80 rpm. Após 10 min, agite manualmente o tubo cônico #1 10 vezes. Isso é considerado Wash #1.
- Transfira suavemente amostras de tecido usando um par de pinças cirúrgicas para o tubo cônico #2.
- Repita as etapas 2.3.2 - 2.3.4, isso é considerado Wash #2.
- Repita as lavagens até lavar #10.
- Os sobrenadantes de cada lavagem contêm as criptas que serão utilizadas para a geração enteróide. Manter os tubos contendo os sobrenadantes a 4 °C até que todas as 10 lavagens estejam completas.
- Após a10ª lavagem estar completa e o corte de tecido descartado, centrifugar os sobrenadantes dos tubos cônicos #6-#10 a 400 x g por 2 min a 4 °C para pellet as criptas isoladas.
NOTA: As lavagens 6-10 contêm as frações mais limpas de criptas intactas com detritos limitados e células únicas. Como tal, recomenda-se que apenas essas frações sejam usadas para geração enteróide, e as lavagens anteriores (#2-#5) sejam descartadas) - Descarte o sobrenadante e adicione 4 mL de PBS fresco e gelado às criptas sem ressuspender (isso ajuda a manter os fragmentos intactos até a microscopia).
- Avaliar a pureza das criptas dissociadas para cada tubo cônico #6-#10 por microscopia.
- Adicionar 50 μL de PBS a uma placa de 384 poços.
- Adicione 10 μL de suspensão de cripta ao PBS e use uma lente objetiva de ampliação de 40x para determinar a pureza, integridade e contagem da cripta.
OBS: Desenhar uma cruz no fundo do poço da placa facilita a contagem.
3. Geração e passagem ex vivo de enteróides ileais bovinos (Figura 2)
NOTA: As criptas dos tubos cônicos com as criptas intestinais mais puras e intactas serão usadas para ensaios a jusante. Para todas as etapas que envolvem criptas e enteróides, as pontas de pipeta, raspadores de células e tubos devem ser pré-revestidos com o tampão de revestimento, e bolhas devem ser evitadas para evitar a perda de criptas. Salvo indicação em contrário, uma ponta de pipeta de 1000 μL deve ser usada para evitar a quebra de fragmentos de cripta.
- Gerando enteróides a partir de fragmentos de cripta
- Combine as frações de cripta mais puras (geralmente #6-#10) em um tubo cônico.
- Centrifugar o tubo cónico que contém as criptas a 400 x g durante 2 min a 4 °C.
- Descarte o sobrenadante aspirando-o com uma pipeta e ressuspenda o pellet da cripta em meio de lavagem.
- Centrifugar como no passo 3.1.2. Decantar o sobrenadante e adicionar 2 mL de Wash Media ao pellet da cripta.
- Conte o número de criptas conforme descrito na etapa 2.3.11.1.
- Centrifugar como na etapa 3.1.2 para peletizar as criptas, descartar o sobrenadante e ressuspender em matriz extracelular (EMB) da membrana basal 100% reduzida com fator de crescimento gelado para atingir uma concentração de aproximadamente 400 criptas/100 μL.
NOTA: é importante descongelar corretamente o BME a 4 °C, pois as mudanças de temperatura alteram sua consistência. O BME pode ser impedido de solidificar prematuramente usando um bloco de resfriamento e pontas de pipeta pré-resfriadas.- O uso de outra formulação de matriz de membrana basal pode exigir diluição do EMB ao criar cúpulas. Consulte as instruções do fabricante específicas para o BME que está sendo usado.
- Pipet para cima e para baixo para suspender completamente as criptas no BME.
- Faça cúpulas de BME de cripta pipetando lentamente 50 μL de suspensão de BME de cripta em uma placa de cultura de tecido de 6 poços em uma placa de aquecimento ajustada para 37 °C com até 8 cúpulas/poço.
NOTA: A placa de 6 poços deve ser pré-aquecida em uma incubadora a 37 °C durante a noite antes do revestimento das cúpulas. - Mantenha a placa de 6 poços na placa de aquecimento por 1 min antes de mover cuidadosamente a placa para uma incubadora de 37 °C, 5% CO2 .
- Após 2 min, vire a placa de 6 poços para que a tampa fique virada para baixo e incube por mais 30 min para permitir que as cúpulas se polimerizem.
- Após 30 min, adicionar cuidadosamente 3 mL de meio de crescimento enteróide à temperatura ambiente (TR) suplementado com 10 μM SB202190, 0,5 μM LY2157299 e 10 μM Y-27632 aos poços contendo cúpulas.
- Incubar a 37 °C, 5% CO2.
- Remova o meio e substitua por meios de crescimento enteróides frescos suplementados com inibidores a cada 2-3 dias.
- Passagem de enteróides
- Após 7-10 dias, certifique-se de que as criptas formaram enteróides 3D com muitas estruturas brotantes, como na Figura 2E, e estão prontas para serem passadas.
- Descarte a mídia dos poços que contêm cúpulas.
- Para cada 4 cúpulas por poço, adicione 1 mL de Solução de Dissociação de Células Não Enzimáticas gelada suplementada com 10 μM Y-27632 a cada poço contendo cúpulas.
- Usando um raspador de células pré-revestido, retire suavemente a cúpula da placa de cultura de tecidos.
- Coletar enteróides em um tubo cônico de 15 mL e triturar pipetando para cima e para baixo 10 vezes.
- Incubar o tubo cônico contendo os enteróides fragmentados em RT em um agitador orbital a 80 rpm por 10 min.
- Adicionar 10 mL de meio de lavagem gelado com 10 μM Y -27632 aos enteróides.
- Centrifugar o tubo cônico a 300 x g por 5 min no TR.
- Descarte o sobrenadante e ressuspenda o pellet em 10 mL de meio de lavagem fresco e transfira para um novo tubo cônico de 15 mL.
- Centrifugar o tubo cônico a 300 x g por 5 min no TR.
- Eliminar o sobrenadante e ressuspender o pellet em 1 mL de Meio de Crescimento Enteróide em tubo de microcentrífuga de 1,5 mL.
- Centrifugar o tubo da microcentrífuga a 300 x g por 5 min no RT e descartar o sobrenadante.
- Ressuspender a pastilha enteróide em BME 100% gelado e seguir os passos 3.1.6-3.1.13.
- Repassagem enteróides a cada 7 dias. Os tempos de expansão podem variar devido à densidade, viabilidade e extensão da brotação. Múltiplas estruturas brotantes criando grandes estruturas enteroides são indicativas da necessidade de passagem dos enteróides.
- Criopreservação de enteróides
- Para criopreservação, certifique-se de que os enteróides sejam passados não mais do que cinco vezes em cultura.
NOTA: Isso não foi testado experimentalmente e é baseado na observação dos autores de que passagens posteriores reduziram a viabilidade e produziram resultados variáveis. - Para colher os enteróides, utilizar o tampão de dissociação descrito nos passos 3.2.2-3.2.9.
NOTA: Dissociar mecanicamente os enteróides usando uma pipeta de 5 mL. - Contar o número de fragmentos enteróides conforme descrito no passo 2.3.11.1.
- Centrifugar o tubo cônico a 300 x g por 5 min no TR.
- Eliminar o sobrenadante e ressuspender os fragmentos enteróides em meio de criopreservação suplementado com 10 μM Y-27632 para atingir uma concentração de ~2000 fragmentos enteróides/mL e alíquota de 1 mL em criofrascos pré-marcados.
- Coloque os criósicos num recipiente de congelação controlada e guarde a -80 °C durante a noite.
- Transfira os criósculos para nitrogênio líquido em fase vapor para armazenamento a longo prazo.
- Para criopreservação, certifique-se de que os enteróides sejam passados não mais do que cinco vezes em cultura.
- Ressuscitação de fragmentos de criptas intestinais
- Coloque uma placa de 6 poços durante a noite dentro da incubadora.
- Pré-revestir um tubo de 5 mL com 5 mL de meio de revestimento.
- Retire os criósculos do armazenamento de nitrogênio líquido.
- Imediatamente, uma vez descongeladas, transfira as criptas do criovial para o tubo de 5 mL pré-revestido. Enxaguar o criovial com Wash Media e adicionar ao tubo de 5 mL. Evite bolhas.
- Elevar o volume até 5 ml com o meio de lavagem e centrifugar a 400 x g durante 5 minutos a 4 °C.
- Durante a centrifugação, pré-revestir um tubo de 1,5 mL com meio de revestimento.
- Após a centrifugação, despeje o sobrenadante, ressuspenda o pellet no meio restante no tubo e transfira para o tubo pré-revestido de 1,5 mL. Lavar o tubo de 5 ml com meio de lavagem e transferi-lo para um tubo de 1,5 ml. Centrifugar a 400 x g durante 5 min a 4 °C.
- Elevar o volume até 1,5 ml com Meios de Crescimento Enteróides.
- Centrifugar como acima (passo 3.4.7) e aspirar cuidadosamente.
- Tome BME a partir de 4 °C e coloque sobre gelo/bloco de gelo.
- Ressuspender a pastilha enteróide em EMB 100% gelada e seguir os passos 3.1.6- 3.1.12.
- Troque a mídia a cada 2-3 dias.
4. Geração e avaliação de monocamadas 2D a partir de enteróides 3D
NOTA: Como acima, para todas as etapas que envolvem criptas e enteróides, as pontas de pipeta, raspadores de células e tubos devem ser pré-revestidos com o Buffer de Revestimento, e bolhas devem ser evitadas para evitar a perda de criptas.
- Preparação de insertos de transwell para formação de monocamada 2D
- Coloque as pastilhas em uma placa adaptadora de cultura de tecido de 24 poços e pré-revestisse o lado apical de pastilhas de cultura celular PET de 24 poços de 1 μm com 100 μL de diluição 1:15 de EMB em meio de crescimento enteróide. Sempre revestir uma pastilha extra que será usada como controle ao fazer medições de integridade de barreira.
- Coloque a pastilha revestida em uma placa adaptadora de cultura de tecidos de 24 poços na incubadora.
NOTA: Um adaptador específico ou uma placa de cultura de tecido complementar deve ser usado com as inserções de transwell. - Incubar as pastilhas de cultura a 37 °C, 5% CO2 por 1 h para permitir a polimerização.
NOTA: Os transwells revestidos com BME podem ser selados com parafilme e armazenados a 4 °C por até 1 semana se não forem usados imediatamente. - Ao final da incubação, aspirar o meio de cultura enteróide 3D.
- Dissociação de enteróides 3D
- Gere monocamadas enteróides 2D a partir de fragmentos enteróides criopreservados que foram ressuscitados, plaqueados e cultivados conforme descrito acima na seção 3.1 para formar enteroides 3D. Passar os enteróides descongelados pelo menos duas vezes, com a última passagem cultivada por um mínimo de 5 dias antes do processamento para gerar culturas de monocamada 2D.
- Colher os enteróides adicionando meios de lavagem gelados suplementados com 10 μM Y-27632 às cúpulas enteróides (use aproximadamente 1 mL de tampão de dissociação para 4 cúpulas)
- Separar as cúpulas com um raspador de células e coletá-las em um tubo cônico de 15 mL.
- Triturar 30 vezes usando uma ponta de pipeta de 1 mL para gerar fragmentos enteróides.
- Triturar 40 vezes com uma ponta de pipeta de 200 μL para quebrar ainda mais os fragmentos enteróides.
- Reduzir o volume do tubo cônico de 15 mL com fragmentos enteroides para 10 mL com meio de lavagem gelado.
- Centrifugar o tubo cônico a 300 x g por 5 min no TR.
- Aspirar o sobrenadante, incluindo a camada de EMB, tomando cuidado para não perturbar a pelota enteróide.
NOTA: A camada de BME aparecerá como uma camada gelatinosa turva logo acima do pellet. - Para cada 4 cúpulas, ressuspenda o pellet em 1 mL da enzima TrypLE express pré-aquecida suplementada com 10 μM de Y-27632.
- Adicionar a mistura enteróide-TrypLE a uma placa de 24 poços e incubar a 37 °C, 5% CO2 por 10 min.
- Após 10 min, pipetar a mistura enteróide-TrypLE 40 vezes usando uma pipeta de 1 mL para fragmentar ainda mais os enteróides.
- Em seguida, fragmentos de pipeta 40 vezes com uma pipeta de 200 μL para quebrar os fragmentos em células únicas.
- Usando uma seringa de 3 mL ou 5 mL com uma agulha estéril de 22 G acoplada, aspirar e dispensar a suspensão celular 4 vezes para obter a suspensão de célula única.
- Monitorar a dissociação celular por microscopia, conforme descrito no passo 2.3.11.1, até que 80% dos enteroides sejam divididos em células únicas.
- Coletar a suspensão celular em um tubo cônico de 15 mL e extinguir a reação enzimática adicionando 4x volume de Wash Media suplementado com FBS a 10%.
- Filtrar os enteróides através de um filtro celular pré-revestido de 40 μm duas vezes para um tubo cônico de 50 mL.
- Pastilhar as células isoladas centrifugando o tubo cônico a 300 x g por 5 min.
- Semeadura monocamada 2D em insertos transwell.
- Decantar o sobrenadante e ressuspender o pellet em um pequeno volume (~600 μL) de meio de crescimento organoide suplementado com 20% de soro fetal bovino (SFB) em RT.
- Determine a densidade e a viabilidade das células enteróides usando o método de exclusão do corante Azul de Tripano, hemacitômetro ou contador automático de células. Espera-se uma viabilidade média de 75%.
- Remover cuidadosamente o excesso de solução de revestimento aplicado na etapa 1.3 da pastilha de cultura celular imediatamente antes de semear as células.
- Semeando as células isoladas a 1 x 105 células em um volume de 200 μL por inserção na superfície apical de uma inserção de cultura celular pré-revestida.
- Adicionar 700 μL de meio completo suplementado com SFB a 20% ao lado basolateral da inserção de cultura celular.
- Manobrar a placa 10 vezes na forma do número 8 para permitir que as células se espalhem uniformemente sobre a inserção.
- Mantenha a placa no fogão mais quente por 10 min no armário de biossegurança.
- Incubar a placa a 37 °C e 5% de CO2.
- Após 48 h, substituir os meios nos compartimentos apical e basal por meios de crescimento enteróides frescos suplementados com SFB a 20% e inibidores.
- No terceiro dia, retirar o meio dos compartimentos apical e basolateral, lavar cuidadosamente a pastilha com PBS 1x e substituí-la por meios de diferenciação enteróide suplementados apenas com inibidores.
- Troque a mídia em ambos os compartimentos a cada 2-3 dias.
- Mensuração quantitativa da integridade da barreira epitelial e confluência da monocamada
NOTA: A integridade da barreira pode ser avaliada usando um voltômetro epitelial para medir a resistência elétrica transepitelial (TEER).- Retire a placa de cultura transwell da incubadora e deixe que ela se equilibre em RT por alguns minutos no gabinete de biossegurança.
- Verifique se os eletrodos STX2 foram pré-condicionados e o voltohmímetro calibrado para 1000Ω de acordo com as instruções do fabricante.
- Inserir o bastão longo da sonda no compartimento basolateral e a extremidade curta no compartimento apical da cultura de células epiteliais transwell. Tome cuidado para não atrapalhar a monocamada ou danificar a pastilha.
- Uma vez estável, registre 3 medidas TEER por inserção de transwell, incluindo a inserção sem células. Faça uma média das medidas para cada inserção.
- Calcular o valor TEER corrigido subtraindo a medida média do poço em branco das medições médias dos poços experimentais e, em seguida, multiplicando-o pela área de superfície da pastilha para determinar a resistência da barreira epitelial (TEER [Ω.cm2] = [Rcell layer - Rblank] × Area).
Resultados
O primeiro passo na geração das monocamadas derivadas de enteróides 2D é preparar o corte do tecido intestinal colhido (Figura 1A) para a dissociação tecidual. Isso é feito removendo-se a gordura aderida e o mesentério do tecido (Figura 1B), seguido do corte longitudinal do tecido para expor a superfície do lúmen para que a camada de muco do intestino possa ser removida por raspagem suave usando uma lâmina de vidro. O corte intestinal colhido é então cortado em cortes de tecido progressivamente menores (Figura 1C) para aumentar a facilidade de dissociação. As criptas são então dissociadas do tecido submucoso subjacente usando uma série de lavagens consistindo de tampões quelantes (Figura 1D,E) e PBS. As criptas intestinais isoladas (Figura 1F) são então incluídas em cúpulas matriciais da membrana basal (Figura 2A) e cultivadas por vários dias para gerar enteróides 3D. A partir de uma seção de 10 polegadas do íleo bovino, aproximadamente 900.000 criptas podem ser isoladas e usadas para a formação de enteróides. Após apenas algumas horas em cultura, as criptas plaqueadas começam a se alongar e evoluir para enterosferas (Figura 2B). Após 2 dias, observa-se lúmen bem definido (Figura 2C), com brotamento de estruturas notadas já no 4º dia de cultura (Figura 2D). No 7º dia, enteroides maduros já se desenvolveram (Figura 2E). A coloração por imunofluorescência do enteróide 3D de 7 dias de idade demonstra a presença de diferentes linhagens celulares. A microscopia confocal dos enteróides demonstra a localização da coloração nuclear DAPI, da proteína E-caderina na junção aderente, da coloração Cromogranina-A (Chr-A) mostrando a presença de células enteroendócrinas, da lisozima (LYZ) demonstrando as células de Paneth, e da citoqueratina-18 (CK-18) representando as células dos enterócitos na Figura 3. Após 7-10 dias em cultura, os enteroides devem ser passados para permitir maior expansão e evitar a superlotação. O tempo ideal para a passagem de enteróides foi determinado como sendo de 7-10 dias após o isolamento inicial da cripta primária e, em última análise, depende da saúde e da taxa de crescimento dos enteroides em cultura. A densidade de semeadura ideal para atingir a morfologia e viabilidade enteróide desejadas, como ilustrado na Figura 2E, é de 400 criptas por cúpula. Os enteróides podem ser facilmente criopreservados, e os fragmentos enteroides descongelados se recuperam totalmente para uso experimental após duas passagens pós-descongelamento. Notavelmente, pelo menos duas passagens da cultura primária da cripta são recomendadas antes da criopreservação.
Para produzir uma monocamada derivada de enteróides 2D, os enteróides 3D são colhidos e, ao longo de uma série de etapas, são triturados mecanicamente na presença de uma solução de dissociação (Figura 4A) em células únicas. Essas células individuais podem então ser semeadas em uma inserção de transwell que foi pré-revestida com uma solução de meio de cultura de matriz de membrana basal. Em média, quatro transwells podem ser semeados a partir de quatro cúpulas enteróides 3D. O número de enteróides 3D processados é, portanto, dependente do número de transwells necessários para o experimento. Planear células isoladas a uma densidade de semeadura de 1 x 105 e inicialmente cultivá-las na presença de 20% de SFB (Figura 4B-D) pode gerar uma monocamada confluente em menos de 1 semana. A confluência progressiva da monocamada 2D em cultura pode ser monitorada ao longo do tempo por meio de microscopia de luz (Figura 4E,F). Medidas da resistência elétrica transepitelial (TEER) podem confirmar a confluência e caracterizar a integridade da barreira epitelial ao longo do tempo e em resposta à estimulação experimental (Figura 5A). Em média, após sete dias em cultura, uma monocamada aproximadamente 100% confluente terá um valor TEER correspondente de ~1500 Ω·cm2. Uma avaliação longitudinal dos valores de TEER da monocamada enteróide 2D demonstra um aumento constante nos valores de TEER ao longo de sete dias, atingindo um valor médio máximo de 1546 Ω·cm2 antes de declinar com o menor valor de 11,5 Ω·cm2 obtido no dia doze (Figura 5B). A marcação imunofluorescente de monocamadas diferenciadas indica que folhas epiteliais intestinais íntegras, organizadas e polarizadas são formadas usando este protocolo (Figura 6). A microscopia confocal da monocamada corada 2D demonstra a localização da coloração nuclear DAPI, E-caderina e F-actina (Figura 6A-D). A microscopia de fluorescência da monocamada 2D mostra características de células epiteliais intestinais diferenciadas com coloração de cromogranina-A (Chr-A) mostrando a presença de células enteroendócrinas, lisozima (LYZ) demonstrando células de Paneth, e citoqueratina-18 (CK-18) indicando linhagens de células de enterócitos (Figura 6E-L). A modelagem Z-stack mostra a polarização esperada da cultura da monocamada 2D com deposição característica de F-actina que é encontrada nas microvilosidades que recobrem o aspecto apical dos enterócitos diferenciados e E-caderina, uma proteína localizada nas junções aderentes interespaçadas entre as células epiteliais (Figura 6M).
A funcionalidade da monocamada pode ser avaliada por estimulação apical com vários componentes, incluindo ligantes ou patógenos do receptor Toll-like (TLR), seguida da quantificação de citocinas de sobrenadantes de culturas celulares colhidas dos compartimentos apical e basal. De fato, quando o aspecto apical da monocamada é estimulado por 24 h com o agonista Pam3csk4 do TLR 1/2 no 4º dia de cultura, observa-se aumento da produção de citocinas em ambos os compartimentos em relação às monocamadas não tratadas (Figura 7A,B).
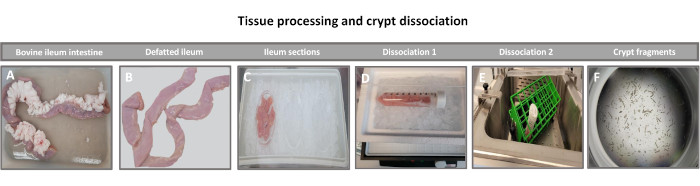
Figura 1: Isolamento de criptas intestinais bovinas de bovinos adultos saudáveis. Imagens ilustrando o processamento tecidual de (A) íleo bovino adulto inteiro, (B) íleo desengordurado, (C) íleo seccionado em pedaços de 2,5 polegadas (6,3 cm) em PBS sobre gelo, (D) cortes de tecido ileal em tampão de dissociação #1 a 4 °C e (E) em tampão de dissociação 2 em banho de água agitada a 37 °C e (F) fragmentos isolados de cripta ileal. Clique aqui para ver uma versão maior desta figura.
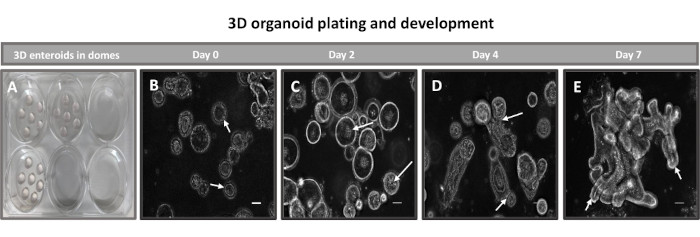
Figura 2: Desenvolvimento enteróide ileal 3D primário bovino em matriz de membrana basal. Imagens representativas de (A) cúpulas enteróides 3D criadas em placa de cultura de tecidos de 6 poços e desenvolvimento enteróide (B-E) 3D dos dias 0, 2, 4 e 7 em cultura. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
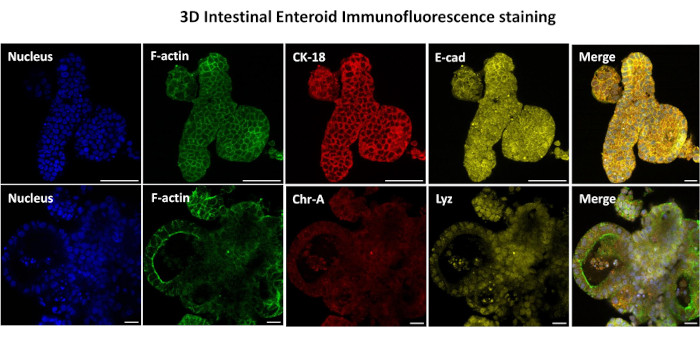
Figura 3: Enteróides intestinais tridimensionais mostram coloração de linhagem celular epitelial. Imagens representativas de enteróides 3D após 7 dias em cultura demonstram a presença de corante nuclear, F-actina, citoqueratina-18 (CK-18), Cromogranina-A (Chr-A), Acaderina (E-cad), lisozima (Lyz) e sobreposição de imagens (Merge). Barra de escala 50 μm. Clique aqui para ver uma versão maior desta figura.
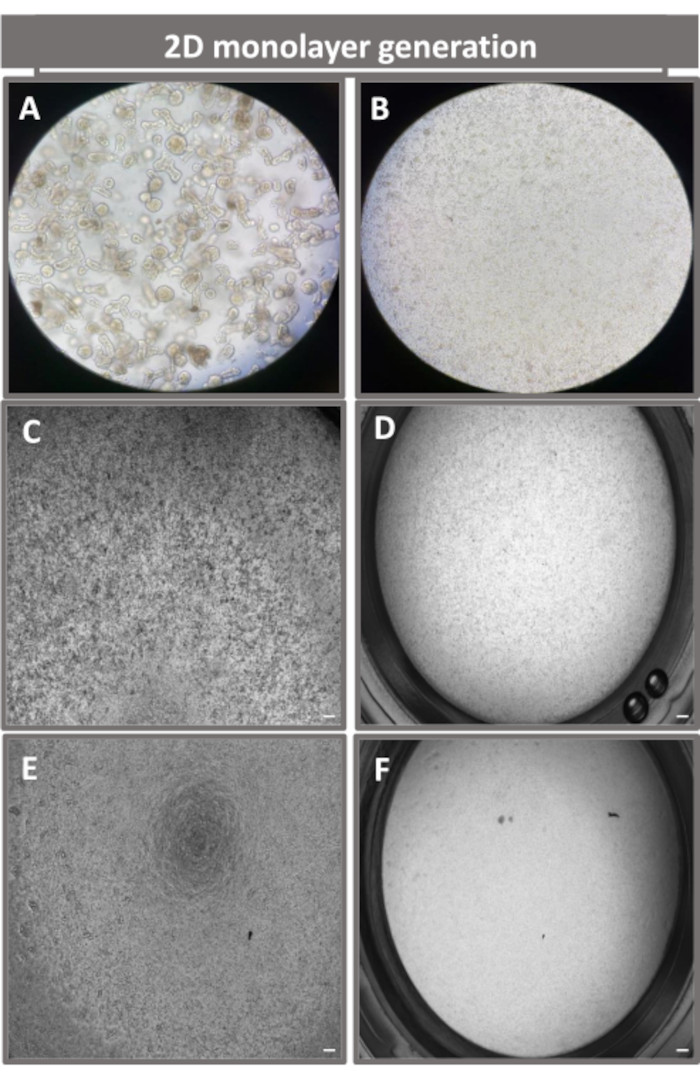
Figura 4: Estabelecimento da monocamada 2D derivada de enteróides ileais. Imagens representativas de (A) fragmentos enteróides 3D em solução de dissociação em preparação para semeadura de monocamada, células únicas plaqueadas em uma inserção de transpoço a uma densidade de semeadura de 1 x 105 imageadas no dia 0 usando (B) luz, (C) contraste de fase e (D) microscopia de campo brilhante, e desenvolvimento de monocamada em insertos de transwell imageados no quinto dia usando (E) contraste de fase e (F) microscopia de campo claro. Aumento de 40x e barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
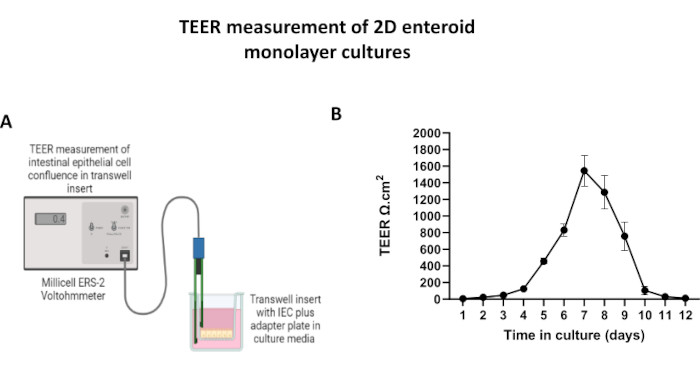
Figura 5: Medidas da resistência elétrica transepitelial (TEER) da monocamada 2D derivada do enteróide em insertos transwell. (A) Diagrama esquemático de como as medidas TEER da monocamada de células epiteliais intestinais (IEC) 2D são obtidas usando os eletrodos de pauzinho STX2 de um voltohmímetro, (B) Monitoramento longitudinal de medidas TEER de monocamada 2D durante 12 dias em cultura celular. Cada ponto de dados representa um valor TEER médio e um erro padrão da média (EPM) obtidos a partir de duas réplicas técnicas. Clique aqui para ver uma versão maior desta figura.
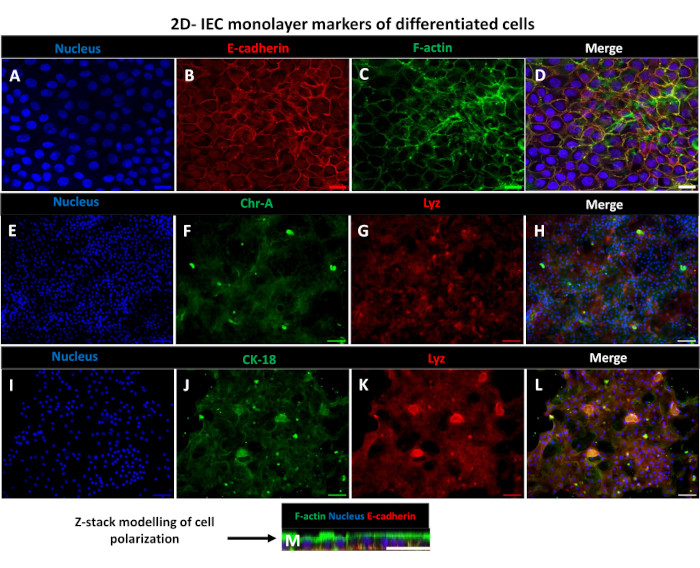
Figura 6: Monocamadas diferenciadas derivadas de enteróides 2D em inserções transwell desenvolvem-se em lâminas epiteliais intestinais polarizadas. (A-M) Imagens representativas de imunofluorescência de uma monocamada 2D derivada de enteróides na inserção transwell após 5 dias em cultura mostrando o núcleo (A) (azul), (B) E-caderina (vermelho), (C) F-actina (verde) e (D) sobreposição das 3 imagens (fusão), (E,I) coloração nuclear, (F) cromogranina-A, (J) citoqueratina-18, (G,K) lisozima e (H,L) fusão de imagens. (M) Modelagem Z-stack mostrando a distribuição das mesmas proteínas marcadores de células epiteliais da folha 2D da monocamada. As imagens foram obtidas a partir de 2 réplicas biológicas. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.
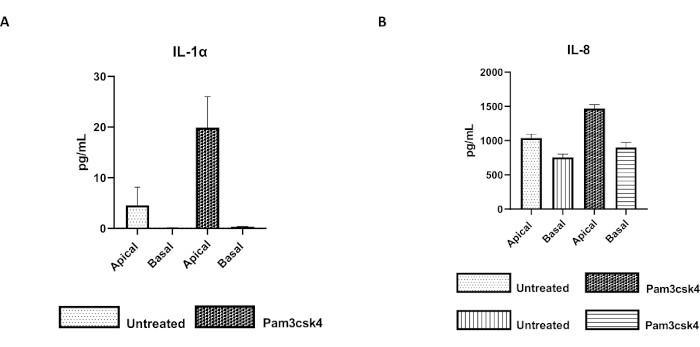
Figura 7: As monocamadas primárias 2D derivadas de enteróides bovinos em insertos transwell são funcionalmente ativas. Secreção de citocinas sobrenadantes em cultura de células apicais e basais de (A) IL-1α e (B) IL-8 por monocamadas 2D em inserções transwell após 5 dias em cultura que não foram tratadas ou estimuladas com Pam3csk4 por 24 h. Os dados são representativos dos níveis médios de citocinas e MEV de monocamadas derivadas de estoques congelados de criptas de um animal e três experimentos independentes. As citocinas foram quantificadas utilizando-se o ensaio multiplex baseado em esferas (Tabela de Materiais) de acordo com as instruções do fabricante e analisadas em uma unidade de multiplexação compacta (Tabela de Materiais) e software de ajuste de curva de imunoensaio (Tabela de Materiais). Clique aqui para ver uma versão maior desta figura.
Quadro 1: Existências e concentrações finais dos reagentes. Clique aqui para baixar a tabela.
Discussão
O protocolo aqui apresentado descreve um modelo fisiologicamente relevante para a investigação da fisiologia intestinal e distúrbios entéricos. Vários grupos de pesquisa têm descrito a geração de culturas enteróides bovinas, incluindo monocamadas 2D 16,19,20,21,22,23,24. Embora a geração de monocamadas não seja tecnicamente desafiadora, etapas de vários minutos são críticas para desenvolver culturas bem-sucedidas de forma consistente. Como tal, a reprodutibilidade de monocamadas 2D usando os métodos brevemente descritos na literatura publicada pode ser um desafio para um pesquisador iniciante na área de organoides empreender. O protocolo aqui descrito é adaptado desses protocolos e daqueles publicados em outras espécies, fornecendo um guia passo-a-passo para a geração de monocamadas em insertos de transpoços que é altamente reprodutível.
O protocolo aqui descrito pode ser facilmente modificado para se adequar aos objetivos específicos do planejamento experimental ou à disponibilidade de reagentes. De fato, seguindo esse protocolo, culturas bem-sucedidas podem ser obtidas pela semeadura de monocamadas em uma densidade celular mais baixa (por exemplo, 2,5 x 104) ou na ausência de SFB, como descrito em outras publicações24. No entanto, a alteração desses parâmetros pode exigir um aumento da cultura para estabelecer uma monocamada confluente. Como tal, se outros fatores integrantes do desenho do estudo, incluindo o co-cultivo com células imunes, ditarem um curso de tempo específico para o experimento, a densidade de semeadura pode ser alterada conforme necessário. Enquanto outras formulações de membrana basal podem ser substituídas pela usada neste protocolo para gerar enteróides 3D e monocamadas 2D, estas exigirão alguma otimização para determinar a relação membrana basal-mídia ideal.
A aplicação de insertos transwell na metodologia descrita tem muitos benefícios sobre o crescimento de monocamadas em plasticware convencional e culturas enteróides 3D. Comparado às placas de cultura de tecidos padrão, o uso de transwells para culturas de monocamadas promove diferenciação e organização celular de forma a manter semelhança com criptas intestinais 14,25. A barreira epitelial intestinal é vital para prevenir a translocação de toxinas e microrganismos para o corpo, ao mesmo tempo em que facilita a absorção de nutrientes. Como tal, é fundamental entender como a integridade da barreira do intestino funciona de forma saudável e é alterada durante distúrbios intestinais ou em resposta a compostos. Diferentemente das culturas enteroides 3D, a avaliação objetiva da integridade da barreira intestinal é possível ao combinar monocamadas em transwells e medir o TEER, como demonstrado aqui14,25. A geração de monocamadas 2D em transwells também permite o cultivo duplo com tipos celulares pertinentes, como células imunes ou estromais. Isso permite caracterizar o crosstalk criticamente importante entre células intestinais e células do microambiente tecidual, o que não pode ser alcançado com culturas 3D. A exposição da superfície apical da monocamada não só permite a exposição experimental a patógenos e compostos e a coleta de produtos luminais, mas também proporciona estudos sobre outros aspectos da fisiologia intestinal e da doença, incluindo a investigação da microbiota intestinal e da fisiologia molecular da absorção ou transporte13. O controle independente sobre as superfícies intestinais apicais e basais é uma vantagem distinta em relação aos modelos enteroides 3D.
Através de vários experimentos experimentais, identificamos as principais etapas que contribuíram para o sucesso do protocolo. Enquanto amostras de tecido intestinal inteiro podem ser refrigeradas durante a noite e processadas no dia seguinte, as etapas de dissociação e isolamento do fragmento de cripta devem ser realizadas prontamente para evitar a desintegração das frações de criptas isoladas. Depois de concluir as lavagens PBS, centrifugar as criptas na mídia de lavagem pode ajudar a evitar a quebra da cripta, conforme detalhado na etapa 2.3.10. Ao passar os enteróides ou colhê-los para a formação de monocamadas, é essencial separar os enteróides das cúpulas BME. O meio de lavagem deve ser gelado para ajudar na dissolução da EMB. Em contraste, usar TrypLE pré-aquecido e filtrar a suspensão celular duas vezes pode ajudar a formar as células únicas necessárias para a geração de monocamadas. Finalmente, manobrar manualmente a placa na forma do número 8 pode ajudar a dispersar uniformemente as células individuais sobre a inserção do transwell.
Uma limitação importante deste protocolo é que as monocamadas 2D foram produzidas a partir de estoques enteróides gerados a partir de um novilho holandês maduro (>2 anos de idade). A maturação do trato gastrointestinal em bezerros pode necessitar de pequenas modificações no protocolo descrito para obter resultados ótimos. Diferenças raça-específicas na fisiologia intestinal de raças bovinas têm sido descritas na literatura26. Embora não se saiba se essas diferenças poderiam afetar a geração de enteroides e subsequentes monocamadas, suspeitamos que quaisquer diferenças resultariam em apenas pequenas mudanças em nosso protocolo. Além disso, o modelo de cultura 2D tem algumas desvantagens inerentes. Comparadas aos modelos enteróides 3D, as culturas 2D podem carecer de alguns aspectos da arquitetura do tecido intestinal e da diversidade celular e criar restrições e desafios associados à propagação da cultura 2D13. Ainda assim, estudos demonstram que algumas monocamadas podem emular a organização esperada de criptas27, e algumas dessas limitações podem até ser superadas com o estabelecimento de culturas 2D com uma interface ar-líquido. No entanto, as limitações desse modelo devem ser plenamente consideradas para determinar se sua aplicação é adequada para a questão experimental que está sendo feita.
Este protocolo descreve um sistema de cultivo otimizado que modela o trato gastrointestinal bovino usando enteróides derivados do íleo bovino para formar monocamadas em insertos transwell. Com uma ampla gama de aplicações, desde a pesquisa de doenças infecciosas até a descoberta de medicamentos e medicina regenerativa, esse sistema de cultura de alto rendimento pode levar ao desenvolvimento sem precedentes de estratégias preventivas e terapêuticas que podem ser mutuamente benéficas para a saúde animal e humana.
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Agradecemos o uso do Cellular and Molecular Core Facility da Midwestern University.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
Referências
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados