需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
啮齿动物下腔静脉成形术球囊模型
摘要
该方案提出了一个存活啮齿动物模型,用于测试静脉成形球囊 (VB) 干预在非血栓形成、血栓形成和血栓形成后深静脉中的应用。
摘要
球囊静脉成形术是一种常用的临床技术,用于治疗因外伤、先天性解剖异常、急性深静脉血栓形成 (DVT) 或支架置入术而导致的深静脉狭窄和闭塞。慢性深静脉阻塞的组织病理学特征为血栓形成、纤维化或两者兼而有之。目前,没有针对这些病理过程的直接治疗方法。因此,需要一个可靠的 体内 动物模型来测试新的干预措施。啮齿动物存活下腔静脉 (IVC) 静脉成形术球囊模型 (VBM) 允许在多个时间点研究非血栓形成和血栓形成后条件下的球囊静脉成形术。涂层和非涂层静脉成形术球囊的局部和全身效应可以通过组织、血栓和血液测定进行量化,例如实时聚合酶链反应 (RT-PCR)、蛋白质印迹、酶联免疫吸附测定 (ELISA)、酶谱、静脉壁和血栓细胞分析、全血和血浆测定以及组织学分析。VBM 是可重复的,可复制手术人工干预,可以识别局部静脉壁血栓蛋白变化,并允许对同一样品进行多次分析,从而减少每组所需的动物数量。
引言
未解决的血栓引起的深静脉阻塞是深静脉血栓形成 (DVT) 的常见后果,是血栓形成后综合征 (PTS) 的原因之一,花费数十亿美元的医疗保健费用并显着影响生活质量 1,2,3。PTS 是一种独特的炎症病理学,随之而来的静脉壁纤维化4 在小动物 DVT 模型中未完全捕获 5,6,7,更重要的是,以前的模型无法评估对治疗干预的反应。血栓性静脉阻塞通常通过支架置入术和球囊静脉成形术来治疗 8,9;由于再狭窄和闭塞,这种干预受到高再干预率的阻碍 10,11,12。
尽管有药物涂层球囊可以解决动脉特异性狭窄/闭塞,但不存在用于深静脉的球囊。静脉再狭窄背后的分子机制知之甚少,也没有直接的治疗方法4。因此,我们的目标是提出一种动物模型,该模型可以通过模拟血栓后深静脉阻塞的静脉成形球囊测试局部给药的治疗。该模型再现了血栓形成后的情况,并评估了不同类型的静脉成形球囊如何影响 体内静脉壁。
研究方案
以下协议遵循密歇根大学 (UMICH) 机构动物护理和使用委员会 (IACUC) 政策和指南、美国政府用于测试、研究和培训的脊椎动物利用和护理原则以及 ARRIVE 指南 2.0。UMICH 动物福利保证协议符合 OLAW 和 USDA,并获得了 AAALAC International 的全面认可。该实验方案的 ID 号为 PRO00010841。使用来自 Charles River Laboratories 的雄性远交 Sprague Dawley 大鼠,体重 450 克,年龄为 15 周龄。
1. 大鼠麻醉
- 将动物从笼子中取出,以 5% 异氟烷和 100% 氧气以 0.8 至 1 L/min(蒸发器控制)的流速将它们放入麻醉术前诱导气室中,以诱导全身麻醉。
- 在麻醉诱导室中镇静大鼠,将其从腔室中取出,称重,用无菌眼药膏润滑它们的眼睛,然后将它们背卧在温水循环加热装置上。使用踏板反射(用力捏住脚趾)确认足够的麻醉深度。
- 用电动剪刀剃掉腹侧腹部。以 2.5% 异氟醚和 100% 氧气以 0.8 至 1 L/min 的速度维持全身麻醉,并通过鼻锥进行非再呼吸回路。
2. 大鼠超声扫描
- 在成像过程中监测生理评估,包括呼吸频率、心率和体温。
- 对于下腔静脉 (IVC) 的腹部成像,使用导电凝胶并将换能器定向在横向位置。在预设外周血管的同时,使用二维成像模式或 B 模式,降低腹部中心的线性探头 (10 MHz),用压力调整深度,直到看到腹腔血管。
- 通过评估可压缩性以及使用彩色和脉冲波多普勒模式以及高频线性探头 (10 mHz) 评估流量,区分 IVC 与腹主动脉。
- 当使用超声探头进行加压时,将两者区分开来,因为 IVC 是可压缩的,而主动脉保持其形状和通畅。
- 使用彩色多普勒和脉冲波多普勒评估血流的方向和速度。彩色多普勒窗口以红色表示流向探头的流向,以蓝色表示流离探头的流出。将仪器切换到脉冲波多普勒模式(双工模式),以评估血流方向和速度随时间的变化。使用超声机的自动图像捕获工具获取必要的流动图像(图像采集的确切规格可能因超声系统而异)。
- 使用以下评估方法:主动脉有流向探头的血流和三相波形,而 IVC 有自发流离探头的血流,振幅要低得多。
- 如果近端 IVC 显示正常波形,但在远端检测到非相位或不存在(平坦)波形,请探索这些检查点之间静脉阻塞的可能性。
- 找到 IVC 后,确定中段,它位于中间三分之一部分,低于肾静脉,高于 IVC 分叉处,很可能是腰静脉所在的位置。
- 使用横截面 B 型图像在横截面 IVC 中段测量横向视图中的壁到壁直径,记录血管的最宽直径。成像采集在不同的超声机器中可能有所不同。使用光盘 (CD) 将数据存储在 DICOM 文件中。
3. 大鼠显微手术和恢复
- 用纱布浸泡的洗必泰磨砂膏和洗必泰溶液清洁腹部 3 次,以确保无菌手术条件。
- 放置消毒的保鲜膜作为手术包裹物,以覆盖大鼠胸部和腹部区域、显微镜旋钮(放大倍率和聚焦)和目镜。
- 用虹膜剪刀穿过皮肤和腹壁,在剑突下方约 3 厘米处做一个腹侧中线切口(3 厘米),露出腹内容物。使用浸泡过无菌盐水的 2 英寸 x 2 英寸纱布将肠道反射到动物的右侧。
- 对于 IVC 暴露,使用无菌棉签涂抹器进行钝性解剖。在切口中放置一个窥器,以便 IVC 可视化。
- 使用低温细尖烧灼术烧灼所有 IVC 腰支,从肾静脉到髂分叉处,并用 7-0 不可吸收的聚丙烯缝合线结扎侧支。
- 在 IVC 上放置一个近端弯曲的血管微夹,IVC 与主动脉分离,位于肾静脉下方。将一个直的微夹放在远端 IVC 上,该 IVC 与主动脉分离,位于 IVC 分叉处上方。
- 放置 8-0尼龙 U 型缝合线尾部至左肾静脉,以 IVC 前表面为中心。
- 插入一根 0.014 毫米的锋利导丝,将静脉成形球囊倒载,逆行以血流进入肾下静脉,尾部到弯曲的微夹。
- 使用 Seldinger 技术将球囊推进到 IVC 中期。取下锋利的导丝,使用 20 mL 充气注射器以 10% 至 15% 的 IVC 过度拉伸为静脉成形球囊充气 3 分钟,以在 0-30 个大气压范围内产生正压。在 IVC 管道之前用无菌生理盐水冲洗所有系统,以避免空气栓塞。
注意:2.8 毫米 IVC 将接受静脉成形术至 3.22 毫米(15% 过度拉伸)。达到所需过度拉伸所需的充气压力由球囊的特性决定,可在制造商的包装上找到。 - 在静脉成形术球囊放气和移除时收紧 U 针。取下微夹。
- 以两层方式关闭剖腹手术部位。使用 5-0 聚乳糖素可吸收合成缝合线以连续模式闭合腹壁和皮肤。
- 术后给予丁丙诺啡缓释注射混悬液,0.65 mg/kg 皮下 (SC) 作为大鼠的镇痛剂,因为它不会干扰用于蛋白质分析的炎症分子的生物标志物组。
- 将大鼠恢复到单独的笼子中,在加热灯下(最小距离 - 距笼子 24 英寸)进行术后观察(30 分钟),然后返回其原始住房单元。
- 对于每个实验组的假动物,仅进行解剖,而不进行 IVC 分支结扎、烧灼和插管。
- 对于血栓形成后的情况,在 IVC 上放置一个近端直血管微夹,IVC 与主动脉分离,就在肾静脉下方,持续 24 小时。使用相同的解剖和闭合技术。
- 检查 IVC 闭塞的超声体征,包括 IVC 夹的可视化、确认远端 IVC 无血流和髂总静脉扩张。可以定制随访时间点以适应研究的规格。
- 为了观察正在建模的生理变化,请选择前 72 小时的时间点进行早期血栓形成,选择术后 3 至 7 天的时间点以进行后期血栓消退。该模型中测试的较晚时间点包括 7 到 28 天 5,13。
- 使用步骤 3.5-3.9 中的技术进行血栓形成后球囊静脉成形术,但需要注意以下事项:可能需要更高的吹气器压力才能达到所需的过度拉伸,因为在血栓形成后情况下 IVC 直径会增加。
- 根据现行美国兽医协会关于啮齿动物安乐死指南的建议,通过执行两种确认方法(去除血液和重要器官)进行安乐死,以确保动物不会复活。
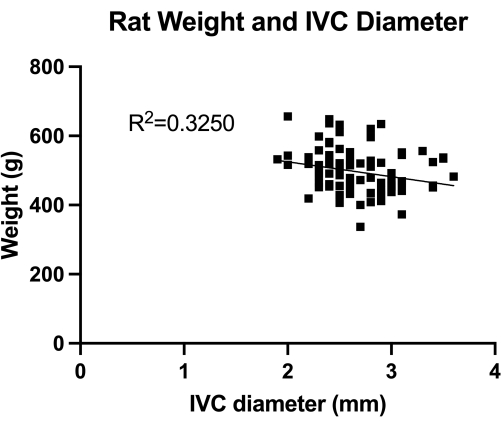
图 1:横腹 IVC(肾下中段)直径的经腹多普勒测量值的分布。 测量是通过动物体重进行的。体重与 IVC 直径之间未发现显著相关性。 请单击此处查看此图的较大版本。
4. 样品制备
- 使用高效液相色谱 (HPLC) 测定技术对药物涂层的静脉成形术球囊进行确认性组织转移。
- 解剖 IVC 和主动脉并 整体 去除福尔马林固定石蜡包埋和组织学分析。
- 对于蛋白质分析,使用稀释浓度为 60,000 μg/g 样品的 RIPA 缓冲液,在 4 °C 的低温室环境中用组织匀浆器处理,处理后储存在 -80 °C。
结果
VBM 是一种评估静脉成形术球囊在完全止血控制中效果的模型。首先,我们量化了 IVC (肾下中段) 直径,如图 1 所示,用于正确的球囊尺寸。其次,开发的分步显微外科技术如图 2 所示,我们还展示了 图 3 中关键步骤的示例。请注意用于 IVC 插管的逆行方法,使用锋利的导丝。
讨论
可以使用 2.5-3.5 mm 范围内的球囊对 250 g ≥大鼠进行 VBM。对于超过 750 g 的大鼠,该技术受到腹腔中脂肪组织数量和器官大小的限制,而不是 IVC 直径的变化。根据我们的经验,我们发现每组需要 10 只或更多动物才能获得组间的统计学显着性,以进行静脉壁蛋白分析或活性测定和组织学。手术干预期间的定期温度控制和呼吸频率监测对于保证手术成功以及勤奋的术后管理非常重要。
披露声明
没有宣布利益冲突。
致谢
这项研究得到了美国静脉论坛 (AVF) 2023 年基础科学研究资助和 Surmodics, Inc. 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
参考文献
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。