È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello di palloncino per venoplastica della vena cava inferiore del roditore
In questo articolo
Riepilogo
Il protocollo presenta un modello di roditore di sopravvivenza per testare interventi di palloncino per venoplastica (VB) in vene profonde non trombotiche, trombotiche e post-trombotiche.
Abstract
La venoplastica con palloncino è una tecnica clinica comunemente usata per trattare la stenosi venosa profonda e l'occlusione come conseguenza di traumi, anomalie anatomiche congenite, trombosi venosa profonda acuta (TVP) o stent. L'ostruzione venosa profonda cronica è istopatologicamente caratterizzata da trombosi, fibrosi o entrambe. Attualmente, non è disponibile alcun trattamento diretto per colpire questi processi patologici. Pertanto, è necessario un modello animale in vivo affidabile per testare nuovi interventi. Il modello di palloncino per venoplastica (VBM) della venoplastica inferiore della vena cava inferiore (IVC) dei roditori consente lo studio della venoplastica con palloncino in condizioni non trombotiche e post-trombotiche in più punti temporali. L'effetto locale e sistemico dei palloncini per venoplastica rivestiti e non rivestiti può essere quantificato tramite saggi tissutali, trombotici e del sangue come la reazione a catena della polimerasi in tempo reale (RT-PCR), il western blot, il saggio di immunoassorbimento enzimatico (ELISA), la zimografia, l'analisi della parete venosa e del trombo cellulare, i saggi del sangue intero e del plasma e l'analisi istologica. Il VBM è riproducibile, replica gli interventi chirurgici sull'uomo, è in grado di identificare le alterazioni locali della proteina della parete venosa e dei trombi e consente analisi multiple dallo stesso campione, diminuendo il numero di animali necessari per gruppo.
Introduzione
Le ostruzioni venose profonde da trombi irrisolti sono una conseguenza comune della trombosi venosa profonda (TVP) e sono una delle cause della sindrome post-trombotica (PTS), costando miliardi di dollari in assistenza sanitaria e avendo un impatto significativo sulla qualità della vita 1,2,3. La PTS è una patologia infiammatoria unica con conseguente fibrosi della parete venosa4 non completamente catturata nei modelli di TVP su piccoli animali 5,6,7 e, cosa più importante, i modelli precedenti non sono in grado di valutare la risposta agli interventi terapeutici. Le ostruzioni venose trombotiche sono spesso trattate con stent e venoplastica con palloncino 8,9; Tali interventi sono ostacolati da un alto tasso di reintervento dovuto a restenosi e occlusione 10,11,12.
Nonostante la disponibilità di palloncini rivestiti di farmaco per affrontare stenosi/occlusioni arterio-specifiche, non ne esistono per le vene profonde. Il meccanismo molecolare alla base della restenosi è scarsamente compreso nelle vene e non ha una terapia diretta4. Pertanto, il nostro obiettivo è quello di presentare un modello animale in grado di testare terapie somministrate localmente tramite palloncini per venoplastica che simulano ostruzioni post-trombotiche venose profonde. Questo modello riproduce la condizione post-trombotica e valuta come diversi tipi di palloncini per venoplastica influenzano la parete venosa in vivo.
Protocollo
Il seguente protocollo segue le politiche e le linee guida del Comitato istituzionale per la cura e l'uso degli animali (IACUC) dell'Università del Michigan (UMICH), i principi del governo degli Stati Uniti per l'utilizzo e la cura degli animali vertebrati utilizzati nei test, nella ricerca e nell'addestramento e le linee guida ARRIVE 2.0. L'accordo UMICH Animal Welfare Assurance è conforme a OLAW e USDA ed è pienamente accreditato da AAALAC International. Questo protocollo è stato approvato con il numero ID PRO00010841. Sono stati utilizzati ratti maschi Sprague Dawley di razza dei Charles River Laboratories, del peso di 450 g e di 15 settimane di età.
1. Anestesia dei ratti
- Togliere gli animali dalla loro gabbia e metterli in una camera a gas di induzione preoperatoria anestetica al 5% di isoflurano e al 100% di ossigeno a una velocità di flusso da 0,8 a 1 L/min (controllata dal vaporizzatore) per indurre l'anestesia generale.
- Sedare i ratti nella camera di induzione dell'anestesia, rimuoverli dalla camera, pesare, lubrificare i loro occhi con un unguento oftalmico sterile, quindi metterli in decubito dorsale su un dispositivo di riscaldamento a circolazione di acqua calda. Confermare un'adeguata profondità dell'anestesia utilizzando il riflesso del pedale (pizzicamento deciso delle dita).
- Radere l'addome ventrale con un tagliacapelli elettrico. Mantenere l'anestesia generale al 2,5% di isoflurano e al 100% di ossigeno a una velocità compresa tra 0,8 e 1 L/min con un circuito di non respirazione attraverso un cono nasale.
2. Ecografia del ratto
- Monitorare le valutazioni fisiologiche, tra cui frequenza respiratoria, frequenza cardiaca e temperatura, durante l'imaging.
- Per l'imaging addominale della Vena Cava Inferiore (IVC), applicare il gel conduttore e orientare il trasduttore in posizione trasversale. Durante la preimpostazione del vascolare periferico, utilizzare la modalità di imaging bidimensionale o la modalità B, abbassare la sonda lineare (10 MHz) al centro dell'addome, regolando la profondità con la pressione fino a quando i vasi addominali non sono visibili.
- Differenziare l'IVC dall'aorta addominale valutando la comprimibilità e valutando il flusso utilizzando sia la modalità Doppler a colori che a onde pulsate con una sonda lineare ad alta frequenza (10 mHz).
- Quando si applica la compressione con la sonda ecografica, differenziare i due poiché l'IVC è comprimibile, mentre l'aorta mantiene la sua forma e pervietà.
- Valuta la direzione e la velocità del flusso sanguigno utilizzando sia il Doppler a colori che quello a onde pulsate. La finestra color Doppler rappresenta il flusso verso la sonda in rosso e il flusso lontano dalla sonda in blu. Passare lo strumento alla modalità Doppler a onde pulsate (modalità Duplex) per valutare la direzione e la velocità del flusso sanguigno nel tempo. Acquisire le immagini di flusso necessarie utilizzando lo strumento di acquisizione automatica delle immagini dell'ecografo (le specifiche esatte per l'acquisizione delle immagini possono variare tra i sistemi a ultrasuoni).
- Utilizzare il seguente metodo di valutazione: l'aorta ha un flusso sanguigno verso la sonda e una forma d'onda trifasica, mentre l'IVC ha un flusso spontaneo lontano dalla sonda con un'ampiezza molto più bassa.
- Se l'IVC prossimale mostra una forma d'onda normale, ma viene rilevata distalmente una forma d'onda non fasica o assente (piatta), esplorare la possibilità di un'ostruzione venosa tra questi punti di esame.
- Una volta individuato l'IVC, identificare la sezione mediana, che si trova nel terzo porzione medio, inferiore alle vene renali e superiore alla biforcazione dell'IVC, molto probabilmente dove si trovano le vene lombari.
- Misurare nella sezione centrale IVC il diametro da parete a parete nella vista trasversale utilizzando l'immagine in sezione trasversale in modalità B, registrando il diametro più largo del recipiente. L'acquisizione delle immagini può variare a seconda delle macchine a ultrasuoni. Memorizza i dati utilizzando compact disk (CD) in file DICOM.
3. Microchirurgia e recupero del ratto
- Pulire l'addome con uno scrub alla clorexidina imbevuto di garza e una soluzione di clorexidina 3 volte per garantire una condizione chirurgica asettica.
- Posizionare la pellicola trasparente sterilizzata come impacco chirurgico per coprire il torace e l'area addominale del ratto, le manopole del microscopio (ingrandimento e messa a fuoco) e l'oculare.
- Praticare un'incisione ventrale sulla linea mediana (3 cm) a circa 2 cm sotto il processo xifoideo con le forbici dell'iride attraverso la pelle e la parete addominale, esponendo il contenuto addominale. Utilizzare una garza sterile imbevuta di soluzione salina da 2 pollici x 2 pollici per riflettere l'intestino sul lato destro dell'animale.
- Per l'esposizione IVC, eseguire una dissezione smussata utilizzando un applicatore sterile con punta di cotone. Posizionare uno speculum metallico nell'incisione, consentendo la visualizzazione IVC.
- Cauterizzare tutti i rami lombari IVC utilizzando un cauterio a punta fine a bassa temperatura, dalle vene renali alla biforcazione iliaca, e legare i rami laterali con suture in polipropilene 7-0 non assorbibili.
- Posizionare una microclip vascolare curva prossimale sull'IVC, che è separata dall'aorta e appena inferiore alle vene renali. Posizionare una microclip diritta sull'IVC distale, che è separata dall'aorta e superiore alla biforcazione dell'IVC.
- Piazzare un 8-0 sutura in nylon con punto a U caudale alla vena renale sinistra centrata sulla superficie anteriore dell'IVC.
- Inserire un filo guida affilato da 0,014 mm con il palloncino per venoplastica retrocaricato, retrogrado al flusso sanguigno nell'IVC infrarenale, caudale alla microclip curva.
- Fai avanzare il palloncino nel mezzo IVC usando la tecnica di Seldinger. Rimuovere il filo guida affilato e gonfiare il palloncino per venoplastica per 3 minuti con un sovrastiramento IVC dal 10% al 15% utilizzando una siringa di gonfiaggio da 20 ml per generare una pressione positiva in un intervallo compreso tra 0 e 30 Atm. Lavare tutti i sistemi con soluzione fisiologica sterile prima della canulazione IVC per evitare l'embolia gassosa.
NOTA: Un IVC da 2,8 mm subirebbe una venoplastica a 3,22 mm (15% di sovraallungamento). La pressione di gonfiaggio richiesta per raggiungere l'allungamento desiderato è determinata dalle caratteristiche del palloncino ed è disponibile sulla confezione del produttore. - Stringere il punto a U dopo lo sgonfiaggio e la rimozione del palloncino per venoplastica. Rimuovere le micro-clip.
- Chiudere il sito della laparotomia in modo a due strati. Utilizzare una sutura sintetica riassorbibile in poliglactina 5-0 in uno schema continuo per chiudere sia la parete addominale che la pelle.
- Somministrare buprenorfina sospensione iniettabile a rilascio prolungato, 0,65 mg/kg per via sottocutanea (SC) dopo l'intervento come analgesico per i ratti poiché non interferisce con i pannelli di biomarcatori delle molecole infiammatorie per l'analisi delle proteine.
- Recuperare i ratti in una gabbia individuale, osservare dopo l'intervento (30 min) sotto una lampada riscaldante (distanza minima - 24 pollici di distanza dalla gabbia), quindi tornare alle loro unità abitative originali.
- Per gli animali fittizi di ciascun gruppo sperimentale, eseguire solo la dissezione, senza la legatura, la cauterizzazione e l'incannulamento dei rami IVC.
- Per le condizioni post-trombotiche, posizionare una microclip vascolare diritta prossimale sull'IVC, che è separata dall'aorta, appena inferiore alle vene renali, per 24 ore. Utilizzare le stesse tecniche di dissezione e chiusura.
- Verificare la presenza di segni ecografici di occlusione IVC, che includono la visualizzazione della clip IVC, la conferma di IVC distale senza flusso e le vene iliache comuni distese. I punti temporali di follow-up possono essere personalizzati per adattarsi alle specifiche dello studio.
- Per osservare i cambiamenti fisiologici che vengono modellati, selezionare i punti temporali nelle prime 72 ore per la formazione precoce dei trombi e da 3 a 7 giorni dopo la procedura per la successiva risoluzione dei trombi. I punti temporali successivi testati in questo modello includono da 7 a 28 giorni 5,13.
- Utilizzare le tecniche nei passaggi 3.5-3.9 per la venoplastica con palloncino post-trombotico con le seguenti avvertenze: Potrebbe essere necessaria una pressione dell'insufflatore più elevata per ottenere l'allungamento desiderato poiché il diametro dell'IVC aumenta in condizioni post-trombotiche.
- Eseguire l'eutanasia secondo le raccomandazioni stabilite dalle attuali linee guida dell'American Veterinary Medical Association sull'eutanasia per i roditori eseguendo due metodi di conferma (rimozione del sangue e rimozione degli organi vitali) per garantire che l'animale non si rianima.
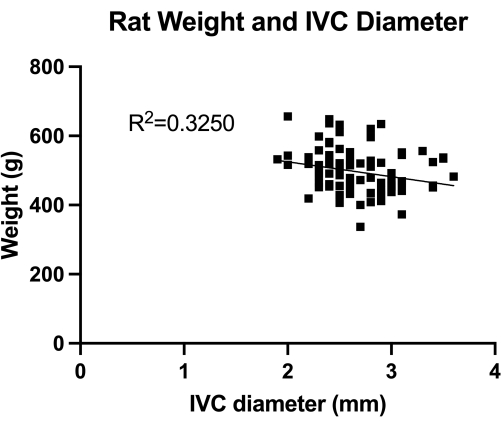
Figura 1: Distribuzione delle misure duplex transaddominali del diametro dell'IVC trasversale (sezione medio-infrarenale). La misurazione è stata effettuata in base al peso dell'animale. Non è stata trovata alcuna correlazione significativa tra il peso e il diametro dell'IVC. Clicca qui per visualizzare una versione più grande di questa figura.
4. Preparazione del campione
- Eseguire il trasferimento tissutale di conferma di palloncini per venoplastica rivestiti di farmaco utilizzando la tecnica di analisi della cromatografia liquida ad alte prestazioni (HPLC).
- Sezionare l'IVC e l'aorta e rimuoverli in blocco per l'inclusione di paraffina fissata in formalina e l'analisi istologica.
- Per l'analisi delle proteine, utilizzare il tampone RIPA in una concentrazione di diluizione di 60.000 μg/g di campione, processare con un omogeneizzatore tissutale in ambienti a bassa temperatura a 4 °C e conservare a -80 °C dopo il trattamento.
Risultati
Il VBM è un modello che valuta l'effetto dei palloncini per venoplastica nel controllo completo dell'emostasi. Innanzitutto, abbiamo quantificato il diametro IVC (sezione medio-infrarenale), come mostrato nella Figura 1, per il corretto dimensionamento del palloncino. In secondo luogo, la tecnica microchirurgica sviluppata passo dopo passo è illustrata nella Figura 2 e mostriamo anche esempi delle fasi critiche nella Figura 3. Si ...
Discussione
Il VBM può essere eseguito su ratti ≥ 250 g utilizzando palloncini nell'intervallo 2,5-3,5 mm. Per i ratti che superano i 750 g, la tecnica è limitata da una maggiore quantità di tessuto adiposo nella cavità addominale e nelle dimensioni degli organi piuttosto che da variazioni del diametro IVC. Dalla nostra esperienza, abbiamo scoperto che sono necessari 10 o più animali per gruppo per ottenere la significatività statistica tra i gruppi per l'analisi delle proteine della parete venosa o i saggi di attività e l'...
Divulgazioni
Non sono stati dichiarati conflitti di interesse.
Riconoscimenti
Questo studio è supportato dalla sovvenzione per la ricerca sulle scienze di base 2023 dell'American Venous Forum (AVF) e da Surmodics, Inc.
Materiali
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
Riferimenti
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon