Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Nagetier untere Vena Cava Venoplastik Ballonmodell
In diesem Artikel
Zusammenfassung
Das Protokoll stellt ein Überlebensmodell für Nagetiere vor, um Venoplastik-Ballon-Eingriffe (VB) in nicht-thrombotischen, thrombotischen und postthrombotischen tiefen Venen zu testen.
Zusammenfassung
Die Ballonvenoplastik ist eine häufig verwendete klinische Technik zur Behandlung von tiefen Venenstenosen und -verschlüssen als Folge von Traumata, angeborenen anatomischen Anomalien, akuter tiefer Venenthrombose (TVT) oder Stents. Die chronische tiefe Venenobstruktion ist histopathologisch durch Thrombose, Fibrose oder beides gekennzeichnet. Derzeit gibt es keine direkte Behandlung, um diese pathologischen Prozesse zu bekämpfen. Daher ist ein zuverlässiges in vivo Tiermodell notwendig, um neuartige Interventionen zu testen. Das Venoplastik-Ballonmodell (VBM) für das Überleben der Vena cava inferior (IVC) von Nagetieren ermöglicht die Untersuchung der Ballonvenoplastik bei nicht-thrombotischen und postthrombotischen Zuständen über mehrere Zeitpunkte. Die lokale und systemische Wirkung von beschichteten und unbeschichteten Venoplastik-Ballons kann über Gewebe-, Thrombus- und Blutassays wie Echtzeit-Polymerase-Kettenreaktion (RT-PCR), Western Blot, Enzyme-Linked Immunosorbent Assay (ELISA), Zymographie, Venenwand- und Thrombus-Zellanalyse, Vollblut- und Plasma-Assays und histologische Analyse quantifiziert werden. Das VBM ist reproduzierbar, repliziert chirurgische Eingriffe am Menschen, kann lokale Veränderungen des Venenwand-Thromben-Proteins identifizieren und ermöglicht mehrere Analysen aus derselben Probe, wodurch die Anzahl der benötigten Tiere pro Gruppe verringert wird.
Einleitung
Tiefvenenobstruktionen durch ungelöste Thromben sind eine häufige Folge der tiefen Venenthrombose (TVT) und eine der Ursachen für das postthrombotische Syndrom (PTS), das Milliarden von Dollar im Gesundheitswesen kostet und die Lebensqualität erheblich beeinträchtigt 1,2,3. PTS ist eine einzigartige entzündliche Pathologie mit einer daraus resultierenden Venenwandfibrose4, die in den TVT-Modellen von Kleintieren nicht vollständig erfasst wurde 5,6,7, und was noch wichtiger ist, frühere Modelle können das Ansprechen auf therapeutische Interventionen nicht bewerten. Thrombotische Venenobstruktionen werden häufig durch Stents und Ballonvenoplastik behandelt 8,9; Solche Eingriffe werden durch eine hohe Reinterventionsrate aufgrund von Restenose und Okklusion erschwert 10,11,12.
Trotz der Verfügbarkeit von medikamentenbeschichteten Ballons zur Behandlung arterieller Stenosen/Verschlüsse gibt es keine für tiefe Venen. Der molekulare Mechanismus hinter der Restenose ist in den Venen nur unzureichend verstanden und es gibt keine direkte Therapie4. Daher ist es unser Ziel, ein Tiermodell vorzustellen, das lokal verabreichte Therapeutika über Venoplastikballons testen kann, die postthrombotische Obstruktionen der tiefen Vene simulieren. Dieses Modell reproduziert den postthrombotischen Zustand und bewertet, wie sich verschiedene Arten von Venoplastikballons in vivo auf die Venenwand auswirken.
Protokoll
Das folgende Protokoll folgt den Richtlinien und Richtlinien des Institutional Animal Care and Use Committee (IACUC) der University of Michigan (UMICH), den Grundsätzen der US-Regierung für die Nutzung und Pflege von Wirbeltieren, die in Tests, Forschung und Ausbildung verwendet werden, und den ANARRIVE-Richtlinien 2.0. Das UMICH Animal Welfare Assurance-Abkommen ist konform mit OLAW und USDA und ist vollständig von AAALAC International akkreditiert. Dieses Protokoll wurde mit der ID-Nummer PRO00010841 genehmigt. Es wurden männliche ausgezüchtete Sprague Dawley-Ratten aus den Charles River Laboratories mit einem Gewicht von 450 g und einem Alter von 15 Wochen verwendet.
1. Rattenanästhesie
- Nehmen Sie die Tiere aus ihrem Käfig und setzen Sie sie in eine präoperative Induktionsgaskammer mit 5 % Isofluran und 100 % Sauerstoff bei einer Durchflussrate von 0,8 bis 1 l/min (verdampfergesteuert), um eine Vollnarkose einzuleiten.
- Betäuben Sie Ratten in der Narkose-Induktionskammer, nehmen Sie sie aus der Kammer, wiegen Sie, schmieren Sie ihre Augen mit steriler Augensalbe und legen Sie sie dann in Rückenlage auf ein warmes Wasser-Zirkulationsgerät. Bestätigen Sie die ausreichende Anästhesietiefe mit dem Pedalreflex (festes Einklemmen der Zehen).
- Rasieren Sie den Bauchbauch mit einer elektrischen Schermaschine. Halten Sie die Vollnarkose bei 2,5 % Isofluran und 100 % Sauerstoff bei 0,8 bis 1 l/min mit einem nicht rückatmenden Kreislauf durch einen Nasenkonus.
2. Ultraschalluntersuchung von Ratten
- Überwachen Sie physiologische Beurteilungen, einschließlich Atemfrequenz, Herzfrequenz und Temperatur, während der Bildgebung.
- Für die abdominale Bildgebung der Vena cava inferior (IVC) tragen Sie leitendes Gel auf und richten Sie den Schallkopf in einer transversalen Position aus. Verwenden Sie bei der Voreinstellung der peripheren Gefäße den zweidimensionalen Bildgebungsmodus oder den B-Modus, senken Sie die lineare Sonde (10 MHz) in der Mitte des Bauches ab und stellen Sie die Tiefe mit Druck ein, bis die Bauchgefäße sichtbar werden.
- Unterscheidung der IVC von der abdominalen Aorta durch Beurteilung der Kompressibilität und durch Beurteilung der Strömung sowohl im Farb- als auch im Pulsed-Wave-Doppler-Modus mit einer hochfrequenten linearen Sonde (10 mHz).
- Wenn Sie eine Kompression mit der Ultraschallsonde anwenden, unterscheiden Sie die beiden, da die IVC kompressibel ist, während die Aorta ihre Form und Durchgängigkeit beibehält.
- Beurteilen Sie die Richtung und Geschwindigkeit des Blutflusses, indem Sie sowohl Farb- als auch Pulswellendoppler verwenden. Das farbige Dopplerfenster stellt die Strömung in Richtung der Sonde in Rot dar und fließt in Blau von der Sonde weg. Schalten Sie das Gerät in den Pulswellen-Doppler-Modus (Duplex-Modus), um die Richtung und Geschwindigkeit des Blutflusses im Laufe der Zeit zu beurteilen. Erfassen Sie die erforderlichen Strömungsbilder mit dem automatisierten Bilderfassungstool des Ultraschallgeräts (Die genauen Spezifikationen für die Bildaufnahme können je nach Ultraschallsystem variieren).
- Verwenden Sie die folgende Bewertungsmethode: Die Aorta hat einen Blutfluss zur Sonde und eine triphasische Wellenform, während die IVC einen spontanen Fluss von der Sonde weg mit einer viel geringeren Amplitude hat.
- Wenn die proximale IVC eine normale Wellenform aufweist, aber eine nichtphasische oder fehlende (flache) Wellenform distal detektiert wird, ist die Möglichkeit einer venösen Obstruktion zwischen diesen Untersuchungspunkten zu untersuchen.
- Sobald die IVC lokalisiert ist, identifizieren Sie den mittleren Abschnitt, der sich im mittleren Drittel befindet, unterhalb der Nierenvenen und oberhalb der IVC-Bifurkation, höchstwahrscheinlich dort, wo sich die Lendenvenen befinden.
- Messen Sie im mittleren Abschnitt IVC den Wand-zu-Wand-Durchmesser in der Queransicht mit dem Querschnittsbild im B-Modus, wobei der breiteste Durchmesser des Behälters aufgezeichnet wird. Die Bildaufnahme kann bei verschiedenen Ultraschallgeräten variieren. Speichern Sie Daten mit Compact Disks (CDs) in DICOM-Dateien.
3. Mikrochirurgie und Genesung von Ratten
- Reinigen Sie den Bauch 3x mit in Mull getränktem Chlorhexidin-Peeling und Chlorhexidinlösung, um einen aseptischen chirurgischen Zustand zu gewährleisten.
- Legen Sie sterilisierte Frischhaltefolie als chirurgische Hülle auf, um den Thorax und den Bauchbereich der Ratte, die Mikroskopknöpfe (Vergrößerung und Fokussierung) und das Okular abzudecken.
- Machen Sie mit einer Irisschere durch die Haut und die Bauchdecke einen ventralen Mittellinienschnitt (3 cm) etwa 2 cm unterhalb des Processus xiphoideus, wobei der Bauchinhalt freigelegt wird. Verwenden Sie sterile, mit Kochsalzlösung getränkte 2 Zoll x 2 Zoll große Gaze, um den Darm auf die rechte Seite des Tieres zu reflektieren.
- Für die IVC-Exposition führen Sie eine stumpfe Dissektion mit einem sterilen Applikator mit Wattespitze durch. Platzieren Sie ein Drahtspekulum in der Inzision, um die IVC-Visualisierung zu ermöglichen.
- Verätzen Sie alle IVC-Lendenläste mit einem Niedertemperatur-Kauter mit feiner Spitze, von den Nierenvenen bis zur Beckenbifurkation, und ligieren Sie die Seitenäste mit 7-0 nicht resorbierbaren Polypropylen-Nähten.
- Platzieren Sie einen proximalen gekrümmten vaskulären Mikroclip auf der IVC, der von der Aorta getrennt und knapp unterhalb der Nierenvenen ist. Platzieren Sie einen geraden Mikroclip auf der distalen IVC, die von der Aorta getrennt und oberhalb der IVC-Bifurkation ist.
- Platzieren Sie einen 8-0 Nylon-U-Stich, Naht kaudal zur linken Nierenvene, zentriert auf der vorderen Oberfläche der IVC.
- Führen Sie einen 0,014 mm geschärften Führungsdraht mit dem Venoplastik-Ballon nach hinten ein, retrograd zum Blutfluss in die infrarenale IVC, kaudal zum gekrümmten Mikroclip.
- Schieben Sie den Ballon mit der Seldinger-Technik in die mittlere IVC. Entfernen Sie den geschärften Führungsdraht und blasen Sie den Venoplastikballon 3 Minuten lang mit einer IVC-Überdehnung von 10 % bis 15 % auf, indem Sie eine 20-ml-Aufblasspritze verwenden, um einen Überdruck über einen Bereich von 0-30 Atm zu erzeugen. Spülen Sie alle Systeme vor der IVC-Kanulation mit steriler Kochsalzlösung, um eine Luftembolie zu vermeiden.
HINWEIS: Eine IVC von 2,8 mm würde einer Venoplastik auf 3,22 mm (15 % Überdehnung) unterzogen werden. Der erforderliche Aufblasdruck, um die gewünschte Überdehnung zu erreichen, wird durch die Eigenschaften des Ballons bestimmt und ist auf der Verpackung des Herstellers angegeben. - Ziehen Sie den U-Stich bei der Venoplastik, der Ballonentleerung und -entfernung fest. Entfernen Sie die Mikroclips.
- Schließen Sie die Laparotomiestelle in zwei Schichten. Verwenden Sie ein 5-0 Polyglactin resorbierbares synthetisches Naht in einem kontinuierlichen Muster, um sowohl die Bauchdecke als auch die Haut zu schließen.
- Verabreichen Sie Buprenorphin in einer injizierbaren Suspension mit verlängerter Freisetzung, 0,65 mg/kg subkutan (SC) postoperativ als Analgetikum bei Ratten, da es die Biomarker-Panels von Entzündungsmolekülen für die Proteinanalyse nicht beeinträchtigt.
- Erholen Sie die Ratten in einem einzelnen Käfig, beobachten Sie sie postoperativ (30 min) unter einer Heizlampe (Mindestabstand - 24 Zoll vom Käfig) und kehren Sie dann in ihre ursprünglichen Haltungseinheiten zurück.
- Bei Scheintieren aus jeder Versuchsgruppe wird nur die Dissektion durchgeführt, ohne die Ligatur der IVC-Äste, die Kauterisation und die Kanülierung.
- Bei postthrombotischen Zuständen platzieren Sie einen proximalen geraden vaskulären Mikroclip für 24 Stunden auf der IVC, die von der Aorta getrennt ist, knapp unterhalb der Nierenvenen. Verwenden Sie die gleichen Präparier- und Schließtechniken.
- Überprüfen Sie auf die Ultraschallzeichen eines IVC-Verschlusses, zu denen die Visualisierung des IVC-Clips, die Bestätigung der distalen IVC ohne Fluss und die Erweiterung der Vena iliaca communis gehören. Die Nachbeobachtungszeitpunkte können an die Spezifikationen der Studie angepasst werden.
- Um die physiologischen Veränderungen zu beobachten, die modelliert werden, wählen Sie Zeitpunkte in den ersten 72 Stunden für die frühe Thrombenbildung und zwischen 3 und 7 Tagen nach dem Eingriff für eine spätere Thrombenauflösung. Spätere Zeitpunkte, die in diesem Modell getestet wurden, umfassen 7 bis 28 Tage 5,13.
- Verwenden Sie die Techniken in den Schritten 3.5-3.9 für die postthrombotische Ballonvenoplastik mit den folgenden Einschränkungen: Möglicherweise ist ein höherer Insufflatordruck erforderlich, um die gewünschte Überdehnung zu erreichen, da der IVC-Durchmesser bei postthrombotischen Zuständen zunimmt.
- Führen Sie die Euthanasie gemäß den Empfehlungen der aktuellen Richtlinien der American Veterinary Medical Association zur Euthanasie für Nagetiere durch, indem Sie zwei Bestätigungsmethoden (Blutentnahme und Entfernung lebenswichtiger Organe) durchführen, um sicherzustellen, dass das Tier nicht wiederbelebt wird.
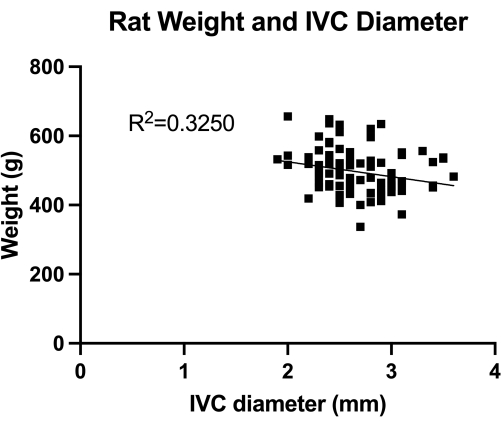
Abbildung 1: Verteilung der transabdominalen Duplexmaße des transversalen IVC-Durchmessers (mittlerer infrarenierender Abschnitt). Die Messung erfolgte anhand des Tiergewichts. Es wurde keine signifikante Korrelation zwischen dem Gewicht und dem IVC-Durchmesser gefunden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Vorbereitung der Probe
- Führen Sie einen konfirmatorischen Gewebetransfer von medikamentenbeschichteten Venoplastikballons mit der Hochleistungsflüssigkeitschromatographie (HPLC)-Assay-Technik durch.
- Präparieren Sie die IVC und die Aorta und entfernen Sie sie en bloc für die formalinfixierte Paraffineinbettung und histologische Analyse.
- Für die Proteinanalyse ist RIPA-Puffer in einer Verdünnungskonzentration von 60.000 μg/g Probe zu verwenden, mit einem Gewebehomogenisator in einem Niedertemperaturraum bei 4 °C zu verarbeiten und nach der Verarbeitung bei -80 °C zu lagern.
Ergebnisse
Das VBM ist ein Modell, das die Wirkung von Venoplastikballons bei der vollständigen Blutstillungskontrolle bewertet. Zunächst quantifizierten wir den IVC-Durchmesser (mittlerer infrarenaler Schnitt), wie in Abbildung 1 gezeigt, für die korrekte Ballongröße. Zweitens ist die entwickelte mikrochirurgische Schritt-für-Schritt-Technik in Abbildung 2 dargestellt, und wir zeigen auch Beispiele für die kritischen Schritte in Abbildung 3
Diskussion
Die VBM kann an Ratten ≥ 250 g mit Ballons im Bereich von 2,5 bis 3,5 mm durchgeführt werden. Bei Ratten mit einem Gewicht von mehr als 750 g ist die Technik durch eine höhere Menge an Fettgewebe in der Bauchhöhle und die Organgröße begrenzt und nicht durch Veränderungen des IVC-Durchmessers. Aus unserer Erfahrung haben wir festgestellt, dass 10 oder mehr Tiere pro Gruppe erforderlich sind, um eine statistische Signifikanz zwischen den Gruppen für die Analyse von Venenwandproteinen oder Aktivitätsassays und die...
Offenlegungen
Es wurden keine Interessenkonflikte erklärt.
Danksagungen
Diese Studie wird durch das American Venous Forum (AVF) 2023 Basic Science Research Grant und Surmodics, Inc. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
Referenzen
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten