Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kemirgen İnferior Vena Cava Venoplasti Balon Modeli
Bu Makalede
Özet
Protokol, trombotik olmayan, trombotik ve trombotik sonrası derin venlerde venoplasti balonu (VB) müdahalelerini test etmek için bir sağkalım kemirgen modeli sunar.
Özet
Balon venoplasti, travma, konjenital anatomik anormallikler, akut derin ven trombozu (DVT) veya stentleme sonucu derin ven darlığı ve tıkanıklığını tedavi etmek için yaygın olarak kullanılan bir klinik tekniktir. Kronik derin ven tıkanıklığı histopatolojik olarak tromboz, fibrozis veya her ikisi ile karakterizedir. Şu anda, bu patolojik süreçleri hedef almak için doğrudan bir tedavi mevcut değildir. Bu nedenle, yeni müdahaleleri test etmek için güvenilir bir in vivo hayvan modeli gereklidir. Kemirgen sağkalımı inferior vena kava (IVC) venoplasti balon modeli (VBM), trombotik olmayan ve trombotik sonrası koşullarda balon venoplastisinin birden fazla zaman noktasında çalışılmasına olanak tanır. Kaplamalı ve kaplamasız venoplasti balonlarının lokal ve sistemik etkisi, gerçek zamanlı polimeraz zincir reaksiyonu (RT-PCR), western blot, enzime bağlı immünosorbent testi (ELISA), zimografi, ven duvarı ve trombüs hücresel analizi, tam kan ve plazma testleri ve histolojik analiz gibi doku, trombüs ve kan testleri ile ölçülebilir. VBM tekrarlanabilir, cerrahi insan müdahalelerini çoğaltır, lokal ven duvarı-trombüs protein değişikliklerini tanımlayabilir ve aynı numuneden birden fazla analize izin vererek grup başına gereken hayvan sayısını azaltır.
Giriş
Çözülmemiş trombüslerden kaynaklanan derin ven tıkanıklıkları, derin ven trombozunun (DVT) yaygın bir sonucudur ve post-trombotik sendromun (PTS) nedenlerinden biridir, sağlık hizmetlerinde milyarlarca dolara mal olur ve yaşam kalitesini önemli ölçüde etkiler 1,2,3. PTS, küçük hayvan DVT modellerinde 5,6,7 tam olarak yakalanamayan ven duvarı fibrozu4 ile benzersiz bir inflamatuar patolojidir ve daha da önemlisi, önceki modeller terapötik müdahalelere yanıtı değerlendiremez. Trombotik venöz tıkanıklıklar sıklıkla stentleme ve balon venoplasti ile tedavi edilir 8,9; Bu tür girişimler, restenoz ve oklüzyon nedeniyle yüksek bir yeniden girişim oranı ile engellenmektedir 10,11,12.
Arteryel spesifik darlık/tıkanıklıkları gidermek için ilaç kaplı balonların mevcudiyetine rağmen, derin venler için hiçbiri mevcut değildir. Restenozun arkasındaki moleküler mekanizma damarlarda tam olarak anlaşılamamıştır ve doğrudan tedavisi yoktur4. Bu nedenle amacımız, derin ven trombotik sonrası tıkanıklıkları simüle eden venoplasti balonları aracılığıyla lokal olarak verilen terapötikleri test edebilen bir hayvan modeli sunmaktır. Bu model, trombotik sonrası durumu yeniden üretir ve farklı venoplasti balonlarının damar duvarını in vivo olarak nasıl etkilediğini değerlendirir.
Protokol
Aşağıdaki protokol, Michigan Üniversitesi (UMICH) Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) politikalarını ve yönergelerini, Test, Araştırma ve Eğitimde Kullanılan Omurgalı Hayvanların Kullanımı ve Bakımına İlişkin ABD Hükümeti İlkeleri ve ARRIVE yönergeleri 2.0'ı takip eder. UMICH Hayvan Refahı Güvencesi anlaşması, OLAW ve USDA ile uyumludur ve AAALAC International tarafından tamamen akredite edilmiştir. Bu protokol PRO00010841 kimlik numarası ile onaylanmıştır. Charles River Laboratuvarları'ndan 450 g ağırlığında ve 15 haftalık erkek soylu Sprague Dawley sıçanları kullanıldı.
1. Sıçan anestezisi
- Hayvanları kafeslerinden çıkarın ve genel anesteziyi indüklemek için 0,8 ila 1 L/dk (buharlaştırıcı kontrollü) akış hızında %5 izofluran ve %100 oksijen içeren anestezik bir ameliyat öncesi indüksiyon gaz odasına yerleştirin.
- Anestezik indüksiyon odasındaki fareleri yatıştırın, odadan çıkarın, tartın, gözlerini steril oftalmik merhem ile yağlayın ve daha sonra ılık su sirkülasyonlu bir ısıtma cihazı üzerinde dorsal yaslanma pozisyonuna yerleştirin. Pedal refleksini (sert ayak parmağı tutam) kullanarak yeterli anestezi derinliğini onaylayın.
- Ventral karnı elektrikli makaslarla tıraş edin. Genel anesteziyi% 2.5 izofluran ve% 100 oksijende 0.8 ila 1 L / dk'da bir burun konisinden yeniden nefes almayan bir devre ile koruyun.
2. Sıçan ultrason taraması
- Görüntüleme sırasında solunum hızı, kalp atış hızı ve sıcaklık dahil olmak üzere fizyolojik değerlendirmeleri izleyin.
- İnferior Vena Cava'nın (IVC) abdominal görüntülemesi için iletken jel uygulayın ve dönüştürücüyü enine pozisyonda yönlendirin. Periferik vasküler prestrüksiyonu ayarlarken, iki boyutlu görüntüleme modunu veya B modunu kullanın, karın merkezindeki doğrusal probu (10 MHz) indirin, karın damarları görünene kadar derinliği basınçla ayarlayın.
- Sıkıştırılabilirliği değerlendirerek ve yüksek frekanslı doğrusal prob (10 mHz) ile hem renkli hem de darbeli dalga Doppler modunu kullanarak akışı değerlendirerek IVC'yi abdominal aorttan ayırt edin.
- Ultrason probu ile kompresyon uygularken, IVC sıkıştırılabilir olduğundan, aort şeklini ve açıklığını koruduğundan ikisini ayırt edin.
- Hem renkli hem de darbeli dalga Doppler kullanarak kan akışının yönünü ve hızını değerlendirin. Renkli Doppler penceresi, proba doğru kırmızı renkte akışı temsil eder ve mavi renkte probdan uzaklaşır. Zaman içindeki kan akış yönünü ve hızını değerlendirmek için cihazı nabız dalgası Doppler moduna (Dubleks modu) geçirin. Ultrason makinesinin otomatik görüntü yakalama aracını kullanarak gerekli akış görüntülerini elde edin (Görüntü alma için kesin özellikler ultrason sistemleri arasında farklılık gösterebilir).
- Aşağıdaki değerlendirme yöntemini kullanın: aort proba doğru kan akışına ve trifazik bir dalga formuna sahipken, IVC probdan çok daha düşük bir genliğe sahip spontan akışa sahiptir.
- Proksimal IVC normal bir dalga formu gösteriyorsa, ancak distal olarak fazik olmayan veya eksik (düz) bir dalga formu tespit edilirse, bu muayene noktaları arasında venöz bir tıkanıklık olasılığını araştırın.
- IVC yerleştirildikten sonra, orta üçüncü kısımda bulunan, renal damarlardan daha düşük ve IVC bifurkasyonundan daha üstün olan, büyük olasılıkla lomber damarların bulunduğu orta bölümü tanımlayın.
- Teknenin en geniş çapını kaydeden enine kesit B-modu görüntüsünü kullanarak enine görünümde duvardan duvara çapı orta kesit IVC'de ölçün. Görüntüleme alımı, farklı ultrason makinelerinde değişebilir. DICOM dosyalarında kompakt diskler (CD'ler) kullanarak verileri depolayın.
3. Sıçan mikro cerrahisi ve iyileşmesi
- Aseptik bir cerrahi durum sağlamak için karnı gazlı bezle ıslatılmış klorheksidin ovma ve klorheksidin solüsyonu 3x ile temizleyin.
- Sıçan göğüs kafesi ve karın bölgesini, mikroskop düğmelerini (büyütme ve odaklama) ve göz merceğini kaplamak için sterilize edilmiş streç filmi cerrahi sargı olarak yerleştirin.
- Ksifoid işleminin yaklaşık 2 cm altında iris makası ile deri ve karın duvarından karın içeriğini açığa çıkaran bir ventral orta hat insizyonu (3 cm) yapın. Bağırsakları hayvanın sağ tarafına yansıtmak için steril tuzlu suya batırılmış 2 inç x 2 inç gazlı bez kullanın.
- IVC maruziyeti için, steril bir pamuk uçlu aplikatör kullanarak künt bir diseksiyon yapın. İnsizyona bir tel spekulum yerleştirin, bu da IVC görselleştirmesine izin verir.
- Renal venlerden iliak bifurkasyona kadar tüm IVC lomber dalları düşük sıcaklıkta ince uçlu bir koter kullanarak koterize edin ve yan dalları 7-0 emilemeyen polipropilen sütürlerle bağlayın.
- IVC'ye, aorttan ayrılan ve renal venlerin hemen altında olan proksimal kavisli bir vasküler mikro klips yerleştirin. Aorttan ayrılan ve IVC bifurkasyonundan daha üstün olan distal IVC'ye düz bir mikroklips yerleştirin.
- 8-0'lık bir skor naylon U dikişli sütür, IVC'nin ön yüzeyi üzerinde ortalanmış sol renal ven kaudal.
- Venoplasti balonu geri yüklü, infrarenal IVC'ye kan akışına retrograd, kavisli mikro klipse kaudal olarak 0.014 mm keskinleştirilmiş bir kılavuz tel yerleştirin.
- Seldinger tekniğini kullanarak balonu IVC'nin ortasına ilerletin. Keskinleştirilmiş kılavuz teli çıkarın ve venoplasti balonunu 0-30 Atm aralığında pozitif basınç oluşturmak için 20 mL'lik bir şişirme şırıngası kullanarak %10 ila %15 IVC aşırı gerilme ile 3 dakika boyunca şişirin. Hava embolisini önlemek için IVC kanülasyonundan önce tüm sistemleri steril tuzlu su ile yıkayın.
NOT: 2,8 mm'lik bir IVC, 3,22 mm'ye (%15 aşırı gerilme) venoplasti uygulanacaktır. İstenen aşırı gerilmeye ulaşmak için gereken şişirme basıncı, balonun özelliklerine göre belirlenir ve üreticinin ambalajında bulunur. - Venoplasti balonunun söndürülmesi ve çıkarılması üzerine U dikişini sıkın. Mikro klipsleri çıkarın.
- Laparotomi bölgesini iki katmanlı bir şekilde kapatın. Hem karın duvarını hem de cildi kapatmak için sürekli bir düzende 5-0 poliglaktin emilebilir sentetik sütür kullanın.
- Protein analizi için enflamatuar moleküllerin biyobelirteç panellerine müdahale etmediğinden, sıçanlar için analjezik olarak ameliyat sonrası 0.65 mg / kg deri altı (SC) buprenorfin uzatılmış salımlı enjekte edilebilir süspansiyon uygulayın.
- Fareleri ayrı bir kafeste kurtarın, ameliyat sonrası (30 dakika) bir ısıtma lambası altında (minimum mesafe - kafesten 24 inç uzakta) gözlemleyin ve ardından orijinal muhafaza birimlerine geri dönün.
- Her deney grubundan sahte hayvanlar için, IVC dalları ligasyonu, koterizasyon ve kanülasyon olmadan sadece diseksiyon yapın.
- Trombotik sonrası durumlar için, 24 saat boyunca aorttan ayrılan, renal damarların hemen altında olan IVC'ye proksimal düz bir vasküler mikro klips yerleştirin. Aynı diseksiyon ve kapatma tekniklerini kullanın.
- IVC klibinin görselleştirilmesini, akışsız distal IVC'nin doğrulanmasını ve şişmiş ortak iliak damarları içeren IVC oklüzyonunun ultrason belirtilerini kontrol edin. Takip zaman noktaları, etüdün özelliklerine uyacak şekilde özelleştirilebilir.
- Modellenmekte olan fizyolojik değişiklikleri gözlemlemek için, erken trombüs oluşumu için ilk 72 saat içinde ve daha sonraki trombüs çözünürlüğü için işlem sonrası 3 ila 7 gün arasında zaman noktalarını seçin. Bu modelde test edilen daha sonraki zaman noktaları 7 ila 28 güniçerir 5,13.
- Trombotik balon venoplasti sonrası için adım 3.5-3.9'daki teknikleri aşağıdaki uyarılarla birlikte kullanın: Trombotik sonrası koşullarda IVC çapı arttığından, istenen aşırı gerilmeyi elde etmek için daha yüksek bir insüflatör basıncı gerekebilir.
- Hayvanın canlanmamasını sağlamak için iki doğrulayıcı yöntem (kan alma ve hayati organın çıkarılması) uygulayarak kemirgenler için Ötanazi Kılavuzu'nun mevcut Amerikan Veteriner Hekimler Birliği Kılavuzu'nda belirtilen tavsiyeler uyarınca ötenazi gerçekleştirin.
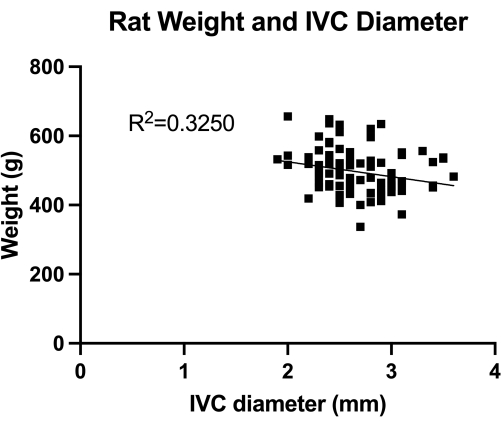
Şekil 1: Transabdominal dubleks transvers IVC (orta infrarenal kesit) çapının dağılımı. Ölçüm hayvan ağırlığına göre yapıldı. Ağırlık ile İVK çapı arasında anlamlı bir ilişki bulunamadı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Numune hazırlama
- Yüksek performanslı sıvı kromatografisi (HPLC) tahlil tekniğini kullanarak ilaç kaplı venoplasti balonlarının doğrulayıcı doku transferini gerçekleştirin.
- IVC ve aortu inceleyin ve formalinle sabitlenmiş parafin yerleştirme ve histolojik analiz için en bloğu çıkarın.
- Protein analizi için, 60.000 μg/g numune seyreltme konsantrasyonunda RIPA tamponu kullanın, düşük sıcaklıktaki oda ortamlarında 4 °C'de bir doku homojenizatörü ile işlem yapın ve işlemden sonra -80 °C'de saklayın.
Sonuçlar
VBM, venoplasti balonlarının tam hemostaz kontrolündeki etkisini değerlendiren bir modeldir. İlk olarak, doğru balon boyutlandırması için Şekil 1'de gösterildiği gibi IVC (orta kızılötesi bölüm) çapını ölçtük. İkinci olarak, geliştirilen adım adım mikrocerrahi tekniği Şekil 2'de gösterilmektedir ve ayrıca Şekil 3'te kritik adımların örneklerini de gösteriyoruz. Bilenmiş kılavuz tel ile IVC kanü...
Tartışmalar
VBM, 2.5-3.5 mm aralığındaki balonlar kullanılarak 250 g'≥ sıçanlarda gerçekleştirilebilir. 750 g'ı aşan sıçanlar için teknik, IVC çapındaki değişikliklerden ziyade karın boşluğunda daha yüksek miktarda yağ dokusu ve organ boyutu ile sınırlıdır. Deneyimlerimize dayanarak, damar duvarı protein analizi veya aktivite tahlilleri ve histoloji için gruplar arasında istatistiksel anlamlılık elde etmek için grup başına 10 veya daha fazla hayvana ihtiyaç olduğunu bulduk. Cerrahi müdahaleler ...
Açıklamalar
Herhangi bir çıkar çatışması ilan edilmedi.
Teşekkürler
Bu çalışma American Venous Forum (AVF) 2023 Temel Bilimler araştırma bursu ve Surmodics, Inc. tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
Referanslar
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır