JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
설치류 하부 정맥 Cava 정맥 성형술 풍선 모델
요약
이 프로토콜은 비혈전성, 혈전성 및 혈전 후 심부 정맥에서 정맥 성형 풍선(VB) 중재를 테스트하기 위한 생존 설치류 모델을 제시합니다.
초록
풍선 정맥 성형술은 외상, 선천성 해부학적 이상, 급성 심부 정맥 혈전증(DVT) 또는 스텐트 시술의 결과로 심부 정맥 협착 및 폐색을 치료하는 데 일반적으로 사용되는 임상 기술입니다. 만성 심부 정맥 폐쇄는 조직 병리학적으로 혈전증, 섬유증 또는 둘 다를 특징으로 합니다. 현재로서는 이러한 병리학적 과정을 표적으로 삼을 수 있는 직접적인 치료법은 없습니다. 따라서 새로운 중재를 테스트하기 위한 신뢰할 수 있는 in vivo 동물 모델이 필요합니다. 설치류 생존 하대정맥(IVC) 정맥 성형 풍선 모델(VBM)을 사용하면 여러 시점에 걸쳐 비혈전성 및 혈전 후 조건에서 풍선 정맥 성형술을 연구할 수 있습니다. 코팅된 정맥 성형술 풍선과 코팅되지 않은 정맥 성형술 풍선의 국소 및 전신 효과는 실시간 중합효소 연쇄 반응(RT-PCR), 웨스턴 블롯, 효소 결합 면역 흡착 분석(ELISA), 자이모그래피, 정맥벽 및 혈전 세포 분석, 전혈 및 혈장 분석, 조직학적 분석과 같은 조직, 혈전 및 혈액 분석을 통해 정량화할 수 있습니다. VBM은 재현성이 있고, 인간의 외과적 개입을 복제하며, 국소 정맥벽 혈전 단백질 변화를 식별할 수 있고, 동일한 샘플에서 여러 분석을 수행할 수 있어 그룹당 필요한 동물 수를 줄일 수 있습니다.
서문
해결되지 않은 혈전으로 인한 심부 정맥 폐색은 심부 정맥 혈전증(DVT)의 흔한 결과이며 혈전 후 증후군(PTS)의 원인 중 하나이며 수십억 달러의 의료 비용이 발생하고 삶의 질에 상당한 영향을 미칩니다 1,2,3. PTS는 소동물 DVT 모델 5,6,7에서 완전히포착되지 않은 결과적인 정맥벽 섬유증4을 동반하는 독특한 염증성 병리학이며, 더 중요한 것은 이전 모델에서는 치료적 개입에 대한 반응을 평가할 수 없다는 것이다. 혈전성 정맥 폐색은 종종 스텐트 삽입술과 풍선 정맥 성형술로 치료한다 8,9; 이러한 중재는 재협착 및 폐색으로 인한 높은 재중재율로 인해 방해를 받는다10,11,12.
동맥 특이적 협착/폐색을 해결하기 위해 약물 코팅된 풍선을 사용할 수 있음에도 불구하고 심부 정맥에는 존재하지 않습니다. 재협착의 분자 기전은 정맥에서 잘 이해되지 않고 있으며 직접적인 치료법이 없다4. 따라서 우리의 목표는 정맥 성형 풍선을 통해 심부 정맥 혈전 후 폐색을 시뮬레이션하여 국소적으로 전달된 치료제를 테스트할 수 있는 동물 모델을 제시하는 것입니다. 이 모델은 혈전 후 상태를 재현하고 다양한 유형의 정맥 성형 풍선이 생체 내 정맥 벽에 어떤 영향을 미치는지 평가합니다.
프로토콜
다음 프로토콜은 University of Michigan (UMICH) Institutional Animal Care and Use Committee (IACUC) 정책 및 지침, 테스트, 연구 및 교육에 사용되는 척추 동물의 활용 및 관리에 대한 미국 정부 원칙 및 ARRIVE 지침 2.0을 따릅니다. UMICH 동물 복지 보증 계약은 OLAW 및 USDA를 준수하며 AAALAC International의 완전한 인증을 받았습니다. 이 프로토콜은 ID 번호 PRO00010841로 승인되었습니다. 찰스 리버 연구소(Charles River Laboratories)의 수컷 외래종 스프라그 돌리(Sprague Dawley) 쥐를 사용했는데, 체중은 450g이고 생후 15주령이었다.
1. 쥐 마취
- 동물을 케이지에서 꺼내 5% 이소플루란과 100% 산소로 0.8-1L/min(기화기 제어)의 유속으로 마취 수술 전 유도 가스실에 넣어 전신 마취를 유도합니다.
- 마취 유도 챔버에서 쥐를 진정시키고 챔버에서 제거하고 무게를 측정하고 멸균 안과 연고로 눈을 윤활한 다음 따뜻한 물 순환 가열 장치에 등쪽 누운 곳에 놓습니다. 페달 반사(확고한 발가락 꼬집기)를 사용하여 적절한 마취 깊이를 확인합니다.
- 전기 가위로 복부 부분을 면도하십시오. 전신 마취를 2.5% 이소플루란, 100% 산소를 0.8-1L/min으로 유지하고 노즈콘을 통한 비재호흡 회로를 사용합니다.
2. 쥐 초음파 검사
- 이미징 중에 호흡수, 심박수 및 온도를 포함한 생리학적 평가를 모니터링합니다.
- IVC(Inferior Vena Cava)의 복부 이미징을 위해 전도성 젤을 바르고 변환기를 가로 위치로 향하게 합니다. 말초 혈관을 사전 설정하는 동안 2차원 이미징 모드 또는 B 모드를 사용하고 복부 중앙의 선형 프로브(10MHz)를 낮추고 복부 혈관이 보일 때까지 압력으로 깊이를 조정합니다.
- 압축률을 평가하고 고주파 선형 프로브(10mHz)와 함께 컬러 및 펄스파 도플러 모드를 사용하여 흐름을 평가하여 IVC를 복부 대동맥과 구별합니다.
- 초음파 프로브로 압박을 가할 때 IVC는 압축성이 있는 반면 대동맥은 모양과 개통성을 유지하므로 두 가지를 구별하십시오.
- 컬러 도플러와 펄스파 도플러를 사용하여 혈류의 방향과 속도를 평가합니다. 컬러 도플러 창은 프로브를 향한 흐름을 빨간색으로 나타내고 프로브에서 멀어지는 흐름을 파란색으로 나타냅니다. 기기를 맥파 도플러 모드(듀플렉스 모드)로 전환하여 시간 경과에 따른 혈류 방향과 속도를 평가합니다. 초음파 기계의 자동 이미지 캡처 도구를 사용하여 필요한 유동 이미지를 획득합니다(이미지 획득을 위한 정확한 사양은 초음파 시스템마다 다를 수 있음).
- 다음과 같은 평가 방법을 사용하십시오: 대동맥은 프로브를 향한 혈류와 삼중 파형을 갖는 반면, IVC는 훨씬 더 낮은 진폭으로 프로브에서 자발적으로 흐르는 흐름을 가지고 있습니다.
- 근위 IVC가 정상 파형을 표시하지만 비위상 파형 또는 부재(평면) 파형이 원위부에서 감지되는 경우 이러한 검사 지점 사이에 정맥 폐쇄가 있을 가능성을 탐색합니다.
- IVC가 발견되면 중간 세 번째 부분에 있는 중간 부분을 식별하며, 이는 신장 정맥보다 열등하고 IVC 분기보다 우월하며, 요추 정맥이 위치한 위치일 가능성이 높습니다.
- 중간 섹션 IVC에서 단면 B-모드 이미지를 사용하여 횡면도에서 벽에서 벽까지의 직경을 측정하고 용기의 가장 넓은 직경을 기록합니다. 이미징 획득은 초음파 기계에 따라 다를 수 있습니다. 컴팩트 디스크(CD)를 사용하여 데이터를 DICOM 파일에 저장합니다.
3. 쥐 미세 수술 및 회복
- 거즈에 적신 클로르헥시딘 스크럽과 클로르헥시딘 용액으로 복부를 3회 세척하여 무균 수술 상태를 보장합니다.
- 멸균된 접착 필름을 쥐의 흉부와 복부 영역, 현미경 손잡이(확대 및 초점) 및 접안렌즈를 덮는 수술용 랩으로 놓습니다.
- 아이리스 가위로 피부와 복벽을 통해 복부 내용물이 노출되도록 시푸스 돌기에서 약 2cm 아래에 복부 정중선(3cm)을 절개합니다. 멸균 식염수에 적신 2인치 x 2인치 거즈를 사용하여 장을 동물의 오른쪽으로 반사시킵니다.
- IVC 노출의 경우 멸균 면 팁 애플리케이터를 사용하여 둔기 절개를 수행합니다. 절개 부위에 와이어 검경을 배치하여 IVC 시각화를 가능하게 합니다.
- 저온의 미세한 팁 소작을 사용하여 신장 정맥에서 장골 분기까지 모든 IVC 요추 가지를 소작하고 7-0 비흡수성 폴리프로필렌 봉합사로 곁가지를 결찰합니다.
- IVC에 근위 곡선 혈관 마이크로 클립을 삽입하며, IVC는 대동맥에서 분리되어 신장 정맥 바로 아래에 있습니다. 대동맥에서 분리되어 IVC 분기보다 우수한 원위 IVC에 직선 마이크로클립을 놓습니다.
- 8-0 플레이스 나일론 U 스티치는 IVC의 전방 표면을 중심으로 왼쪽 신장 정맥까지 꼬리를 봉합합니다.
- 정맥 성형술 풍선이 백로드된 상태에서 0.014mm의 날카로운 가이드와이어를 삽입하고 구부러진 마이크로 클립의 꼬리 부분인 infraarenal IVC로 혈류를 역행합니다.
- Seldinger 기술을 사용하여 풍선을 IVC 중반으로 전진시킵니다. 날카로운 가이드와이어를 제거하고 20mL 팽창 주사기를 사용하여 10%에서 15% IVC 오버스트레치로 정맥 성형 풍선을 3분 동안 팽창시켜 0-30atm 범위에서 양압을 생성합니다. 공기 색전증을 방지하기 위해 IVC 캐뉼레이션 전에 모든 시스템을 멸균 식염수로 세척합니다.
참고: 2.8mm IVC는 3.22mm(15% 과신전)로 정맥 성형술을 받습니다. 원하는 오버스트레치에 도달하는 데 필요한 팽창 압력은 풍선의 특성에 따라 결정되며 제조업체의 포장에서 사용할 수 있습니다. - 정맥 성형술 풍선 수축 및 제거 시 U 스티치를 조입니다. 마이크로 클립을 제거합니다.
- 개복술 부위를 2층으로 닫습니다. 5-0 폴리글락틴 흡수성 합성 봉합사를 연속적인 패턴으로 사용하여 복벽과 피부를 모두 닫습니다.
- 단백질 분석을 위한 염증성 분자의 바이오마커 패널을 방해하지 않기 때문에 수술 후 부프레노르핀 서방형 주사 가능한 현탁액인 0.65mg/kg 피하(SC)를 쥐용 진통제로 투여합니다.
- 개별 케이지에서 쥐를 회수하고 가열 램프 아래에서 수술 후(30분) 관찰한 다음(케이지에서 최소 거리 - 24인치) 원래 주택 유닛으로 돌아갑니다.
- 각 실험 그룹의 가짜 동물의 경우 IVC 가지 결찰, 소작 및 캐뉼레이션 없이 해부만 수행합니다.
- 혈전 후 상태의 경우, 신장 정맥 바로 아래쪽에 있는 대동맥에서 분리된 IVC에 근위 직선 혈관 마이크로 클립을 24시간 동안 놓습니다. 동일한 해부 및 폐쇄 기술을 사용합니다.
- IVC 클립의 시각화, 흐름이 없는 원위 IVC 확인, 총회장맥 팽창을 포함하는 IVC 폐색의 초음파 징후를 확인합니다. 후속 시점은 연구 사양에 맞게 사용자 지정할 수 있습니다.
- 모델링되는 생리적 변화를 관찰하려면 초기 혈전 형성을 위해 처음 72시간 동안의 시점을 선택하고 나중에 혈전 해결을 위해 시술 후 3일에서 7일 사이의 시점을 선택합니다. 이 모델에서 테스트된 나중 시점에는 7일에서 28일(5,13)이 포함됩니다.
- 혈전 후 풍선 정맥 성형술을 위해 3.5-3.9단계의 기술을 다음 주의 사항과 함께 사용하십시오: 혈전 후 조건에서 IVC 직경이 증가하기 때문에 원하는 과신전을 달성하기 위해 더 높은 인서플리터 압력이 필요할 수 있습니다.
- 설치류에 대한 안락사에 대한 미국 수의학 협회 지침(American Veterinary Medical Association Guidelines on Euthanasia)에 명시된 권장 사항에 따라 동물이 소생하지 않도록 두 가지 확인 방법(혈액 제거 및 필수 장기 제거)을 수행하여 안락사를 수행합니다.
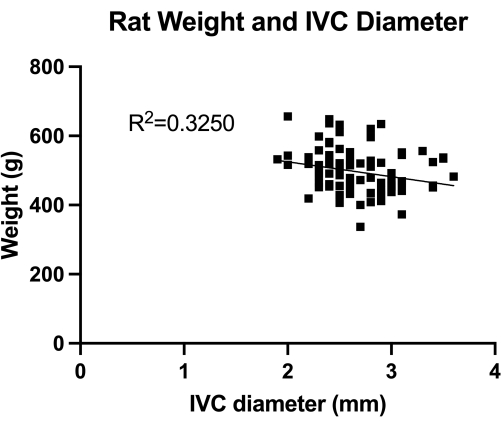
그림 1: 횡방향 IVC(mid-infrarenal section) 직경의 경복부 이중체 측정 분포. 측정은 동물의 무게로 수행되었습니다. 무게와 IVC 직경 사이에는 유의미한 상관관계가 발견되지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 시료 전처리
- 고성능 액체 크로마토그래피(HPLC) 분석 기법을 사용하여 약물 코팅 정맥 성형술 풍선의 확인 조직 이식을 수행합니다.
- IVC와 대동맥을 절제하고 포르말린 고정 파라핀 매립 및 조직학적 분석을 위해 en bloc 을 제거합니다.
- 단백질 분석을 위해 60,000μg/g의 희석 농도로 RIPA 버퍼를 사용하고, 4°C의 저온 실내 설정에서 조직 균질기로 처리하고, 처리 후 -80°C에서 보관합니다.
결과
VBM은 완전한 지혈 제어에서 정맥 성형 풍선의 효과를 평가하는 모델입니다. 먼저, 올바른 풍선 크기 조정을 위해 그림 1과 같이 IVC(mid-infrarenal section) 직경을 정량화했습니다. 둘째, 개발된 단계별 미세수술 기법이 그림 2에 나와 있으며, 그림 3에도 중요한 단계의 예가 나와 있습니다. 날카로운 가이드 와이어를 사용한 IVC 캐뉼레이...
토론
VBM은 2.5-3.5mm 범위의 풍선을 사용하여 250g ≥ 쥐에 대해 수행할 수 있습니다. 750g을 초과하는 쥐의 경우, IVC 직경의 변화보다는 복강 내 지방 조직과 장기 크기의 양이 더 많아 이 기술이 제한됩니다. 우리의 경험에 비추어 볼 때, 정맥벽 단백질 분석 또는 활성 분석 및 조직학을 위해 그룹 간의 통계적 유의성을 얻기 위해 그룹당 10마리 이상의 동물이 필요하다는 것을 발견했습니다. 수술 중 주기적?...
공개
이해 상충은 선언되지 않았습니다.
감사의 말
이 연구는 AVF(American Venous Forum) 2023 기초 과학 연구 보조금 및 Surmodics, Inc.의 지원을 받습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
참고문헌
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유