É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo de balão de venoplastia de veia cava inferior de roedores
Neste Artigo
Resumo
O protocolo apresenta um modelo de roedor de sobrevivência para testar intervenções com balão de venoplastia (VB) em veias profundas não trombóticas, trombóticas e pós-trombóticas.
Resumo
A venoplastia por balão é uma técnica clínica comumente usada para tratar estenose e oclusão venosa profunda como consequência de trauma, anormalidades anatômicas congênitas, trombose venosa profunda aguda (TVP) ou implante de stent. A obstrução venosa profunda crônica é caracterizada histopatologicamente por trombose, fibrose ou ambas. Atualmente, nenhum tratamento direto está disponível para atingir esses processos patológicos. Portanto, é necessário um modelo animal in vivo confiável para testar novas intervenções. O modelo de balão de venoplastia de venoplastia de veia cava inferior (VCI) de sobrevivência de roedores (VBM) permite o estudo da venoplastia por balão em condições não trombóticas e pós-trombóticas em vários pontos de tempo. O efeito local e sistêmico dos balões de venoplastia revestidos e não revestidos pode ser quantificado por meio de ensaios de tecido, trombo e sangue, como reação em cadeia da polimerase em tempo real (RT-PCR), western blot, ensaio de imunoabsorção enzimática (ELISA), zimografia, análise celular da parede venosa e do trombo, ensaios de sangue total e plasma e análise histológica. O VBM é reprodutível, replica intervenções cirúrgicas humanas, pode identificar alterações proteicas locais na parede venosa e permite múltiplas análises da mesma amostra, diminuindo o número de animais necessários por grupo.
Introdução
As obstruções venosas profundas causadas por trombos não resolvidos são uma consequência comum da trombose venosa profunda (TVP) e são uma das causas da síndrome pós-trombótica (PTS), custando bilhões de dólares em saúde e impactando significativamente a qualidade de vida 1,2,3. A SPT é uma patologia inflamatória única com consequentefibrose da parede venosa4 não totalmente capturada em modelos de TVP de pequenos animais 5,6,7 e, mais importante, modelos anteriores não podem avaliar a resposta a intervenções terapêuticas. As obstruções venosas trombóticas são frequentemente tratadas com implante de stent e venoplastia por balão 8,9; tais intervenções são dificultadas por uma alta taxa de reintervenção devido à reestenose e oclusão 10,11,12.
Apesar da disponibilidade de balões revestidos com medicamentos para tratar estenoses/oclusões arteriais específicas, não existem para veias profundas. O mecanismo molecular por trás da reestenose é pouco compreendido nas veias e não tem terapia direta4. Portanto, nosso objetivo é apresentar um modelo animal que possa testar terapêuticas administradas localmente por meio de balões de venoplastia simulando obstruções pós-trombóticas venosas profundas. Este modelo reproduz a condição pós-trombótica e avalia como diferentes tipos de balões de venoplastia afetam a parede da veia in vivo.
Protocolo
O protocolo a seguir segue as políticas e diretrizes do Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade de Michigan (UMICH), os Princípios do Governo dos EUA para a Utilização e Cuidado de Animais Vertebrados Usados em Testes, Pesquisa e Treinamento e as diretrizes ARRIVE 2.0. O contrato de Garantia de Bem-Estar Animal da UMICH está em conformidade com OLAW e USDA e é totalmente credenciado pela AAALAC International. Este protocolo foi aprovado com o número de identificação PRO00010841. Foram utilizados ratos Sprague Dawley machos da raça externa do Charles River Laboratories, pesando 450 g e 15 semanas de idade.
1. Anestesia de ratos
- Retirar os animais de sua gaiola e colocá-los em uma câmara de gás de indução pré-operatória anestésica a 5% de isoflurano e oxigênio a 100% a uma taxa de fluxo de 0,8 a 1 L/min (controlada por vaporizador) para induzir a anestesia geral.
- Sedar os ratos na câmara de indução anestésica, removê-los da câmara, pesar, lubrificar os olhos com pomada oftálmica estéril e, em seguida, colocá-los em decúbito dorsal em um dispositivo de aquecimento de circulação de água quente. Confirme a profundidade adequada da anestesia usando reflexo pedal (pinça firme do dedo do pé).
- Depile o abdômen ventral com uma tesoura elétrica. Mantenha a anestesia geral a 2,5% de isoflurano e oxigênio a 100% a 0,8 a 1 L/min com um circuito sem reinalação através de um cone nasal.
2. Ultrassonografia de rato
- Monitore avaliações fisiológicas, incluindo frequência respiratória, frequência cardíaca e temperatura, durante a imagem.
- Para imagens abdominais da Veia Cava Inferior (VCI), aplique gel condutor e oriente o transdutor em uma posição transversal. Enquanto predefine o vascular periférico, use o modo de imagem bidimensional ou o modo B, abaixe a sonda linear (10 MHz) no centro do abdômen, ajustando a profundidade com a pressão até que os vasos abdominais sejam visualizados.
- Diferencie a VCI da aorta abdominal avaliando a compressibilidade e avaliando o fluxo usando o modo Doppler colorido e pulsado com uma sonda linear de alta frequência (10 mHz).
- Ao aplicar a compressão com a sonda de ultrassom, diferencie os dois, pois a VCI é compressível, enquanto a aorta mantém sua forma e patência.
- Avalie a direção e a velocidade do fluxo sanguíneo usando Doppler colorido e pulsado. A janela Doppler colorida representa o fluxo em direção à sonda em vermelho e flui para longe da sonda em azul. Mude o instrumento para o modo Doppler de onda de pulso (modo Duplex) para avaliar a direção e a velocidade do fluxo sanguíneo ao longo do tempo. Adquira as imagens de fluxo necessárias usando a ferramenta de captura de imagem automatizada da máquina de ultrassom (as especificações exatas para aquisição de imagens podem variar entre os sistemas de ultrassom).
- Use o seguinte método de avaliação: a aorta tem fluxo sanguíneo em direção à sonda e uma forma de onda trifásica, enquanto a VCI tem fluxo espontâneo para longe da sonda com uma amplitude muito menor.
- Se a VCI proximal exibir uma forma de onda normal, mas uma forma de onda não fásica ou ausente (plana) for detectada distalmente, explore a possibilidade de uma obstrução venosa entre esses pontos de exame.
- Uma vez localizada a VCI, identifique a seção intermediária, que fica na porção do terço médio, inferior às veias renais e superior à bifurcação da VCI, provavelmente onde as veias lombares estão localizadas.
- Meça na seção intermediária da VCI o diâmetro de parede a parede na vista transversal usando a imagem transversal do modo B, registrando o diâmetro mais largo do vaso. A aquisição de imagens pode variar em diferentes aparelhos de ultrassom. Armazene dados usando discos compactos (CDs) em arquivos DICOM.
3. Microcirurgia e recuperação de ratos
- Limpe o abdômen com esfoliante de clorexidina embebido em gaze e solução de clorexidina 3x para garantir uma condição cirúrgica asséptica.
- Coloque filme plástico esterilizado como um envoltório cirúrgico para cobrir o tórax do rato e a área abdominal, os botões do microscópio (ampliação e foco) e a ocular.
- Faça uma incisão na linha média ventral (3 cm) aproximadamente 2 cm abaixo do processo xifóide com tesoura de íris através da pele e da parede abdominal, expondo o conteúdo abdominal. Use gaze estéril embebida em solução salina de 2 polegadas x 2 polegadas para refletir os intestinos para o lado direito do animal.
- Para exposição à VCI, faça uma dissecção romba usando um aplicador estéril com ponta de algodão. Coloque um espéculo de arame na incisão, permitindo a visualização da VCI.
- Cauterize todos os ramos lombares da VCI usando uma cauterização de ponta fina de baixa temperatura, desde as veias renais até a bifurcação ilíaca, e ligue os ramos laterais com pontos de polipropileno inabsorvíveis 7-0.
- Coloque um microclipe vascular curvo proximal na VCI, que é separada da aorta e logo abaixo das veias renais. Coloque um microclipe reto na VCI distal, que é separada da aorta e superior à bifurcação da VCI.
- Coloque um 8-0 sutura de ponto em U de náilon caudal à veia renal esquerda centrada na superfície anterior da VCI.
- Insira um fio-guia afiado de 0,014 mm com o balão de venoplastia recarregado, retrógrado ao fluxo sanguíneo para a VCI infrarrenal, caudal ao microclipe curvo.
- Avance o balão para o meio da VCI usando a técnica de Seldinger. Remova o fio-guia afiado e infle o balão de venoplastia por 3 min com um alongamento excessivo de 10% a 15% da VCI usando uma seringa de insuflação de 20 mL para gerar pressão positiva em uma faixa de 0-30 Atm. Lave todos os sistemas com solução salina estéril antes da canulação da VCI para evitar embolia gasosa.
NOTA: Uma VCI de 2,8 mm seria submetida a venoplastia a 3,22 mm (15% de sobreestiramento). A pressão de enchimento necessária para atingir o alongamento desejado é determinada pelas características do balão e está disponível na embalagem do fabricante. - Aperte o ponto em U após a deflação e remoção do balão de venoplastia. Remova os microclipes.
- Feche o local da laparotomia em duas camadas. Use uma sutura sintética absorvível de poliglactina 5-0 em um padrão contínuo para fechar a parede abdominal e a pele.
- Administrar suspensão injetável de liberação prolongada de buprenorfina, 0,65 mg/kg subcutâneo (SC) no pós-operatório como analgésico para ratos, uma vez que não interfere nos painéis de biomarcadores de moléculas inflamatórias para análise de proteínas.
- Recupere os ratos em uma gaiola individual, observe no pós-operatório (30 min) sob uma lâmpada de aquecimento (distância mínima - 24 polegadas de distância da gaiola) e, em seguida, retorne às suas unidades de alojamento originais.
- Para os animais sham de cada grupo experimental, realizar apenas a dissecção, sem a ligadura, cauterização e canulação dos ramos da VCI.
- Para condições pós-trombóticas, coloque um microclipe vascular reto proximal na VCI, que é separada da aorta, logo abaixo das veias renais, por 24 h. Use as mesmas técnicas de dissecação e fechamento.
- Verifique os sinais ultrassonográficos de oclusão da VCI, que incluem a visualização do clipe da VCI, a confirmação da VCI distal sem fluxo e as veias ilíacas comuns distendidas. Os pontos de tempo de acompanhamento podem ser personalizados para atender às especificações do estudo.
- Para observar as alterações fisiológicas que estão sendo modeladas, selecione pontos de tempo nas primeiras 72 h para a formação precoce de trombos e de 3 a 7 dias pós-procedimento para resolução posterior dos trombos. Os pontos de tempo posteriores testados neste modelo incluem 7 a 28 dias 5,13.
- Use as técnicas nas etapas 3.5-3.9 para venoplastia por balão pós-trombótica com as seguintes ressalvas: Uma pressão insufladora mais alta pode ser necessária para atingir o alongamento excessivo desejado, pois o diâmetro da VCI aumenta em condições pós-trombóticas.
- Realize a eutanásia de acordo com as recomendações estabelecidas pelas atuais Diretrizes da American Veterinary Medical Association sobre eutanásia para roedores, realizando dois métodos confirmatórios (remoção de sangue e remoção de órgãos vitais) para garantir que o animal não reviva.
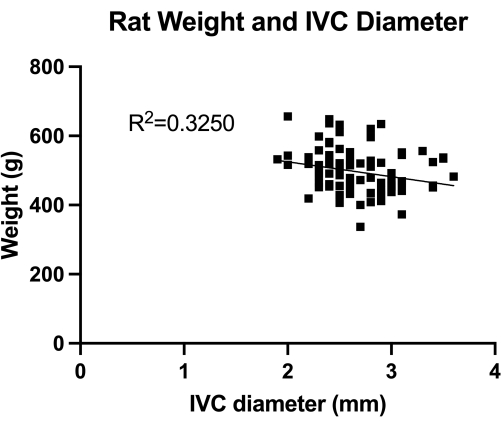
Figura 1: Distribuição das medidas duplex transabdominais do diâmetro transverso da VCI (seção infrarrenal média). A medida foi feita pelo peso do animal. Não foi encontrada correlação significativa entre o peso e o diâmetro da VCI. Clique aqui para ver uma versão maior desta figura.
4. Preparação da amostra
- Realize a transferência confirmatória de tecido de balões de venoplastia revestidos com medicamentos usando a técnica de ensaio de cromatografia líquida de alta eficiência (HPLC).
- Disseque a VCI e a aorta e remova-a em bloco para inclusão em parafina fixada em formalina e análise histológica.
- Para análise de proteínas, use tampão RIPA em uma concentração diluída de 60.000 μg/g de amostra, processe com um homogeneizador de tecidos em ambientes de baixa temperatura a 4 °C e armazene a -80 °C após o processamento.
Resultados
O VBM é um modelo que avalia o efeito dos balões de venoplastia no controle completo da hemostasia. Primeiramente, quantificamos o diâmetro da VCI (seção infrarrenal média), conforme mostrado na Figura 1, para o correto dimensionamento do balão. Em segundo lugar, a técnica microcirúrgica passo a passo desenvolvida é ilustrada na Figura 2, e também mostramos exemplos das etapas críticas na Figura 3. Observe a abordagem re...
Discussão
O VBM pode ser realizado em ratos ≥ 250 g usando balões na faixa de 2,5-3,5 mm. Para ratos com mais de 750 g, a técnica é limitada por uma maior quantidade de tecido adiposo na cavidade abdominal e no tamanho do órgão, em vez de alterações no diâmetro da VCI. A partir de nossa experiência, descobrimos que 10 ou mais animais por grupo são necessários para obter significância estatística entre os grupos para análise de proteínas da parede venosa ou ensaios de atividade e histologia. O controle periódico d...
Divulgações
Nenhum conflito de interesse foi declarado.
Agradecimentos
Este estudo é apoiado pela bolsa de pesquisa em Ciências Básicas do American Venous Forum (AVF) 2023 e pela Surmodics, Inc.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
Referências
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados