Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de globo de vena cava inferior de roedores
En este artículo
Resumen
El protocolo presenta un modelo de supervivencia en roedores para probar intervenciones con balón de venoplastia (VB) en venas profundas no trombóticas, trombóticas y postrombóticas.
Resumen
La venoplastia con balón es una técnica clínica comúnmente utilizada para tratar la estenosis venosa profunda y la oclusión como consecuencia de un traumatismo, anomalías anatómicas congénitas, trombosis venosa profunda aguda (TVP) o colocación de stents. La obstrucción venosa profunda crónica se caracteriza histopatológicamente por trombosis, fibrosis o ambas. En la actualidad, no existe un tratamiento directo que se dirija a estos procesos patológicos. Por lo tanto, es necesario un modelo animal in vivo fiable para probar nuevas intervenciones. El modelo de balón de venoplastia (VBM) de venoplastia de supervivencia en roedores permite el estudio de la venoplastia con balón en condiciones no trombóticas y postrombóticas en múltiples puntos temporales. El efecto local y sistémico de los balones de venoplastia recubiertos y no recubiertos se puede cuantificar mediante ensayos de tejidos, trombos y sangre, como la reacción en cadena de la polimerasa en tiempo real (RT-PCR), Western blot, ensayo de inmunoadsorción enzimática (ELISA), zimografía, análisis de la pared de las venas y de las células de los trombos, ensayos de sangre total y plasma, y análisis histológico. El VBM es reproducible, replica las intervenciones quirúrgicas humanas, puede identificar cambios locales en las proteínas de los trombos de la pared venosa y permite múltiples análisis a partir de la misma muestra, disminuyendo el número de animales necesarios por grupo.
Introducción
Las obstrucciones venosas profundas por trombos no resueltos son una consecuencia común de la trombosis venosa profunda (TVP) y son una de las causas del síndrome postrombótico (SPT), que cuesta miles de millones de dólares en atención médica e impacta significativamente en la calidad de vida 1,2,3. El SPT es una patología inflamatoria única con la consiguiente fibrosis de la pared venosa4 que no se capta completamente en modelos de TVP en animales pequeños 5,6,7 y, lo que es más importante, los modelos anteriores no pueden evaluar la respuesta a las intervenciones terapéuticas. Las obstrucciones venosas trombóticas a menudo se tratan con colocación de stents y venoplastia con balón 8,9; Tales intervenciones se ven obstaculizadas por una alta tasa de reintervención debido a la reestenosis y la oclusión 10,11,12.
A pesar de la disponibilidad de balones recubiertos de fármacos para tratar las estenosis/oclusiones arteriales específicas, no existe ninguno para las venas profundas. El mecanismo molecular detrás de la reestenosis es poco conocido en las venas y no tiene terapia directa4. Por lo tanto, nuestro objetivo es presentar un modelo animal que pueda probar terapias administradas localmente a través de balones de venoplastia que simulen obstrucciones postrombóticas venosas profundas. Este modelo reproduce la condición postrombótica y evalúa cómo los diferentes tipos de balones de venoplastia afectan a la pared venosa in vivo.
Protocolo
El siguiente protocolo sigue las políticas y pautas del Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Michigan (UMICH), los Principios del Gobierno de los EE. UU. para la Utilización y el Cuidado de Animales Vertebrados Utilizados en Pruebas, Investigación y Capacitación, y las pautas ARRIVE 2.0. El acuerdo de Aseguramiento de Bienestar Animal de UMICH cumple con OLAW y USDA y está totalmente acreditado por AAALAC International. Este protocolo fue aprobado con el número de identificación PRO00010841. Se utilizaron ratas macho Sprague Dawley de Charles River Laboratories, de 450 g de peso y 15 semanas de edad.
1. Anestesia para ratas
- Retirar a los animales de su jaula y colocarlos en una cámara de gas de inducción anestésica preoperatoria con 5% de isoflurano y 100% de oxígeno a un caudal de 0,8 a 1 L/min (controlado por vaporizador) para inducir la anestesia general.
- Sedar ratas en la cámara de inducción anestésica, sacarlas de la cámara, pesarlas, lubricar sus ojos con ungüento oftálmico estéril y luego colocarlas en decúbito dorsal sobre un dispositivo de calentamiento que circula con agua tibia. Confirme la profundidad adecuada de la anestesia usando el reflejo del pedal (pellizco firme del dedo del pie).
- Afeita el abdomen ventral con una maquinilla eléctrica. Mantener la anestesia general al 2,5% de isoflurano y al 100% de oxígeno de 0,8 a 1 L/min con un circuito sin reinhalación a través de un cono nasal.
2. Ecografía de rata
- Controle las evaluaciones fisiológicas, incluida la frecuencia respiratoria, la frecuencia cardíaca y la temperatura, durante la toma de imágenes.
- Para la obtención de imágenes abdominales de la vena cava inferior (IVC), aplique gel conductor y oriente el transductor en posición transversal. Mientras preajusta el vascular periférico, use el modo de imagen bidimensional o el modo B, baje la sonda lineal (10 MHz) en el centro del abdomen, ajustando la profundidad con presión hasta que los vasos abdominales estén a la vista.
- Diferencie la VCI de la aorta abdominal mediante la evaluación de la compresibilidad y la evaluación del flujo utilizando el modo Doppler color y de onda pulsada con una sonda lineal de alta frecuencia (10 mHz).
- Al aplicar la compresión con la sonda ecográfica, diferencie las dos ya que la VCI es compresible, mientras que la aorta mantiene su forma y permeabilidad.
- Evalúe la dirección y la velocidad del flujo sanguíneo mediante el uso de Doppler de color y de onda pulsada. La ventana Doppler de color representa el flujo hacia la sonda en rojo y los flujos que se alejan de la sonda en azul. Cambie el instrumento al modo Doppler de onda de pulso (modo dúplex) para evaluar la dirección y la velocidad del flujo sanguíneo a lo largo del tiempo. Adquiera las imágenes de flujo necesarias mediante el uso de la herramienta de captura de imágenes automatizada de la máquina de ultrasonido (las especificaciones exactas para la adquisición de imágenes pueden variar entre los sistemas de ultrasonido).
- Utilice el siguiente método de evaluación: la aorta tiene flujo sanguíneo hacia la sonda y una forma de onda trifásica, mientras que la VCI tiene un flujo espontáneo que se aleja de la sonda con una amplitud mucho menor.
- Si la VCI proximal muestra una forma de onda normal, pero se detecta distalmente una forma de onda no fásica o ausente (plana), explore la posibilidad de una obstrucción venosa entre estos puntos de examen.
- Una vez localizada la VCI, identifique la sección media, que se encuentra en la tercera porción media, inferior a las venas renales y superior a la bifurcación de la VCI, muy probablemente donde se encuentran las venas lumbares.
- Mida en la sección media IVC el diámetro de pared a pared en la vista transversal utilizando la imagen de modo B de la sección transversal, registrando el diámetro más ancho del vaso. La adquisición de imágenes puede variar en diferentes máquinas de ultrasonido. Almacene datos mediante discos compactos (CD) en archivos DICOM.
3. Microcirugía y recuperación de ratas
- Limpie el abdomen con un exfoliante de clorhexidina empapado en gasa y una solución de clorhexidina 3 veces para garantizar una condición quirúrgica aséptica.
- Coloque una película adhesiva esterilizada como envoltura quirúrgica para cubrir el tórax y el área abdominal de la rata, las perillas del microscopio (aumento y enfoque) y el ocular.
- Realice una incisión en la línea media ventral (3 cm) aproximadamente 2 cm por debajo de la apófisis xifoides con tijeras de iris a través de la piel y la pared abdominal, exponiendo el contenido abdominal. Use una gasa estéril empapada en solución salina de 2 pulgadas x 2 pulgadas para reflejar los intestinos hacia el lado derecho del animal.
- Para la exposición a la VCI, realice una disección roma con un aplicador estéril con punta de algodón. Coloque un espéculo de alambre en la incisión, lo que permite la visualización de la VCI.
- Cauterizar todas las ramas lumbares de la VCI con una cauterio de punta fina a baja temperatura, desde las venas renales hasta la bifurcación ilíaca, y ligar las ramas laterales con suturas de polipropileno no absorbible 7-0.
- Coloque un microclip vascular curvo proximal en la VCI, que está separada de la aorta y justo debajo de las venas renales. Colocar un microclip recto en la VCI distal, que está separada de la aorta y es superior a la bifurcación de la VCI.
- Coloca un 8-0 Sutura de nylon con punto en U caudal a la vena renal izquierda centrada en la superficie anterior de la VCI.
- Inserte una guía afilada de 0,014 mm con el balón de venoplastia cargado hacia atrás, retrógrado al flujo sanguíneo hacia la VCI infrarrenal, caudal al microclip curvo.
- Avance el balón hacia la VCI media utilizando la técnica de Seldinger. Retire la guía afilada e infle el balón de venoplastia durante 3 minutos con un sobreestiramiento del 10% al 15% de la VCI utilizando una jeringa de inflado de 20 ml para generar presión positiva en un rango de 0 a 30 Atm. Enjuague todos los sistemas con solución salina estéril antes de la canulación de la VCI para evitar la embolia gaseosa.
NOTA: Una VCI de 2,8 mm se sometería a una venoplastia hasta 3,22 mm (15% de sobreestiramiento). La presión de inflado requerida para alcanzar el sobreestiramiento deseado está determinada por las características del globo y está disponible en el embalaje del fabricante. - Apriete la puntada en U al desinflar y retirar el globo de venoplastia. Retire los microclips.
- Cierre el sitio de la laparotomía en forma de dos capas. Utilice una sutura sintética absorbible de poliglactina 5-0 en un patrón continuo para cerrar tanto la pared abdominal como la piel.
- Administrar buprenorfina suspensión inyectable de liberación prolongada, 0,65 mg/kg subcutánea (SC) en el postoperatorio como analgésico para ratas, ya que no interfiere con los paneles de biomarcadores de moléculas inflamatorias para el análisis de proteínas.
- Recupere las ratas en una jaula individual, obsérvelas después de la operación (30 min) bajo una lámpara de calefacción (distancia mínima: 24 pulgadas de distancia de la jaula) y luego regrese a sus unidades de alojamiento originales.
- En el caso de los animales simulados de cada grupo experimental, se debe realizar únicamente la disección, sin la ligadura, cauterización y canulación de las ramas de la VCI.
- Para afecciones postrombóticas, colocar un microclip vascular recto proximal en la VCI, que está separada de la aorta, justo por debajo de las venas renales, durante 24 h. Utilice las mismas técnicas de disección y cierre.
- Verifique los signos ecográficos de oclusión de la VCI, que incluyen la visualización del clip de la VCI, la confirmación de la VCI distal sin flujo y las venas ilíacas comunes distendidas. Los puntos de tiempo de seguimiento se pueden personalizar para que se ajusten a las especificaciones del estudio.
- Para observar los cambios fisiológicos que se están modelando, seleccione puntos temporales en las primeras 72 h para la formación temprana de trombos y de 3 a 7 días después del procedimiento para la resolución posterior de los trombos. Los puntos de tiempo posteriores probados en este modelo incluyen de 7 a 28 días 5,13.
- Utilice las técnicas de los pasos 3.5-3.9 para la venoplastia postrombótica con balón con las siguientes advertencias: Es posible que se requiera una presión de insuflado más alta para lograr el sobreestiramiento deseado, ya que el diámetro de la VCI aumenta en las condiciones postrombóticas.
- Realizar la eutanasia bajo las recomendaciones establecidas por las Directrices actuales de la Asociación Americana de Medicina Veterinaria sobre la Eutanasia para roedores mediante la realización de dos métodos confirmatorios (extracción de sangre y extracción de órganos vitales) para garantizar que el animal no reviva.
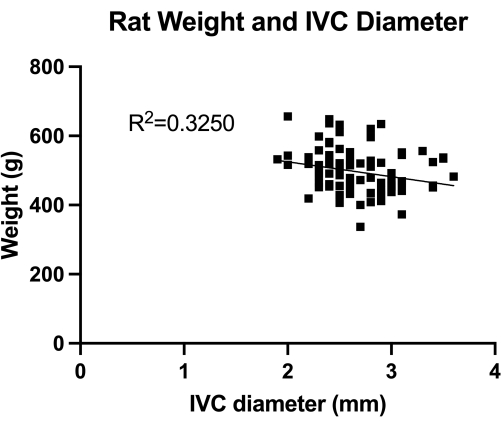
Figura 1: Distribución de las medidas dúplex transabdominales del diámetro transverso de la VCI (sección infrarrenal media). La medición se realizó por peso animal. No se encontró correlación significativa entre el peso y el diámetro de la VCI. Haga clic aquí para ver una versión más grande de esta figura.
4. Preparación de la muestra
- Realizar la transferencia de tejido confirmatoria de balones de venoplastia recubiertos de fármaco mediante la técnica de ensayo de cromatografía líquida de alta resolución (HPLC).
- Diseccionar la VCI y la aorta y retirarlas en bloque para la inclusión de parafina fijada en formol y el análisis histológico.
- Para el análisis de proteínas, utilice el tampón RIPA en una concentración de dilución de 60.000 μg/g de muestra, procese con un homogeneizador de tejidos en una habitación a baja temperatura a 4 °C y almacene a -80 °C después del procesamiento.
Resultados
El VBM es un modelo que evalúa el efecto de los balones de venoplastia en el control completo de la hemostasia. En primer lugar, cuantificamos el diámetro de la VCI (sección infrarrenal media), como se muestra en la Figura 1, para el correcto dimensionamiento del balón. En segundo lugar, la técnica microquirúrgica desarrollada paso a paso se ilustra en la Figura 2, y también mostramos ejemplos de los pasos críticos en la Figura 3
Discusión
El VBM se puede realizar en ratas ≥ 250 g utilizando globos en el rango de 2,5-3,5 mm. Para las ratas que superan los 750 g, la técnica está limitada por una mayor cantidad de tejido adiposo en la cavidad abdominal y el tamaño del órgano, en lugar de cambios en el diámetro de la VCI. A partir de nuestra experiencia, hemos encontrado que se necesitan 10 o más animales por grupo para obtener significación estadística entre los grupos para el análisis de proteínas de la pared venosa o ensayos de actividad e hist...
Divulgaciones
No se declararon conflictos de interés.
Agradecimientos
Este estudio cuenta con el apoyo de la beca de investigación en Ciencias Básicas 2023 del American Venous Forum (AVF) y Surmodics, Inc.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
Referencias
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados