Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модель баллона для венопластики нижней полой вены грызуна
В этой статье
Резюме
В протоколе представлена модель выживания грызунов для тестирования вмешательств с помощью баллона венопластики (VB) в нетромботических, тромботических и посттромботических глубоких венах.
Аннотация
Баллонная венопластика является широко используемым клиническим методом лечения стеноза глубоких вен и окклюзии в результате травмы, врожденных анатомических аномалий, острого тромбоза глубоких вен (ТГВ) или стентирования. Хроническая обструкция глубоких вен гистопатологически характеризуется тромбозом, фиброзом или и тем, и другим. В настоящее время не существует прямого лечения для борьбы с этими патологическими процессами. Таким образом, необходима надежная животная модель in vivo для тестирования новых вмешательств. Модель баллонной венопластики (VBM) выживаемости грызунов в нижней полой вене (IVC) позволяет изучать баллонную венопластику при нетромботических и посттромботических состояниях в различные временные точки. Местный и системный эффект баллонов венопластики с покрытием и без покрытия может быть количественно определен с помощью анализов тканей, тромбов и крови, таких как полимеразная цепная реакция в реальном времени (ОТ-ПЦР), вестерн-блоттинг, иммуноферментный анализ (ИФА), зимография, клеточный анализ стенок вен и тромбов, анализы цельной крови и плазмы, а также гистологический анализ. VBM воспроизводим, воспроизводим, воспроизводит хирургические вмешательства человека, может идентифицировать локальные изменения белка стенки вены и позволяет проводить несколько анализов одного и того же образца, уменьшая количество необходимых животных в группе.
Введение
Обструкция глубоких вен из-за неустраненных тромбов является распространенным последствием тромбоза глубоких вен (ТГВ) и является одной из причин посттромботического синдрома (ПТС), обходясь в миллиарды долларов в здравоохранение и значительно влияя на качество жизни 1,2,3. ПТС является уникальной воспалительной патологией с последующим фиброзом стенки вены4, который не полностью отражен в моделях ТГВ мелких животных 5,6,7, и, что более важно, предыдущие модели не могут оценить реакцию на терапевтические вмешательства. Тромботические венозные обструкции часто лечатся стентированием и баллонной венопластикой 8,9; Такие вмешательства затруднены высокой частотой повторных вмешательств из-за рестеноза и окклюзии 10,11,12.
Несмотря на наличие баллонов с лекарственным покрытием для лечения артериально-специфических стенозов/окклюзий, для глубоких вен их не существует. Молекулярный механизм рестеноза в венах плохо изучен и не имеет прямой терапии4. Таким образом, наша цель состоит в том, чтобы представить животную модель, которая может тестировать местную терапию с помощью баллонов венопластики, имитирующих посттромботическую обструкцию глубоких вен. Эта модель воспроизводит посттромботическое состояние и оценивает, как различные типы баллонов венопластики влияют на стенку вены in vivo.
протокол
Следующий протокол соответствует политике и рекомендациям Комитета по уходу за животными и их использованию (IACUC) Мичиганского университета (UMICH), Принципам правительства США по использованию и уходу за позвоночными животными, используемыми при тестировании, исследованиях и дрессировке, а также рекомендациям ARRIVE. Соглашение UMICH о благополучии животных соответствует требованиям OLAW и USDA и полностью аккредитовано AAALAC International. Данный протокол был утвержден с идентификационным номером PRO00010841. Использовались самцы аутбредных крыс Sprague Dawley от Charles River Laboratories весом 450 г и возрастом 15 недель.
1. Крысиная анестезия
- Извлеките животных из клетки и поместите их в анестезирующую предоперационную индукционную газовую камеру с 5% изофлураном и 100% кислородом со скоростью потока от 0,8 до 1 л/мин (контролируемая испарителем) для индукции общей анестезии.
- Усыпить крыс в камере индукции анестетика, извлечь их из камеры, взвесить, смазать их глаза стерильной офтальмологической мазью, а затем поместить их в спинное лежачее положение на теплое водонагревательное устройство. Подтвердите достаточную глубину анестезии с помощью педального рефлекса (твердое защемление пальца ноги).
- Побрейте брюшную полость с помощью электрических машинок для стрижки. Поддерживайте общую анестезию на уровне 2,5% изофлурана и 100% кислорода со скоростью от 0,8 до 1 л/мин с помощью контура без повторного дыхания через носовой конус.
2. Ультразвуковое сканирование крыс
- Контролируйте физиологические показатели, включая частоту дыхания, частоту сердечных сокращений и температуру, во время визуализации.
- Для визуализации нижней полой вены (НПВ) нанесите проводящий гель и поверните датчик в поперечное положение. При предварительной настройке периферических сосудов используйте режим двумерной визуализации или B-режим, опустите линейный зонд (10 МГц) на центр брюшной полости, регулируя глубину давлением до тех пор, пока не появятся сосуды брюшной полости.
- Дифференциация НПВ от брюшной аорты путем оценки сжимаемости и оценки потока с использованием как цветного, так и импульсно-волнового режима допплера с высокочастотным линейным зондом (10 мГц).
- При выполнении компрессии с помощью ультразвукового датчика дифференцируйте их, так как НПВ является сжимаемым, в то время как аорта сохраняет свою форму и проходимость.
- Оцените направление и скорость кровотока с помощью цветного и импульсно-волнового допплера. Цветное доплеровское окно представляет поток к зонду красным цветом и отток от преобразователя синим цветом. Переключите прибор в режим импульсно-волновой допплерографии (дуплексный режим), чтобы оценить направление и скорость кровотока с течением времени. Получение необходимых изображений потока с помощью автоматизированного инструмента захвата изображений ультразвукового аппарата (точные характеристики получения изображений могут отличаться в зависимости от ультразвуковой системы).
- Используйте следующий метод оценки: аорта имеет приток крови к зонду и трехфазную волну, в то время как НПВ имеет спонтанный отток от зонда с гораздо меньшей амплитудой.
- Если проксимальный НПВ демонстрирует нормальную форму волны, но дистально обнаруживается бесфазная или отсутствующая (плоская) форма волны, исследуйте возможность венозной обструкции между этими точками исследования.
- После того, как НПВ будет обнаружен, определите средний отдел, который находится в средней трети отдела, ниже почечных вен и выше бифуркации НПВ, скорее всего, там, где расположены поясничные вены.
- Измерьте в среднем сечении IVC диаметр от стенки до стенки в поперечном виде с помощью изображения поперечного сечения B-моды, зафиксировав самый широкий диаметр сосуда. Получение изображений может отличаться в разных ультразвуковых аппаратах. Храните данные с помощью компакт-дисков (CD) в файлах DICOM.
3. Микрохирургия и восстановление крыс
- Очистите брюшную полость скрабом, смоченным в марле, и раствором хлоргексидина 3 раза, чтобы обеспечить асептическое хирургическое состояние.
- Поместите стерилизованную пищевую пленку в качестве хирургической пленки, чтобы закрыть грудную клетку крысы и область живота, ручки микроскопа (увеличение и фокусировка) и окуляр.
- Сделайте вентральный разрез по средней линии (3 см) примерно на 2 см ниже мечевидного отростка ножницами радужной оболочки через кожу и брюшную стенку, обнажая содержимое брюшной полости. Используйте стерильную марлю, пропитанную физиологическим раствором, размером 2 x 2 дюйма, чтобы отразить кишечник в правую сторону животного.
- Для воздействия НПВ выполните тупое рассечение с помощью стерильного аппликатора с ватным наконечником. Поместите проволочное зеркало в разрез, чтобы обеспечить визуализацию НПВ.
- Прижгите все ветви поясницы IVC с помощью низкотемпературного прижигания тонкого кончика, от почечных вен до бифуркации подвздошной кости, и перевяжите боковые ветви 7-0 нерассасывающимися полипропиленовыми швами.
- Поместите проксимально изогнутый сосудистый микрозажим на НПВ, который отделен от аорты и находится чуть ниже почечных вен. Поместите прямой микрозажим на дистальный отдел НПВ, который отделен от аорты и находится выше бифуркации НПВ.
- Ставка 8-0 нейлоновый U-образный шов каудально к левой почечной вене с центром на передней поверхности НПВ.
- Вставьте заточенный проводник на 0,014 мм с обратным баллоном венопластики, ретроградно к кровотоку в инфраренальный НПВ, каудально к изогнутому микрозажиму.
- Переместите воздушный шар в середину IVC, используя технику Сельдингера. Снимите заточенный проводник и надувайте баллон для венопластики в течение 3 минут с перенапряжением от 10% до 15% НПВ с помощью шприца объемом 20 мл для создания положительного давления в диапазоне 0-30 атм. Промойте все системы стерильным физиологическим раствором перед канюляцией НПВ, чтобы избежать воздушной эмболии.
ПРИМЕЧАНИЕ: НПВ диаметром 2,8 мм подвергнется венопластике до 3,22 мм (15% растяжения). Необходимое давление накачивания для достижения желаемого перенапряжения определяется характеристиками баллона и доступно на упаковке производителя. - Затяните U-образный шов после венопластики, баллонной сдувания и удаления. Снимите микрозажимы.
- Закройте место лапаротомии в два слоя. Используйте рассасывающийся синтетический шов 5-0 полиглактина непрерывным способом, чтобы закрыть как брюшную стенку, так и кожу.
- Вводите бупренорфин в инъекционной суспензии с пролонгированным высвобождением, 0,65 мг/кг подкожно (ПКК) после операции в качестве анальгетика для крыс, поскольку он не влияет на панели биомаркеров воспалительных молекул для анализа белка.
- Восстановите крыс в индивидуальной клетке, понаблюдайте после операции (30 мин) под нагревательной лампой (минимальное расстояние - 24 дюйма от клетки), а затем вернитесь в их исходные жилища.
- Для фиктивных животных из каждой экспериментальной группы проводят только диссекцию, без лигирования ветвей НПВ, прижигания и канюляции.
- При посттромботических состояниях поместите проксимальный прямой сосудистый микрозажим на НПВ, который отделен от аорты, чуть ниже почечных вен, на 24 ч. Используйте те же методы рассечения и закрытия.
- Проверьте наличие ультразвуковых признаков окклюзии НПВ, которые включают визуализацию клипсы НПВ, подтверждение дистального отдела НПВ без кровотока и расширения общих подвздошных вен. Временные точки последующего наблюдения могут быть настроены в соответствии со спецификациями исследования.
- Чтобы наблюдать за моделируемыми физиологическими изменениями, выберите временные точки в первые 72 ч для раннего образования тромбов и от 3 до 7 дней после процедуры для более позднего разрешения тромбов. Более поздние временные точки, протестированные в этой модели, включают от 7 до 28 дней 5,13.
- Используйте методы, описанные на шагах 3.5-3.9, для посттромботической баллонной венопластики со следующими оговорками: Для достижения желаемого перенапряжения может потребоваться более высокое давление инсуффлейтора, поскольку диаметр IVC увеличивается в посттромботических условиях.
- Выполняйте эвтаназию в соответствии с рекомендациями, изложенными в действующем Руководстве Американской ветеринарной медицинской ассоциации по эвтаназии для грызунов, выполняя два подтверждающих метода (удаление крови и удаление жизненно важных органов), чтобы гарантировать, что животное не оживет.
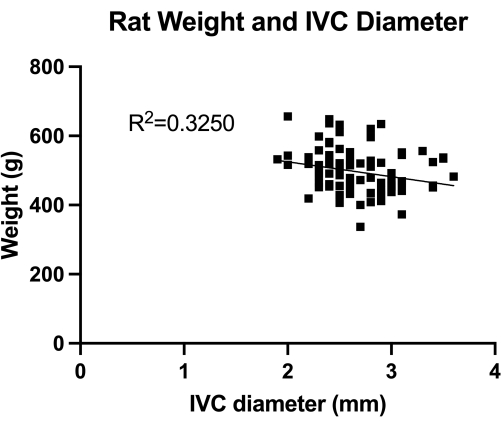
Рисунок 1: Распределение трансабдоминальных дуплексных измерений поперечного диаметра IVC (среднеинфраренального сечения). Измерение проводилось по весу животного. Достоверной корреляции между весом и диаметром НПВ не обнаружено. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Подготовка образцов
- Выполните подтверждающий перенос тканей баллонов венопластики с лекарственным покрытием с использованием высокоэффективного метода жидкостной хроматографии (ВЭЖХ).
- Рассеките НПВ и аорту и удалите их целиком для встраивания парафина, зафиксированного формалином, и гистологического анализа.
- Для анализа белка используйте буфер RIPA в разбавляющей концентрации 60 000 мкг/г образца, обрабатывайте тканевым гомогенизатором в условиях низкой температуры при температуре 4 °C и храните при -80 °C после обработки.
Результаты
VBM – это модель, которая оценивает эффект баллонов венопластики при полном контроле гемостаза. Во-первых, мы количественно измерили диаметр IVC (среднеинфраренального сечения), как показано на рисунке 1, для правильного определения размера баллона. Во-вторых, разработанн?...
Обсуждение
VBM может быть выполнена на крысах ≥ 250 г с использованием баллонов в диапазоне 2,5-3,5 мм. Для крыс весом более 750 г этот метод ограничен большим количеством жировой ткани в брюшной полости и размером органа, а не изменениями диаметра НПВ. Исходя из нашего опыта, мы обнаружили, что для получен...
Раскрытие информации
О конфликте интересов заявлено не было.
Благодарности
Это исследование поддержано грантом Американского венозного форума (AVF) 2023 года по фундаментальным наукам и компанией Surmodics, Inc.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
Ссылки
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены