A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מכרסם נחות Vena Cava Venoplasty בלון מודל
In This Article
Summary
הפרוטוקול מציג מודל הישרדות של מכרסמים לבדיקת התערבויות של בלון ארסי (VB) בוורידים עמוקים שאינם טרומבוטים, טרומבוטיים ופוסט-טרומבוטיים.
Abstract
ארס בלון הוא טכניקה קלינית נפוצה לטיפול בהיצרות ורידים עמוקים וחסימה כתוצאה מטראומה, הפרעות אנטומיות מולדות, פקקת ורידים עמוקים חריפה (DVT) או סטנט. חסימה ורידית עמוקה כרונית מאופיינת היסטופתולוגית בפקקת, פיברוזיס או שניהם. נכון לעכשיו, אין טיפול ישיר זמין כדי להתמקד בתהליכים פתולוגיים אלה. לכן, יש צורך במודל אמין של בעלי חיים in vivo לבדיקת התערבויות חדשניות. מודל בלון הווריד הנחותים של הווריד הנבוב (IVC) (VBM) מאפשר לחקור את ארס הבלון בתנאים שאינם טרומבוטיים ופוסט-טרומבוטיים על פני נקודות זמן מרובות. ניתן לכמת את ההשפעה המקומית והמערכתית של בלוני וריד מצופים ולא מצופים באמצעות בדיקות רקמות, פקקת ודם כגון תגובת שרשרת פולימראז בזמן אמת (RT-PCR), כתם מערבי, בדיקת אימונוסורבנט מקושרת אנזימים (ELISA), זימוגרפיה, אנליזה תאית של דופן ורידים ופקקת, בדיקות דם ופלזמה שלמות וניתוח היסטולוגי. ה-VBM ניתן לשחזור, משכפל התערבויות כירורגיות בבני אדם, יכול לזהות שינויים מקומיים בחלבון תרומבי בדופן הוורידים, ומאפשר ניתוחים מרובים מאותה דגימה, מה שמקטין את מספר בעלי החיים הנדרשים לכל קבוצה.
Introduction
חסימות ורידים עמוקים כתוצאה מפקקת ורידים לא פתורה הן תוצאה נפוצה של פקקת ורידים עמוקים (DVT) והן אחד הגורמים לתסמונת פוסט-טרומבוטית (PTS), שעלותה מיליארדי דולרים בתחום הבריאות ומשפיעה באופן משמעותי על איכות החיים 1,2,3. PTS היא פתולוגיה דלקתית ייחודית עם פיברוזיס4 בדופן הווריד שלא נלכדה במלואה במודלים 5,6,7 של בעלי חיים קטנים, וחשוב מכך, מודלים קודמים אינם יכולים להעריך את התגובה להתערבויות טיפוליות. חסימות ורידים טרומבוטיות מטופלות לעתים קרובות על ידי stenting ו venoplastyבלון 8,9; התערבויות כאלה נפגעות על ידי שיעור התערבות חוזרת גבוה עקב רסטנוזיס וחסימה 10,11,12.
למרות זמינותם של בלונים מצופים תרופות לטיפול בהיצרות / חסימות ספציפיות לעורקים, אף אחד מהם לא קיים עבור ורידים עמוקים. המנגנון המולקולרי מאחורי רסטנוזיס אינו מובן היטב בוורידים ואין לו טיפול ישיר4. לכן, המטרה שלנו היא להציג מודל של בעלי חיים שיכול לבחון טיפולים מקומיים באמצעות בלוני ורידים המדמים חסימות פוסט-טרומבוטיות של ורידים עמוקים. מודל זה משחזר את המצב הפוסט-טרומבוטי ומעריך כיצד סוגים שונים של בלוני ארס משפיעים על דופן הווריד in vivo.
Protocol
הפרוטוקול הבא עוקב אחר המדיניות וההנחיות של הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת מישיגן (UMICH), עקרונות ממשלת ארה"ב לשימוש וטיפול בבעלי חוליות המשמשים בניסויים, מחקר והכשרה, והנחיות ARRIVE 2.0. הסכם הבטחת רווחת בעלי החיים של UMICH תואם ל- OLAW ול- USDA ומוכר באופן מלא על ידי AAALAC International. פרוטוקול זה אושר עם מספר תעודת זהות PRO00010841. נעשה שימוש בחולדות ספראג דולי זכרים ממעבדות נהר צ'ארלס, במשקל 450 גרם ובגיל 15 שבועות.
1. הרדמת חולדות
- הוציאו בעלי חיים מהכלוב שלהם והכניסו אותם לתא גזים אינדוקציה לפני הניתוח ב-5% איזופלורן ו-100% חמצן בקצב זרימה של 0.8 עד 1 ליטר/דקה (מבוקר וופורייזר) כדי לגרום להרדמה כללית.
- מרדימים חולדות בתא ההרדמה, מוציאים אותן מהחדר, שוקלות, משמנים את עיניהן במשחה אופתלמית סטרילית, ואז מניחים אותן בשכיבה גבית על מכשיר חימום במחזור מים חמים. ודא עומק הרדמה מספיק באמצעות רפלקס הדוושה (צביטת בוהן מוצקה).
- לגלח את הבטן הגחון עם קוצץ חשמלי. יש לשמור על הרדמה כללית ב-2.5% איזופלורן ו-100% חמצן ב-0.8 עד 1 ליטר/דקה עם מעגל חשמלי ללא נשימה דרך חרוט האף.
2. סריקת אולטרסאונד חולדות
- עקוב אחר הערכות פיזיולוגיות, כולל קצב נשימה, קצב לב וטמפרטורה, במהלך ההדמיה.
- להדמיית בטן של הווריד הוורידי התחתון (IVC), יש למרוח ג'ל מוליך ולכוון את המתמר במצב רוחבי. בעת הגדרה מראש של כלי הדם ההיקפיים, השתמש במצב הדמיה דו מימדי או במצב B, להוריד את הבדיקה ליניארית (10 MHz) על מרכז הבטן, התאמת עומק עם לחץ עד כלי הבטן לבוא לידי ביטוי.
- הבדיל בין IVC לאבי העורקים הבטני על ידי הערכת דחיסות ועל ידי הערכת זרימה הן באמצעות צבע והן באמצעות מצב דופלר גל פועם עם בדיקה ליניארית בתדר גבוה (10 MHz).
- בעת הפעלת דחיסה עם בדיקת אולטרסאונד, להבדיל בין השניים כמו IVC הוא דחיסה, בעוד אבי העורקים שומר על צורתו ופטנטיות.
- הערך את הכיוון והמהירות של זרימת הדם באמצעות דופלר צבע וגל פולסים. חלון דופלר בצבע מייצג את הזרימה לכיוון הגשושית באדום וזורם הרחק מהגשושית בכחול. העבר את המכשיר למצב דופלר גל דופק (מצב דופלקס) כדי להעריך את כיוון זרימת הדם ומהירותה לאורך זמן. קבל תמונות זרימה נחוצות באמצעות כלי לכידת התמונה האוטומטי של מכשיר האולטרסאונד (המפרטים המדויקים לרכישת תמונה עשויים להשתנות בין מערכות אולטרסאונד).
- השתמש בשיטת ההערכה הבאה: לאבי העורקים יש זרימת דם לכיוון הגשושית וצורת גל טריפאזית, ואילו ל- IVC יש זרימה ספונטנית הרחק מהגשושית עם משרעת נמוכה בהרבה.
- אם ה- IVC הפרוקסימלי מציג צורת גל נורמלית, אך צורת גל לא פאזית או נעדרת (שטוחה) מזוהה באופן דיסטלי, בדוק את האפשרות של חסימה ורידית בין נקודות בדיקה אלה.
- לאחר איתור ה- IVC, זהה את החלק האמצעי, שנמצא בחלק השלישי האמצעי, נחות מוורידי הכליה ועדיף על התפצלות IVC, ככל הנראה היכן נמצאים הורידים המותניים.
- מדדו בחתך האמצע IVC את הקוטר מקיר לקיר במבט הרוחבי באמצעות תמונת חתך B במצב רישום, תוך רישום הקוטר הרחב ביותר של כלי השיט. רכישת הדמיה עשויה להשתנות במכשירי אולטרסאונד שונים. אחסן נתונים באמצעות דיסקים קומפקטיים (תקליטורים) בקובצי DICOM.
3. מיקרו-כירורגיה של חולדות והתאוששות
- נקו את הבטן עם פילינג כלורהקסידין ספוג גזה ותמיסת כלורהקסידין 3x כדי להבטיח מצב כירורגי אספטי.
- הניחו סרט נצמד מעוקר כעטיפה כירורגית לכיסוי בית החזה ואזור הבטן של החולדה, ידיות מיקרוסקופ (הגדלה ומיקוד) ועינית.
- בצע חתך קו אמצע גחוני (3 ס"מ) כ 2 ס"מ מתחת לתהליך xiphoid עם מספריים קשתית דרך העור ואת דופן הבטן, לחשוף את התוכן הבטן. השתמש בגזה סטרילית ספוגה במי מלח בגודל 2 אינץ 'x 2 אינץ 'כדי לשקף את המעיים לצד ימין של החיה.
- לחשיפת IVC יש לבצע דיסקציה קהה באמצעות מוליך סטרילי מכותנה. הניחו ספקולום תיל בחתך, המאפשר הדמיה IVC.
- צרוב את כל ענפי המותניים IVC באמצעות צוואר קצה דק בטמפרטורה נמוכה, מוורידי הכליה ועד הביפורקציה האיליאקית, ולקשור ענפים צדדיים עם 7-0 תפרים פוליפרופילן שאינם נספגים.
- מניחים מיקרוקליפ כלי דם מעוקל פרוקסימלי על IVC, המופרד מאבי העורקים ופשוט נחות מוורידי הכליה. מניחים מיקרוקליפ ישר על IVC דיסטלי, אשר מופרד מאבי העורקים ועדיף על ביפורקציה IVC.
- מקום 8-0 תפר ניילון U תפר קאודלי לווריד הכליה השמאלי במרכז המשטח הקדמי של ה- IVC.
- הכנס חוט מנחה מושחז בקוטר 0.014 מ"מ כאשר בלון הווריד טעון לאחור, מדרדר לזרימת הדם לתוך IVC אינפרא כלייתי, קאודלי למיקרוקליפ המעוקל.
- מקדמים את הבלון לאמצע IVC בטכניקת סלינגר. הסר את חוט ההנחיה המושחז וניפח את בלון הווריד למשך 3 דקות עם מתיחת יתר IVC של 10% עד 15% באמצעות מזרק ניפוח של 20 מ"ל ליצירת לחץ חיובי בטווח של 0-30 אטמ. שטוף את כל המערכות במי מלח סטריליים לפני קנולציית IVC כדי למנוע תסחיף אוויר.
הערה: IVC בקוטר 2.8 מ"מ יעבור מתן ארס עד 3.22 מ"מ (מתיחת יתר של 15%). לחץ הניפוח הנדרש כדי להגיע למתיחת היתר הרצויה נקבע על פי מאפייני הבלון וזמין על אריזת היצרן. - הדקו את תפר ה-U בעת ניפוח והסרת בלון הווריד. הסר את המיקרוקליפים.
- סגור את אתר הלפרטומיה בצורה דו שכבתית. השתמש בתפר סינתטי 5-0 פוליגלקטין נספג בתבנית רציפה כדי לסגור הן את דופן הבטן והן את העור.
- מתן תרחיף הזרקה בופרנורפין בשחרור מורחב, 0.65 מ"ג / ק"ג תת עורית (SC) לאחר הניתוח כמשכך כאבים לחולדות מכיוון שהוא אינו מפריע ללוחות הסמנים הביולוגיים של מולקולות דלקתיות לניתוח חלבונים.
- לשחזר חולדות בכלוב בודד, לצפות לאחר הניתוח (30 דקות) תחת מנורת חימום (מרחק מינימלי - 24 אינץ 'מהכלוב), ולאחר מכן לחזור ליחידות הדיור המקוריות שלהם.
- עבור חיות דמה מכל קבוצת ניסוי, יש לבצע רק את הדיסקציה, ללא קשירת ענפי IVC, צריבה וקנולציה.
- עבור תנאים פוסט-טרומבוטיים, מניחים מיקרוקליפ כלי דם ישר פרוקסימלי על IVC, המופרד מאבי העורקים, רק נחות מוורידי הכליה, למשך 24 שעות. השתמש באותן טכניקות דיסקציה וסגירה.
- בדוק את סימני האולטרסאונד של חסימת IVC, הכוללים הדמיה של קליפ IVC, אישור של IVC דיסטלי ללא זרימה, ורידים iliac משותף נפוח. ניתן להתאים אישית את נקודות הזמן למעקב כך שיתאימו לדרישות המחקר.
- כדי לבחון את השינויים הפיזיולוגיים המודלים, בחר נקודות זמן ב -72 השעות הראשונות להיווצרות תרומבי מוקדמת ומ- 3 עד 7 ימים לאחר הפרוצדורל לפתרון טרומבי מאוחר יותר. נקודות זמן מאוחרות יותר שנבדקו במודל זה כוללות 7 עד 28 ימים 5,13.
- השתמש בטכניקות בשלבים 3.5-3.9 עבור ארס בלון פוסט-טרומבוטי עם האזהרות הבאות: לחץ אינסופלטור גבוה יותר עשוי להידרש כדי להשיג את מתיחת היתר הרצויה מכיוון שקוטר IVC גדל בתנאים פוסט-טרומבוטיים.
- לבצע המתת חסד על פי ההמלצות שנקבעו על ידי ההנחיות הנוכחיות של האגודה הרפואית הווטרינרית האמריקאית על המתת חסד עבור מכרסמים על ידי ביצוע שתי שיטות אישור (הסרת דם והסרת איברים חיוניים) כדי להבטיח את בעל החיים לא להחיות.
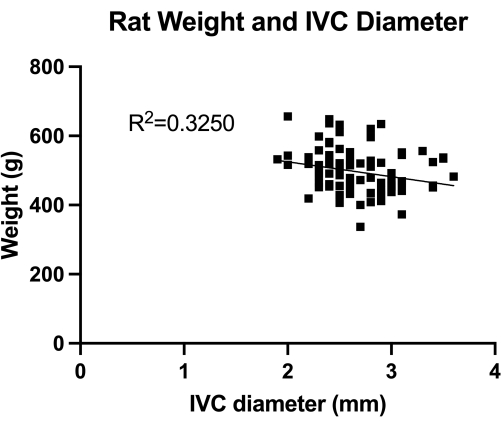
איור 1: התפלגות מדידות דופלקס טרנס-בטני בקוטר IVC רוחבי (חתך אינפרא-כלייתי אמצעי). המדידה נעשתה לפי משקל בעלי חיים. לא נמצא קשר מובהק בין המשקל לקוטר IVC. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. הכנת מדגם
- בצע העברת רקמות מאשרת של בלוני וריד מצופים בתרופות באמצעות טכניקת בדיקת כרומטוגרפיה נוזלית (HPLC) בעלת ביצועים גבוהים.
- מנתחים את IVC ואבי העורקים ומסירים את en bloc לצורך הטמעת פרפין קבוע פורמלין וניתוח היסטולוגי.
- לניתוח חלבונים, יש להשתמש במאגר RIPA בריכוז מדלל של 60,000 מיקרוגרם/גרם דגימה, לעבד עם הומוגנייזר רקמה בתנאי חדר בטמפרטורה נמוכה ב-4°C, ולאחסן בטמפרטורה של -80°C לאחר העיבוד.
תוצאות
VBM הוא מודל המעריך את ההשפעה של בלוני venoplasty בשליטה מלאה hemostasis. ראשית, כימתנו את קוטר ה-IVC (חתך אינפרא-כלייתי אמצעי), כפי שמוצג באיור 1, עבור גודל נכון של הבלון. שנית, הטכניקה המיקרוכירורגית שפותחה שלב אחר שלב מודגמת באיור 2, ואנו גם מראים דוגמאות לשלבים הקריטיים ...
Discussion
VBM יכול להתבצע על חולדות ≥ 250 גרם באמצעות בלונים בטווח 2.5-3.5 מ"מ. עבור חולדות העולות על 750 גרם, הטכניקה מוגבלת על ידי כמות גבוהה יותר של רקמת שומן בחלל הבטן וגודל האיבר ולא על ידי שינויים בקוטר IVC. מניסיוננו, מצאנו כי נדרשים 10 בעלי חיים או יותר בכל קבוצה כדי לקבל מובהקות סטטיסטית בין הקבוצות לצו?...
Disclosures
לא הוכרז על ניגוד עניינים.
Acknowledgements
מחקר זה נתמך על ידי מענק המחקר American Venous Forum (AVF) 2023 ו-Surmodics, Inc.
Materials
| Name | Company | Catalog Number | Comments |
| 3-0 DemeCRYL | DemeTech | G183019F4P | 12 per box |
| 5-0 DemeCRYL | DemeTech | G285017B0P | 12 per box |
| 7-0 DemeLENE | DemeTech | PM197011F13M | 12 per box |
| 8-0 DemeLON | DemeTech | NL868007C7P | 12 per box |
| Angled Clip Applier | SCANLAN | 3795-01A | 7-1/4″ (18.5 cm) |
| Baxter 0.9% Sodium Chloride Irrigation Bottle | Baxter | SKU: 195-7124 | 1000mL Bottle |
| Bovie Cautery Low Temperature Fine Tip | Symmetry Surgical Inc | AA00 | 10/bx |
| Buprenorphine | Fidelis Animal Health | SKU- 099114 | 1.3mg/mL, 3mL |
| CD (Sprague Dawley) Rats | Charles River | Strain Code 001 | Male, 400 gm |
| Clip-It Traceable Timer | TRACEABLE PRODUCTS | Cat. No. 5046 | |
| Cotton-Tip Applicator 3" | Dukal Corporation | 922-00037BX100 | 1000/BOX |
| Enzymatic Surgical Instrument Detergent and Presoak | Medline | MDS88000B9 | 1 Gal |
| Eye Lube | Optixcare | SKU-065441 | 20gm |
| Gaymar T/Pump Stryker Localized Warming/Cooling Therapy System | Stryker | TP700 | |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-20 | Straight |
| Heifetz Microclips 12mmx2.25mm | SCANLAN | 3795-28 | Curved |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-14 | Straight |
| Heifetz Microclips 8mmx1.75mm | SCANLAN | 3795-18 | Curved |
| Inflation device | Merit Medical | IN4130 | BasixCOMPAK with Analog Display |
| Isoflurane | MFR VETONE | SKU-501017 | 100mL, Liquid for Inhalation |
| Microsurgery kit containing tweezers and forceps | Customized | ||
| Oxygen, E-tank | Medline | MDM1630 | |
| Sharpened Guidewire | Customized | ||
| Sterile Glad Press-n-Seal | Glad | SKU # PSS-140 | ETO Exposed |
| Sterile Nonwoven Gauze Sponges 2s 4ply 4x4 | Medline | SKU PRM21444H | 100Ct |
| Surgical microscope | Zeiss | S100 / OPMI pico | |
| Surgical Scrub & Handwash | Vetoquinol | NDC: 17030-003-16 | 16 oz |
| Ultrasound Gel | Medline | CTR001305 | 8.5 oz, 12/CS |
| Ultrasound system | Siemens | ACUSON Antares | 3-D, Color, Continuous wave (CW), Pulsed wave (PW), Power CW/CW Spectral |
| Venoplasty Balloon | Customized |
References
- Prandoni, P., et al. The long-term clinical course of acute deep venous thrombosis. Ann Inter Med. 125 (1), 1-7 (1996).
- Prandoni, P., Kahn, S. R. Post-thrombotic syndrome: prevalence, prognostication and need for progress. Br J Haematol. 145 (3), 286-295 (2009).
- Gloviczki, P., et al. The 2023 Society for Vascular Surgery, American Venous Forum, and American Vein and Lymphatic Society clinical practice guidelines for the management of varicose veins of the lower extremities. Part II. J Vas Surg Venous Lymph Diso. 12 (1), 101670 (2024).
- Henke, P., Sharma, S., Wakefield, T., Myers, D., Obi, A. Insights from experimental post-thrombotic syndrome and potential for novel therapies. Transl Res. 225, 95-104 (2020).
- Diaz, J. A., et al. Choosing a mouse model of venous thrombosis: A consensus assessment of utility and application. Arterioscl Thrombo Vasc Biol. 39 (3), 311-318 (2019).
- Lee, Y. U., Lee, A. Y., Humphrey, J. D., Rausch, M. K. Histological and biomechanical changes in a mouse model of venous thrombus remodeling. Biorheology. 52 (3), 235-245 (2015).
- Xie, H., et al. Correspondence of ultrasound elasticity imaging to direct mechanical measurement in aging DVT in rats. Ultrasound Med Biol. 31 (10), 1351-1359 (2005).
- Moini, M., et al. Venoplasty and stenting in post-thrombotic syndrome and non-thrombotic iliac vein lesion. Minim Invasive Ther Allied Technol. 29 (1), 35-41 (2020).
- Chaitidis, N., et al. Management of post-thrombotic syndrome: A comprehensive review. Curr Pharma Des. 28 (7), 550-559 (2022).
- Dangas, G. D., et al. In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol. 56 (23), 1897-1907 (2010).
- Neglén, P., Berry, M. A., Raju, S. Endovascular surgery in the treatment of chronic primary and post-thrombotic iliac vein obstruction. Euro J Vas Endovas Surg. 20 (6), 560-571 (2000).
- Sharifi, M., Mehdipour, M., Bay, C., Smith, G., Sharifi, J. Endovenous therapy for deep venous thrombosis: The TORPEDO trial. Catheter Cardiovasc Interv. 76 (3), 316-325 (2010).
- Nicklas, J. M., Gordon, A. E., Henke, P. K. Resolution of deep venous thrombosis: Proposed immune paradigms. Int J Mol Sci. 21 (6), 2080 (2020).
- Li, J., Kim, S. G., Blenis, J. Rapamycin: One drug, many effects. Cell Metabol. 19 (3), 373-379 (2014).
- Chen, X., et al. Rapamycin regulates Akt and ERK phosphorylation through mTORC1 and mTORC2 signaling pathways. Mol Carcinogen. 49 (6), 603-610 (2010).
- Diaz, J. A., Farris, D. M., Wrobleski, S. K., Myers, D. D., Wakefield, T. W. Inferior vena cava branch variations in C57BL/6 mice have an impact on thrombus size in an IVC ligation (stasis) model. J Thromb Haemo. 13 (4), 660-664 (2015).
- Schönfelder, T., Jäckel, S., Wenzel, P. Mouse models of deep vein thrombosis. Gefässchirurgie. 22 (1), 28-33 (2017).
- de Barros, R. S. M., et al. Morphometric analysis of rat femoral vessels under a video magnification system. J Vasc Bras. 16 (1), 73-76 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved