需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Methods Article
发育中的斑马鱼幼虫的双光子激光介导的成骨细胞消融
摘要
该协议描述了在斑马鱼幼虫中进行的双光子激光消融方法,该方法用作研究骨再生和免疫反应对消融的影响的模型。
摘要
斑马鱼 (Danio rerio) 具有出色的再生不同器官和附属物的能力。斑马鱼的骨骼再生已经使用不同的方法进行了研究,例如鳍截肢、拔鳞、颅骨环切和显微镜方法。使用配备双光子激光器的共聚焦激光扫描装置,开发了一种激光消融方法作为病变范式,以消融斑马鱼幼虫发育中的成骨细胞(成骨细胞)。这里描述的方法允许以精确的方式消融细胞,因为面积、形状和深度可以微调。此外,这种方法允许在消融之前和之后对区域进行成像,以便分析损伤的短期影响。在这个实验装置中,研究了受伤区域成骨细胞消融后的免疫反应。消融后观察到巨噬细胞募集的增加,表明它们在骨再生过程中存在的相关性。
引言
斑马鱼可以再生各种器官,例如视网膜、大脑、心脏和胰腺1。此外,斑马鱼可以再生骨骼元素,这就是为什么它们被用来研究鳍、鳞片和颅骨(颅帽)的再生2。不同的实验范式已被用于研究组织和骨骼再生,例如鳍切除术(截肢)、鳍骨折、颅骨穿孔 3,4、冷冻损伤 5,6 或遗传消融 7,8,9。最近,激光消融方法已广泛用于斑马鱼,以研究受伤后的愈合和再生反应 10,11,12,13,14。
激光介导的消融已用于生物学研究的不同领域,例如机械生物学、发育生物学、再生研究和肿瘤手术 10,11,12,15,16,17,18,19。激光烧蚀的方法多种多样,例如使用 YAG(钇铝石榴石)、UV(紫外线)或 2p(双光子)激光器20。激光消融可以非常准确地去除单个细胞或较大部分的组织,从而能够研究不同的过程,例如免疫系统对肿瘤消融的反应21 或斑马鱼鳃盖再生过程中。在后一个例子中,通过细胞核和细胞质荧光团信号的消失以及坏死染色来证实消融10,22。
众所周知,先天免疫反应及其调节动力学对于适当的组织再生至关重要。中性粒细胞和巨噬细胞是最早被募集到损伤部位的细胞,它们在那里发挥不同的作用,例如细胞因子和生长因子释放、细胞碎片清除和细胞外基质重塑23。在截肢的斑马鱼鳍24 和发育中的鳃盖中也观察到这种募集和随后的巨噬细胞功能化,鳃盖经受激光"纳米解剖"导致成骨细胞消融10。在后一个实验中,观察到紫外激光和双光子激光介导的消融后成骨细胞数量恢复、鳃盖发育正常以及先天免疫细胞(中性粒细胞、巨噬细胞和破骨细胞样细胞)向受伤区域募集10。使用糖皮质激素对免疫系统进行药理学抑制的斑马鱼实验表明,免疫力失调后再生受损,支持免疫系统在组织修复中的功能作用 3,10,25,26。
在这里,描述了一种双光子激光介导的消融方法,用于研究发育中的斑马鱼骨骼中骨再生的生物学。特别是,成骨细胞消融方法在鳃盖中的作用表现在免疫反应方面,这是通过监测巨噬细胞募集到消融部位来研究的。
研究方案
该研究方案获得了萨克森州州长的批准,许可证编号为 25-5131/564/2、DD25-5131/450/4、25-5131/496/56、DD25.1-5131/354/87。所使用的斑马鱼品系根据国家法律和标准化条件进行维护,如前所述 27,28。材料表中列出了研究中使用的所有试剂和设备的详细信息。
1. 材料和溶液的制备
- 将胚胎维持在 1x E3 培养基中。通过在 10 L 去离子水中稀释 170 mL 的 60x E3 原液并加入 2 mL 0.1% 亚甲蓝来制备 1x E3 培养基。
- 通过在 1 L 去离子高压灭菌水中混合 17.2 g NaCl、0.76 g KCl、2.90 g CaCl2·2 H2O、4.90 g MgSO4·7 H2O 来制备 60x E3 培养基储备液。
- 对于幼虫包埋,提前准备 1% 低熔点琼脂糖 (LMA) 的等分试样,并将其保存在室温下。
- 要制备等分试样,将 LMA 溶解在 1x E3 培养基中,例如,在锥形瓶中将 500 mg LMA 溶于 50 mL 1x E3 中,在微波炉中加热溶液直至琼脂糖完全溶解,然后将其分装成 1 mL 等分试样,装在 1.5 mL 试管中。
2. 斑马鱼育种和胚胎采集
注意:双转基因斑马鱼幼虫报告存在定型成骨细胞 [osterix:nGFP = Tg(Ola.Sp7:NLS-GFP)zf132]29 和巨噬细胞 [mpeg:mCherry = Tg(mpeg:mCherry)gl23] 在这里使用30 (图 1A)。
- 在交配前一天晚上,将具有所需单转基因的亲本斑马鱼放在标准交配笼中。
注意:标准交配笼允许卵传递到亲本斑马鱼无法接触到它们的较低隔间。- 使用交配笼中的隔板将雄性和雌性分开,直到交配。第二天早上取下隔板以开始交配。
- 最迟在中午,从繁殖箱中取出亲本斑马鱼并收集胚胎,通过筛子过滤交配笼中的水。
注意:如果幼虫的确切年龄是决定性的,请定期收获胚胎,间隔约为 30 分钟。离合器配合应用于不同实验组的实验。 - 将胚胎放入含有 1x E3 培养基的 100 mm 直径培养皿中,并将它们保存在 28 °C31 的培养箱中。
- 在立体显微镜的帮助下,使用塑料移液器从培养皿中取出未受精的鸡蛋和死胚胎,并每天更换 1x E3 培养基。
- 实验前,使用荧光立体显微镜对报告基因转基因阳性的幼虫进行分类。
3. 幼虫包埋在低熔点琼脂糖中
- 在 65 °C 的热块或水浴中熔化 LMA 等分试样。 一旦LMA熔化,将其保持在42°C直至包埋(图1B)。将 50 μL 0.4% MS-222 添加到熔化的 1 mL LMA 等分试样中,以达到 0.02% MS-222 浓度用于麻醉。
- 在 0.02% MS-222 E3 培养基中麻醉 4 dpf(受精后天数)幼虫(或更老的幼虫)。
- 使用 3 mL 塑料巴斯德移液器将麻醉的幼虫转移到玻璃底微孔培养皿中,并使用相同的移液器去除多余的 E3 培养基(图 1B)。避免幼虫干燥。
注意:一个培养皿中可以同时包埋多个幼虫;建议包埋 3 到 5 只幼虫,以便有足够的时间放置。 - 从水浴/热块中取出熔化的 LMA 琼脂糖,向培养皿中加入(冷却)LMA 滴,覆盖幼虫所在的玻璃底部。注意 LMA 不会太热,但仍然是液体。
- 然后,在琼脂糖凝固之前将幼虫置于所需的横向位置。在这里,确保鳃盖的横向位置尽可能靠近培养皿的玻璃底部,作为反向显微镜设置的准备(图 1B)。
- 让琼脂糖凝固,然后将 E3 培养基(最多含有 0.02% MS-222)添加到培养皿中,以避免琼脂糖干燥(图 1B)。
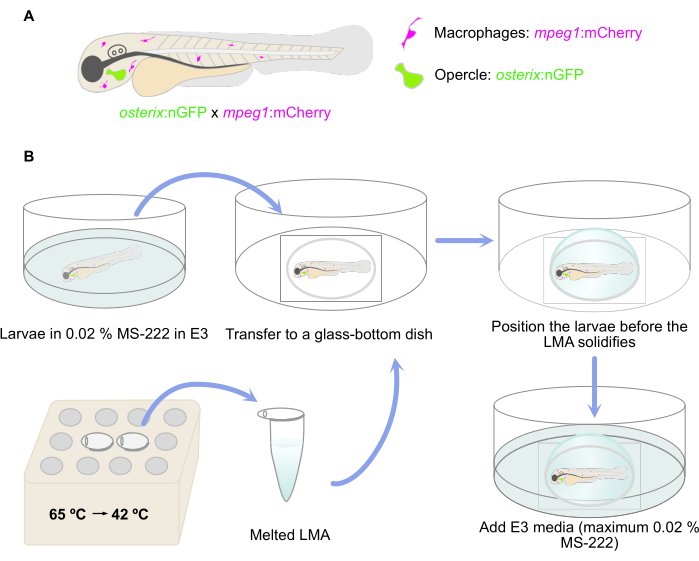
图 1:包埋程序的示意图。(A) 双转基因 Tg(osterix:nGFP;mpeg1:mCherry)29,30 只斑马鱼幼虫,绿色标记的鳃盖成骨细胞和红色标记的巨噬细胞。(B) 嵌入程序的工作流程,如协议的步骤 3 中所述。请单击此处查看此图的较大版本。
4. 幼虫 的活体 成像和激光消融
- 激光消融转基因斑马鱼发育中鳃盖中的成骨细胞 Tg(osterix:nGFP;mpeg1:mCherry)29,30,使用带有 25x/0.95 水物镜或等效设置的倒置双光子激光扫描显微镜。
- 将带有嵌入幼虫的培养皿放在倒置显微镜的显微载物台上,并将所需的消融区域定位在视野中心。在 GFP 荧光信号的帮助下,可以很容易地识别鳃盖。
- 一旦鳃盖聚焦并在显微镜的视野中居中,选择 z 堆栈设置(通常使用 1-2 μm z 间隔)来对鳃盖的整个宽度进行成像。同时,在特定的 z 平面中选择要消融的区域(通常在鳃盖的后区)。双光子激光烧蚀仅在该平面上施加。
注意:z 维度的分辨率越高,成像时间越长,但稍后将能够对采集的数据进行体积分析。 - 消融前对感兴趣的鳃盖区域进行成像。对于 GFP 检测,请使用 488 nm 的白光激光器和 495 nm 至 550 nm 或等效波长的混合检测器。使用 555 nm(白光激光)激发对巨噬细胞进行成像,在混合检测器(或等效检测器)上,mCherry 检测范围为 595 至 780 nm。
- 使用 512 x 512 图像格式以获得良好的质量/时间比(如果需要更高分辨率或更高的速度,可以使用其他格式)。
注意:可以使用安装在显微镜上的温控培养箱并进行调整,例如,至 28 °C。
- 使用 512 x 512 图像格式以获得良好的质量/时间比(如果需要更高分辨率或更高的速度,可以使用其他格式)。
- 在选定的 2D 平面上绘制一个直径为 25 μm 的圆形区域(可根据实验选择其他形状和大小),使用 ROI 工具聚焦鳃盖。
- 要进行消融,请以 450 mW 的功率(无物镜测量)施加,并以 400 Hz 的扫描速度和 10 秒的总持续时间将所选区域暴露于双光子激光器。在消融过程中,可以使用 401-443 nm 或等效范围内的混合探测器可视化该区域。
- 消融后,通过使用相同的设置再次成像相同的 z 堆栈来确认消融的结构。消融区域不再包含荧光细胞。
5. 幼虫的恢复和成像监测免疫细胞募集
- 如果需要延迟进行免疫细胞募集的成像,请从成像和麻醉中恢复幼虫。使用镊子或解剖针小心地从 LMA 中取出幼虫。
- 首先,去除覆盖幼虫的一层琼脂糖。其次,去除与幼虫直接接触的琼脂糖。如果正在立即进行免疫细胞募集的成像,则省略此步骤。
- 将幼虫放回装有纯 E3 培养基的培养皿中,并检查其恢复情况。幼虫的游泳可以明显恢复。
- 在 4 或 6 hpl(病变后小时),在同一显微镜上使用相同的设置再次对鳃盖区域进行成像,以检查消融对巨噬细胞募集的影响。为此,请重复嵌入(步骤 3)和之前执行的成像(步骤 4)。
- 成像后,从 LMA 中取出幼虫。根据法律要求,可以通过在冰水中孵育或在 E3 中过量的 MS-222 来杀死幼虫。然后,标本可用于后续研究或丢弃。
6. 图像分析和统计分析
- 使用图像处理软件(如 Fiji32)处理图像。根据所采集数据的 z 分辨率,可以在 2D 或 3D 中进行分析。
- 通过包括明显分离的细胞(例如通过识别主要细胞体),或者用核标记定量细胞,或者在细胞重叠的情况下测量面积(下一步),手动定量巨噬细胞。
- 为了量化该区域,请创建一个包含巨噬细胞的面膜。为此,请使用 Image > Adjust > Threshold 工具,并在斐济创建一个 ROI(Analyze > Tools > ROI Manager > Add)。在背景中排除小颗粒进行定量。
- 然后,测量面积 (Analyze > Measure)。考虑是否需要在测量中包括重叠细胞荧光的区域。
注意:在这里,面积测量中省略了圆形消融区域,因为在该区域无法区分募集的巨噬细胞。
- 然后,测量面积 (Analyze > Measure)。考虑是否需要在测量中包括重叠细胞荧光的区域。
- 使用合适的软件生成图表,绘制测量结果。为了比较消融前后的数据,请进行适当的统计检验(这里进行了成对的单尾 t 检验 )。
注意:可以使用照片编辑和图形设计软件准备这些图表。
结果
按照上述方案中的指示进行激光消融。消融后消融区成骨细胞的 GFP 信号瞬间消失。为了研究成骨细胞消融对免疫反应的反应,对 6 dpf 幼虫中巨噬细胞在 6 hpl 之前和 6 hpl 时的存在进行了成像。消融前,在鳃盖区10 观察到的巨噬细胞非常少(图 2)。在 6 hpl 时,检测到巨噬细胞在消融的鳃盖区的强烈积累和视野中巨噬细胞数量的增?...
讨论
激光消融已应用于生物学研究的各个学科。特别是,它作为研究组织再生的方法很有用 10,11,12。例如,最近使用紫外激光或双光子激光消融测定分析了先天免疫细胞随时间的变化,以及激光消融位点成骨细胞的恢复10。免疫细胞募集的实时成像在病变后 12 小时 (hpl) 进行;但是,通?...
披露声明
作者没有什么可披露的。
致谢
这项工作得到了德国研究基金会 (DFG) Transregio 67(项目 387653785)、DFG SPP 2084 μBone(项目 KN 1102/2-1)到 FK 的支持。这项工作得到了光学显微镜设施(DFG 项目 413875620)的支持,该设施是德累斯顿工业大学 CMCB 技术平台的核心设施。德累斯顿工业大学的工作是根据撒克逊议会("州议会")商定的预算与税收共同资助的。
材料
| Name | Company | Catalog Number | Comments |
| Calcium chloride dihydrate, CaCl2·H2O | Carl Roth | 5239.1 | |
| Cell Culture Dish, PS, 100/20 mm | Greiner Bio-one | 664160 | |
| Dumont #55 Foceps | FST | 11295-51 | Tip shape straight, 11 cm, 0.05 x 0.02 mm |
| Falcon 6-well plate | Corning | 353502 | |
| Glass-bottom microwell dish | MatTek | P35G-1.5-14-C | 35 mm Dish, No. 1.5 Coverslip, 14 mm Glass Diameter, Uncoated |
| Insight X3 multiphoton laser | Spectra-Physics | ||
| Leica Application Suite | LAS X, Leica Microsystems | ||
| Low melting agarose | Biozyme | 840101 | Biozym Plaque Agarose |
| Magnesium sulfate heptahydrate, MgSO4·7H2O | Sigma-Aldrich | M5921 | |
| Mating cages | many varieties, e.g. Tecniplast | ||
| Methyleneblue | Carl Roth | A514.1 | |
| MS-222 | SIGMA Aldrich | A5040 | |
| Potassium Chloride, KCl | PanReac AppliChem | 131494 | |
| Sodium chloride, NaCl | Carl Roth | 3957.1 | |
| SP8 FALCON | Leica Microsystems | Equipped with a Insight X3 multiphoton laser and Leica Application Suite software | |
| Stainless Steel Dissect Needle | Bochem | 12010 | 140 mm |
| Stereo Microscope System SZX16 | Olympus | Equipped with a LED illumination base SZX2-ILLTQ | |
| Thermostatic Cabinets TS - WTW | xylem | TS 608/2-i | For incubation (embryo) |
| Transfer pipette, 3.5 mL | SARSTEDT | 861171 | 155 x 15 mm, LD-PE, transparent |
| Zeiss SteREO Discovery.V12 version 4.7.1.0. | Zeiss | Equipped with Axiocam MRm camera and AxioVision sofware |
参考文献
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: Zebrafish. Dev. 146 (18), dev167692 (2019).
- Dietrich, K., Fiedler, I. A. K., Kurzyukova, A. Skeletal biology and disease modeling in zebrafish. J Bone Miner Res. 36 (3), 436-458 (2021).
- Geurtzen, K., Knopf, F. Adult zebrafish injury models to study the effects of prednisolone in regenerating bone tissue. J Vis Exp. (140), e58429 (2018).
- Sousa, S., Valerio, F., Jacinto, A. A new zebrafish bone crush injury model. Biol Open. 1 (9), 915-921 (2012).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nat Protoc. 7 (4), 782-788 (2012).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biol Open. 5 (6), 819-828 (2016).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Dev Cell. 22 (4), 879-886 (2012).
- Curado, S., et al. Conditional targeted cell ablation in zebrafish: a new tool for regeneration studies. Dev Dyn. 236 (4), 1025-1035 (2007).
- Ando, K., Shibata, E., Hans, S., Brand, M., Kawakami, A. Osteoblast production by reserved progenitor cells in zebrafish bone regeneration and maintenance. Dev Cell. 43 (5), 643-650.e3 (2017).
- Geurtzen, K., López-Delgado, A. C., Duseja, A., Kurzyukova, A., Knopf, F. Laser-mediated osteoblast ablation triggers a pro-osteogenic inflammatory response regulated by reactive oxygen species and glucocorticoid signaling in zebrafish. Dev. 149 (8), 1998030 (2022).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. J Vis Exp. (159), e60966 (2020).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845 (2011).
- Goldstein, A. M., Fishman, M. C. Notochord regulates cardiac lineage in zebrafish embryos. Dev Biol. 201 (2), 247-252 (1998).
- Zhang, J., Jeradi, S., Strähle, U., Akimenko, M. A. Laser ablation of the sonic hedgehog-a-expressing cells during fin regeneration affects ray branching morphogenesis. Dev Biol. 365 (2), 424-433 (2012).
- Marshall, A. R., et al. Two-photon cell and tissue level laser ablation methods to study morphogenetic biomechanics. Methods Mol Biol. 2438, 217-230 (2022).
- Angelo, J. R., Tremblay, K. D. Laser-mediated cell ablation during post-implantation mouse development. Dev Dyn. 242 (10), 1202-1209 (2013).
- Lee, J., Lee, S., Truong, V. G., et al. Laser ablation of pancreatic cancer using a cylindrical light diffuser. Lasers Med Sci. 37 (6), 2615-2621 (2022).
- Luther, E., Mansour, S., Echeverry, N., et al. Laser ablation for cerebral metastases. Neurosurg Clin N Am. 31 (4), 537-547 (2020).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -. P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods Mol Biol. 1189, 219-235 (2015).
- Vogel, A., Venugopalan, V. Mechanisms of pulsed laser ablation of biological tissues. Chem Rev. 103 (2), 577-644 (2003).
- Wu, F. Heat-based tumor ablation: Role of the immune response. Adv Exp Med Biol. 880, 131-153 (2016).
- Renvoizé, C., Biola, A., Pallardy, M., Bréard, J. Apoptosis: Identification of dying cells. Cell Biol Toxicol. 14 (2), 111-120 (1998).
- Julier, Z., Park, A. J., Briquez, P. S., Martino, M. M. Promoting tissue regeneration by modulating the immune system. Acta Biomater. 53, 13-28 (2017).
- Petrie, T. A., Strand, N. S., Tsung-Yang, C., Rabinowitz, J. S., Moon, R. T. Macrophages modulate adult zebrafish tail fin regeneration. Dev. 141 (13), 2581-2591 (2014).
- Geurtzen, K., Vernet, A., Freidin, A. Immune suppressive and bone inhibitory effects of prednisolone in growing and regenerating zebrafish tissues. J Bone Miner Res. 32 (12), 2476-2488 (2017).
- Fleischhauer, L., López-Delgado, A. C., Geurtzen, K., Knopf, F. Glucocorticoid effects in the regenerating fin reflect tissue homeostasis disturbances in zebrafish by affecting Wnt signaling. Front Endocrinol. (Lausanne). 14, 1122351 (2023).
- Westerfield, M. . The Zebrafish Book: A Guide for the laboratory use of zebrafish (Danio rerio). , (2002).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish: A Practical Approach. , (2002).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Dev. 135 (22), 3765-3774 (2008).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- JoVE Science Education Database. Zebrafish Breeding and Embryo Handling. Biology II: Mouse, Zebrafish, and Chick. , (2023).
- Schindelin, J., Arganda-Carreras, I., Frise, E. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Niethammer, P., Grabher, C., Look, A. T., Mitchison, T. J. A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish. Nature. 459 (7249), 996-999 (2009).
- Blanchard, G. B., Scarpa, E., Muresan, L., Sanson, B. Mechanical stress combines with planar polarised patterning during metaphase to orient embryonic epithelial cell divisions. Dev. 151 (10), dev202862 (2024).
- Park, W., Wei, S., Kim, B. -. S., et al. Diversity and complexity of cell death: A historical review. Exp Mol Med. 55 (8), 1573-1594 (2023).
- O'Connor, J., Akbar, F. B., Hutson, M. S., Page-McCaw, A. Zones of cellular damage around pulsed-laser wounds. PLoS One. 16 (9), e0253032 (2021).
- Griebel, M., Vasan, A., Chen, C., Eyckmans, J. Fibroblast clearance of damaged tissue following laser ablation in engineered microtissues. APL Bioeng. 7 (1), 16112 (2023).
- Matrone, G., Taylor, J. M., Wilson, K. S. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。