È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ablazione mediata da laser a due fotoni di osteoblasti nello sviluppo di larve di zebrafish
In questo articolo
Riepilogo
Questo protocollo descrive un approccio di ablazione laser a due fotoni effettuato su larve di zebrafish, che funge da modello per studiare la rigenerazione ossea e gli effetti della risposta immunitaria all'ablazione.
Abstract
Il pesce zebra (Danio rerio) ha un'eccezionale capacità di rigenerare diversi organi e appendici. La rigenerazione ossea nel pesce zebra è stata studiata utilizzando diversi metodi come l'amputazione delle pinne, la depilazione delle squame, la trapanazione del cranio e approcci microscopici. Utilizzando una configurazione di scansione laser confocale dotata di un laser a due fotoni, è stato sviluppato un metodo di ablazione laser come paradigma di lesione per l'ablazione delle cellule che formano l'osso (osteoblasti) nell'opercolo in via di sviluppo delle larve di zebrafish. Il metodo qui descritto consente l'ablazione delle cellule in modo preciso, poiché l'area, la forma e la profondità possono essere regolate con precisione. Inoltre, questo metodo consente l'imaging dell'area prima e subito dopo l'ablazione, in modo da poter analizzare gli effetti a breve termine della lesione. In questa configurazione sperimentale, è stata studiata la risposta immunitaria dopo l'ablazione degli osteoblasti nell'area lesa. Dopo l'ablazione è stato osservato un aumento del reclutamento dei macrofagi, indicando l'importanza della loro presenza durante la rigenerazione ossea.
Introduzione
Il pesce zebra rigenera diversi organi come la retina, il cervello, il cuore e il pancreas1. Inoltre, il pesce zebra rigenera gli elementi scheletrici, motivo per cui è stato utilizzato per studiare la rigenerazione di pinne, squame e calvariae (calotte craniche)2. Diversi paradigmi sperimentali sono stati utilizzati per studiare la rigenerazione tissutale e ossea, come la resezione delle pinne (amputazione), la frattura delle pinne, la trapanazione del cranio 3,4, la criolesione 5,6 o l'ablazione genetica 7,8,9. Recentemente, gli approcci di ablazione laser sono stati ampiamente utilizzati nel pesce zebra per studiare la risposta di guarigione e rigenerazione dopo una lesione 10,11,12,13,14.
L'ablazione laser-mediata è stata utilizzata in diverse aree della ricerca biologica, come la meccanobiologia, la biologia dello sviluppo, la ricerca sulla rigenerazione e la chirurgia dei tumori 10,11,12,15,16,17,18,19. Esistono varie metodologie di ablazione laser, come l'utilizzo di laser YAG (granato di ittrio e alluminio), UV (ultravioletto) o 2p (due fotoni)20. L'ablazione laser consente la rimozione di singole cellule o porzioni più grandi di tessuti in modo molto accurato, consentendo lo studio di diversi processi, come la risposta del sistema immunitario all'ablazione tumorale21 o durante la rigenerazione dell'opercolo di zebrafish. In quest'ultimo esempio, l'ablazione è stata confermata dalla scomparsa del segnale del fluoroforo nucleare e citoplasmatico e dalla colorazione di necrosi10,22.
È noto che la risposta immunitaria innata e la sua cinetica regolata sono essenziali per un'appropriata rigenerazione tissutale. I neutrofili e i macrofagi sono le prime cellule ad essere reclutate nel sito della lesione, dove svolgono ruoli diversi, come il rilascio di citochine e fattori di crescita, la rimozione di detriti cellulari e il rimodellamento della matrice extracellulare23. Questo reclutamento e la successiva funzionalizzazione dei macrofagi sono stati osservati anche nelle pinne amputate di zebrafish24 e nell'opercolo in via di sviluppo, che è stato sottoposto a "nanodissezione" laser che ha portato all'ablazione degli osteoblasti10. In quest'ultimo esperimento, il recupero del numero di osteoblasti, il normale sviluppo degli opercoli e il reclutamento di cellule immunitarie innate (neutrofili, macrofagi e cellule simili agli osteoclasti) nell'area lesa sono stati osservati dopo il laser UV e l'ablazione mediata da laser a due fotoni10. Gli esperimenti sul pesce zebra in cui il sistema immunitario è stato farmacologicamente soppresso dall'uso di glucocorticoidi hanno mostrato una compromissione della rigenerazione in caso di immunità mal regolata, supportando il ruolo funzionale del sistema immunitario nella riparazione dei tessuti 3,10,25,26.
Qui viene descritta una metodologia di ablazione mediata da laser a due fotoni per studiare la biologia della rigenerazione ossea nello sviluppo di ossa di zebrafish. In particolare, l'effetto dell'approccio di ablazione degli osteoblasti nell'opercolo è mostrato in termini di risposta immunitaria, che viene indagata monitorando il reclutamento dei macrofagi nel sito di ablazione.
Protocollo
Il protocollo di studio ha ricevuto l'approvazione dalla Landesdirektion Sachsen, numeri di permesso 25-5131/564/2, DD25-5131/450/4, 25-5131/496/56, DD25.1-5131/354/87. I ceppi di zebrafish utilizzati sono stati mantenuti secondo la legge nazionale e in condizioni standardizzate come descritto in precedenza27,28. I dettagli di tutti i reagenti e delle attrezzature utilizzate nello studio sono elencati nella Tabella dei materiali.
1. Preparazione dei materiali e delle soluzioni
- Mantenere gli embrioni in 1x terreno E3. Preparare il terreno E3 1x diluendo 170 mL di un stock E3 60x in 10 L di acqua deionizzata e aggiungendo 2 mL di blu di metilene allo 0,1%.
- Preparare il terreno di coltura E3 60x mescolando 17,2 g di NaCl, 0,76 g di KCl, 2,90 g di CaCl2·2 H2O, 4,90 g di MgSO4·7 H2O in 1 L di acqua autoclavata deionizzata.
- Per l'inclusione delle larve, preparare in anticipo aliquote di agarosio a basso punto di fusione (LMA) all'1% e conservarle a temperatura ambiente.
- Per preparare le aliquote, sciogliere l'LMA in 1 terreno E3, ad esempio 500 mg di LMA in 50 ml di 1x E3 in un pallone di Erlenmeyer, riscaldare la soluzione nel microonde fino a quando l'agarosio non si dissolve completamente e dispensarla in aliquote da 1 ml in provette da 1,5 mL.
2. Allevamento di zebrafish e raccolta di embrioni
NOTA: Qui sono state utilizzate larve di zebrafish transgeniche doppie che riportano la presenza di osteoblasti impegnati [osterix:nGFP = Tg(Ola.Sp7:NLS-GFP)zf132]29 e macrofagi [mpeg:mCherry = Tg(mpeg:mCherry)gl23]30 (Figura 1A).
- Prepara il pesce zebra parentale con i singoli transgeni desiderati in gabbie di accoppiamento standard la sera prima dell'accoppiamento.
NOTA: Le gabbie standard per l'accoppiamento consentono alle uova di passare in uno scomparto inferiore dove i genitori del pesce zebra non possono raggiungerle.- Tenere separati maschi e femmine fino all'accoppiamento utilizzando un divisorio nella gabbia di accoppiamento. Rimuovere il divisore la mattina del giorno successivo per iniziare l'accoppiamento.
- Al più tardi a mezzogiorno, rimuovete i genitori del pesce zebra dalle vasche di riproduzione e raccogliete gli embrioni, filtrando l'acqua dalla gabbia di accoppiamento attraverso un setaccio.
NOTA: Nel caso in cui l'età esatta delle larve sia decisiva, raccogliere gli embrioni a intervalli regolari di circa 30 minuti. I clutch mate dovrebbero essere utilizzati in esperimenti con diversi gruppi sperimentali. - Mettere gli embrioni in un piatto di 100 mm di diametro contenente 1x terreno E3 e conservarli in un'incubatrice a 28 °C31.
- Rimuovere gli ovuli non fecondati e gli embrioni morti dal piatto utilizzando una pipetta di plastica con l'aiuto di uno stereomicroscopio e cambiare 1 terreno E3 al giorno.
- Prima dell'esperimento, selezionare le larve positive per i transgeni reporter utilizzando uno stereomicroscopio a fluorescenza.
3. Larve che si incastrano nell'agarosio a basso punto di fusione
- Fondere le aliquote LMA in un termoblocco o in un bagno d'acqua a 65 °C. Una volta che l'LMA è fuso, mantenerlo a 42 °C fino all'inclusione (Figura 1B). Aggiungere 50 μL di MS-222 allo 0,4% di aliquota LMA fusa per ottenere una concentrazione di MS-222 dello 0,02% per l'anestesia.
- Anestetizzare 4 larve dpf (giorni dopo la fecondazione) (o larve più vecchie) in terreno MS-222 E3 allo 0,02%.
- Trasferire le larve anestetizzate in una capsula a micropozzetti con fondo di vetro utilizzando una pipetta Pasteur di plastica da 3 ml e rimuovere il terreno E3 in eccesso con la stessa pipetta (Figura 1B). Evitare l'essiccazione delle larve.
NOTA: Più di una larva può essere incorporata in un piatto contemporaneamente; Si consiglia di incorporare da 3 a 5 larve per consentire un tempo sufficiente per il posizionamento. - Prelevare l'agarosio LMA fuso dal bagnomaria/termoblocco e aggiungere una goccia (di raffreddamento) di LMA al piatto, coprendo il fondo di vetro dove erano posizionate le larve. Prestare attenzione che l'LMA non sia troppo caldo ma comunque liquido.
- Quindi, posizionare le larve nella posizione laterale desiderata prima che l'agarosio si solidifichi. Qui, assicurarsi di una posizione laterale in cui l'opercolo sia il più vicino possibile al fondo di vetro del piatto come preparazione per la configurazione del microscopio inverso (Figura 1B).
- Lasciare solidificare l'agarosio e quindi aggiungere il terreno E3 (contenente un massimo dello 0,02% di MS-222) alla piastra per evitare l'essiccazione dell'agarosio (Figura 1B).
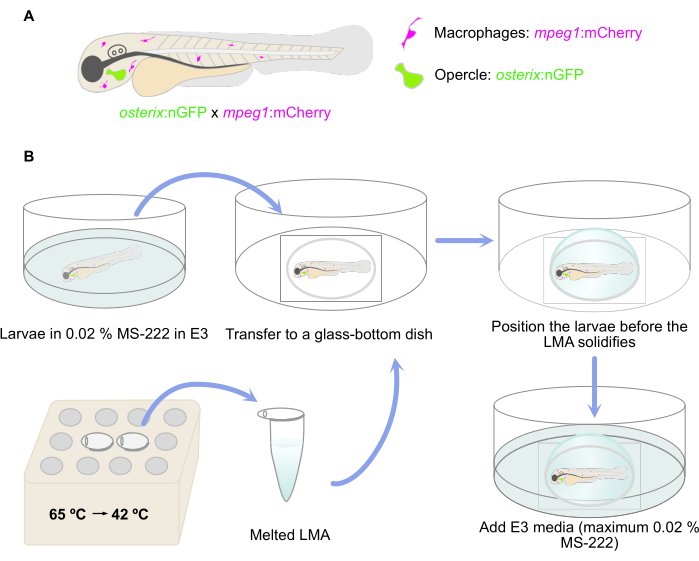
Figura 1: Rappresentazione schematica della procedura di inclusione. (A) Doppia Tg(osterix:nGFP; Sono state utilizzate 29,30 larve di zebrafish con osteoblasti opercolari marcati in verde e macrofagi marcati in rosso. (B) Il flusso di lavoro della procedura di incorporamento, come descritto nella fase 3 del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
4. Imaging in vivo delle larve e ablazione laser
- Per l'ablazione laser di osteoblasti nell'opercolo in via di sviluppo del pesce zebra transgenico Tg(osterix:nGFP; mpeg1:mCherry)29,30, utilizzare un microscopio a scansione laser a due fotoni invertito con un obiettivo ad acqua 25x/0.95 o una configurazione equivalente.
- Posizionare la capsula con le larve incorporate sul tavolino microscopico al microscopio invertito e posizionare la regione desiderata per l'ablazione al centro del campo visivo. L'opercolo può essere facilmente identificato con l'aiuto del segnale di fluorescenza GFP.
- Una volta che l'opercolo è stato messo a fuoco e centrato nel campo visivo del microscopio, scegliere le impostazioni z-stack (spesso vengono utilizzati intervalli z di 1-2 μm) per visualizzare l'intera larghezza dell'opercolo. Allo stesso tempo, scegliere l'area in uno specifico piano z da ablare (di solito nella zona posteriore dell'opercolo). L'ablazione laser a due fotoni viene esercitata solo su questo piano.
NOTA: Una risoluzione più elevata nella dimensione z porterà a tempi di imaging più lunghi, ma consentirà analisi volumetriche dei dati acquisiti in un secondo momento. - Visualizzare l'area dell'opercolo di interesse prima dell'ablazione. Per il rilevamento della GFP, utilizzare un laser a luce bianca a 488 nm e un rivelatore ibrido da 495 nm a 550 nm o equivalente. Imaging dei macrofagi utilizzando un'eccitazione a 555 nm (laser a luce bianca), con un intervallo di rilevamento mCherry da 595 a 780 nm su un rivelatore ibrido (o equivalente).
- Utilizzare il formato immagine 512 x 512 per un buon rapporto qualità/tempo (altri formati possono essere utilizzati se si desidera una risoluzione più elevata o in alternativa una velocità maggiore).
NOTA: È possibile utilizzare e regolare un'incubatrice a temperatura controllata installata sul microscopio, ad es. a 28 °C.
- Utilizzare il formato immagine 512 x 512 per un buon rapporto qualità/tempo (altri formati possono essere utilizzati se si desidera una risoluzione più elevata o in alternativa una velocità maggiore).
- Disegna una regione circolare con un diametro di 25 μm (altre forme e dimensioni possono essere selezionate a seconda dell'esperimento) in un piano 2D selezionato, focalizzando l'opercolo utilizzando lo strumento ROI.
- Per eseguire l'ablazione, applicare la potenza di ablazione (misurata senza obiettivo) a 450 mW ed esporre l'area selezionata al laser a due fotoni a una velocità di scansione di 400 Hz e una durata totale di 10 s. Durante l'ablazione, l'area può essere visualizzata utilizzando un rivelatore ibrido nell'intervallo 401-443 nm o equivalente.
- Dopo l'ablazione, confermare l'ablazione strutturalmente visualizzando nuovamente lo stesso z-stack con le stesse impostazioni utilizzate prima dell'ablazione. L'area ablata non contiene più cellule fluorescenti.
5. Recupero delle larve e imaging per monitorare il reclutamento delle cellule immunitarie
- Se l'imaging del reclutamento delle cellule immunitarie deve essere eseguito con un ritardo, recuperare le larve dall'imaging e dall'anestesia. Rimuovere con cura le larve dall'LMA utilizzando una pinza o un ago da dissezione.
- Per prima cosa, rimuovi uno strato di agarosio che copre le larve. In secondo luogo, rimuovere l'agarosio a diretto contatto con le larve. Omettere questo passaggio se è in corso l'imaging immediato del reclutamento delle cellule immunitarie.
- Rimettere le larve in un piatto con terreno E3 puro e verificarne il recupero. Il recupero è evidente nuotando delle larve.
- A 4 o 6 hpl (ore dopo la lesione), visualizzare nuovamente l'area opercolare utilizzando le stesse impostazioni allo stesso microscopio per verificare gli effetti dell'ablazione sul reclutamento dei macrofagi. A tale scopo, ripetere l'incorporamento (passaggio 3) e l'imaging come eseguito in precedenza (passaggio 4).
- Dopo l'imaging, rimuovere le larve dall'LMA. Il sacrificio delle larve può essere eseguito mediante incubazione in acqua ghiacciata o con un sovradosaggio di MS-222 in E3, a seconda dei requisiti di legge. I campioni possono quindi essere utilizzati per studi di follow-up o smaltiti.
6. Analisi delle immagini e analisi statistiche
- Elabora le immagini utilizzando un software di elaborazione delle immagini come Fiji32. A seconda della risoluzione z dei dati acquisiti, le analisi possono essere eseguite in 2D o 3D.
- Quantificare manualmente i macrofagi includendo cellule chiaramente separate, ad esempio distinguendo i corpi cellulari principali, o in alternativa quantificando le cellule con un'etichetta nucleare o misurando l'area nel caso in cui le cellule si sovrappongano (passaggio successivo).
- Per quantificare l'area, creare una maschera che includa i macrofagi. A tale scopo, utilizza lo strumento Regola > soglia > immagine e crea un ROI (Strumenti di analisi > > Gestore ROI > Aggiungi) nelle Fiji. Escludere piccole particelle sullo sfondo per la quantificazione.
- Quindi, misurare l'area (Analizza > misura). Considerare se le aree di fluorescenza cellulare sovrapposta devono essere incluse nella misurazione.
NOTA: Qui, l'area di ablazione circolare è stata omessa dalle misurazioni dell'area poiché i macrofagi reclutati non possono essere distinti in quest'area.
- Quindi, misurare l'area (Analizza > misura). Considerare se le aree di fluorescenza cellulare sovrapposta devono essere incluse nella misurazione.
- Genera grafici che tracciano i risultati della misurazione utilizzando un software adatto. Per confrontare i dati prima e dopo l'ablazione, eseguire un test statistico appropriato (qui è stato eseguito un test t accoppiato a una coda).
NOTA: Le figure possono essere preparate utilizzando software di fotoritocco e progettazione grafica.
Risultati
L'ablazione laser è stata eseguita come indicato nel protocollo di cui sopra. Il segnale GFP degli osteoblasti nell'area ablata è scomparso istantaneamente dopo l'ablazione. Per studiare la risposta dell'ablazione degli osteoblasti in termini di risposta immunitaria, è stata rilevata la presenza di macrofagi in larve di 6 dpf prima e a 6 hpl. Prima dell'ablazione, sono stati osservati pochissimi macrofagi nell'area opercolare10 (Figura 2
Discussione
L'ablazione laser è stata applicata in varie discipline della ricerca biologica. In particolare, è stato utile come metodo per studiare la rigenerazione tissutale 10,11,12. Ad esempio, il reclutamento e i cambiamenti fenotipici delle cellule immunitarie innate sono stati recentemente analizzati nel tempo utilizzando saggi di ablazione laser UV o laser a due fotoni, insieme al recupero di osteo...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione tedesca per la ricerca (DFG) Transregio 67 (progetto 387653785), dal DFG SPP 2084 μBone (progetto KN 1102/2-1) a FK. Questo lavoro è stato supportato dalla Light Microscopy Facility (DFG project 413875620), una struttura centrale della piattaforma tecnologica CMCB presso l'Università tecnica di Dresda. I lavori presso l'Università Tecnica di Dresda sono stati cofinanziati con entrate fiscali sulla base del bilancio approvato dal Parlamento sassone («Landtag»).
Materiali
| Name | Company | Catalog Number | Comments |
| Calcium chloride dihydrate, CaCl2·H2O | Carl Roth | 5239.1 | |
| Cell Culture Dish, PS, 100/20 mm | Greiner Bio-one | 664160 | |
| Dumont #55 Foceps | FST | 11295-51 | Tip shape straight, 11 cm, 0.05 x 0.02 mm |
| Falcon 6-well plate | Corning | 353502 | |
| Glass-bottom microwell dish | MatTek | P35G-1.5-14-C | 35 mm Dish, No. 1.5 Coverslip, 14 mm Glass Diameter, Uncoated |
| Insight X3 multiphoton laser | Spectra-Physics | ||
| Leica Application Suite | LAS X, Leica Microsystems | ||
| Low melting agarose | Biozyme | 840101 | Biozym Plaque Agarose |
| Magnesium sulfate heptahydrate, MgSO4·7H2O | Sigma-Aldrich | M5921 | |
| Mating cages | many varieties, e.g. Tecniplast | ||
| Methyleneblue | Carl Roth | A514.1 | |
| MS-222 | SIGMA Aldrich | A5040 | |
| Potassium Chloride, KCl | PanReac AppliChem | 131494 | |
| Sodium chloride, NaCl | Carl Roth | 3957.1 | |
| SP8 FALCON | Leica Microsystems | Equipped with a Insight X3 multiphoton laser and Leica Application Suite software | |
| Stainless Steel Dissect Needle | Bochem | 12010 | 140 mm |
| Stereo Microscope System SZX16 | Olympus | Equipped with a LED illumination base SZX2-ILLTQ | |
| Thermostatic Cabinets TS - WTW | xylem | TS 608/2-i | For incubation (embryo) |
| Transfer pipette, 3.5 mL | SARSTEDT | 861171 | 155 x 15 mm, LD-PE, transparent |
| Zeiss SteREO Discovery.V12 version 4.7.1.0. | Zeiss | Equipped with Axiocam MRm camera and AxioVision sofware |
Riferimenti
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: Zebrafish. Dev. 146 (18), dev167692 (2019).
- Dietrich, K., Fiedler, I. A. K., Kurzyukova, A. Skeletal biology and disease modeling in zebrafish. J Bone Miner Res. 36 (3), 436-458 (2021).
- Geurtzen, K., Knopf, F. Adult zebrafish injury models to study the effects of prednisolone in regenerating bone tissue. J Vis Exp. (140), e58429 (2018).
- Sousa, S., Valerio, F., Jacinto, A. A new zebrafish bone crush injury model. Biol Open. 1 (9), 915-921 (2012).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nat Protoc. 7 (4), 782-788 (2012).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biol Open. 5 (6), 819-828 (2016).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Dev Cell. 22 (4), 879-886 (2012).
- Curado, S., et al. Conditional targeted cell ablation in zebrafish: a new tool for regeneration studies. Dev Dyn. 236 (4), 1025-1035 (2007).
- Ando, K., Shibata, E., Hans, S., Brand, M., Kawakami, A. Osteoblast production by reserved progenitor cells in zebrafish bone regeneration and maintenance. Dev Cell. 43 (5), 643-650.e3 (2017).
- Geurtzen, K., López-Delgado, A. C., Duseja, A., Kurzyukova, A., Knopf, F. Laser-mediated osteoblast ablation triggers a pro-osteogenic inflammatory response regulated by reactive oxygen species and glucocorticoid signaling in zebrafish. Dev. 149 (8), 1998030 (2022).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. J Vis Exp. (159), e60966 (2020).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845 (2011).
- Goldstein, A. M., Fishman, M. C. Notochord regulates cardiac lineage in zebrafish embryos. Dev Biol. 201 (2), 247-252 (1998).
- Zhang, J., Jeradi, S., Strähle, U., Akimenko, M. A. Laser ablation of the sonic hedgehog-a-expressing cells during fin regeneration affects ray branching morphogenesis. Dev Biol. 365 (2), 424-433 (2012).
- Marshall, A. R., et al. Two-photon cell and tissue level laser ablation methods to study morphogenetic biomechanics. Methods Mol Biol. 2438, 217-230 (2022).
- Angelo, J. R., Tremblay, K. D. Laser-mediated cell ablation during post-implantation mouse development. Dev Dyn. 242 (10), 1202-1209 (2013).
- Lee, J., Lee, S., Truong, V. G., et al. Laser ablation of pancreatic cancer using a cylindrical light diffuser. Lasers Med Sci. 37 (6), 2615-2621 (2022).
- Luther, E., Mansour, S., Echeverry, N., et al. Laser ablation for cerebral metastases. Neurosurg Clin N Am. 31 (4), 537-547 (2020).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -. P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods Mol Biol. 1189, 219-235 (2015).
- Vogel, A., Venugopalan, V. Mechanisms of pulsed laser ablation of biological tissues. Chem Rev. 103 (2), 577-644 (2003).
- Wu, F. Heat-based tumor ablation: Role of the immune response. Adv Exp Med Biol. 880, 131-153 (2016).
- Renvoizé, C., Biola, A., Pallardy, M., Bréard, J. Apoptosis: Identification of dying cells. Cell Biol Toxicol. 14 (2), 111-120 (1998).
- Julier, Z., Park, A. J., Briquez, P. S., Martino, M. M. Promoting tissue regeneration by modulating the immune system. Acta Biomater. 53, 13-28 (2017).
- Petrie, T. A., Strand, N. S., Tsung-Yang, C., Rabinowitz, J. S., Moon, R. T. Macrophages modulate adult zebrafish tail fin regeneration. Dev. 141 (13), 2581-2591 (2014).
- Geurtzen, K., Vernet, A., Freidin, A. Immune suppressive and bone inhibitory effects of prednisolone in growing and regenerating zebrafish tissues. J Bone Miner Res. 32 (12), 2476-2488 (2017).
- Fleischhauer, L., López-Delgado, A. C., Geurtzen, K., Knopf, F. Glucocorticoid effects in the regenerating fin reflect tissue homeostasis disturbances in zebrafish by affecting Wnt signaling. Front Endocrinol. (Lausanne). 14, 1122351 (2023).
- Westerfield, M. . The Zebrafish Book: A Guide for the laboratory use of zebrafish (Danio rerio). , (2002).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish: A Practical Approach. , (2002).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Dev. 135 (22), 3765-3774 (2008).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- JoVE Science Education Database. Zebrafish Breeding and Embryo Handling. Biology II: Mouse, Zebrafish, and Chick. , (2023).
- Schindelin, J., Arganda-Carreras, I., Frise, E. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Niethammer, P., Grabher, C., Look, A. T., Mitchison, T. J. A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish. Nature. 459 (7249), 996-999 (2009).
- Blanchard, G. B., Scarpa, E., Muresan, L., Sanson, B. Mechanical stress combines with planar polarised patterning during metaphase to orient embryonic epithelial cell divisions. Dev. 151 (10), dev202862 (2024).
- Park, W., Wei, S., Kim, B. -. S., et al. Diversity and complexity of cell death: A historical review. Exp Mol Med. 55 (8), 1573-1594 (2023).
- O'Connor, J., Akbar, F. B., Hutson, M. S., Page-McCaw, A. Zones of cellular damage around pulsed-laser wounds. PLoS One. 16 (9), e0253032 (2021).
- Griebel, M., Vasan, A., Chen, C., Eyckmans, J. Fibroblast clearance of damaged tissue following laser ablation in engineered microtissues. APL Bioeng. 7 (1), 16112 (2023).
- Matrone, G., Taylor, J. M., Wilson, K. S. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon