É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ablação mediada por laser de dois fótons de osteoblastos em larvas de peixe-zebra em desenvolvimento
Neste Artigo
Resumo
Este protocolo descreve uma abordagem de ablação a laser de dois fótons realizada em larvas de peixe-zebra, que serve como modelo para estudar a regeneração óssea e os efeitos da resposta imune à ablação.
Resumo
O peixe-zebra (Danio rerio) tem uma excelente capacidade de regenerar diferentes órgãos e apêndices. A regeneração óssea em peixe-zebra tem sido estudada usando diferentes métodos, como amputação de barbatanas, arrancamento de escamas, trepanação de crânio e abordagens microscópicas. Usando uma configuração de varredura a laser confocal equipada com um laser de dois fótons, um método de ablação a laser foi desenvolvido como um paradigma de lesão para ablação de células formadoras de osso (osteoblastos) no opérculo em desenvolvimento de larvas de peixe-zebra. O método descrito aqui permite a ablação das células de maneira precisa, pois a área, a forma e a profundidade podem ser ajustadas com precisão. Além disso, esse método permite a obtenção de imagens da área antes e logo após a ablação, para que os efeitos de curto prazo da lesão possam ser analisados. Nesta configuração experimental, a resposta imune após a ablação de osteoblastos na área lesada foi estudada. Observou-se um aumento no recrutamento de macrófagos após a ablação, indicando a relevância de sua presença durante a regeneração óssea.
Introdução
O peixe-zebra regenera diversos órgãos, como retina, cérebro, coração e pâncreas1. Além disso, o peixe-zebra regenera elementos esqueléticos, razão pela qual tem sido usado para estudar a regeneração de barbatanas, escamas e calvárias (calotas cranianas)2. Diferentes paradigmas experimentais têm sido utilizados para estudar a regeneração tecidual e óssea, como ressecção de nadadeiras (amputação), fratura de nadadeiras, trepanação craniana 3,4, crioleferimento 5,6 ou ablação genética 7,8,9. Recentemente, as abordagens de ablação a laser têm sido amplamente utilizadas em peixes-zebra para estudar a resposta de cicatrização e regeneração após lesões 10,11,12,13,14.
A ablação mediada por laser tem sido usada em diferentes áreas da pesquisa biológica, como mecanobiologia, biologia do desenvolvimento, pesquisa de regeneração e cirurgia tumoral 10,11,12,15,16,17,18,19. Existem várias metodologias de ablação a laser, como o uso de lasers YAG (granada de ítrio e alumínio), UV (ultravioleta) ou 2p (dois fótons)20. A ablação a laser permite a remoção de células individuais ou porções maiores de tecidos de maneira muito precisa, possibilitando o estudo de diferentes processos, como a resposta do sistema imunológico à ablação tumoral21 ou durante a regeneração do opérculo do peixe-zebra. Neste último exemplo, a ablação foi confirmada pelo desaparecimento do sinal do fluoróforo nuclear e citoplasmático e coloração de necrose10,22.
É bem conhecido que a resposta imune inata e sua cinética regulada são essenciais para a regeneração tecidual adequada. Neutrófilos e macrófagos são as primeiras células a serem recrutadas para o local da lesão, onde desempenham diferentes papéis, como liberação de citocinas e fatores de crescimento, remoção de detritos celulares e remodelação da matriz extracelular23. Esse recrutamento e subsequente funcionalização de macrófagos também foram observados em barbatanas de peixe-zebra amputadas24 e no opérculo em desenvolvimento, que foi submetido a 'nanodissecção' a laser levando à ablação de osteoblastos10. Neste último experimento, a recuperação do número de osteoblastos, o desenvolvimento normal do opérculo e o recrutamento de células imunes inatas (neutrófilos, macrófagos e células semelhantes a osteoclastos) para a área lesada foram observados após ablação mediada por laser UV e laser de dois fótons10. Experimentos em peixe-zebra nos quais o sistema imunológico foi farmacologicamente suprimido pelo uso de glicocorticóides mostraram um comprometimento da regeneração após imunidade desregulada, apoiando o papel funcional do sistema imunológico no reparo tecidual 3,10,25,26.
Aqui, é descrita uma metodologia de ablação mediada por laser de dois fótons para estudar a biologia da regeneração óssea no desenvolvimento de ossos de peixe-zebra. Em particular, o efeito da abordagem de ablação de osteoblastos no opérculo é mostrado em termos da resposta imune, que é investigada pelo monitoramento do recrutamento de macrófagos para o local da ablação.
Protocolo
O protocolo do estudo recebeu aprovação da Landesdirektion Sachsen, números de licença 25-5131/564/2, DD25-5131/450/4, 25-5131/496/56, DD25.1-5131/354/87. As linhagens de peixe-zebra utilizadas foram mantidas de acordo com a legislação nacional e sob condições padronizadas, conforme descrito anteriormente27,28. Os detalhes de todos os reagentes e equipamentos utilizados no estudo estão listados na Tabela de Materiais.
1. Preparação de materiais e soluções
- Mantenha os embriões em 1x meio E3. Prepare o meio 1x E3 diluindo 170 mL de um estoque E3 60x em 10 L de água deionizada e adicionando 2 mL de azul de metileno a 0,1%.
- Prepare o estoque de mídia E3 60x misturando 17,2 g de NaCl, 0,76 g de KCl, 2,90 g de CaCl2·2 H2O, 4,90 g de MgSO4·7 H2O em 1 L de água autoclavada deionizada.
- Para a inclusão das larvas, prepare alíquotas de agarose de baixo ponto de fusão (LMA) a 1% com antecedência e mantenha-as em temperatura ambiente.
- Para preparar alíquotas, dissolva a ML em 1x meio E3, por exemplo, 500 mg de LMA em 50 mL de 1x E3 em um frasco Erlenmeyer, aqueça a solução no micro-ondas até que a agarose se dissolva completamente e distribua-a em alíquotas de 1 mL em tubos de 1,5 mL.
2. Reprodução de peixe-zebra e coleta de embriões
NOTA: Larvas de peixe-zebra transgênicas duplas relatando a presença de osteoblastos comprometidos [osterix: nGFP = Tg (Ola.Sp7: NLS-GFP) zf132] 29 e macrófagos [mpeg: mCherry = Tg (mpeg: mCherry) gl23] foram usados aqui30 (Figura 1A).
- Configure o peixe-zebra parental com os transgenes individuais desejados em gaiolas de acasalamento padrão na noite anterior ao acasalamento.
NOTA: As gaiolas de acasalamento padrão permitem que os ovos passem para um compartimento inferior, onde o peixe-zebra parental não pode alcançá-los.- Mantenha machos e fêmeas separados até o acasalamento usando uma divisória na gaiola de acasalamento. Remova a divisória na manhã do dia seguinte para iniciar o acasalamento.
- Ao meio-dia, o mais tardar, remova o peixe-zebra parental dos tanques de reprodução e colete os embriões, coando a água da gaiola de acasalamento por uma peneira.
NOTA: Caso a idade exata das larvas seja decisiva, colher embriões em intervalos regulares de aproximadamente 30 min. Companheiros de ninhada devem ser usados em experimentos com diferentes grupos experimentais. - Colocar os embriões numa placa de 100 mm de diâmetro contendo 1 meio E3 e mantê-los numa incubadora a 28 °C31.
- Remova os óvulos não fertilizados e os embriões mortos do prato usando uma pipeta de plástico com a ajuda de um estereomicroscópio e troque 1x mídia E3 diariamente.
- Antes do experimento, classifique as larvas positivas para os transgenes repórteres usando um estereomicroscópio de fluorescência.
3. Larvas incorporadas em agarose de baixo ponto de fusão
- Derreter as alíquotas LMA num termobloco ou em banho-maria a 65 °C. Uma vez derretida a ML, mantenha-a a 42 °C até a incorporação (Figura 1B). Adicione 50 μL de 0,4% de MS-222 à alíquota de 1 mL de LMA derretida para obter uma concentração de 0,02% de MS-222 para anestesia.
- Anestesie 4 larvas dpf (dias após a fertilização) (ou larvas mais velhas) em meio MS-222 E3 a 0,02%.
- Transfira as larvas anestesiadas para uma placa de micropoços com fundo de vidro usando uma pipeta de plástico Pasteur de 3 mL e remova o excesso de meio E3 com a mesma pipeta (Figura 1B). Evite secar as larvas.
NOTA: Mais de uma larva pode ser embutida em um prato simultaneamente; Recomenda-se incorporar 3 a 5 larvas para permitir tempo suficiente para a colocação. - Pegue a agarose LMA derretida do banho-maria / termobloco e adicione uma gota (resfriante) de LMA ao prato, cobrindo o fundo do vidro onde as larvas foram posicionadas. Preste atenção que o LMA não está muito quente, mas ainda líquido.
- Em seguida, coloque as larvas na posição lateral desejada antes que a agarose se solidifique. Aqui, certifique-se de uma posição lateral na qual o opérculo esteja o mais próximo possível do fundo de vidro do prato como uma preparação para a configuração do microscópio inverso (Figura 1B).
- Deixe a agarose solidificar e, em seguida, adicione o meio E3 (contendo no máximo 0,02% MS-222) ao prato para evitar o ressecamento da agarose (Figura 1B).
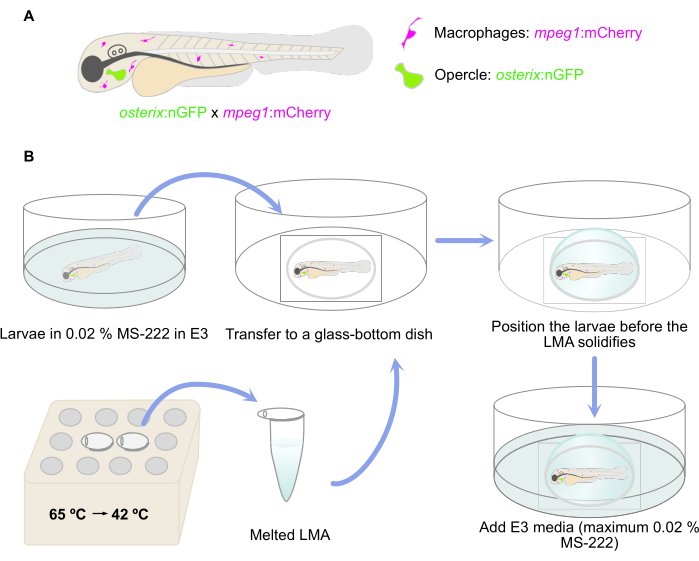
Figura 1: Representação esquemática do procedimento de incorporação. (A) Tg(osterix:nGFP) transgênica dupla; mpeg1:mCherry)29,30 larvas de peixe-zebra com osteoblastos operculares marcados em verde e macrófagos marcados em vermelho foram usados. (B) O fluxo de trabalho do procedimento de incorporação, conforme descrito na etapa 3 do protocolo. Clique aqui para ver uma versão maior desta figura.
4. Imagem in vivo das larvas e ablação a laser
- Para osteoblastos de ablação a laser no opérculo em desenvolvimento de peixe-zebra transgênico Tg(osterix:nGFP; mpeg1:mCherry)29,30, use um microscópio de varredura a laser invertido de dois fótons com uma objetiva de água 25x/0,95 ou uma configuração equivalente.
- Coloque o prato com as larvas embutidas no estágio microscópico no microscópio invertido e posicione a região desejada para ablação no centro do campo de visão. O opérculo pode ser facilmente identificado com a ajuda do sinal de fluorescência GFP.
- Uma vez que o opérculo esteja focado e centralizado no campo de visão do microscópio, escolha as configurações da pilha z (geralmente intervalos z de 1-2 μm são usados) para obter imagens de toda a largura do opérculo. Ao mesmo tempo, escolha a área em um plano z específico a ser ablacionado (geralmente na zona posterior do opérculo). A ablação a laser de dois fótons é exercida apenas neste plano.
NOTA: Uma resolução mais alta na dimensão z levará a tempos de imagem mais longos, mas permitirá análises volumétricas dos dados adquiridos posteriormente. - Imagem da área de interesse do opérculo antes da ablação. Para a detecção de GFP, use um laser de luz branca a 488 nm e um detector híbrido variando de 495 nm a 550 nm ou equivalente. Visualize os macrófagos usando excitação de 555 nm (laser de luz branca), com uma faixa de detecção mCherry de 595 a 780 nm em um detector híbrido (ou equivalente).
- Use o formato de imagem 512 x 512 para uma boa relação qualidade/tempo (outros formatos podem ser usados se desejar uma resolução mais alta ou, alternativamente, uma velocidade mais alta).
NOTA: Uma incubadora com temperatura controlada instalada no microscópio pode ser usada e ajustada, por exemplo, para 28 °C.
- Use o formato de imagem 512 x 512 para uma boa relação qualidade/tempo (outros formatos podem ser usados se desejar uma resolução mais alta ou, alternativamente, uma velocidade mais alta).
- Desenhe uma região circular com um diâmetro de 25 μm (outras formas e tamanhos podem ser selecionados dependendo do experimento) em um plano 2D selecionado, focalizando o opérculo usando a ferramenta ROI.
- Para realizar a ablação, aplique a potência de ablação (medida sem objetiva) a 450 mW e exponha a área selecionada ao laser de dois fótons a uma velocidade de varredura de 400 Hz e uma duração total de 10 s. Durante a ablação, a área pode ser visualizada usando um detector híbrido na faixa de 401-443 nm ou equivalente.
- Após a ablação, confirme a ablação estruturalmente criando imagens novamente da mesma pilha z com as mesmas configurações usadas antes da ablação. A área de ablação não contém mais células fluorescentes.
5. Recuperação de larvas e imagens para monitorar o recrutamento de células imunes
- Se a imagem do recrutamento de células imunes precisar ser realizada com atraso, recupere as larvas da imagem e da anestesia. Remova as larvas cuidadosamente da ML usando uma pinça ou uma agulha de dissecção.
- Primeiro, remova uma camada de agarose que cobre as larvas. Em segundo lugar, remova a agarose em contato direto com as larvas. Omita esta etapa se a imagem imediata do recrutamento de células imunes estiver ocorrendo.
- Coloque as larvas de volta em um prato com meio E3 puro e verifique sua recuperação. A recuperação é evidente pela natação das larvas.
- Aos 4 ou 6 hpl (horas após a lesão), imagine a área do opérculo novamente usando as mesmas configurações no mesmo microscópio para verificar os efeitos da ablação no recrutamento de macrófagos. Para fazer isso, repita a incorporação (etapa 3) e a imagem como realizada anteriormente (etapa 4).
- Após a imagem, remova as larvas da ML. O sacrifício das larvas pode ser realizado por incubação em água gelada ou com uma overdose de MS-222 em E3, dependendo dos requisitos legais. As amostras podem então ser usadas para estudos de acompanhamento ou descartadas.
6. Análise de imagem e análise estatística
- Processe as imagens usando um software de processamento de imagem, como o Fiji32. Dependendo da resolução z dos dados adquiridos, as análises podem ser realizadas em 2D ou 3D.
- Quantifique os macrófagos manualmente, incluindo células claramente separadas, por exemplo, discernindo os principais corpos celulares ou, alternativamente, quantificando as células com um rótulo nuclear ou medindo a área caso as células estejam sobrepostas (próximo passo).
- Para quantificação da área, crie uma máscara abrangendo os macrófagos. Para fazer isso, use a ferramenta Ajustar > Limite do > Imagem e crie um ROI (Analisar Ferramentas > > Gerenciador de ROI > Adicionar) em Fiji. Exclua pequenas partículas no fundo para quantificação.
- Em seguida, meça a área (Analisar > Medir). Considere se as áreas de fluorescência celular sobreposta precisam ser incluídas na medição.
NOTA: Aqui, a área de ablação circular foi omitida das medidas de área, uma vez que os macrófagos recrutados não podem ser distinguidos nesta área.
- Em seguida, meça a área (Analisar > Medir). Considere se as áreas de fluorescência celular sobreposta precisam ser incluídas na medição.
- Gere gráficos traçando os resultados da medição usando um software adequado. Para comparar os dados antes e depois da ablação, realize um teste estatístico apropriado (aqui, um teste t unicaudal pareado foi realizado).
NOTA: As figuras podem ser preparadas usando software de edição de fotos e design gráfico.
Resultados
A ablação a laser foi realizada conforme indicado no protocolo acima. O sinal GFP dos osteoblastos na área ablacionada desapareceu instantaneamente após a ablação. Para estudar a resposta da ablação de osteoblastos em termos de resposta imune, foi observada a presença de macrófagos em larvas de 6 dpf antes e em 6 hpl. Antes da ablação, muito poucos macrófagos foram observados na área do opérculo10 (Figura 2). Aos 6 hpl,...
Discussão
A ablação a laser tem sido aplicada em várias disciplinas da pesquisa biológica. Em particular, tem sido útil como método para estudar a regeneração tecidual 10,11,12. Por exemplo, o recrutamento e as alterações fenotípicas das células imunes inatas foram recentemente analisados ao longo do tempo usando ensaios de ablação a laser UV ou laser de dois fótons, juntamente com a recupe...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pela Fundação Alemã de Pesquisa (DFG) Transregio 67 (projeto 387653785), o DFG SPP 2084 μBone (projeto KN 1102/2-1) para FK. Este trabalho foi apoiado pela Light Microscopy Facility (DFG project 413875620), uma instalação central da Plataforma de Tecnologia CMCB na TU Dresden. Os trabalhos na TU Dresden foram cofinanciados com receitas fiscais baseadas no orçamento acordado pelo Parlamento da Saxónia («Landtag»).
Materiais
| Name | Company | Catalog Number | Comments |
| Calcium chloride dihydrate, CaCl2·H2O | Carl Roth | 5239.1 | |
| Cell Culture Dish, PS, 100/20 mm | Greiner Bio-one | 664160 | |
| Dumont #55 Foceps | FST | 11295-51 | Tip shape straight, 11 cm, 0.05 x 0.02 mm |
| Falcon 6-well plate | Corning | 353502 | |
| Glass-bottom microwell dish | MatTek | P35G-1.5-14-C | 35 mm Dish, No. 1.5 Coverslip, 14 mm Glass Diameter, Uncoated |
| Insight X3 multiphoton laser | Spectra-Physics | ||
| Leica Application Suite | LAS X, Leica Microsystems | ||
| Low melting agarose | Biozyme | 840101 | Biozym Plaque Agarose |
| Magnesium sulfate heptahydrate, MgSO4·7H2O | Sigma-Aldrich | M5921 | |
| Mating cages | many varieties, e.g. Tecniplast | ||
| Methyleneblue | Carl Roth | A514.1 | |
| MS-222 | SIGMA Aldrich | A5040 | |
| Potassium Chloride, KCl | PanReac AppliChem | 131494 | |
| Sodium chloride, NaCl | Carl Roth | 3957.1 | |
| SP8 FALCON | Leica Microsystems | Equipped with a Insight X3 multiphoton laser and Leica Application Suite software | |
| Stainless Steel Dissect Needle | Bochem | 12010 | 140 mm |
| Stereo Microscope System SZX16 | Olympus | Equipped with a LED illumination base SZX2-ILLTQ | |
| Thermostatic Cabinets TS - WTW | xylem | TS 608/2-i | For incubation (embryo) |
| Transfer pipette, 3.5 mL | SARSTEDT | 861171 | 155 x 15 mm, LD-PE, transparent |
| Zeiss SteREO Discovery.V12 version 4.7.1.0. | Zeiss | Equipped with Axiocam MRm camera and AxioVision sofware |
Referências
- Marques, I. J., Lupi, E., Mercader, N. Model systems for regeneration: Zebrafish. Dev. 146 (18), dev167692 (2019).
- Dietrich, K., Fiedler, I. A. K., Kurzyukova, A. Skeletal biology and disease modeling in zebrafish. J Bone Miner Res. 36 (3), 436-458 (2021).
- Geurtzen, K., Knopf, F. Adult zebrafish injury models to study the effects of prednisolone in regenerating bone tissue. J Vis Exp. (140), e58429 (2018).
- Sousa, S., Valerio, F., Jacinto, A. A new zebrafish bone crush injury model. Biol Open. 1 (9), 915-921 (2012).
- González-Rosa, J. M., Mercader, N. Cryoinjury as a myocardial infarction model for the study of cardiac regeneration in the zebrafish. Nat Protoc. 7 (4), 782-788 (2012).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biol Open. 5 (6), 819-828 (2016).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Dev Cell. 22 (4), 879-886 (2012).
- Curado, S., et al. Conditional targeted cell ablation in zebrafish: a new tool for regeneration studies. Dev Dyn. 236 (4), 1025-1035 (2007).
- Ando, K., Shibata, E., Hans, S., Brand, M., Kawakami, A. Osteoblast production by reserved progenitor cells in zebrafish bone regeneration and maintenance. Dev Cell. 43 (5), 643-650.e3 (2017).
- Geurtzen, K., López-Delgado, A. C., Duseja, A., Kurzyukova, A., Knopf, F. Laser-mediated osteoblast ablation triggers a pro-osteogenic inflammatory response regulated by reactive oxygen species and glucocorticoid signaling in zebrafish. Dev. 149 (8), 1998030 (2022).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. J Vis Exp. (159), e60966 (2020).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845 (2011).
- Goldstein, A. M., Fishman, M. C. Notochord regulates cardiac lineage in zebrafish embryos. Dev Biol. 201 (2), 247-252 (1998).
- Zhang, J., Jeradi, S., Strähle, U., Akimenko, M. A. Laser ablation of the sonic hedgehog-a-expressing cells during fin regeneration affects ray branching morphogenesis. Dev Biol. 365 (2), 424-433 (2012).
- Marshall, A. R., et al. Two-photon cell and tissue level laser ablation methods to study morphogenetic biomechanics. Methods Mol Biol. 2438, 217-230 (2022).
- Angelo, J. R., Tremblay, K. D. Laser-mediated cell ablation during post-implantation mouse development. Dev Dyn. 242 (10), 1202-1209 (2013).
- Lee, J., Lee, S., Truong, V. G., et al. Laser ablation of pancreatic cancer using a cylindrical light diffuser. Lasers Med Sci. 37 (6), 2615-2621 (2022).
- Luther, E., Mansour, S., Echeverry, N., et al. Laser ablation for cerebral metastases. Neurosurg Clin N Am. 31 (4), 537-547 (2020).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -. P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods Mol Biol. 1189, 219-235 (2015).
- Vogel, A., Venugopalan, V. Mechanisms of pulsed laser ablation of biological tissues. Chem Rev. 103 (2), 577-644 (2003).
- Wu, F. Heat-based tumor ablation: Role of the immune response. Adv Exp Med Biol. 880, 131-153 (2016).
- Renvoizé, C., Biola, A., Pallardy, M., Bréard, J. Apoptosis: Identification of dying cells. Cell Biol Toxicol. 14 (2), 111-120 (1998).
- Julier, Z., Park, A. J., Briquez, P. S., Martino, M. M. Promoting tissue regeneration by modulating the immune system. Acta Biomater. 53, 13-28 (2017).
- Petrie, T. A., Strand, N. S., Tsung-Yang, C., Rabinowitz, J. S., Moon, R. T. Macrophages modulate adult zebrafish tail fin regeneration. Dev. 141 (13), 2581-2591 (2014).
- Geurtzen, K., Vernet, A., Freidin, A. Immune suppressive and bone inhibitory effects of prednisolone in growing and regenerating zebrafish tissues. J Bone Miner Res. 32 (12), 2476-2488 (2017).
- Fleischhauer, L., López-Delgado, A. C., Geurtzen, K., Knopf, F. Glucocorticoid effects in the regenerating fin reflect tissue homeostasis disturbances in zebrafish by affecting Wnt signaling. Front Endocrinol. (Lausanne). 14, 1122351 (2023).
- Westerfield, M. . The Zebrafish Book: A Guide for the laboratory use of zebrafish (Danio rerio). , (2002).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish: A Practical Approach. , (2002).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Dev. 135 (22), 3765-3774 (2008).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), e49-e56 (2011).
- JoVE Science Education Database. Zebrafish Breeding and Embryo Handling. Biology II: Mouse, Zebrafish, and Chick. , (2023).
- Schindelin, J., Arganda-Carreras, I., Frise, E. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Niethammer, P., Grabher, C., Look, A. T., Mitchison, T. J. A tissue-scale gradient of hydrogen peroxide mediates rapid wound detection in zebrafish. Nature. 459 (7249), 996-999 (2009).
- Blanchard, G. B., Scarpa, E., Muresan, L., Sanson, B. Mechanical stress combines with planar polarised patterning during metaphase to orient embryonic epithelial cell divisions. Dev. 151 (10), dev202862 (2024).
- Park, W., Wei, S., Kim, B. -. S., et al. Diversity and complexity of cell death: A historical review. Exp Mol Med. 55 (8), 1573-1594 (2023).
- O'Connor, J., Akbar, F. B., Hutson, M. S., Page-McCaw, A. Zones of cellular damage around pulsed-laser wounds. PLoS One. 16 (9), e0253032 (2021).
- Griebel, M., Vasan, A., Chen, C., Eyckmans, J. Fibroblast clearance of damaged tissue following laser ablation in engineered microtissues. APL Bioeng. 7 (1), 16112 (2023).
- Matrone, G., Taylor, J. M., Wilson, K. S. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados