Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ex-vivo-Mimikry von normalen und anormalen menschlichen Hämatopoese
In diesem Artikel
Zusammenfassung
Ein 3D-Kultur für Hämatopoese wird unter Verwendung von humanem Nabelschnurblut und leukämischen Knochenmarkszellen. Verfahren basiert auf der Verwendung eines porösen, synthetischen Polyurethan Gerüst mit Proteinen der extrazellulären Matrix beschichtet ist. Dieses Gerüst ist anpassbar an eine Vielzahl von Zellen aufnehmen.
Zusammenfassung
Hämatopoetischen Stammzellen erfordern eine einzigartige Mikroumgebung um die Bildung roter Blutkörperchen ein zu unterhalten; das Knochenmark (BM) ist eine komplexe dreidimensionale (3D) Gewebe, bei Hämatopoese wird durch räumlich organisiert zelluläre Mikroumgebung reguliert bezeichnet Nischen 2-4. Die Organisation der BM Nischen ist entscheidend für die Funktion oder Dysfunktion des normalen oder malignen BM 5. Deshalb ein besseres Verständnis für die in-vivo-Mikroumgebung mit einem Ex-vivo-Mimikry würde uns helfen, Aufklärung der molekularen, zellulären und Determinanten der Mikroumgebung Leukämogenese 6.
Derzeit werden hämatopoetischer Zellen in vitro in einem zweidimensionalen (2D) Gewebekulturflaschen / Well-Platten 7 erfordern entweder Co-Kultur mit allogenen oder xenogenen Stromazellen oder Zugabe von exogenen Zytokinen 8 kultiviert. Diese Bedingungen sind künstliche und unterscheiden sich von der in vivo 9,10 führen kann.
Hier präsentieren wir eine neuartige 3D-Knochenmark-Kultur-System, das die 3D simuliert in vivo das Wachstum und Umwelt unterstützt multilineage Hämatopoese in Abwesenheit von exogenen Wachstumsfaktoren. Die hoch porösen Gerüst in diesem System aus Polyurethan (PU) verwendet, ermöglicht eine hohe Dichte Zellwachstum über eine höhere spezifische Oberfläche als die herkömmliche 2D-Monolayer-Kultur in 11. Unsere Studien zeigen, dass dieses Modell das Wachstum von menschlichem Nabelschnurblut (CB) mononukleäre Zellen (MNC) 12 und primären leukämischen Zellen in Abwesenheit von exogenen Zytokinen unterstützt. Diese neuartige 3D-Mimikry bietet eine tragfähige Plattform für die Entwicklung eines menschlichen experimentelles Modell zur Blutbildung zu studieren und neuartige Behandlungsmöglichkeiten gegen Leukämie zu erforschen.
Protokoll
1. Scaffold Herstellung und Bio-Funktionalisierung von Gerüsten
- Um PU Gerüste (Porengröße 100-250 mm, Porosität 90-95%) in Form von Scheiben Petrischale herzustellen, verwenden die thermisch induzierte Phasentrennung 13 process durch Herstellen einer Polymer-Lösung (5 Gew.% in Dioxan), gefolgt von Einfrieren und anschließende Lösungsmittel Sublimation (Abbildung 1A).
- Schneiden Sie das Gerüst Festplatte in Würfel von 0,5 x 0,5 x 0,5 mm vor der Beschichtung mit ECM-Proteine (Abbildung 1B).
- Vornässen die Gerüste durch Eintauchen in Ethanol (70%) für 1 min und danach in Phosphat-gepufferter Salzlösung (PBS) für 20 min. Dann für 10 min zentrifugieren bei 3630 xg und fügen Sie die Protein-Lösung.
- Zentrifugieren Sie die Gerüste in der Protein-Lösung bei 1420 xg für 20 min.
- Um die Oberflächenporen freizugeben, und damit die Zellen ausgesät, um tiefer in das Gerüst zu durchdringen, zentrifugieren die Gerüste noch einmal bei 910 xg für 10 minin PBS.
- Sterilisieren Sie die Gerüste mit einer Kombination von 8 min Belichtung bei 230 V, 50 Hz, 0,14 A, UV-Lampe, mit Eintauchen für 2 h in Ethanol (70%). Danach wäscht die Gerüste zweimal in PBS vor der Zugabe Iscoves modifiziertem Dulbecco Medium (IMDM) mit 30% fötalem Rinderserum (FBS) und 1% Penicillin und Streptomycin (P / S) ergänzt. Platzieren der Gerüste in einem befeuchteten Inkubator für 3 Tage bei 37 ° C und 5% CO 2 vor der Verwendung. Sterile Gerüste werden in einer 24-Well-Gewebekulturplatten (ein Gerüst pro Vertiefung) angeordnet ist.
2. Mononukleären Zellen Isolierung und Gerüstbau Seeding
- Auszug menschlichen MNC aus Nabelschnurblut oder Knochenmark bestimmt Proben mit Ficoll-Paque Dichtegradientenzentrifugation (35 min bei 1500 rpm) (Abbildung 1C).
- Resuspendieren MNC in IMDM, enthaltend 30% FBS und 1% P / S
- Seed 100 &mgr; von MNC-Suspension (2 x 10 6 Zellen / Gerüst) auf die Gerüste mit Hilfe eines Mikro-Pipette.
- Inkubieren Sie die gesetzten Gerüste bei 37 ° C unter 5% CO 2 für 10 Minuten für die Zellen, in die Gerüste zu begleichen.
- Füllen jeder Vertiefung mit 1,5 ml IMDM, enthaltend 30% FBS und 1% P / S und Ort Well-Platten im Inkubator bei 37 ° C und 5% CO 2 für die Dauer des Experiments.
- Gesetzt Gerüste unterziehen täglich von allen Medien ändern.
3 In situ Cell Proliferation und Morphologie:. MTS, SEM und Cytospins
- MTS-Assay: Sofort von der Kultur ein un-entkernt und zwei gesetzten Gerüste und in einem sauberen neuen 24-Loch-Platte. 1 ml der Medien-und 200 ul der MTS-Lösung, Inkubation für 3 h bei 37 ° C und 5% CO 2.
- Nehmen Sie 8 x 100 ul-Proben aus dem Überstand; Platz in einer 96-Well-Platte und messen die Absorption bei 490 nm mit einem Mikroplatten-Reader.
- Die Rasterelektronenmikroskopie (REM): Zu verschiedenen Zeitpunkten von the Kultur, entfernen Sie die Gerüste mit MNC aus den Medien ausgesät, und fixieren mit 2,5% PBS-gepuffertem Glutaraldehyd-Lösung für 40 min bei 4 ° C, dann zweimal mit PBS waschen.
- Dehydratisierte die Gerüste in einer abgestuften Serie von Ethanol (25, 50, 70, 80, 90, 95 und 100%), jeweils für 10 min und trocken in einer aseptischen Umgebung für 4 Stunden.
- § Proben und dann Sputter-Schicht sie mit Gold in einer Argon-Atmosphäre für 2 min vor dem REM-Auswertung, verwenden Sie eine Beschleunigung von 20 kV.
- Cytospins: Sammeln 2,0 x 10 4 Zellen / Dia durch Absaugen der Zellen aus dem Schafott zu verschiedenen Zeitpunkten in der Kultur.
- Zentrifugation der Zellen auf einen Objektträger für 3 min bei 1500 Umdrehungen pro Minute.
- Stain die Folien mit Wright-Giemsa-Färbung und beobachten Geändert durch Verwendung eines optischen Mikroskops. F-View Soft Imaging System verwendet werden, um Bilder zu machen sein.
- Den Objektträger vor dem Mikroskop Beobachtung.
- M ultiphoton Analyse: Fix Gerüste zu verschiedenen Zeitpunkten mit Ethanol Dampf (70%) und dann über Nacht trocken und bei -20 ° C bis zur weiteren Analyse. Vor der Visualisierung mit dem Mikroskop Multiphotonen Abschnitt das Gerüst in 30 Mikrometer dicke Folien und nass mit PBS.
- Sperren der geimpften Gerüste in PBS mit 10% fötalem Rinderserum für 30 min bei Raumtemperatur.
- Inkubieren Sie die Gerüste über Nacht bei 4 ° C im Dunkeln mit einer 1:50-Verdünnung des primären monoklonalen Antikörper: anti-Maus menschlichen CD71.
- Proben dreimal Waschen in PBS und Färbung mit dem sekundären Antikörper: Anti-Maus-Alexa Fluor 488 für 1 h bei Raumtemperatur im Dunkeln.
- Waschen Proben dreimal mit PBS und beobachten mit einem konfokalen Mikroskop mit Hilfe eines Wasser-Emission x60 Objektiv.
- Fluorophor Alexa Fluor 488 wird bei 488 nm durch den pulsierenden Laser angeregt. Endgeschwindigkeit, 5.3.2-Software kann für die nachfolgende Bildanalyse genutzt werden.
- Bevor zelluläre Analyse im Durchflusszytometer (FC), beschriften Sie die Zellen von Interesse mit den entsprechenden Antikörpern Immunfluoreszenz für die Erkennung. Eine Anzahl von Proben werden gemäß den ausgewählten Antikörper zum Nachweis hergestellt. Für MNC-Erkennung folgende Kombination von Antikörpern verwendet werden: CD45-FITC/CD71-PE/CD235a-PE-Cy5.
- Absaugen der Zellen von dem Gerüst zu verschiedenen Zeitpunkten und zentrifugiert. Lösen Sie ein Zellpellet von etwa 1x10 6 Zellen in 100 ul FC-Puffer (PBS + 0,1% Natriumazid) und mit 10 ul jeder Antikörper-Fluoreszenz-Farbstoff. Inkubieren der Zellen für 30 min bei 4 ° C, zweimal waschen mit PBS gewaschen und schließlich in FC-Puffer erneut zu suspendieren.
- Legen Sie die Probe in das Durchflusszytometer befleckt mit dem Isotyp-Kontrolle, um die "Negativität" des Antikörpers Ausdruck festlegen und kalibrieren die Erkennung Kanäle mit dem Durchflusszytometer Kontrolle.
- Lesen Sie die Probe befleckt w it den drei verschiedenen Antikörpern und schließlich stellen die Daten bei der Nutzung des WinList Software.
5. Repräsentative Ergebnisse
Ein Beispiel von hämatopoetischen Zellen Wachstumskinetik ohne die Zugabe von exogenen Wachstumsfaktoren in 2 gezeigt. Aufgrund der heterogenen Natur der Blutbildung, zwei verschiedene Zellen: normale und abnormale hämatopoetische Zellen dargestellt. In 2A ist die zelluläre Proliferation von humanen CBMNC nach 28 Tagen in Kultur zeigt. 2B zeigt die Wachstumskinetik in der Mimik mit primären humanen Leukämiezellen. Die Zellproliferation wird anhand des MTS-Assay, der zellulären metabolischen Aktivität in Bezug auf Absorption misst. In beiden Fällen vermehrten sich die Zellen und ihren Sitz in dem Modell. Unterschiede in der Wachstumskinetik werden beachtet; normalen hämatopoetischen Zellen gründen die Kultur schneller als die leukämischen Zellen.
_content "> Die Morphologie der geernteten Zellen auch nach 28 Tagen Kultur in Abwesenheit von exogenen Wachstumsfaktoren typisch für die normale hämatopoetische Zellen (Abbildung 3A) und leukämischen Zellen (Abbildung 3B) war. Zentrale Teile der Gerüste wurden mittels SEM analysiert nach Die Gerüste wurden von der Kultur entfernt, und zeigte die Ausbreitung der ausgesäten Zellen in dem Gerüst, etablieren sich in Clustern und in "Nischen-like"-Strukturen (3A '& B'). Abbildung C zeigt die Porengröße und-verteilung in einem ungesetzte Gerüst als Kontrolle verwendet. Multiphotonenmikroskopie nach 28 Tagen wurde verwendet, um die Verteilung der Zellen in dem 3D-Gerüst in situ zu markieren, und es zeigte das Vorhandensein von Erythrozyten-Inseln in mittleren Abschnitten des Gerüsts (4) durch die Expression des Markers CD71, die positiv ist in Erythroblasten. Dies beweist die Bedeutung der reifen und reifenden Zellen duRing Erythropoese. Schließlich zeigt Durchflusszytometrie Graphen der Zellen vor Seeder den Unterschied in der Phänotyp von hämatopoetischen Zellen, wobei 5A stellt normalen hämatopoetischen Zellen: menschliche CBMNCs und 5B zeigt abnormale hämatopoetische Zellen: primäre Leukämiezellen. Ebenen der CD235a + und CD45 + entspricht, Erythrozyten und Leukozyten jeweils höher sind in der normalen Probe als in der leukämischen Hervorhebung der hemoblastic Art der Leukämien.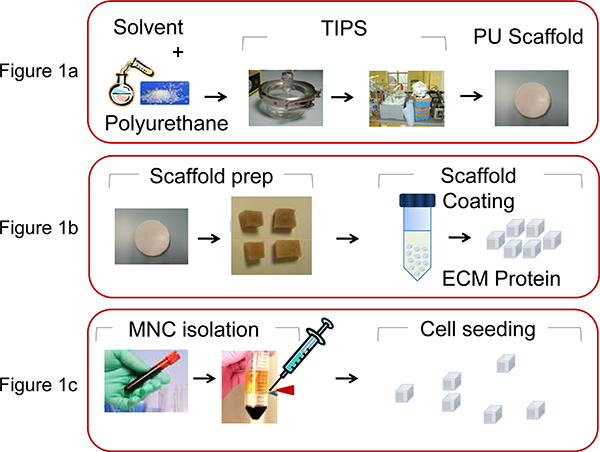
Abbildung 1. Illustration der Prozesse in der PU-Gerüst Herstellung und Bio-Funktionalisierung beteiligt. A) PU in Dioxan (5 Gew.%) gelöst und durch thermisch induzierte Phasentrennung und die anschließende Lösungsmittel Sublimation das Stützgerüst hergestellt wird, wie durch Safinia et al 13 beschrieben. B) Das Gerüst Scheibe wird dann geschnitten into Würfel von 0,5 x 0,5 x 0,5 mm und dann durch Zentrifugation mit extrazellulären Matrix (ECM) Proteinen beschichtet. C) MNC werden aus humanen Nabelschnur CB oder von BM Aspiration mittels Dichtegradientenzentrifugation und entkernt (2x10 6 Zellen / Gerüst) in der PU-Gerüste mit einer Mikropipette entnommen.
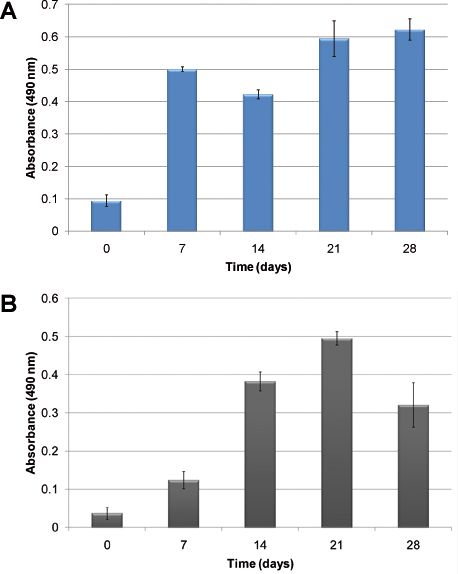
. 2 Zellproliferation unter Verwendung des MTS-Assay: A) mit humanem Nabelschnurblut MNU, B) unter Verwendung von humanen primären Leukämiezellen. Die Spalten zeigen das Wachstum von Zellen im Laufe der Zeit, wenn in der PU-Gerüsten ohne die Zugabe von exogenen Zytokinen ausgesät.
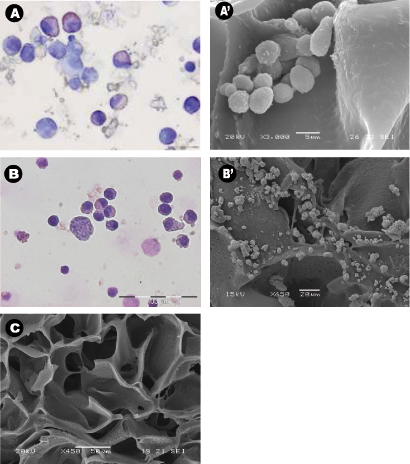
Abbildung 3: Cell Morphologie und Verteilung um die Verwendung von Gerüsten Zytospins, scanning elektronenmikroskopischen Aufnahmen. (AB) Vertreter Wright-Giemsa gefärbten Zytospins von A) Nabelschnurblut mononukleäre Zellen aus PU Gerüste nach 28 Tagen Kultur gesammelt, und B) Knochen aspiriert Leukämiezellen aus PU Gerüste nach 14 Tagen Kultur gesammelt. Beide Versuche wurden in Zytokin-freien Zustand durchgeführt. (A'-B ') Vertreter zentralen Abschnitte der PU-Gerüst REM-Aufnahmen von A') seeded Nabelschnurblut Multis und B ') leukämischen Zellen, nachdem sie 28 Tage lang kultiviert, und C) Kontrolle Gerüst ohne Zellen.
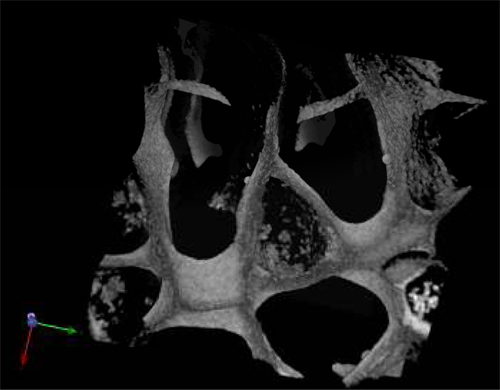
Abbildung 4. Multiphotonen Aufnahme eines PU-Gerüst entkernt mit Nabelschnurblut MNCs nach 28 d in Kultur und gebeizt mit der erythroiden Markers CD71.

Abbildung 5. Durchflusszytometrie 3D Dot-Plots für CD45, CD71 und CD235a Oberflächenexpression Marker gefärbt. Die Isotyp-Kontrolle erhalten wird auch für den Vergleich der relativen Fluoreszenzintensität dargestellt. Feld A zeigt menschlichem Nabelschnurblut mononukleäre Zellen positiv für die oben genannten Marker; Tafel B zeigt primären humanen leukämischen Zellen.
Diskussion
Die Ex-vivo-3D-Kultur hier vorgestellte System ermöglicht es uns, eine 3D-biomimicry der Blutbildung feststellen, dass der ursprüngliche BM rekapituliert Architektur und zelluläre Phänotyp unabhängig von exogenen Zytokinen. Das 3D-Modell stellt die Struktur und die Mikroumgebung, die normale und abnormale hämatopoetische Zellen unter Bedingungen ähnlich denen in vivo angetroffen vermehren können.
Die Auswahl der polymeren Trägermaterial zu vertreten ein entscheiden...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der Richard Thomas Leukämie-Fonds, die Lady Tata Memorial Trust, das Northwick Park Hospital Leukämieforschung Treuhandfonds und des National Institute of Health Research (NIHR), UK finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name of the reagent | Company | Catalogue No | |
| Dioxan | Invitrogen | D20,186-3 | |
| PBS | Gibco | 14190-094 | |
| IMDM | Invitrogen | 12440-053 | |
| Ficoll-Paque | GE Healthcare | 17-1440-02 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| MTS | Promega | G3580 | |
| Glutaraldehyde | Fluka Biochemika | 49624 | |
| Wright-Giemsa | Sigma-Aldrich | WG32 | |
| Fetal bovine serum | Gibco | 10108-165 | |
| CD71 | Santa Cruz Biotechnology | sc-32272 | |
| Alexa Fluor 488 | Invitrogen | A11001 | |
| CD45-FITC | BD Pharmigen | 74895 | |
| CD71-PE | BD Pharmigen | 555537 | |
| CD235a-PE-Cy5 | BD Pharmigen | 555570 | |
| Sodium azide | Sigma-Aldrich | S-8032 |
Referenzen
- Orkin, S., Zon, L. Hematopoiesis: an evolving paradigm for stem cell biology. Cell. 132, 631-644 (2008).
- Spradling, A., Drummond-Barbosa, D., Kai, T. Stem cells find their niche. Nature. 414, 98-104 (2001).
- Panoskaltsis, N., Mantalaris, A., Wu, D. Engineering a mimicry of bone marrow tissue ex vivo. J Biosci. Bioeng. 100, 28-35 (2005).
- Lo Celso, C. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457, 92-96 (2009).
- Mantalaris, A., Bourne, P., Wu, J. Production of human osteoclasts in a three-dimensional bone marrow culture system. Biochem. Eng. J. 20, 189-196 (2004).
- Placzek, M. Stem cell bioprocessing: fundamentals and principles. J. R. Soc. Interface. 6, 209-232 (2009).
- Dexter, T., Testa, N., Prescott, D. . Methods in Cell Biology. 14, 387-405 (1976).
- Piacibello, W. Differential growth factor requirement of primitive cord blood hematopoietic stem cell for self-renewal and amplification vs proliferation and differentiation. Leukemia. 12, 718-727 (1998).
- Yoshida, T., Takagi, M. Cell processing engineering for ex vivo expansion of hematopoietic cells: a review. Biochemical Engineering Journal. 20, 99-106 (2004).
- Lim, M. Intelligent bioprocessing for haemotopoietic cell cultures using monitoring and design of experiments. Biotechnol. Adv. 25, 353-368 (2007).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Panoskaltsis, N. The development of a three-dimensional scaffold for ex vivo biomimicry of human acute myeloid leukaemia. Biomaterials. 31, 2243-2251 (2010).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Aqel, N., Panoskaltsis, N. Long-term cytokine-free expansion of cord blood mononuclear cells in three-dimensional scaffolds. Biomaterials. 32, 9263-9270 (2011).
- Safinia, L., Datan, N., Hohse, M., Mantalaris, A., Bismarck, A. Towards a methodology for the effective surface modification of porous polymer scaffolds. Biomaterials. 26, 7537-7547 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten