È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ex vivo Mimicry di emopoiesi normale e anormale umana
In questo articolo
Riepilogo
Un sistema di coltura 3D per ematopoiesi è descritta utilizzando sangue umano corda e leucemiche cellule del midollo osseo. Il metodo si basa sull'impiego di un poliuretano poroso scaffold sintetico rivestito con proteine della matrice extracellulare. Questa impalcatura è adattabile per soddisfare una vasta gamma di celle.
Abstract
Le cellule staminali ematopoietiche richiedono un microambiente unico al fine di sostenere la formazione di cellule del sangue 1, del midollo osseo (BM) è un complesso tridimensionale (3D) ematopoiesi del tessuto in cui è regolato da spazialmente organizzati microambienti cellulari chiamato nicchie 2-4. L'organizzazione delle nicchie BM è fondamentale per la funzione o la disfunzione del normale o maligna BM 5. Pertanto, una migliore comprensione del microambiente in vivo usando un mimetismo ex vivo ci aiuterebbe a chiarire i determinanti molecolari, cellulari e microambientali di leucemogenesi 6.
Attualmente, cellule ematopoietiche vengono coltivate in vitro in palloni tessuto bidimensionale (2D) di coltura / pozzetto di piastre 7 richiedono sia co-coltura con allogenico o xenogenici cellule stromali o aggiunta di citochine esogene 8. Queste condizioni sono artificiali e differiscono dalla in vivo 9,10.
Qui, presentiamo un nuovo 3D midollo osseo sistema cultura che simula l'ambiente in vivo crescita 3D e supporta ematopoiesi multilineare in assenza di fattori di crescita esogeni. Il altamente porosa scaffold utilizzato in questo sistema di poliuretano (PU), ad alta densità facilita la crescita delle cellule attraverso un'area superficiale specifica superiore rispetto alla coltura monostrato convenzionale in 2D 11. Il nostro lavoro ha indicato che questo modello sostenuto la crescita di cordone ombelicale umano (CB) cellule mononucleate (MNC) 12 e primarie cellule leucemiche in assenza di citochine esogene. Questo mimetismo romanzo 3D fornisce una valida piattaforma per lo sviluppo di un modello umano sperimentale per studiare ematopoiesi e di esplorare nuovi trattamenti per la leucemia.
Protocollo
1. Scaffold Produzione e Bio-funzionalizzazione di ponteggi
- Per fabbricare ponteggi PU (dimensione dei pori 100-250 mm, porosità 90-95%) sotto forma di dischi piatto Petri, utilizzare la separazione di fase indotta termicamente processo 13 preparando una soluzione di polimero (5% in peso in diossano) seguita da congelamento e successivo sublimazione solvente (Figura 1A).
- Tagliare il disco scaffold a cubetti di 0,5 x 0,5 x 0,5 mm prima del rivestimento con proteine ECM (figura 1B).
- Pre-bagnato i ponteggi immergendoli in etanolo (70%) per 1 min e poi trasferire in salina tamponata con fosfato (PBS) per 20 min. Quindi si centrifuga per 10 min a 3630 xg e aggiungere la soluzione proteica.
- Centrifugare i ponteggi nella soluzione proteica a 1420 xg per 20 min.
- Al fine di sbloccare i pori della superficie, e permettere alle cellule inseminate di penetrare più in profondità il patibolo, centrifugare i ponteggi ancora una volta a 910 xg per 10 minin PBS.
- Sterilizzare i ponteggi utilizzando una combinazione di 8 minuti di esposizione a 230 v, 50 Hz, 0,14 A, lampada UV, con l'immersione per 2 h in etanolo (70%). Dopo di che, lavare i ponteggi due volte in PBS prima di aggiungere Iscove Modificato di Dulbecco Medium (IMDM) supplementato con 30% siero fetale bovino (FBS) e 1% di penicillina e streptomicina (P / S). Posizionare i ponteggi in un incubatore umidificato per 3 giorni a 37 ° C e 5% CO 2 prima dell'uso. Ponteggi sterili vengono inseriti in un tessuto ben 24 piastre di coltura (uno scaffold per pozzetto).
2. Cella di isolamento mononucleare e Seeding Scaffold
- Estratto umana MNC da cordone ombelicale o leucemiche campioni di midollo osseo, con Ficoll-Paque centrifugazione in gradiente di densità (35 min a 1500 rpm) (Figura 1C).
- Risospendere MNC in IMDM contenente il 30% FBS e 1% P / S.
- 100 microlitri di semi di sospensione MNC (2 × 10 6 cellule / scaffold) sulle impalcature utilizzando una micro-pipetta.
- Incubare la ponteggi seminata a 37 ° C in 5% CO 2 per 10 minuti per le cellule a depositare nella ponteggi.
- Rabbocco ciascun pozzetto con 1,5 ml di IMDM contenente 30% FBS e 1% P / S e posto pozzetti in incubatore a 37 ° C e 5% CO 2 per la durata dell'esperimento.
- Le impalcature semi subiscono ogni giorno cambiano di tutti i media.
3 nella proliferazione cellulare in situ e Morfologia:. MTS, SEM e Cytospins
- Saggio MTS: Rimuovere dalla cultura uno un-seeded e due ponteggi semi e metteteli in un luogo pulito e ben 24 nuovi piastra. Aggiungere 1 ml di media e 200 pl della soluzione MTS ed incubare per 3 ore a 37 ° C e 5% CO 2.
- Prendete 8 x 100 campioni pl dal surnatante, posto in una piastra a 96 pozzetti e misura assorbanza a 490 nm usando un lettore per micropiastre.
- Microscopio elettronico a scansione (SEM): in momenti diversi thcultura e, rimuovere i ponteggi seminate con MNC da parte dei media, e fissare con il 2,5% PBS-tampone glutaraldeide per 40 min a 4 ° C, quindi lavare due volte con PBS.
- Disidratato i ponteggi in una serie graduata di etanolo (25, 50, 70, 80, 90, 95, e 100%), ciascuno per 10 min e secco in un ambiente asettico per 4 ore.
- Campioni sezione e quindi sputtering-strato d'oro in atmosfera di argon per 2 minuti prima della valutazione SEM, utilizzare una tensione di accelerazione di 20 kV.
- Cytospins: Raccogliere 2,0 x 10 4 cellule / vetrino aspirando le cellule del patibolo in momenti diversi della cultura.
- Centrifugare le cellule su un vetrino per 3 min a 1500 rpm.
- Colorare i vetrini con Wright-Giemsa modificato ed osservate mediante un microscopio ottico. F-view Imaging System Soft può essere utilizzato per scattare foto.
- Lavare i vetrini prima osservazione al microscopio.
- M ultiphoton analisi: ponteggi Fix in momenti diversi, con vapori di etanolo (70%) per una notte e poi asciugare e conservare a -20 ° C fino a ulteriori analisi. Prima di visualizzazione con la sezione microscopio multiphoton al patibolo in 30 micron di spessore diapositive e bagnato con PBS.
- Bloccare la ponteggi seminato in PBS con 10% siero fetale bovino per 30 minuti a temperatura ambiente.
- Incubare i ponteggi notte a 4 ° C al buio con una diluizione 1:50 di primaria anticorpo monoclonale: topo anti CD71 umano.
- Lavare i campioni per tre volte in PBS e si colorano con il secondario anticorpi: anti-mouse Alexa Fluor 488 per 1 ora a temperatura ambiente al buio.
- Lavare campioni tre volte con PBS e osservare con un microscopio confocale con una emissione di acqua x60 lente obiettivo.
- Fluoroforo Alexa Fluor 488 è eccitato a 488 nm dai laser pulsatili. Volocity 5.3.2 software può essere utilizzato per l'analisi dell'immagine successiva.
- Prima analisi cellulare nel citometro a flusso (FC), marcare le cellule di interesse con i corrispondenti anticorpi per il rilevamento di immunofluorescenza. Un certo numero di campioni vengono preparati secondo gli anticorpi selezionati per il rilevamento. Per il rilevamento MNC la seguente combinazione di anticorpi sono utilizzati: CD45-FITC/CD71-PE/CD235a-PE-Cy5.
- Aspirare le cellule del patibolo in diversi momenti e centrifugare. Sciogliere una cella pellet di circa 1x10 6 cellule in 100 microlitri tampone FC (sodio azide PBS + 0,1%) e aggiungere 10 ul di ciascun colorante fluorescenza anticorpo. Incubare le cellule per 30 minuti a 4 ° C, lavate due volte con PBS e infine risospendere in tampone FC.
- Caricare il campione nel tinto citometro a flusso con il controllo isotipico per impostare la "negatività" dell'espressione anticorpo e calibrare i canali di rivelazione con il controllo citometro a flusso.
- Leggi il campione colorato w esima i tre differenti anticorpi e infine rappresentano i dati utilizzando il software WinList.
5. Risultati rappresentativi
Un esempio di cinetica di crescita ematopoietici cellulari senza l'aggiunta di fattori di crescita esogeni è mostrato in Figura 2. A causa della natura eterogenea di ematopoiesi, due celle diverse: normali e cellule ematopoietiche anomale vengono illustrati. In figura 2A, la proliferazione cellulare di CBMNC umana è evidente dopo 28 giorni di coltura. Figura 2B mostra la cinetica di crescita nel mimetismo utilizzando cellule leucemiche umane primarie. Proliferazione cellulare è valutato utilizzando il saggio che misura MTS attività metabolica cellulare in relazione alla assorbanza. In entrambi i casi, le cellule si moltiplicano e stabilito nel modello. Differenze nella cinetica di crescita sono osservate; normali cellule ematopoietiche stabiliscono la coltura più velocemente rispetto alle cellule leucemiche.
_content "> La morfologia delle cellule raccolte anche dopo 28 giorni di coltura in assenza di fattori di crescita esogeni era tipica delle normali cellule ematopoietiche (Figura 3A) e cellule leucemiche (Figura 3B). sezioni centrali di ponteggi sono stati analizzati mediante SEM dopo i ponteggi sono stati rimossi dalla cultura e ha mostrato la diffusione delle cellule seminate in tutto il patibolo, stabilirsi in cluster e in "di nicchia come" strutture (Figura 3A '& B'). La figura C mostra la dimensione dei pori e la distribuzione in un seminata scaffold usato come controllo. microscopio multifotone dopo 28 giorni è stato utilizzato per evidenziare la distribuzione delle cellule all'interno del ponteggio 3D in situ e ha mostrato la presenza di isole eritroide in sezioni centrali di ponteggio (figura 4) per l'espressione del marcatore CD71 che è positivo in eritroblasti. Questo dimostra l'importanza di matura e maturazione delle cellule duAnello eritropoiesi. Infine, i grafici di citometria a flusso di cellule prima della semina mostra la differenza nel fenotipo di cellule ematopoietiche, in cui la figura 5A rappresenta normali cellule ematopoietiche: CBMNCs umani e 5B figura illustra le cellule ematopoietiche anomale: cellule leucemiche primarie. Livelli di CD235a + e CD45 + corrispondente eritrociti e leucociti, rispettivamente, sono maggiori nel campione normale rispetto al leucemica evidenziando la natura hemoblastic delle leucemie.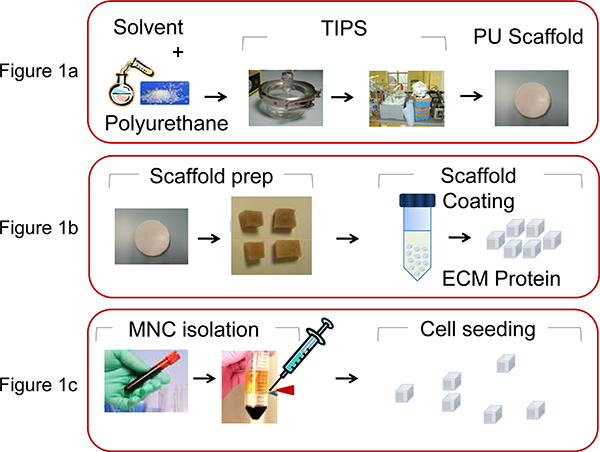
Figura 1. Illustrazione dei processi coinvolti in PU scaffold produzione e bio-funzionalizzazione. A) PU viene sciolto in diossano (5% in peso) e dal processo di fase indotta termicamente separazione e successiva sublimazione solvente il ponteggio viene prodotto, come descritto da Safinia et al 13. B) Il disco viene quindi tagliato scaffold intcubetti o di 0,5 x 0,5 x 0,5 mm e quindi rivestita per centrifugazione con extracellulari della matrice (ECM) proteine. C) MNC sono estratte dal cordone ombelicale CB umano o da aspirazione BM con centrifugazione in gradiente di densità e la testa di serie (2x10 6 cellule / scaffold) nel ponteggi PU con una micropipetta.
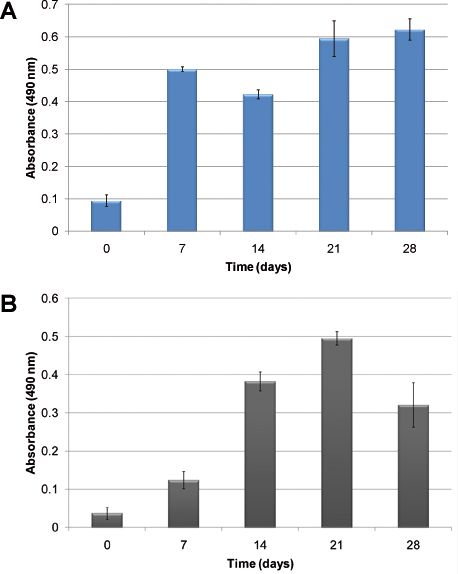
. Figura 2 proliferazione cellulare misurato con il saggio MTS: A) con il sangue del cordone umano MNC; B) che utilizza le cellule leucemiche primarie. Le colonne mostrano la crescita di cellule nel tempo quando seminate in impalcature PU senza l'aggiunta di citochine esogene.
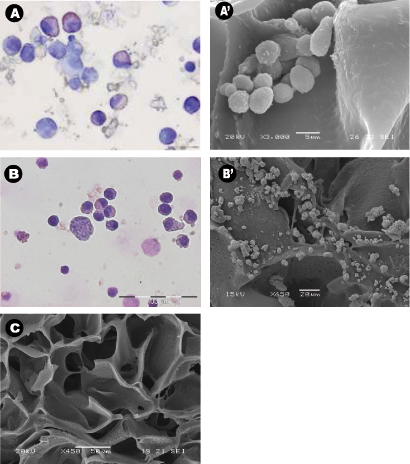
Figura 3: morfologia cellulare e la distribuzione intorno ai ponteggi con cytospins, scanning micrografie elettroni. (AB) rappresentativi Wright-Giemsa cytospins macchiati di A le cellule mononucleate del sangue del cordone) raccolti da impalcature PU dopo 28 giorni di cultura, e B) nelle cellule leucemiche aspirati raccolti da impalcature PU dopo 14 giorni di coltura. Entrambi gli esperimenti sono stati condotti in condizioni citochina libero. (A'-B '), rappresentativi sezioni centrali del patibolo PU micrografie SEM di A'), testa di serie del sangue del cordone multinazionali e B '), le cellule leucemiche dopo essere stati in coltura per 28 giorni, e C) il controllo scaffold privi di celle.
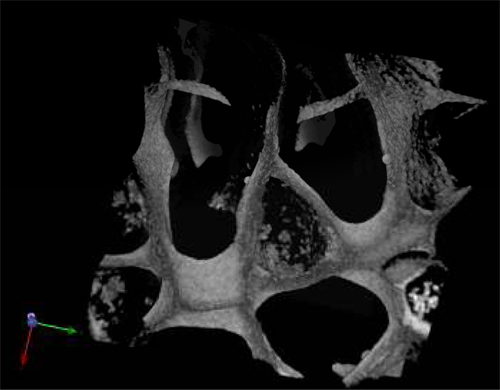
Figura 4. Multiphoton al microscopio di un ponteggio PU seminato con il sangue le multinazionali cordone dopo il 28 d in cultura e tinto con il marcatore CD71 eritroide.

Figura 5. Citometria a flusso 3D Dot-trame colorate per CD45, CD71 e CD235a marcatori di espressione di superficie. L'isotipo di controllo ottenuta viene anche presentata per confronto della intensità relativa fluorescenza. Panel A presenta cellule mononucleate del sangue del cordone positivi per i marcatori di cui sopra; B pannello mostra cellule leucemiche primarie.
Discussione
L'ex vivo sistema di coltura 3D qui presentata ci consente di stabilire una biomimicry 3D dell'emopoiesi che riassume l'architettura originale BM e fenotipo cellulare indipendente di citochine esogene. Il modello 3D fornisce la struttura e il microambiente che consente alle cellule ematopoietiche normali e patologici a proliferare in condizioni simili a quelli riscontrati in vivo.
La selezione del materiale polimerico scaffold rappresentato un passo importante n...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dal Fondo Richard Thomas leucemia, la Lady Tata Memorial Trust, il Northwick Park Hospital leucemia Fund Research Trust e il National Institute of Health Research (NIHR), Regno Unito.
Materiali
| Name | Company | Catalog Number | Comments |
| Name of the reagent | Company | Catalogue No | |
| Dioxan | Invitrogen | D20,186-3 | |
| PBS | Gibco | 14190-094 | |
| IMDM | Invitrogen | 12440-053 | |
| Ficoll-Paque | GE Healthcare | 17-1440-02 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| MTS | Promega | G3580 | |
| Glutaraldehyde | Fluka Biochemika | 49624 | |
| Wright-Giemsa | Sigma-Aldrich | WG32 | |
| Fetal bovine serum | Gibco | 10108-165 | |
| CD71 | Santa Cruz Biotechnology | sc-32272 | |
| Alexa Fluor 488 | Invitrogen | A11001 | |
| CD45-FITC | BD Pharmigen | 74895 | |
| CD71-PE | BD Pharmigen | 555537 | |
| CD235a-PE-Cy5 | BD Pharmigen | 555570 | |
| Sodium azide | Sigma-Aldrich | S-8032 |
Riferimenti
- Orkin, S., Zon, L. Hematopoiesis: an evolving paradigm for stem cell biology. Cell. 132, 631-644 (2008).
- Spradling, A., Drummond-Barbosa, D., Kai, T. Stem cells find their niche. Nature. 414, 98-104 (2001).
- Panoskaltsis, N., Mantalaris, A., Wu, D. Engineering a mimicry of bone marrow tissue ex vivo. J Biosci. Bioeng. 100, 28-35 (2005).
- Lo Celso, C. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457, 92-96 (2009).
- Mantalaris, A., Bourne, P., Wu, J. Production of human osteoclasts in a three-dimensional bone marrow culture system. Biochem. Eng. J. 20, 189-196 (2004).
- Placzek, M. Stem cell bioprocessing: fundamentals and principles. J. R. Soc. Interface. 6, 209-232 (2009).
- Dexter, T., Testa, N., Prescott, D. . Methods in Cell Biology. 14, 387-405 (1976).
- Piacibello, W. Differential growth factor requirement of primitive cord blood hematopoietic stem cell for self-renewal and amplification vs proliferation and differentiation. Leukemia. 12, 718-727 (1998).
- Yoshida, T., Takagi, M. Cell processing engineering for ex vivo expansion of hematopoietic cells: a review. Biochemical Engineering Journal. 20, 99-106 (2004).
- Lim, M. Intelligent bioprocessing for haemotopoietic cell cultures using monitoring and design of experiments. Biotechnol. Adv. 25, 353-368 (2007).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Panoskaltsis, N. The development of a three-dimensional scaffold for ex vivo biomimicry of human acute myeloid leukaemia. Biomaterials. 31, 2243-2251 (2010).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Aqel, N., Panoskaltsis, N. Long-term cytokine-free expansion of cord blood mononuclear cells in three-dimensional scaffolds. Biomaterials. 32, 9263-9270 (2011).
- Safinia, L., Datan, N., Hohse, M., Mantalaris, A., Bismarck, A. Towards a methodology for the effective surface modification of porous polymer scaffolds. Biomaterials. 26, 7537-7547 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon