É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ex vivo Mimetismo de normal e anormal Hematopoese Humanos
Neste Artigo
Resumo
Um sistema de cultura de 3D para a hematopoiese é descrito usando sangue do cordão umbilical humano e células de medula óssea leucémicas. O método baseia-se na utilização de um poliuretano poroso sintético andaime revestido com proteínas da matriz extracelular. Este andaime é adaptável para acomodar uma grande variedade de células.
Resumo
Células-tronco hematopoéticas requer um microambiente único, a fim de sustentar a formação do sangue célula 1, a medula óssea (BM) é um complexo tridimensional (3D) tecido hematopoiese em que é regulada por espacialmente organizadas microambientes celulares denominados nichos 2-4. A organização dos nichos BM é crítico para a função ou disfunção de BM normal ou maligno 5. Por conseguinte, uma melhor compreensão do microambiente em in vivo utilizando um mimetismo ex vivo nos ajudaria elucidar os determinantes moleculares, celulares e microambiental de leucemogênese 6.
Actualmente, as células hematopoiéticas são cultivadas in vitro em frascos de tecidos bidimensionais (2D) de cultura / poço de placas 7 que requerem ou de co-cultura com alogénico ou xenogénica células estromais ou adição de citocinas exógenas 8. Estas condições são artificiais e diferem do in vivo 9,10 pluripotência.
Aqui, apresentamos um romance 3D osso sistema de cultura de medula que simula o ambiente de crescimento in vivo em 3D e suporta hematopoiese multilinhagens na ausência de fatores de crescimento exógenos. O andaime altamente poroso utilizado neste sistema de poliuretano (PU), facilita a alta densidade crescimento celular através de uma maior área superficial específica do que a cultura em monocamada em 2D convencional 11. O nosso trabalho indicou que este modelo de suporte o crescimento de sangue do cordão umbilical humano (CB), as células mononucleares (MNC) 12 e primárias de células leucémicas, na ausência de citocinas exógenas. Este mimetismo 3D romance proporciona uma plataforma viável para o desenvolvimento de um modelo humano experimental para estudar a hematopoiese e para explorar novos tratamentos para a leucemia.
Protocolo
1. Andaime Fabricação e Bio-funcionalização de Andaimes
- Para fabricar PU andaimes (tamanho de poro 100-250 mm, porosidade de 90-95%) sob a forma de discos de Petri, utilizar a separação de fases induzida termicamente 13 processo através da preparação de uma solução de polímero (5wt% em dioxano), seguido de congelamento e subsequente sublimação do solvente (Figura 1A).
- Cortar o disco de andaime em cubos de 0,5 x 0,5 x 0,5 mm antes do revestimento com ECM proteínas (Figura 1B).
- Pré-molhadas os suportes por imersão em etanol (70%) durante 1 min e depois transferir em salina tamponada com fosfato (PBS) durante 20 min. Em seguida, centrifugar durante 10 min a 3630 xg e adicionar a solução de proteína.
- Centrifugar os suportes na solução de proteína a 1420 xg durante 20 min.
- A fim de desbloquear os poros da superfície, e permitir que as células semeadas a penetrar mais profundamente na andaime, centrifugar o scaffolds mais uma vez em 910 xg durante 10 minem PBS.
- Esterilizar os andaimes usando uma combinação de 8 min de exposição a 230 V, 50 Hz, 0,14 Uma lâmpada de UV, com a imersão durante 2 h em etanol (70%). Depois disso, lavar os suportes duas vezes em PBS antes da adição Modificado por Dulbecco Médio de Iscove (IMDM), suplementado com 30% de soro fetal bovino (FBS) e 1% de penicilina e estreptomicina (P / S). Colocar os suportes em um incubador humidificado durante 3 dias a 37 ° C e 5% de CO 2 antes de usar. Andaimes estéreis são colocados num placas de 24 poços de tecido-cultura (um andaime por poço).
2. Isolamento de células mononucleares e Plantio de andaime
- Extrair humano MNC do sangue do cordão ou amostras de medula óssea leucémicas, usando Ficoll-Paque centrifugação em gradiente de densidade (35 min a 1500 rpm) (Figura 1C).
- Ressuspender o MNC em IMDM contendo 30% de FBS e 1% P / S.
- 100 ul de semente de suspensão MNC (2 × 10 6 células / andaime) para a andaimes usando uma pipeta de micro-.
- Incubar a andaimes semeadas a 37 ° C sob 5% de CO 2 durante 10 minutos para as células para se adaptar à andaimes.
- Encher cada poço com 1,5 ml de IMDM contendo 30% de FBS e 1% P / S e as placas assim lugar na incubadora a 37 ° C e 5% de CO2 durante a duração da experiência.
- Os arcabouços semeados sofrem diariamente mudam de todos os meios de comunicação.
3 na proliferação celular in situ e Morfologia:. MTS, SEM e cytospins
- Ensaio MTS: Retire uma cultura não-sementes e dois andaimes sem sementes e coloque em um 24 novo e limpo bem-chapa. Adicionar 1 ml de meio e 200 uL da solução de MTS e incubar durante 3 horas a 37 ° C e 5% de CO 2.
- Exame de 8 x 100 uL de amostras a partir do sobrenadante; lugar em uma placa de 96 poços e absorvância medida a 490 nm usando um leitor de microplacas.
- Microscopia eletrônica de varredura (MEV): em diferentes momentos do diacultura e, remover os andaimes semeadas com MNC a partir dos meios de comunicação, e fixar com 2,5% de PBS-tamponada solução de glutaraldeído por 40 min a 4 ° C, em seguida, lavar duas vezes com PBS.
- Desidratado os suportes em uma série graduada de etanol (25, 50, 70, 80, 90, 95 e 100%), cada um durante 10 min e seco num ambiente asséptico durante 4 horas.
- Espécimes de secção e, em seguida, por pulverização catódica-revestimento com ouro numa atmosfera de árgon durante 2 min antes da avaliação SEM, utilizar uma voltagem de aceleração de 20 kV.
- Cytospins: Recolha 2,0 x 10 4 células / lâmina por aspiração das células do andaime em pontos de tempo diferentes na cultura.
- Centrifugar as células numa lâmina de vidro durante 3 min a 1500 rpm.
- Coloração das lâminas com Wright-Giemsa modificado e observar por meio de um microscópio óptico. F-visualizar Imaging System Soft pode ser usado para tirar fotos.
- Lave as lâminas antes da observação ao microscópio.
- M análise ultiphoton: andaimes fixos em pontos de tempo diferentes, com vapor de etanol (70%) durante a noite e, em seguida, seco e armazenar a -20 ° C até análise posterior. Antes de visualização com a seção de microscópio multifotônica o andaime em 30 mm de espessura, slides e molhado com PBS.
- Bloquear a andaimes seeded em PBS com 10% de soro fetal de bovino durante 30 min à temperatura ambiente.
- Incubar as andaimes durante a noite a 4 ° C na escuridão com uma diluição de 1:50 de anticorpo monoclonal primário: ratinho anti CD71 humano.
- Lavar as amostras três vezes em PBS e coradas com o anticorpo secundário: anti-ratinho Alexa Fluor 488 durante 1 h à temperatura ambiente na escuridão.
- Lavar as amostras três vezes com PBS e observar com um microscópio confocal usando uma água de emissão lente objectiva x60.
- Fluoróforo Alexa Fluor 488 é excitado a 488 nm pelos lasers pulsáteis. O software Volocity 5.3.2 pode ser utilizado para análise de imagem subsequente.
- Antes da análise celular no citómetro de fluxo (FC), rótulo as células de interesse com os anticorpos correspondentes de imunofluorescência para a detecção. Um certo número de amostras são preparadas de acordo com os anticorpos seleccionados, para detecção. Para a detecção MNC a seguinte combinação de anticorpos são utilizados: CD45-FITC/CD71-PE/CD235a-PE-Cy5.
- Aspirar as células do andaime em pontos de tempo diferentes e centrifugar. Dissolve-se uma pelete de células de cerca de 1x10 6 células em 100 uL de tampão FC (PBS azida de sódio + 0,1%) e adicionar 10 uL de cada corante de fluorescência de anticorpos. Incubar as células durante 30 min a 4 ° C, lavar duas vezes com PBS e finalmente re-suspender em tampão de FC.
- Carregar a amostra para o manchado citómetro de fluxo com o controlo de isotipo para definir o "negatividade" da expressão do anticorpo e calibrar os canais de detecção com o controle citómetro de fluxo.
- Leia a amostra manchado w om os três anticorpos diferentes e, finalmente, representam os dados no uso do software WinList.
5. Os resultados representativos
Um exemplo de hematopoiéticas cinética de crescimento celular, sem a adição de factores de crescimento exógenos é mostrado na Figura 2. Devido à natureza heterogénea de hematopoiese, duas células diferentes: normais e anormais células hematopoiéticas são ilustrados. Na Figura 2A, a proliferação celular de CBMNC humana é evidente após 28 dias em cultura. Figura 2B mostra a cinética de crescimento no mimetismo usando células humanas leucémicas primárias. Proliferação celular é avaliada utilizando o ensaio de MTS que mede a actividade metabólica celular em relação à absorvância. Em ambos os casos, as células proliferaram e estabeleceu no modelo. As diferenças na cinética de crescimento são observados; células hematopoiéticas normais estabelecer a cultura mais rápido do que as células leucémicas.
_content "> A morfologia das células colhidas, mesmo após 28 dias de cultura na ausência de factores de crescimento exógenos era típica de células hematopoiéticas normais (Figura 3A) e células leucémicas (Figura 3B). secções centrais dos suportes foram analisados por SEM após os andaimes foram retirados da cultura e mostrou a propagação das células semeadas em todo o andaime, estabelecendo-se em agrupamentos e em "nicho-estruturas semelhantes (Figura 3A '& B'). Figura C mostra o tamanho dos poros e distribuição em um unseeded andaime usado como um controlo. microscopia multifotônica após 28 dias foi utilizado para destacar a distribuição das células no interior da andaime 3D in situ e que mostrou a presença de eritróide ilhas nas secções centrais do andaime (Figura 4) pela expressão do marcador CD71, que é positiva em eritroblastos. Isso prova a importância da du madura e células vencimentoeritropoiese anel. Finalmente, os gráficos de citometria de fluxo da semeadura células antes mostra a diferença no fenótipo de células hematopoiéticas, em que A Figura 5A representa células hematopoiéticas normais: CBMNCs humanos e Figura 5B ilustra anormais células hematopoiéticas: células leucémicas primárias. Níveis de CD235a + e CD45 + correspondente a eritrócitos e leucócitos, respectivamente são superiores na amostra normal do que no leucémicas destacando a natureza hemoblastic das leucemias.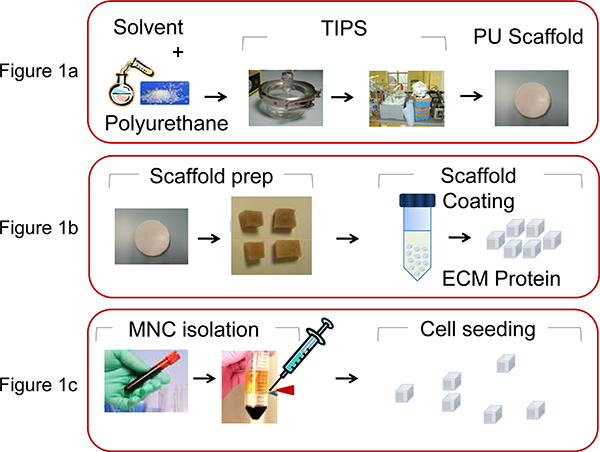
Figura 1. Ilustração dos processos envolvidos na fabricação e PU andaime bio-funcionalização. A) PU é dissolvido em dioxano (5wt%) e pelo processo termicamente induzida fase de separação e sublimação solvente subsequente do andaime é produzido, como descrito por Safinia et al 13. B) O disco de andaime é então cortada intO cubos de 0,5 x 0,5 x 0,5 mm e, então, revestido por centrifugação com matriz extra-celular (ECM) proteínas. C) MNC são extraídos umbilical humano CB ou a partir de aspiração BM utilizando centrifugação em gradiente de densidade e semeado (2x10 6 células / andaime) na andaimes PU com uma micropipeta.
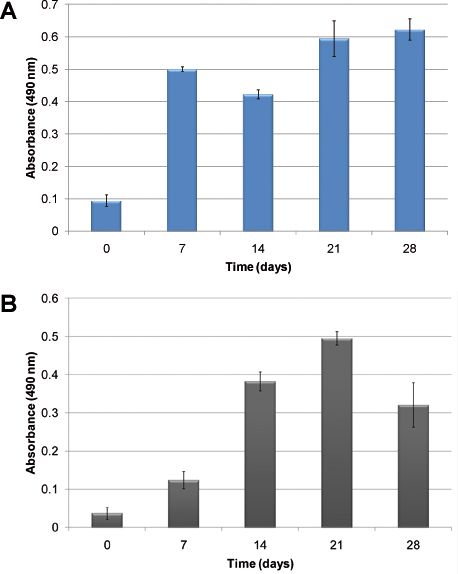
. Figura 2 proliferação celular medido utilizando o ensaio de MTS: A) usando sangue do cordão umbilical humano EMNs; B), utilizando células humanas leucémicas primárias. As colunas mostram o crescimento de células ao longo do tempo, quando semeadas no andaimes PU, sem a adição de citocinas exógenas.
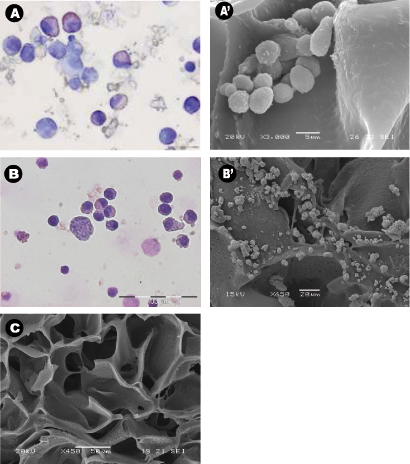
Figura 3: A morfologia e distribuição em torno dos andaimes utilizando cytospins, scannimicrografias ng elétrons. (AB) Representante Wright-Giemsa cytospins manchadas de A) células mononucleares do sangue do cordão coletadas em PU andaimes após 28 dias de cultura, e B) osso aspirados células leucêmicas coletadas de PU andaimes após 14 dias de cultura. Ambos os experimentos foram realizados em condições de citocinas livre. (A'-B ') Representante seções centrais das micrografias de MEV de PU andaime A') cabo semeado sangue multinacionais e B ') células leucêmicas após serem cultivadas durante 28 dias, e C) controle andaime sem células.
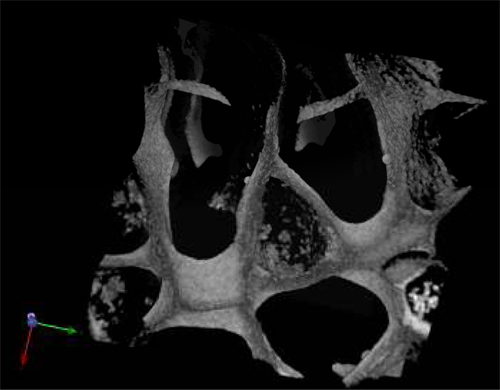
Figura 4. Multifotônica micrografia de um andaime PU semeado com sangue do cordão umbilical multinacionais após 28 d na cultura e corados com o marcador CD71 eritróide.

Figura 5. Citometria de Fluxo 3D Dot-plots coradas para CD45, CD71 e marcadores de expressão CD235a superfície. O controlo de isotipo obtido é também apresentados para comparação da intensidade relativa da fluorescência. O painel A mostra células do cordão humanos de sangue mononucleares positivos para os marcadores acima; B Painel mostra células leucémicas humanas primárias.
Discussão
O ex vivo sistema de cultura 3D apresentado aqui permite-nos estabelecer uma biomimicry 3D da hematopoiese que recapitula a arquitetura original BM e fenótipo celular independente de citocinas exógenas. O modelo 3D fornece a estrutura e do microambiente que permite normais e anormais células hematopoiéticas para proliferar em condições similares àquelas encontradas in vivo.
A seleção do material polimérico andaime representou um passo crítico no projeto biomimicr...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi financiado pelo Fundo Thomas Richard leucemia, a Senhora Tata Memorial Trust, do Northwick Park Hospital Fundo Fiduciário Leucemia Research e do Instituto Nacional de Pesquisa em Saúde (NIHR), Reino Unido.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of the reagent | Company | Catalogue No | |
| Dioxan | Invitrogen | D20,186-3 | |
| PBS | Gibco | 14190-094 | |
| IMDM | Invitrogen | 12440-053 | |
| Ficoll-Paque | GE Healthcare | 17-1440-02 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| MTS | Promega | G3580 | |
| Glutaraldehyde | Fluka Biochemika | 49624 | |
| Wright-Giemsa | Sigma-Aldrich | WG32 | |
| Fetal bovine serum | Gibco | 10108-165 | |
| CD71 | Santa Cruz Biotechnology | sc-32272 | |
| Alexa Fluor 488 | Invitrogen | A11001 | |
| CD45-FITC | BD Pharmigen | 74895 | |
| CD71-PE | BD Pharmigen | 555537 | |
| CD235a-PE-Cy5 | BD Pharmigen | 555570 | |
| Sodium azide | Sigma-Aldrich | S-8032 |
Referências
- Orkin, S., Zon, L. Hematopoiesis: an evolving paradigm for stem cell biology. Cell. 132, 631-644 (2008).
- Spradling, A., Drummond-Barbosa, D., Kai, T. Stem cells find their niche. Nature. 414, 98-104 (2001).
- Panoskaltsis, N., Mantalaris, A., Wu, D. Engineering a mimicry of bone marrow tissue ex vivo. J Biosci. Bioeng. 100, 28-35 (2005).
- Lo Celso, C. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457, 92-96 (2009).
- Mantalaris, A., Bourne, P., Wu, J. Production of human osteoclasts in a three-dimensional bone marrow culture system. Biochem. Eng. J. 20, 189-196 (2004).
- Placzek, M. Stem cell bioprocessing: fundamentals and principles. J. R. Soc. Interface. 6, 209-232 (2009).
- Dexter, T., Testa, N., Prescott, D. . Methods in Cell Biology. 14, 387-405 (1976).
- Piacibello, W. Differential growth factor requirement of primitive cord blood hematopoietic stem cell for self-renewal and amplification vs proliferation and differentiation. Leukemia. 12, 718-727 (1998).
- Yoshida, T., Takagi, M. Cell processing engineering for ex vivo expansion of hematopoietic cells: a review. Biochemical Engineering Journal. 20, 99-106 (2004).
- Lim, M. Intelligent bioprocessing for haemotopoietic cell cultures using monitoring and design of experiments. Biotechnol. Adv. 25, 353-368 (2007).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Panoskaltsis, N. The development of a three-dimensional scaffold for ex vivo biomimicry of human acute myeloid leukaemia. Biomaterials. 31, 2243-2251 (2010).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Aqel, N., Panoskaltsis, N. Long-term cytokine-free expansion of cord blood mononuclear cells in three-dimensional scaffolds. Biomaterials. 32, 9263-9270 (2011).
- Safinia, L., Datan, N., Hohse, M., Mantalaris, A., Bismarck, A. Towards a methodology for the effective surface modification of porous polymer scaffolds. Biomaterials. 26, 7537-7547 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados