Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экс естественных Мимикрия нормального и аномального человека Кровотворение
В этой статье
Резюме
3D системы кроветворения культуры описывается с помощью человеческого мозга и крови лейкозных клеток костного мозга. Метод основан на использовании синтетических пористых полиуретановых леса покрыты белки внеклеточного матрикса. Это леса также является адаптируемой, чтобы приспособить широкий диапазон ячеек.
Аннотация
Гемопоэтических стволовых клеток требует уникального микроокружения для того, чтобы поддерживать формирование клеток крови 1, костного мозга (КМ) представляет собой сложную трехмерную (3D) ткань которой кроветворения регулируется пространственно организованных сотовой микросреды называют ниши 2-4. Организация BM ниши является критическим для функции или дисфункции нормальных и злокачественных BM 5. Поэтому более глубокое понимание в естественных условиях микросреды использование бывших мимика естественных условиях поможет нам выяснить молекулярные, клеточные и микросреды детерминанты возникновение и развитие лейкоза 6.
В настоящее время кроветворные клетки культивируют в пробирке в двумерной (2D) культуры тканей колбы / и пластины 7, требующих, как со-культуры аллогенных или ксеногенных стромальных клеток или добавление экзогенных цитокинов 8. Эти условия являются искусственными и отличаются от в естественных условиях 9,10.
Здесь мы представляем новую 3D костного мозга культуры система, которая имитирует в естественных условиях окружающей среды роста 3D и поддерживает мультилинейной кроветворения в отсутствии экзогенных факторов роста. Высокопористые леса, используемые в этой системе из полиуретана (ПУ), способствует высокой плотности роста клеток по более высокой удельной площадью поверхности, чем обычные культуры монослоя в 2D 11. Наши работы показали, что эта модель поддерживает рост человеческой пуповинной крови (ЦБ) мононуклеарных клеток (МНК) 12 и первичных лейкозных клеток в отсутствии экзогенных цитокинов. Этот роман мимика 3D обеспечивает жизнеспособную платформу для развития человека экспериментальной моделью для изучения кроветворения, а также изучить новые методы лечения лейкемии.
протокол
1. Леса Производство и Био-функционализации Строительные леса
- Для изготовления PU леса (размер пор 100-250 мм, пористость 90-95%) в виде дисков чашки Петри, используя термически индуцированного расслоения 13 Процесс приготовления раствора полимера (5 Вт в диоксане%) с последующим замораживанием и последующим растворителя сублимации (рис. 1а).
- Вырезать диск леса на кубики 0,5 х 0,5 х 0,5 мм до покрытия ECM белков (рис. 1б).
- Предварительно мокрый лесов путем погружения их в этанол (70%) в течение 1 мин, а затем передать в фосфатный буферный раствор (PBS) в течение 20 мин. Затем центрифуги в течение 10 мин при 3630 мкг и добавить раствор белка.
- Центрифуга лесов в растворе белка на 1420 мкг в течение 20 мин.
- Для того, чтобы разблокировать поверхности поры и позволяют клеткам посеяны проникнуть глубже в леса, центрифуги леса один раз в 910 мкг в течение 10 минутв PBS.
- Стерилизовать леса, используя комбинацию из 8 мин воздействия при 230 В, 50 Гц, 0,14 А, УФ-лампы, с погружением в течение 2 ч в этанол (70%). После этого промыть леса дважды в PBS, прежде чем добавлять Искова изменения Дульбекко среды (IMDM) с добавлением 30% эмбриональной телячьей сыворотки (FBS) и 1% пенициллина и стрептомицина (P / S). Поместите лесов в увлажненном инкубаторе в течение 3 дней при 37 ° С и 5% CO 2 до использования. Стерильные леса расположены в 24 хорошо культуре ткани пластины (одна леса на лунку).
2. Одноядерных изоляторе и леса Посев
- Извлечение человека MNC из пуповинной крови или лейкозных образцы костного мозга, используя Ficoll-Paque центрифугирования в градиенте плотности (35 мин со скоростью 1500 оборотов в минуту) (рис. 1в).
- Ресуспендируйте MNC в IMDM, содержащей 30% FBS и 1% P / S.
- Семенной 100 мкл суспензии МНК (2 × 10 6 кл / леса) на строительные леса помощью микро-пипетки.
- Инкубируйте семенами лесов при 37 ° С до 5% CO 2 в течение 10 минут для клеток, чтобы обосноваться в лесах.
- Пополните каждую лунку с 1,5 мл IMDM, содержащей 30% FBS и 1% P / S и место также пластин в инкубаторе при температуре 37 ° С и 5% CO 2 на протяжении всего эксперимента.
- Отобранный леса подвергаются ежедневно, смена всех средствах массовой информации.
3 В местах пролиферации клеток и морфология. МТС, SEM и Cytospins
- МТС анализа: Удалить из культуре, не-семенами и двумя семенами леса и места в чистоте и новый 24-пластины. Добавьте 1 мл среды и 200 мкл раствора МТС и инкубировать в течение 3 ч при температуре 37 ° С и 5% CO 2.
- Возьмите 8 х 100 мкл пробы супернатант, место в 96-луночного планшета и мерой поглощения при 490 нм с использованием планшетного.
- Сканирующей электронной микроскопии (SEM): В разные моменты времени в гоэлектронная культура, удалите лесов посеян с ТНК из средств массовой информации, и исправить с 2,5% PBS-буфере глутаральдегида решение в течение 40 мин при 4 ° С, затем промыть два раза PBS.
- Высушенные леса в серии градуированных этанола (25, 50, 70, 80, 90, 95 и 100%), каждый в течение 10 мин и сухой в асептических условиях в течение 4 часов.
- Раздел образцов, а затем распыление покрытия их золотом в атмосфере аргона в течение 2 мин до оценки SEM, использовать ускоряющее напряжение 20 кВ.
- Cytospins: собрать 2,0 х 10 4 клеток / слайд аспирации клеток из леса в различные моменты времени в культуре.
- Центрифуга клеток на стекле в течение 3 мин при 1500 оборотах в минуту.
- Пятно слайды с Райт-Гимза изменения и наблюдать с помощью оптического микроскопа. F-Soft System просмотра изображений можно использовать для съемки фотографий.
- Промойте скользит до микроскоп наблюдений.
- M ultiphoton анализа: Fix лесов в различные моменты времени с паров этанола (70%) в течение ночи, а затем сухой и хранить при температуре -20 ° C до последующего анализа. До визуализации с многофотонной разделе микроскоп леса в 30 мкм толщиной слайды и влажный с PBS.
- Блок семенами лесов в PBS с 10% эмбриональной телячьей сыворотки в течение 30 мин при комнатной температуре.
- Инкубируйте леса ночи при 4 ° С в темноте с 1:50 разведение первичных моноклональных антител: мышь анти CD71 человека.
- Вымойте образцы в три раза PBS и пятна с вторичными антителами: анти-мышь Alexa Fluor 488 в течение 1 часа при комнатной температуре в темноте.
- Вымойте образцы три раза PBS и наблюдать с использованием конфокальной микроскопии x60 воды излучение объективом.
- Флуорофора Alexa Fluor 488 возбуждается на 488 нм в пульсирующий лазеров. Volocity 5.3.2 программное обеспечение может быть использовано для последующего анализа изображений.
- Перед сотовой анализа в проточной цитометрии (FC), маркировать клетки интерес с соответствующими иммунофлюоресценции для выявления антител. Количество образцов готовят в соответствии с выбранным для обнаружения антител. Для обнаружения MNC следующую комбинацию антитела используются: CD45-FITC/CD71-PE/CD235a-PE-Cy5.
- Аспирируйте клеток из леса в различные моменты времени и центрифуги. Растворить осадок клеток около 1x10 6 клеток в 100 мкл буфера FC (PBS + 0,1% азида натрия) и добавить 10 мкл каждого красителя флуоресценции антител. Инкубируйте клетки в течение 30 мин при 4 ° С, мыть два раза PBS и, наконец, повторно приостанавливать в буфер FC.
- Загрузка образца в окрашенных цитометр потока с изотипа контроль, чтобы установить "отрицательность" антитела выражения и калибровки обнаружение каналов с контролем цитометр потока.
- Читайте образца окрашенных W го три различных антител и, наконец, представлять данные в использовании WinList программного обеспечения.
5. Представитель Результаты
Например гемопоэтических клеточной кинетики роста без того экзогенных факторов роста показано на рисунке 2. В связи с гетерогенный характер кроветворения, два разных клетках: нормальные и аномальные гемопоэтические клетки показано на рисунке. На рисунке 2А, клеточную пролиферацию в человека CBMNC очевидно, через 28 дней в культуре. Рисунок 2B показывает кинетики роста в мимикрии с использованием человеческих клеток первичной лейкозных. Клеточную пролиферацию оценивается с помощью анализа МТС, который измеряет сотовой метаболической активности по отношению к поглощению. В обоих случаях клетки распространились и установили в модель. Различия в кинетике роста наблюдаются, нормальный гемопоэтических клеток устанавливают культуре быстрее, чем лейкозных клеток.
_content "> морфологии собранных клеток даже после 28 дней культуры в отсутствии экзогенных факторов роста было характерно для нормальных гемопоэтических клеток (рис. 3А) и лейкозных клеток (рис. 3В). Центральный участки леса были проанализированы с помощью SEM после леса были сняты с культурой и показал распространение клеток отобранные по всему лесов, создание себя в кластерах и в "нишу как" структуры (рис. 3А "и В '). Рисунок С показывает размер пор и распределения в unseeded строительные леса используются в качестве контроля. Многофотонная микроскопия через 28 дней был использован для выделения распределение клеток в 3D леса на месте, и она показала наличие эритроидных островов в центральных частях леса (рис. 4) по выражению маркера CD71, положительная в эритробласты. Это доказывает важность зрелый и созревания клеток-дю-Кольцо эритропоэза. Наконец, проточной цитометрии графики клеток до посева показывает разницу в фенотипе гемопоэтических клеток, где рис 5А представляет нормальные гемопоэтические клетки человека: CBMNCs и рис 5B показывает аномальные гемопоэтические клетки: первичные клетки лейкозных. Уровни CD235a + и CD45 + соответствующий эритроцитов и лейкоцитов, соответственно, выше в нормальных образцов, чем в лейкозных подчеркнув hemoblastic природе лейкозов.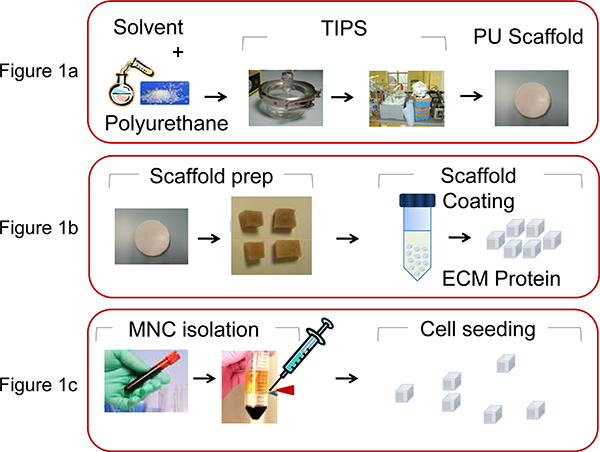
Рисунок 1. Иллюстрация процессов в ПУ эшафот производства и био-функциональных групп. А) PU растворяется в диоксане (5 Вт%) и термически индуцированных фаза процесса разделения и последующего растворителя сублимации леса производится, как описано Safinia и др. 13. Б) диск эшафот затем разрезается Intо кубиками 0,5 х 0,5 х 0,5 мм, а затем покрыты путем центрифугирования с внеклеточной матрицы (ECM) белков. C) MNC извлекаются из пуповины человека ЦБ или BM стремление использованием центрифугирования в градиенте плотности и семенами (2х10 6 кл / леса) в ПУ леса с пипетки.
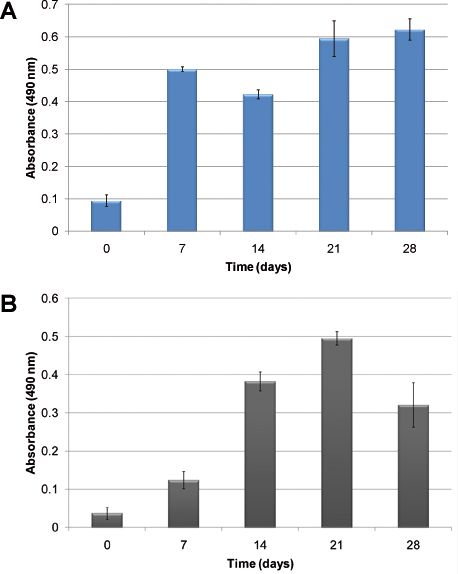
На рис. 2 пролиферацию клеток измеряется с помощью анализа МТС) с использованием пуповинной крови человека МНК, В) с использованием человеческих клеток первичной лейкозных. Столбцы показывают рост клеток с течением времени, когда засевали в ПУ леса без добавления экзогенных цитокинов.
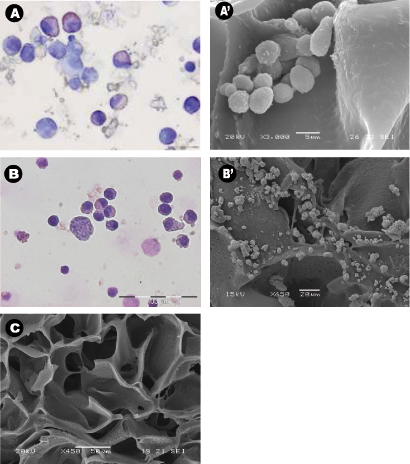
Рисунок 3: морфология клеток и распределение вокруг леса использованием cytospins, scanniнг электронной микроскопии. (AB) представитель Райт-Гимза окрашенных cytospins А) пуповинной крови мононуклеаров собраны из PU леса через 28 дней культуры, и б) костный атмосферный лейкозных клеток собраны из PU леса через 14 дней культуры. И эксперименты были проведены в цитокинов свободном состоянии. (А'-В ') представитель центрального участков леса PU микрофотографии РЭМ) семенами МНК пуповинной крови и B') лейкозных клеток после того, культивировали в течение 28 дней, и C) с контролем леса нет клеток.
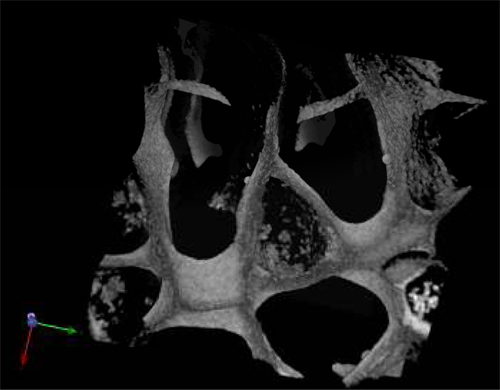
Рисунок 4. Многофотонные микрофотография PU лесов семенами с МНК пуповинной крови после 28 дней в области культуры и окрашенные с маркером CD71 эритроидных.
 Рисунок 5. Проточная цитометрия 3D интернет-участки окрашиваются для CD45, CD71 и CD235a поверхностных маркеров выражения. Изотипа управления получили также представлены для сравнения относительной интенсивности флуоресценции. Группа показывает человека пуповинной крови мононуклеаров положительный для вышеуказанных маркеров, группа B показывает человека лейкозных клеток первичной.
Рисунок 5. Проточная цитометрия 3D интернет-участки окрашиваются для CD45, CD71 и CD235a поверхностных маркеров выражения. Изотипа управления получили также представлены для сравнения относительной интенсивности флуоресценции. Группа показывает человека пуповинной крови мононуклеаров положительный для вышеуказанных маркеров, группа B показывает человека лейкозных клеток первичной.
Обсуждение
Экс живом 3D системе культуры, представленные здесь позволяет установить 3D биомимикрия кроветворения, что повторяет оригинальный BM архитектуры и клеточный фенотип зависят от экзогенных цитокинов. 3D модель дает структуру и микросреда, которая позволяет нормальной и аномальные ге?...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа финансировалась Ричард Томас Лейкемия фонда, леди Тата Мемориал Trust, Northwick Парк больницы Лейкемия Целевого фонда исследований и Национального института медицинских исследований (NIHR), Великобритания.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of the reagent | Company | Catalogue No | |
| Dioxan | Invitrogen | D20,186-3 | |
| PBS | Gibco | 14190-094 | |
| IMDM | Invitrogen | 12440-053 | |
| Ficoll-Paque | GE Healthcare | 17-1440-02 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| MTS | Promega | G3580 | |
| Glutaraldehyde | Fluka Biochemika | 49624 | |
| Wright-Giemsa | Sigma-Aldrich | WG32 | |
| Fetal bovine serum | Gibco | 10108-165 | |
| CD71 | Santa Cruz Biotechnology | sc-32272 | |
| Alexa Fluor 488 | Invitrogen | A11001 | |
| CD45-FITC | BD Pharmigen | 74895 | |
| CD71-PE | BD Pharmigen | 555537 | |
| CD235a-PE-Cy5 | BD Pharmigen | 555570 | |
| Sodium azide | Sigma-Aldrich | S-8032 |
Ссылки
- Orkin, S., Zon, L. Hematopoiesis: an evolving paradigm for stem cell biology. Cell. 132, 631-644 (2008).
- Spradling, A., Drummond-Barbosa, D., Kai, T. Stem cells find their niche. Nature. 414, 98-104 (2001).
- Panoskaltsis, N., Mantalaris, A., Wu, D. Engineering a mimicry of bone marrow tissue ex vivo. J Biosci. Bioeng. 100, 28-35 (2005).
- Lo Celso, C. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457, 92-96 (2009).
- Mantalaris, A., Bourne, P., Wu, J. Production of human osteoclasts in a three-dimensional bone marrow culture system. Biochem. Eng. J. 20, 189-196 (2004).
- Placzek, M. Stem cell bioprocessing: fundamentals and principles. J. R. Soc. Interface. 6, 209-232 (2009).
- Dexter, T., Testa, N., Prescott, D. . Methods in Cell Biology. 14, 387-405 (1976).
- Piacibello, W. Differential growth factor requirement of primitive cord blood hematopoietic stem cell for self-renewal and amplification vs proliferation and differentiation. Leukemia. 12, 718-727 (1998).
- Yoshida, T., Takagi, M. Cell processing engineering for ex vivo expansion of hematopoietic cells: a review. Biochemical Engineering Journal. 20, 99-106 (2004).
- Lim, M. Intelligent bioprocessing for haemotopoietic cell cultures using monitoring and design of experiments. Biotechnol. Adv. 25, 353-368 (2007).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Panoskaltsis, N. The development of a three-dimensional scaffold for ex vivo biomimicry of human acute myeloid leukaemia. Biomaterials. 31, 2243-2251 (2010).
- Mortera-Blanco, T., Mantalaris, A., Bismarck, A., Aqel, N., Panoskaltsis, N. Long-term cytokine-free expansion of cord blood mononuclear cells in three-dimensional scaffolds. Biomaterials. 32, 9263-9270 (2011).
- Safinia, L., Datan, N., Hohse, M., Mantalaris, A., Bismarck, A. Towards a methodology for the effective surface modification of porous polymer scaffolds. Biomaterials. 26, 7537-7547 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены