Method Article
Bewertung der Verfügbarkeit von Mineralien in Fischfuttermitteln mit komplementären Methoden, die am Beispiel von Zink im Atlantischen Lachs demonstriert wurden
In diesem Artikel
Zusammenfassung
Dieser Artikel erläutert ausführlich einen systematischen Ansatz zur Bewertung der Verfügbarkeit von Mikromineralien im Atlantischen Lachs. Die Methodik umfasst Werkzeuge und Modelle mit zunehmender biologischer Komplexität: (1) chemische Artbildungsanalyse, (2) In-vitro-Löslichkeit, (3) Aufnahmestudien in Zelllinien und (4) In-vivo-Fischstudien.
Zusammenfassung
Die Beurteilung der Verfügbarkeit von nahrungsbedingten Mikromineralien ist eine große Herausforderung in der mineralischen Ernährung von Fischarten. Der vorliegende Artikel zielt darauf ab, einen systematischen Ansatz zu beschreiben, der verschiedene Methoden kombiniert, um die Verfügbarkeit von Zink (Zn) im Atlantischen Lachs (Salmo salar )zu bewerten. In Anbetracht der Möglichkeit, dass mehrere chemische Zn-Spezies in einem atlantischen Lachsfutter vorhanden sein können, wurde die Hypothese aufgestellt, dass die Zn-Verfügbarkeit von den im Futter vorhandenen Zn-Chemischen Spezies beeinflusst wird. So geht es in dieser Studie im ersten Protokoll darum, wie die verschiedenen chemischen Zn-Spezies aus dem Futter extrahiert und mit einer Größenausschlusschromatographie-induktiv gekoppelten Plasma-Massenspektroskopie (SEC-ICP-MS) analysiert werden können. Anschließend wurde eine In-vitro-Methode entwickelt, um die Löslichkeit von nahrungsbedingtem Zn in atlantischen Lachsfuttermitteln zu bewerten. Das dritte Protokoll beschreibt die Methode, um den Einfluss der Änderung der chemischen Spezieszusammensetzung von Zn auf die Aufnahme von Zn in einem Fischdarmepithelmodell unter Verwendung einer Regenbogenforellen-Darmzelllinie (RTgutGC) zu untersuchen. Zusammen wurden die Ergebnisse der In-vitro-Methoden mit einer In-vivo-Studie verglichen, in der die offensichtliche Verfügbarkeit von anorganischen und organischen Zn-Quellen untersucht wurde, die mit atlantischen Lachsfuttermitteln ergänzt wurden. Die Ergebnisse zeigten, dass mehrere chemische Zn-Spezies in Futtermitteln gefunden werden können und die Effizienz einer organischen Zn-Quelle sehr stark von dem Aminosäureliganden abhängt, der zum Chelatieren von Zn verwendet wird. Die Ergebnisse der In-vitro-Methoden waren weniger mit dem Ergebnis der In-vivo-Studie zu entsprechen. Nichtsdestotrotz lieferten die in diesem Artikel beschriebenen In-vitro-Protokolle entscheidende Informationen über die Verfügbarkeit von Zn und seine Bewertung in Fischfutter.
Einleitung
Fischmehl und Fischöl wurden traditionell in atlantischen Lachsfuttern verwendet. Diese Inhaltsstoffe werden jedoch zunehmend durch pflanzliche Inhaltsstoffe ersetzt1. Die oben erwähnte Verschiebung der Futterzusammensetzung hat zu einer geringen Verfügbarkeit der Nahrung und einem erhöhten Bedarf an einer Verbesserung der Mineralverfügbarkeit in atlantischen Lachsfuttermitteln, insbesondere Zink (Zn)2, geführt. Die reduzierte Verfügbarkeit kann auf eine Änderung des Zn-Spiegels, der chemischen Zn-Spezies und/oder der in der Futtermatrix vorhandenen Antinährstofffaktoren zurückzuführen sein. In diesem Szenario ist eine neue Reihe von Zusatzstoffen entstanden, die allgemein als "organische Quellen" betrachtet werden und das Potenzial haben, eine bessere verfügbare Quelle für Nahrungsmineralien für Fische zu sein. Daher ist es wichtig, die grundlegende Chemie und Physiologie zu verstehen, die die Verfügbarkeit von Mineralien und ihre Quellen für Fische regeln. Zink ist ein essentielles Spurenelement für alle lebenden Organismen3. Die Rolle von Zn als Signalmolekül wurde sowohl auf parazellulärer als auch auf intrazellulärer Ebene bei Fischen beschrieben4. Beim Atlantischen Lachs wurde Zn-Mangel mit Skelettanomalien und reduzierter Aktivität verschiedener Zn-Metalloenzyme in Verbindung gebracht5,6.
Diese Studie beschreibt einen systematischen Ansatz, um die Verfügbarkeit von Zn zu verstehen, indem sie in vier verschiedene Kompartimente unterschiedlicher chemischer und biologischer Komplexität eingeteilt wird. Die beteiligten Methoden sind in vier Abschnitten beschrieben, wie in Abbildung 1zu sehen ist: (1) Bewertung von Zn-chemischen Spezies in der löslichen Fraktion eines atlantischen Lachsfutters unter Verwendung einer Größenausschlusschromatographie-induktiv gekoppelten Plasma-Massenspektroskopie (SEC-ICP-MS) Methode7; (2) In-vitro-Löslichkeit von ergänzten Zn in Atlantischem Lachsfutter; (3) Bewertung der Aufnahme chemischer Spezies Zn durch in vitro Darmmodell (RTgutGC)8; und (4) offensichtliche Verfügbarkeit von Zn in Atlantischem Lachs (Salmo salar)9. Ähnliche Protokolle können für andere Mineralien (z. B. Mangan, Selen, Kupfer) entwickelt werden, die für Aquakulturfischarten von ernährungsphysiologischem Interesse sind.
Protokoll
Der Fütterungsversuch in Abschnitt 4 wurde gemäß norwegischer (FOR-2015-06 - 18-761) und europäischer Gesetzgebung (Richtlinie 2010/63/EU) durchgeführt.
1. Bewertung von Zn-Chemischen Spezies in der löslichen Fraktion eines atlantischen Lachsfutters mit einer SEC-ICP-MS-Methode
- Extraktionspuffer (100 mM Tris-HCl, pH 8,5)
- Bereiten Sie den Extraktionspuffer vor, indem Sie eine angemessene Menge Tris(hydroxymethyl)aminomethan auflösen, um die gewünschte Ionenstärke (100 mM) in hochreinemH2Ozu erreichen.
- Stellen Sie den pH-Wert der Lösung mit HCl-Lösung auf pH 8,5 ein und überwachen Sie die pH-Änderung mit einem pH-Messgerät.
- Vorbereitung von Futterproben
HINWEIS: Die verwendete Futterprobe wurde auf der Grundlage von kommerziellem Futter für Atlantischen Lachs formuliert, das Proteinquellen hauptsächlich aus pflanzlichen Inhaltsstoffen enthält (d. H. Ca. 5% Fischprotein, 10% Fischöl, 68% pflanzliches Protein und 12% pflanzliches Öl). Zinksulfat wurde dem Futter zugegänkt.- Mahlen Sie die Futterprobe von Hand mit einem Stößel und einem Mörser.
- Sieben Sie die Futterprobe, um sicherzustellen, dass die Extraktion in einer Futterfraktion mit ähnlicher Partikelgröße (von 850 μm bis 1,12 mm) durchgeführt wird.
- Fahren Sie mit der Zn-Extraktion fort.
- Zinkextraktion aus einer Futterprobe
- Wiegen Sie ca. 0,5 g Futter in dreifacher Ausfertigung in 15 mL konische Röhrchen.
- Fügen Sie den Extraktionspuffer (5 ml 100 mM Tris-HCl, pH 8,5) zu den Proben hinzu.
- Extrahieren Sie die Proben in einem Rotator (20 U/ min) bei 4 °C für 24 h.
- Trennen Sie die löslichen und nicht löslichen Fraktionen durch Zentrifugation für 10 min bei 3000 x g.
- Verwenden Sie einen 0,45 μm Einwegspritzenfilter, um die lösliche Fraktion zu filtern.
- Die gefilterten Proben in saubere Röhrchen überführen.
- Führen Sie die Zn-Speziationsanalyse in den löslichen Fraktionen mit SEC-ICP-MS durch, wie in Schritt 1.6 beschrieben.
HINWEIS: Eine Zusammenfassung des Verfahrens zur Zn-Extraktion aus einer Futterprobe ist in Abbildung 2beschrieben.
- Mobile Phasenlösung (50 mM Tris-HCl + 3% MeOH, pH 7,5)
- Die mobile Phasenlösung löst 6,057 g Tris(hydroxymethyl)aminomethan in 1 L 3%iger MeOH-Lösung (v/v).
- Stellen Sie den pH-Wert der Lösung auf pH auf 7,5 mit HCl-Lösung ein und überwachen Sie die pH-Änderung mit einem pH-Messgerät.
- Filtern Sie die mobile Phasenlösung durch einen 0,45 μm Membranfilter.
- Molekulargewichtskalibrierung des SEC-Säulentrennbereichs
- Kalibrieren Sie den Trennbereich durch eine Molekulargewichtskalibrierung.
HINWEIS: In dieser Studie wurden Thyreoglobulin (660 kDa), Zn/Cu-Superoxiddismutase (32 kDa), Myoglobin (17 kDa) und Vitamin B12 (1,36 kDa) verwendet. - Bereiten Sie jeden der Standards mit einer bekannten Konzentration in hochreinemH2Ovor.
- Bereiten Sie eine Hochleistungsflüssigkeitschromatographie (HPLC) Durchstechflasche vor, indem Sie 250 μL Standard in eine Durchstechflasche geben.
- Laden Sie die Fläschchen mit Standards in den Sequenzlauf der Proben.
- Führen Sie die Molekulargewichtskalibrierung zu Beginn und am Ende der Analysesequenz durch und überwachen Sie 127I (Thyreoglobulin), 66Zn (Zn / Cu-Superoxiddismutase), 57Fe (Myoglobin) und 59Co (Vitamin B12).
HINWEIS: Die Molekulargewichtskalibrierung wird gleichzeitig mit der Zn-Speziationsanalyse durchgeführt.
- Kalibrieren Sie den Trennbereich durch eine Molekulargewichtskalibrierung.
- Zink-Speziationsanalyse mit SEC-ICP-MS
HINWEIS: Die Zn-Speziationsanalyse nach der SEC-ICP-MS-Methode wurde auf der Grundlage der an anderer Stelle beschriebenen Prinzipien10,11 entwickelt und für die Analyse eines atlantischen Lachsfutters7weiter optimiert.- Führen Sie die Zn-Speziationsanalyse an den löslichen Fraktionen durch, indem Sie eine SEC-Säule (Size Exclusion Chromatography) und eine HPLC in Verbindung mit induktiv gekoppelter Plasmamassenspektroskopie (ICP-MS) verwenden.
- Bereiten Sie eine HPLC-Durchstechflasche vor, indem Sie 250 μL lösliche Fraktion zu einer Durchstechflasche hinzufügen.
- Vor der Analyse alle Proben mit 0,5 μL Vitamin B12 aufspießen. Dieser Schritt ermöglicht es, Verweilzeitenverschiebungen zu korrigieren und 59Co. zu überwachen.
- Die lösliche Fraktion mit Extraktionspuffer (100 mM Tris-HCl, pH 8,5) verdünnen und auf ein Endvolumen von 1 ml einstellen.
- Bereiten Sie den Sequenzlauf der Stichproben in zufälliger Reihenfolge vor.
- Stimmen Sie den ICP-MS gemäß den Anweisungen des Herstellers ab.
- Befolgen Sie die Geräteeinstellungen für HPLC und ICP-MS, um die Zn-Speziationsanalyse durchzuführen (siehe Tabelle 1).
2. In-vitro-Löslichkeit von ergänzten Zn in atlantischem Lachsfutter
HINWEIS: Die verwendete Futterprobe wurde auf der Grundlage von kommerziellem Futter für Atlantischen Lachs formuliert, das Proteinquellen hauptsächlich aus pflanzlichen Zutaten enthält (d. H. Ca. 5% Fischmehl, 10% Fischöl, 68% pflanzliche Zutaten und 12% Pflanzenöl).
- Die Futterproben des Atlantischen Lachses für 10 s bei 3000 U/min mit einer Messermühle mahlen und bis zur weiteren Analyse bei 4 °C lagern.
- Wiegen Sie ~ 0,2 g der in Schritt 2.1 gemahlenen Futterproben und fügen Sie Zn-Radiotracer(65Zn) mit bekannter spezifischer Aktivität in ein Probenröhrchen mit 5 ml Volumen (mit einer Kappe) hinzu.
ACHTUNG: Dieses Verfahren muss in einer Radionuklidsuite durchgeführt werden. Die Person, die diesen Schritt durchführt, sollte für den Umgang mit Radioisotopen geschult und zertifiziert sein. Die von der Strahlenschutzverwaltung des Instituts empfohlenen Sicherheits- und Vorsichtsmaßnahmen sind strikt zu beachten. - Bereiten Sie dann die Süßwasser-Darm-Luminalpufferlösung wie unten beschrieben vor.
- Für Salzlösung A werden 11,65 gNaNO3, 0,55 g KNO3 und 0,4 g MgSO4gewogen. Die Salze in hochreinemH2O auflösen und auf ein Endvolumen von 60 ml einstellen.
- Für Salzlösung B 0,31 g Ca(NO3)2· 4 H2O.Die Salze in hochreinemH2O auflösen und auf ein Endvolumen von 10 ml einstellen.
- Verwenden Sie 500 mM HEPES-Stammlösung als Salzlösung C.
- Für Salzlösung D 1,2 gMgCl2 wiegen,das Salz in hochreinemH2O auflösen und auf ein Endvolumen von 20 ml einstellen.
- Für Salzlösung E 0,9 gMgSO4 wiegen,das Salz in hochreinemH2O auflösen und auf ein Endvolumen von 20 ml einstellen.
- Pyruvatlösung durch Lösen von 0,55 gCH3COCOONa in 10 ml hochreinemH2Ovorbereiten.
- 0,9 g Galactose (C6H12O6) werden in hochreinemH2Ogelöst.
- Mit einem Magnetrührer gut auflösen und Salzlösungen A, B, D und E durch Autoklavieren sowie Lösung C, Pyruvat und Galactose durch Filtration durch einen 200 μm Spritzenfilter sterilisieren.
- Nach der Herstellung der verschiedenen Stammlösungen, um 100 ml Arbeitslösung des Puffers zu erhalten, mischen Sie die oben hergestellten Lösungen in folgendem Verhältnis: 6,8 ml Salzlösung A, 4,14 ml B, 5 ml C, 2,5 ml D, 1,5 ml E und jeweils 1,14 ml Pyruvat und Galactose. Machen Sie das Volumen mit entionisiertem Wasser auf 100 ml.
HINWEIS: Der obige Puffer stellt nun die ionische Zusammensetzung des Darmlumens dar, das in Süßwassersmosiden gefunden wird.
- Bereiten Sie sechs weitere Aliquoten des in Schritt 2.6 beschriebenen Puffers vor und fügen Sie eine der folgenden Aminosäuren (Cystein, Methionin, Glycin, Histidin, Lysin und Arginin) hinzu, um eine endgültige Molkonzentration von 5 mM zu erreichen.
- Der Süßwasser-Darm-Luminalpuffer (Reaktionsvolumen = 3 mL; pH 7,4) wird der Futterprobe zugefügen.
- Wiederholen Sie Schritt 2.5 mit den in 2.4 beschriebenen Puffern (in Gegenwart verschiedener Aminosäuren bei einer Konzentration von 5 mM).
- Schließen Sie die Rohre und lassen Sie sie in einem Drehspinner für 30 min bei 25 U / min drehen.
- Trennen Sie die löslichen und unlöslichen Fraktionen durch Zentrifugal für 10 min bei 1157 x g.
- Verwenden Sie einen Gamma-Kassierer, um die Anzahl pro Minute (cpm) von 65Zn in den löslichen und nicht löslichen Fraktionen zu messen.
- Berechnen Sie den Anteil der Radioisotope von Zn (65Zn), die in den löslichen und nicht löslichen Fraktionen vorhanden sind.
3. Bewertung der Aufnahme chemischer Zn-Spezies mit einem In-vitro-Darmmodell (RTgutGC)
- RTgutGC-Zellkultur
HINWEIS: Alle in diesem Schritt verwendeten Arbeitsmaterialien sollten steril sein.- Beleben Sie die gefrorenen RTgutGC-Zellen sanft in einem bei 20 °C eingestellten Wasserbad.
- Pipetten Sie die Lösung, die die Zellen enthält, vorsichtig aus und suspendieren Sie sie in 10 ml L15-Medium mit 10% fetalem Rinderserum (FBS).
HINWEIS: 10% FBS wird nur zur Wiederbelebung der gefrorenen Zellen verwendet. Für die anschließende Passage wird FBS zu 5% verwendet. Die Zusammensetzung von FBS kann zwischen den Chargen variieren, daher ist es ratsam, so viel wie nötig von einer einzigen Charge zu kaufen und zu lagern, um Variationen zwischen den Chargen in der Serumzusammensetzung zu vermeiden. - Die Zellsuspension in 75 cm2 Zellkulturkolben geben und in einem bei 19 °C eingestellten Inkubator unter normaler Atmosphäre inkubieren.
- Überprüfen Sie die Zellen und teilen Sie die Zellen bei Konfluenz (80% Konfluenz, beurteilen Sie visuell, indem Sie die Dichte der Zelloberfläche unter einem Mikroskop untersuchen), teilen Sie die Zellen in neue Kolben (nachfolgende Passage) oder ernten Sie sie, um sie in Experimenten zu verwenden.
HINWEIS: Ein Beispiel für die RTgutGC-Zellen 1 h und 1 Woche nach der Aussaat in die Zellkulturkolben ist in Abbildung 3 dargestellt.
- Zellernte und Vorbereitung auf Expositionsexperimente
- Waschen Sie die Zellen zweimal mit 1 ml Ethylendiamintetraessigsäure (EDTA) Lösung. Nach jeder Wäsche saugen Sie die EDTA-Lösung mit einem sterilen Saugrohr ab.
- Behandeln Sie die Zellen mit Trypsin (0,7 ml Trypsin, in 0,25% in phosphatgepufferter Kochsalzlösung [PBS]).
- Drehen Sie den Kolben vorsichtig in spitzen Winkeln, um das Trypsin entlang der gesamten Oberfläche des Kolbens zu verteilen.
- Setzen Sie die Rotation für 2 Minuten fort, während sich die Zellen lösen.
- Nach 2 min vorsichtigem Drehen 10 ml L15/FBS-Medium hinzufügen, um Trypsin zu neutralisieren.
- Dekantieren Sie die resultierende Zellsuspension mit einer sterilen Pipette und Zentrifuge für 3 min bei 130 x gin ein konisches Bodenzentrifugenröhrchen.
- Bestimmen Sie die Dichte der geernteten Zellen durch manuelles Zählen mit Hämozytometer.
- Fügen Sie das erforderliche Volumen von L15 / FBS-Medium hinzu, um eine Zelldichte von 5 x 104 Zellen / ml zu erreichen.
- Säen Sie die Zellen auf 24-Well-Platten, indem Sie 1 ml Zellsuspension pro Vertiefung pipettieren, um die endgültige Zelldichte von 5 x 104 Zellen / Well zu erreichen.
HINWEIS: Verwenden Sie vorzugsweise Multi-Dispensing-Pipetten, um Variationen zu minimieren und die Zeit zu verkürzen. - Legen Sie die ausgesäten Platten vor den Experimenten 48 h lang in einen Inkubator unter normaler Atmosphäre bei 19 °C.
HINWEIS: Trypsin bei -20 °C zu lagern; EDTA-Lösung und L15/FBS-Medien bei 4 °C. Stellen Sie die Temperatur aller Arbeitslösungen und Medien kurz vor Gebrauch auf 19 °C ein.
- Aufbereitung von Belichtungsmedien
HINWEIS: Dieser Schritt muss unter dem Abzug unter aseptischen und sterilen Bedingungen durchgeführt werden.- L15/ex werden durch Mischen von 6,8 ml Salzlösung A (Schritt 2.3.1), 1,14 ml B (Schritt 2.3.2), 5 ml C (Schritt 2.3.3) und je 1,14 ml Pyruvat (Schritt 2.3.6) und Galactose (Schritt 2.3.7) zubereitet. Machen Sie das Volumen mit sterilem destilliertem Wasser in Zellkulturqualität auf 100 ml auf.
- FW wird durch Mischen von 6,8 ml Salzlösung A (2.3.1), 4,14 ml B (2.3.2), 5 ml C (2.3.3), 2,5 ml D (2.3.4), 1,5 ml E (2.3.5) und jeweils 1,14 ml Pyruvat (2.3.6) und Galactose (2.3.7) zubereitet. Machen Sie das Volumen mit sterilem, zellkulturiertem destilliertem Wasser auf 100 ml auf.
- Quantifizierung der Ionenkonzentrationen in den Expositionsmedien mit ICP-MS, wie an anderer Stelle beschrieben12.
HINWEIS: Die in den Medienpräparaten analysierten Ionenkonzentrationen sind in Tabelle 2 dargestellt.
- Zink(65Zn) Influx Assays
- Säen Sie die RTgutGC-Zellen auf 24-Well-Platten (5 x10 4 Zellen/Well) in vollständigem L15/FBS-Medium.
- 48 h in einem Inkubator mit normaler Atmosphäre bei 19 °C inkubieren.
- Alle experimentellen Medienpräparate werden mit 0,5 M NaOH in Gegenwart oder Abwesenheit von L-Methionin (L-Met) oder DL-Methionin (DL-Met) bei einer Konzentration von 2 mM auf pH 7,4 eingestellt.
HINWEIS: Die in 3.4.3 beschriebene pH-Einstellung der Puffer muss vor der Behandlung der Zellen in Schritt 3.4.5 frisch erfolgen. - Nach Abschluss der Inkubationszeit das Medium aus den Vertiefungen entfernen und gründlich mit PBS abspülen.
- Fügen Sie das pH-eingestellte FW-Experimentiermedium hinzu und lassen Sie es 20 Minuten lang akklimatisieren.
- Setzen Sie die RTgutGC-Zellen in den in Schritt 3.4.3 beschriebenen Medien Nominalkonzentrationen von 3,07, 6,14, 12,27 und24,55 μM 65Zn(II) (als ZnCl 2; ~4 kBq/ml) aus.
- Unmittelbar danach die Zellen im Inkubator für 15 min bei 19 °C aufbewahren.
- Nachdem die 15-minütige Inkubation beendet ist, saugen Sie den Kulturüberstand an und entfernen Sie ihn aus dem Brunnen.
- Spülen Sie die Zellen mit eiskaltem FW-Medium (mit 200 μM Zn, pH 7,4) und löschen Sie dann durch Zugabe des 5 mM Ethylenglykol-bis(β-aminoethylether)-N,N,N',N'-Tetraessigsäure (EGTA)-Puffers (pH 7,4) für 5 min, um adsorbierte 65Zn(II) loszuwerden.
- Setzen Sie die Zellen den oben genannten Medienpräparaten in Gegenwart oder Abwesenheit von 10 mM 2-Aminobicyclo [2.2.1] Heptan-2-carbonsäure (BCH), einem Aminosäuretransportinhibitor, aus.
- Wiederholen Sie nach der Expositionszeit von 15 minuten die Schritte 3.4.8 und 3.4.9.
- Die RtgutGC-Zellen werden als Monoschicht am Boden der Vertiefungen haften. Verdauen Sie die Zellen mit 0,2% heißem Natriumdodecylsulfat (SDS) Reinigungsmittel (100 μL / Well).
HINWEIS: Die SDS-Lösung muss vor gebrauchen 1 h in einem auf 90 °C eingestellten Wasserbad platziert werden. - Saugen Sie den Zellferment ab und gewinnen Sie es in ein 1,5 ml Röhrchen zurück.
- Messen Sie die Radioaktivität der Zellverdauungen mit einem Gammazähler.
HINWEIS: Die Zählungen pro Minute (cpm) müssen für radioaktiven Zerfall und Hintergrundaktivität korrigiert werden und werden spezifischen Aktivitätsberechnungen nach den von Glover und Hogstrand13beschriebenen Formeln unterzogen. - Um die Proteinkonzentration der Zellen zu quantifizieren, homogenisieren Sie die Zellen mit 500 μL von 0,5 M NaOH.
- Verwenden Sie ein Bradford-Assay-Kit, um die Proteinkonzentration in der Zellprobe zu messen, wobei Rinderserumalbumin (BSA) als Standard verwendet wird.
HINWEIS: Sobald die Proteinkonzentration quantifiziert ist, kann die Zn-Aufnahmerate durch RTgutGC-Zellen als Pmolen Zn min-1 mg-1 Protein exprimiert werden.
4. Scheinbare Verfügbarkeit von nahrungsfreiem Zn im Atlantischen Lachs (Salmo salar)
HINWEIS: Die atlantischen Lachsfuttermittel wurden auf der Grundlage kommerzieller Futtermittel formuliert, die Proteinquellen hauptsächlich aus pflanzlichen Zutaten enthalten (d. H. Ca. 5% Fischprotein, 10% Fischöl, 68% pflanzliches Protein und 12% Pflanzenöl). Zwei Futtermittel wurden mit einer anorganischen Quelle (Zn-Sulfat) oder einer organischen Quelle (Zn-Glycinchelat) ergänzt, um eine Zn-Konzentration von 150 mg/kg Futter zu erreichen. Zusätzlich wurde dem Futter Yttriumoxid (Feed Grade) mit 0,01% als inerter Marker zugesetzt, um die Berechnung des scheinbaren Verfügbarkeitskoeffizienten zu ermöglichen.
- Akklimatisieren Sie den Atlantischen Lachs (SalmoBreed-Stamm, Alter 1+ Jahre, gemischtgeschlechtliche Gruppen) in ihren jeweiligen Becken, bis die Fische an die Experimentellenbedingungen gewöhnt sind.
- Beurteilen Sie die Akklimatisierung des Atlantischen Lachses, indem Sie ihre tägliche Futteraufnahme überwachen.
HINWEIS: Dieser Versuch wurde in dreifachen Tanks durchgeführt, so dass insgesamt sechs Panzer verwendet wurden. Während des Fütterungsversuchs betrug die Wassertemperatur 11,9 ± 0,3 °C und die Sättigung des gelösten Sauerstoffs betrug 101 ± 5%. - Füttern Sie die Fische 11 Tage lang mit experimentellen Fütterungen.
- Euthanisieren Sie die Fische durch Überdosierung mit 6 ml Tricainmethansulfonat-Stammlösung pro Liter Wasser.
- Sammeln Sie eine gepoolte Kotprobe aus dem Fisch aus demselben Becken in eine Platte, indem Sie von der Bauchflosse zum Anus streifen.
- Entfernen Sie den Kot von der Platte mit einem Spatel in ein 50 ml konisches Röhrchen und lagern Sie die Proben sofort bei -20 °C.
HINWEIS: Die Proben wurden bis zur weiteren Analyse bei -20 °C gehalten. - Gefriertrocknung der Kotproben für 72 h bei -80 °C.
- Homogenisieren Sie die Kotprobe manuell zu einem feinen Pulver mit einem Stößel und Mörser.
- Bestimmen Sie die Konzentration von Zn und Yttrium in den Futter- und Kotproben mit einem ICP-MS (wie an anderer Stelle beschrieben9).
- Bestimmen Sie den Koeffizienten für die scheinbare Verfügbarkeit (AAC, %) mit der folgenden Formel:

Ergebnisse
Bewertung chemischer Zn-Spezies in der löslichen Fraktion eines atlantischen Lachsfutters mit einer SEC-ICP-MS-Methode
Die SEC-ICP-MS-Methode liefert Daten über die chemische Spezies Zn, die in der löslichen Fraktion des atlantischen Lachsfutters gefunden werden. Abbildung 4 zeigt das chromatographische Profil von Zn in der löslichen Fraktion. Dieses Chromatogramm wurde mit der SEC-ICP-MS-Methode erhalten. Fünf Zn-haltige Peaks wurden in den löslichen Fraktionen des atlantischen Lachsfutters gefunden. Jeder Peak hat ein anderes Molekulargewicht; Peak eins (~ 600 kDa), Peak zwei und Peak drei (von 32 bis 17 kDa), Peak Four (von 17 bis 1,36 kDa) und Peak Five (> 1,36 kDa). Peak four war der häufigste, gefolgt von Peak zwei, drei, fünf und eins. Die Zn-Chemikalienart, die in der löslichen Fraktion gefunden wird, kann unterschiedliche Quellen haben, da das verwendete Futter sowohl marine als auch pflanzliche Inhaltsstoffe und eine ergänzte Form (d. H. Zn-Sulfat) enthält. Der Molekulargewichtsbereich der chemischen Spezies Zn deutete darauf hin, dass diese Verbindungen Metalloproteine sein könnten.
In-vitro-Löslichkeit von ergänzten Zn in atlantischem Lachsfutter
Die Löslichkeit von ergänzten 65Zn erhöhte sich in Gegenwart von Aminosäuren. Alle getesteten Aminosäuren erhöhten die Löslichkeit von ergänzten 65Zn. Methionin, Glycin, Cystein, Histidin und Lysin verbesserten die Löslichkeit von 65Zn; eine höhere Löslichkeit wurde mit Histidin und Lysin gefunden (Abbildung 5).
Bewertung der Aufnahme von Zn-Spezies mit einem In-vitro-Darmmodell (RTgutGC)
Die apikale Zinkaufnahme in RTgutGC-Zellen wurde signifikant durch das Vorhandensein von L-Met oder DL-Met bei Konzentrationen von 2 mM beeinflusst. Darüber hinaus wurde der Einfluss von Methionin auf die Zn-Aufnahme in RTgutGC-Zellen durch das Vorhandensein von BCH (einem Blocker des Aminosäuretransportsystems) im Vergleich zu Zellen, die nicht mit BCH behandelt wurden, negativ beeinflusst (Abbildung 6).
Offensichtliche Verfügbarkeit von nahrungsfreiem Zn im Atlantischen Lachs (Salmo salar)
In praktischen Futtermitteln für Atlantischen Lachs war die scheinbare Zn-Verfügbarkeit die gleiche, wenn sie mit einer anorganischen Quelle (Zn-Sulfat) oder einer organischen Quelle (Zn-Glycinchelat) ergänzt wurde. Die geschätzten Werte für die scheinbare Verfügbarkeit von Zn (%, n = 3) im Atlantischen Lachs betrugen 31% ± 12% bei der Ergänzung mit einer anorganischen Quelle (Zn-Sulfat) und 31% ± 3% bei der Ergänzung einer organischen Quelle (Zn-Glycinchelat).
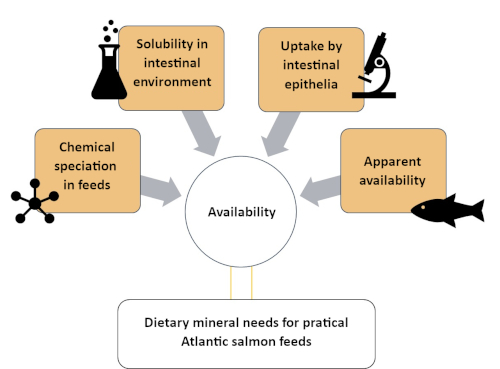
Abbildung 1: Zusammenfassung des systematischen Ansatzes zur Bewertung der Mineralverfügbarkeit mit komplementären Methoden. Dieser Ansatz wurde verwendet, um die Zinkverfügbarkeit bei atlantischem Lachs zu untersuchen, einschließlich Zn-Artbildung, Zn-Löslichkeit im Darm, Zn-Aufnahme durch Darmzellen und Zn-scheinbare Verfügbarkeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
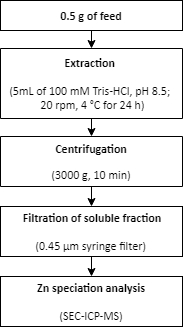
Abbildung 2: Zusammenfassung des Verfahrens zur Zn-Extraktion aus einer Futterprobe. Zink wird unter milden Extraktionsbedingungen aus einer Futterprobe extrahiert. Auf die Extraktion folgt die Zn-Speziationsanalyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
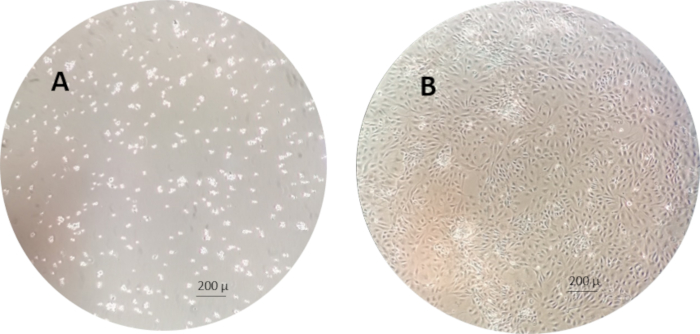
Abbildung 3: Ein Beispiel der RTgutGC-Zellen 1 h (links) und 1 Woche (rechts) nach der Aussaat in den Zellkulturkolben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
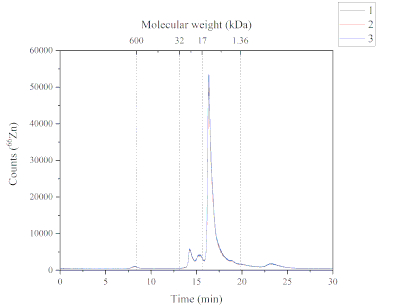
Abbildung 4: Ein Chromatogramm, das die Zn-haltigen Peaks aus der löslichen Fraktion des atlantischen Lachsfutters zeigt und mit SEC-ICP-MS analysiert. Die drei Replikate zeichnen sich durch die blauen, roten und schwarzen Linien aus. Eine Molekulargewichtskalibrierung wurde mit Thyreoglobulin (660 kDa, Überwachung 127I), Zn/Cu-Superoxiddismutase (32 kDa, Überwachung 66Zn), Myoglobin (17 kDa, Überwachung 57Fe), Vitamin B12 (1,36 kDa, Überwachung 59Co) durchgeführt; Peak 1 (P1): ~600 kDa, Retentionszeit (RT) 8,2 min; Peak 2+3 (P2+3): von 32 bis 17 kDa, RT 14,2 + 15,3 min; Peak 4 (P4): von 17 bis 1,36 kDa, RT 16,3 min; Peak 5 (P5): > 1,36 kDa, Rt 23,2 min. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
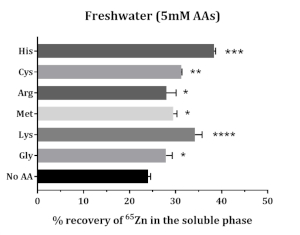
Abbildung 5: Der Einfluss von Aminosäuren auf die In-vitro-Löslichkeit von ergänzten Zn in atlantischem Lachsfutter. Die Daten werden als Mittelwert ± SD (n = 3) dargestellt. Die Daten wurden durch Einweg-ANOVA analysiert, gefolgt von Dunnets Mehrfachvergleichstest, bei dem der Mittelwert jeder AA-Gruppe mit dem der Kontrollgruppe (No AA) verglichen wurde. Die Sternchen bezeichnen die Signifikanz von ANOVA (P-Werte < 0,05 (*), < 0,01 (**), < 0,001 (***) und < 0,0001 (****)). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
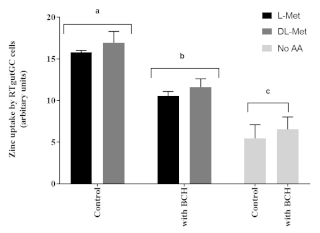
Abbildung 6: Der Einfluss von Methionin und einem Aminosäuretransportinhibitor (2-Aminobicyclo[2.2.1]heptan-2-carbonsäure, BCH, 10 mM). Die Daten werden als Mittelwert ± SD (n = 3) dargestellt. Die Daten wurden durch Zwei-Wege-ANOVA analysiert, gefolgt von Tukeys Mehrfachvergleichstest mit p < 0,05 Signifikanzniveau. Post-hoc-Unterschiede zwischen Gruppen werden als hochgestellter Buchstabe über den Balken dargestellt; Balken mit unterschiedlichen hochgestellten Zeichen sind statistisch unterschiedlich (s. < 0,05). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| HPLC-Einstellungen | |
| Spalte | SEC-Spalte (30 cm x 7,8 mm, 5 μm Partikelgröße) + Schutzsäule (7 μm Partikelgröße) |
| Kalibrierbereich | 1,0 × 104 - 5,0 × 105 Da |
| Mobile Phase | 50 mM Tris-HCl + 3% MeOH (pH 7,5) |
| Durchfluss | 0,7 ml min−1 |
| Injektionsvolumen | 50 μL |
| ICP–MS-Einstellungen | |
| Vorwärtsleistung | 1550 W |
| Plasmagasstrom | 15,0 l min−1 |
| Trägergasstrom | 0,86 l min−1 |
| Make-up-Gasfluss | 0,34 l min−1 |
| Verweildauer | 0,1 s pro Isotop |
| Überwachte Isotope | 127 I, 66Zn, 59Co, 57Fe |
Tabelle 1. Eine Übersicht über die Geräteeinstellungen für HPLC und ICP-MS.
| Chemische Zusammensetzung (mM) | L15/ex | Versuchsmedium (L15/FW) |
| Natriumnitrat | 155 | 155 |
| Kaliumnitrat | 6.2 | 6.2 |
| Magnesiumsulfat | 3.8 | 19.5 |
| Calciumnitrat | 1.5 | 5.4 |
| HEPES | 5 | 5 |
| Magnesiumchlorid | - | 15 |
| Natriumpyruvat | 5.7 | 5.7 |
| Galaktose | 5.7 | 5.7 |
| Ph | 7.1 | 7.4 |
| Ionenstärke | 178 | 258 |
| Ionische Zusammensetzung (mM) | ||
| Calcium, Ca2+ * | 1,6 ± 0,1 | 5,3 ± 0,2 |
| Magnesium, Mg2+ * | 3,9 ± 0,3 | 32,5 ± 0,7 |
| Kalium, K+ * | 8.2 ± 1.2 | 8.6 ± 1.1 |
| Natrium, Na+ * | 160 ± 3 | 157 ± 2 |
| Nitrat, NO3- ** | 164 | 172.4 |
| Sulfat, SO4- ** | 3.8 | 18.7 |
| Chlorid, Cl- ** | 1.5 | 31.5 |
Tabelle 2. Die chemische und ionische Zusammensetzung der getesteten Experimentellen Medien.
Diskussion
Die intestinale Absorption von Zn scheint durch die chemische Form der Zn-Spezies beeinflusst zu werden13. In diesem Zusammenhang ermöglichte die Verwendung der in diesem Artikel beschriebenen Protokolle die sequentielle Untersuchung der chemischen und biologischen Aspekte, die der "Verfügbarkeit" von Zn im Atlantischen Lachs zugrunde liegen.
Diese Studie berichtete über die Verwendung einer Zn-Speziationsanalysemethode. Die SEC-ICP-MS-Methode lieferte qualitative Daten über das Molekulargewicht der chemischen Zn-Spezies, die in der löslichen Fraktion eines atlantischen Lachsfutters vorhanden sind. Dies wurde durch den Vergleich der Retentionszeiten der Molekulargewichtskalibrierungsstandards (d.h. Thyreoglobulin (660 kDa), Zn/Cu-Superoxiddismutase (32 kDa), Myoglobin (17 kDa) und Vitamin B12 (1,36 kDa)) mit den Retentionszeiten von Zn-haltigen Peaks erreicht. Eine Herausforderung bei der Zn-Speziationsanalyse war die Identifizierung der unbekannten chemischen Zn-Spezies aufgrund fehlender analytischer Standards. In SEC basiert die Trennung der Moleküle auf ihrer Größe relativ zu den Poren in der stationären Phase. Im Prinzip werden größere Moleküle schneller reisen und zuerst eluieren, und kleinere Moleküle werden langsamer reisen und später14 eluieren. Folglich kann jedes Zn, das peak enthält, mehrere Verbindungen mit ähnlichem Molekulargewichtenthalten 15. Dies trägt auch zur Herausforderung bei, unbekannte chemische Zn-Spezies zu identifizieren. Darüber hinaus wurden mehrere milde Extraktionsbedingungen für die Extraktion von Zn getestet. Der extrahierte Zn war niedrig (~10%). Es wurden milde Extraktionsbedingungen angewendet, um die chemische Spezies Zn intakt zu halten, aber dies könnte die Extraktionseffizienz beeinträchtigt haben7.
Im In-vitro-Löslichkeitstest zeigte die Löslichkeit von ergänzten Zn (als Radioisotop 65ZnCl2),dass die Aminosäuren, insbesondere Histidin und Lysin, die Löslichkeit von Zn erhöhten (Abbildung 5). Die direkte Verwendung von Futterproben für In-vitro-Löslichkeitstests unter simulierten gastrointestinalen Bedingungen basiert auf dem Wissen, dass die Veränderung der Zn-Artbildung pH-abhängigist 16. Saure Bedingungen am Anfang des GI-Traktes können jedoch zu einer Veränderung der Artbildung führen, die irreversibel sein kann (z. B. ZnO-> ZnCl2in Gegenwart von HCl unter sauren Bedingungen im Magen). Dennoch ist die hier verwendete Zn-Quelle ZnSO4 und deren Löslichkeit durch Aminosäuren im Medium verbessert wurde. Die nächste Frage, die beantwortet werden musste, war, kann die erhöhte Löslichkeit in Verfügbarkeit übersetzt werden? Die RTgutGC-Darmzelllinie wurde verwendet, um diese Frage zu untersuchen. Im Zusammenhang mit der mineralischen Ernährung bei Tieren ist der Begriff "Verfügbarkeit" schwer zu definieren und kann in den Zellen (in vitro) im Vergleich zu einem Tier (in vivo) unterschiedlich reguliert werden. Daher wurde der Begriff "Aufnahme" verwendet, wenn es um die In-vitro-Bewertung mit Darmzelllinie ging. Die Zelllinie lieferte nützliche Informationen über die Zn-Aufnahmemechanismen am Darmepithel, die Teil des komplexen Regulationsprozesses sind, der die Verfügbarkeit von Mineralien bei Tieren steuert. Die RTgutGC-Zellen lösten eine bessere Kapazität für die apikale Aufnahme von Zn in Gegenwart einer Aminosäure (d.h. Methionin; Abbildung 6). Die scheinbare Verfügbarkeit in vivo unterschied sich jedoch nicht signifikant zwischen anorganischen und organischen Zn-Quellen beim Atlantischen Lachs. In der In-vivo-Verfügbarkeitsstudie wurde der Zn-Quellenvergleich bei diätetischen Zn-Werten durchgeführt, die weit über den bekannten Zn-Anforderungen von Atlantischem Lachs17, Gesamt-Zn-Konzentration von 150 mg / kg Futter, weit überstiegen. Die Unterschiede in der Verfügbarkeit werden besser visualisiert, wenn die getesteten Ernährungsmengen in den linearen Dynamikbereich fallen, bevor das Tier die Sättigung erreicht. In der vorliegenden In-vivo-Studie ist es möglich, dass die Atlantischen Lachse gut gesättigt waren, um einen Unterschied in der Zn-Absorption zwischen den verwendeten Quellen zu beobachten.
Zusammenfassend lieferte die erste Methode qualitative Informationen über verschiedene chemische Zn-Spezies, die in der löslichen Fraktion eines atlantischen Lachsfutters gefunden wurden; die zweite Methode, die In-vitro-Löslichkeit von ergänzten Zn, wurde in Gegenwart von Aminosäureliganden verbessert; die dritte Methode bestätigte, dass eine verbesserte Löslichkeit durch Aminosäuren die Aufnahme im Darmepithel verbessern kann; Umgekehrt konnte die vierte Methode keine Unterschiede in der Verfügbarkeit von Zn von anorganischen oder organischen Quellen zu Atlantischem Lachs feststellen. Zusammenfassend lässt sich sagen, dass die In-vitro-Protokolle, obwohl sie nicht mit den In-vivo-Befunden übereinstimmen, interessante Einblicke in das Verständnis der verschiedenen Komponenten der Zn-Verfügbarkeit lieferten.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeiten wurden im Rahmen des vom norwegischen Forschungsrat finanzierten Projekts APREMIA (Apparent availability and requirement of minerals in Atlantic salmon, grant no. 244490) durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Sartorius | ||
| 0.45 μm membrane filter | Pall | ||
| 10 % fetal bovine serum | Eurobio | ||
| 1282 Compugamma Laboratory Gamma Counter | LKB Wallac | ||
| 24 well plates (Falcon, TPP microplates) | Thermo Fisher Scientific | 10048760 | |
| 2-aminobicyclo(2.2.1)heptane-2-carboxylic acid | Sigma Aldrich | A7902 | |
| 75 cm2 cell culture flasks (Falcon, TPP tissue culture flasks) | TPP Techno Plastic Products AG | 90075 | |
| L-Arginine | Sigma Aldrich | A5006 | |
| Bradford assay kit | Bio-Rad | 5000001 | |
| Centrifuge | Eppendorf Centrifuge 5702 | ||
| L-Cysteine | Sigma Aldrich | 30089 | |
| DL-methionine | Alfa Aesar | 59-51-8 | |
| D-methionine | Sigma Aldrich | M9375 | |
| Experimental fish feeds | Skretting | ||
| Glycine | Sigma Aldrich | 410225 | |
| Guard column, TSKgel SWxl Type (7 μm particle size) | Tosoh | ||
| L-Histidine | Sigma Aldrich | 53319 | |
| HPLC coupled with a 7500ce ICP-MS | Agilent Technologies | ||
| Hydrochloric acid | Emsure ACS, ISO, 37% w/w, Merck | 1.00317 | |
| Knife mill | GM 300, Retsch Gmbh | ||
| L-15 medium | Invitrogen/Gibco | 21083027 | |
| L-methionine | Sigma Aldrich | M9625 | |
| L-Lysine | Sigma Aldrich | 23128 | |
| Methanol | LiChrosolv, HPLC grade, Merck | 1.06035 | |
| Milli-Q water (18.2 MΩ cm) | EMD Millipore Corporation | ||
| Myoglobin | Sigma Aldrich | M1882 | |
| NexION 350D ICP-MS | Perkin Elmer | ||
| Pasteur pipette | VWR | ||
| pH meter | inoLab | ||
| Phosphate-buffered saline (PBS) | Sigma Aldrich | 806552 | |
| RTgutGC cells | Obtained in kind from Professor Dr. Kristin Schirmer, Dept. of Environmental Toxicology, Eawag, Swiss Federal Institute of Aquatic Science and Technology, Switzerland | ||
| SEC column, TSKgel G3000SWxl | Tosoh | ||
| Sieve stainless steel (850?μm - 1.12?mm) | Retsch | ||
| Sodium dodecyl sulphate (SDS) | Sigma Aldrich | 436143 | |
| Superoxide dismutase | Sigma Aldrich | S7571 | |
| Thyroglobulin | Sigma Aldrich | T1001 | |
| Tricaine methanesulphonate | PharmaQ | ||
| Tris(hydroxymethyl)aminomethane | Sigma Aldrich | 252859 | |
| Trypsin in 0.25% in phosphate-buffer saline | Biowest | L0910 | |
| Versene EDTA solution | Invitrogen/Gibco | 15040-033 | |
| Vitamin B12 | Sigma Aldrich | V2876 | |
| Zinc chelate of glycine | Phytobiotics | ||
| Zinc sulphate | Vilomix |
Referenzen
- Ytrestoyl, T., Aas, T. S., Asgard, T. Utilisation of feed resources in production of Atlantic salmon (Salmo salar) in Norway. Aquaculture. 448, 365-374 (2015).
- Prabhu, P. A. J., et al. Evaluating dietary supply of microminerals as a premix in a complete plant ingredient-based diet to juvenile rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition. 24 (1), 539-547 (2018).
- Maret, W. Zinc biochemistry: from a single zinc enzyme to a key element of life. Advances in nutrition. 4 (1), 82-91 (2013).
- Hogstrand, C., Wood, C. M., Farrell, A. P., Brauner, C. J. . Fish Physiology. 31, 135-200 (2011).
- Baeverfjord, G., et al. Mineral nutrition and bone health in salmonids. Reviews in Aquaculture. , (2018).
- Maage, A., Julshamn, K. Assessment of zinc status in juvenile Atlantic salmon (Salmo salar) by measurement of whole body and tissue levels of zinc. Aquaculture. 117 (1), 179-191 (1993).
- Silva, M. S., Sele, V., Sloth, J. J., Araujo, P., Amlund, H. Speciation of zinc in fish feed by size exclusion chromatography coupled to inductively coupled plasma mass spectrometry – Using fractional factorial design for method optimization and mild extraction conditions. Journal of Chromatography B. , (2018).
- Prabhu, A. J., et al. Zinc uptake in fish intestinal epithelial model RTgutGC: Impact of media ion composition and methionine chelation. Journal of Trace Elements in Medicine and Biology. 50, 377-383 (2018).
- Silva, M. S., et al. Apparent availability of zinc, selenium and manganese as inorganic metal salts or organic forms in plant-based diets for Atlantic salmon (Salmo salar). Aquaculture. 503, 562-570 (2019).
- Persson, D. P., Hansen, T. H., Laursen, K. H., Schjoerring, J. K., Husted, S. Simultaneous iron, zinc, sulfur and phosphorus speciation analysis of barley grain tissues using SEC-ICP-MS and IP-ICP-MS. Metallomics. 1 (5), 418-426 (2009).
- Lothian, A., Roberts, B. R. Standards for Quantitative Metalloproteomic Analysis Using Size Exclusion ICP-MS. Journal of Visualized Experiments. (110), (2016).
- Minghetti, M., Schirmer, K. Effect of media composition on bioavailability and toxicity of silver and silver nanoparticles in fish intestinal cells (RTgutGC). Nanotoxicology. 10 (10), 1526-1534 (2016).
- Glover, C. N., Hogstrand, C. Amino acid modulation of in vivo intestinal zinc absorption in freshwater rainbow trout. Journal of Experimental Biology. 205 (1), 151-158 (2002).
- Ekman, R., Ekman, R. . Mass spectrometry: Instrumentation, interpretation, and applications. Wiley Series on Mass Spectrometry. , 105-115 (2009).
- Hong, P., Koza, S., Bouvier, E. S. P. A Review Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and Their Aggregates. Journal of Liquid Chromatography & Related Technologies. 35 (20), 2923-2950 (2012).
- Krezel, A., Maret, W. The biological inorganic chemistry of zinc ions. Archives of Biochemistry and Biophysics. 611, 3-19 (2016).
- National Research Council. . Nutrient Requirements of Fish and Shrimp. , (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten