Method Article
Оценка минеральной доступности в кормах для рыб с использованием дополнительных методов, продемонстрированная на примере цинка в атлантическом лососе
В этой статье
Резюме
В данной статье подробно объясняется системный подход к оценке наличия микроминеральности у атлантического лосося. Методология включает в себя инструменты и модели с возрастающей биологической сложностью: (1) химический анализ видообразования, (2) растворимость in vitro, (3) исследования поглощения в клеточных линиях и (4) исследования in vivo рыб.
Аннотация
Оценка доступности диетических микроминералов является серьезной проблемой в минеральном питании видов рыб. Целью настоящей статьи является описание системного подхода, сочетающего различные методологии оценки доступности цинка (Zn) в атлантическом лососе(Salmo salar). Учитывая, что несколько химических видов Zn могут присутствовать в корме атлантического лосося, было выдвинуто предположение, что доступность Zn зависит от химических веществ Zn, присутствующих в корме. Таким образом, в данном исследовании первый протокол касается того, как извлечь различные химические виды Zn из корма и проанализировать их методом масс-спектроскопии плазмы с индуктивно-индуктивно связанной плазменной (SEC-ICP-MS) с помощью исключения размеров. Впоследствии был разработан метод in vitro для оценки растворимости диетического Zn в кормах атлантического лосося. Третий протокол описывает метод изучения влияния изменения химического видового состава Zn на поглощение Zn в модели эпителия кишечника рыбы с использованием клеточной линии кишечника радужной форели (RTgutGC). Вместе результаты методов in vitro сравнивались с исследованием in vivo, изучающим очевидную доступность неорганических и органических источников Zn, добавляемых в корма атлантического лосося. Результаты показали, что в кормах можно найти несколько химических видов Zn, и эффективность органического источника Zn очень сильно зависит от аминокислотного лиганда, используемого для хелатного Zn. Результаты методов in vitro имели меньшую корреляцию с результатом исследования in vivo. Тем не менее, протоколы in vitro, описанные в этой статье, предоставили важную информацию о наличии Zn и его оценке в кормах для рыб.
Введение
Рыбная мука и рыбий жир традиционно использовались в кормах для атлантического лосося. Однако эти ингредиенты все чаще заменяются растительными ингредиентами1. Вышеупомянутый сдвиг в составе кормов привел к низкой диетической доступности и увеличению потребности в улучшении минеральной доступности в кормах для атлантического лосося, особенно цинка (Zn)2. Снижение доступности может быть результатом изменения уровня Zn, химических веществ Zn и/или антипитательных факторов, присутствующих в матрице корма. В этом сценарии появился новый набор добавок, которые в целом считаются «органическими источниками», которые могут стать более доступным источником диетических минералов для рыбы. Поэтому важно понимать фундаментальную химию и физиологию, регулирующие доступность минералов и их источников для рыб. Цинк является важным микроэлементом для всех живых организмов3. Роль Zn как сигнальной молекулы была описана как на параклеточном, так и на внутриклеточном уровне у рыб4. У атлантического лосося дефицит Zn был связан со скелетными аномалиями и снижением активности различных металлоферментовZn 5,6.
Это исследование описывает систематический подход к пониманию доступности Zn путем его классификации на четыре различных отдела различной химической и биологической сложности. Используемые методы описаны в четырех разделах, как видно на фиг.1: (1)оценка химических веществ Zn в растворимой фракции корма атлантического лосося с использованием размерно-исключающей хроматографии с индуктивно связанной плазменной масс-спектроскопией (SEC-ICP-MS) метод7; (2) растворимость in vitro дополненного Zn в корме для атлантического лосося; (3) оценка поглощения химических веществ Zn кишечной моделью in vitro (RTgutGC)8; и (4) очевидная доступность Zn в атлантическом лососе(Salmo salar)9. Аналогичные протоколы могут быть разработаны для других минералов (например, марганца, селена, меди), представляющих питательный интерес для видов рыб аквакультуры.
протокол
Испытание кормления в разделе 4 проводилось в соответствии с норвежским (FOR-2015-06 - 18-761) и европейским законодательством (Директива 2010/63/EU).
1. Оценка химических веществ Zn в растворимой фракции корма атлантического лосося методом SEC-ICP-MS
- Экстракционный буфер (100 мМ Tris-HCl, pH 8,5)
- Готовят экстракционный буфер путем растворения соответствующего количества трис(гидроксиметил)аминометана для достижения желаемой ионной силы (100 мМ) в сверхчистомH2O.
- Отрегулируйте pH раствора до pH 8,5 с раствором HCl, контролируя изменение pH с помощью pH-метра.
- Подготовка образцов кормов
ПРИМЕЧАНИЕ: Использованный образец корма был составлен на основе коммерческих кормов для атлантического лосося, содержащих источники белка в основном из растительных ингредиентов (т.е. приблизительно 5% рыбьего белка, 10% рыбьего жира, 68% растительного белка и 12% растительного масла). Сульфат цинка добавляли в корм.- Измельчите образец корма вручную с помощью пестиков и ступки.
- Просеиваем образец корма, чтобы гарантировать, что экстракция выполняется в кормовой фракции с аналогичным размером частиц (от 850 мкм до 1,12 мм).
- Приступайте к извлечению Zn.
- Извлечение цинка из образца корма
- Взвесите приблизительно 0,5 г корма в трехместных пробирках по 15 мл.
- Добавьте к образцам буфер экстракции (5 мл 100 мМ Tris-HCl, рН 8,5).
- Извлекайте образцы в ротаторе (20 об/мин) при 4 °C в течение 24 ч.
- Отделяют растворимые и нерастворимые фракции центрифугированием в течение 10 мин при 3000 х г.
- Используйте одноразовый шприцевой фильтр 0,45 мкм для фильтрации растворимой фракции.
- Перенесите отфильтрованные образцы в чистые пробирки.
- Выполните анализ видообразования Zn в растворимых фракциях с использованием SEC-ICP-MS, как описано в шаге 1.6.
ПРИМЕЧАНИЕ: Краткое описание процедуры извлечения Zn из образца корма описано на рисунке 2.
- Раствор подвижной фазы (50 мМ Tris-HCl + 3% MeOH, рН 7,5)
- Готовят раствор подвижной фазы, растворяя 6,057 г трис(гидроксиметил)аминометана в 1 л 3% раствора MeOH (v/v).
- Отрегулируйте pH раствора до pH до 7,5 с помощью раствора HCl, контролируя изменение pH с помощью рН-метра.
- Фильтруйте раствор подвижной фазы через мембранный фильтр 0,45 мкм.
- Калибровка молекулярной массы диапазона разделения колонн SEC
- Откалибруйку диапазона разделения, выполнив калибровку молекулярной массы.
ПРИМЕЧАНИЕ: В данном исследовании использовались тиреоглобулин (660 кДа), супероксиддисмутаза Zn/Cu (32 кДа), миоглобин (17 кДа) и витамин B12 (1,36 кДа). - Готовят каждый из эталонов с известной концентрацией в сверхчистомH2O.
- Приготовьте флакон с высокоэффективной жидкостной хроматографией (ВЭЖХ), добавив во флакон 250 мкл стандартного образца.
- Загрузите флаконы со стандартами для последовательного выполнения образцов.
- Выполните калибровку молекулярной массы в начале и в конце аналитической последовательности, контролируя 127I (тиреоглобулин), 66Zn (супероксиддисмутаза Zn / Cu), 57 Fe (миоглобин) и 59Co (витамин B12).
ПРИМЕЧАНИЕ: Калибровка молекулярной массы выполняется одновременно с анализом видообразования Zn.
- Откалибруйку диапазона разделения, выполнив калибровку молекулярной массы.
- Анализ видообразования цинка с использованием SEC-ICP-MS
ПРИМЕЧАНИЕ: Анализ видообразования Zn методом SEC-ICP-MS был разработан на основе принципов, описанных в других разделах10,11, и дальнейшая оптимизация была выполнена для анализа корма для атлантического лосося7.- Выполните анализ видообразования Zn на растворимых фракциях с помощью колонки исключающей хроматографии (SEC) и ВЭЖХ в сочетании с масс-спектроскопией плазмы с индуктивно связанной (ICP-MS).
- Приготовьте флакон вэжх, добавив во флакон 250 мкл растворимой фракции.
- Перед анализом дополняйте все образцы 0,5 мкл витамина B12. Этот шаг позволяет корректировать время удержания сдвигов, контролируя 59Co.
- Разбавить растворимую фракцию экстракционным буфером (100 мМ Tris-HCl, рН 8,5) и довести до конечного объема 1 мл.
- Подготовьте последовательный запуск образцов в случайном порядке.
- Настройте ICP-MS в соответствии с инструкциями производителя.
- Следуйте настройкам приборов для ВЭЖХ и ICP-MS, выполняющих анализ видообразования Zn (см. таблицу 1).
2. Растворимость in vitro дополненного Zn в корме для атлантического лосося
ПРИМЕЧАНИЕ: Использованный образец корма был составлен на основе коммерческих кормов для атлантического лосося, содержащих источники белка в основном из растительных ингредиентов (т.е. приблизительно 5% рыбной муки, 10% рыбьего жира, 68% растительных ингредиентов и 12% растительного масла).
- Измельчите образцы корма для атлантического лосося в течение 10 с при 3000 об/мин с помощью ножевой мельницы и храните при 4 °C до дальнейшего анализа.
- Взвесьте ~0,2 г образцов подачи, измельченных на этапе 2.1, и добавьте радиоинследователь Zn(65Zn) известной удельной активности в пробочку объемом 5 мл (с колпачком).
ВНИМАНИЕ: Эта процедура должна выполняться внутри радионуклидного набора. Человек, выполняющий этот шаг, должен быть обучен и сертифицирован для работы с радиоизотопами. Необходимо строго соблюдать меры безопасности и предосторожности, рекомендованные администрацией радиационной безопасности института. - Затем готовят пресноводный кишечный просветный буферный раствор, как описано ниже.
- Для солевого раствора А взвесьте 11,65 г NaNO3,0,55 г KNO3 и 0,4 г MgSO4. Растворите соли в сверхчистомH2O и отрегулируйте до конечного объема 60 мл.
- Для солевого раствора B взвесьте 0,31 г Ca(NO3)2· 4 4 H2O. Растворите соли в сверхчистомH2O и отрегулируйте до конечного объема 10 мл.
- Используйте 500 мМ раствора HEPES в качестве раствора соли C.
- Для солевого раствора D взвесьте 1,2 гMgCl2,растворите соль в сверхчистомH2O и отрегулируйте до конечного объема 20 мл.
- Для солевого раствора Е взвесьте 0,9 г MgSO4,растворите соль в сверхчистомH2O и отрегулируйте до конечного объема 20 мл.
- Готовят раствор пирувата, растворяя 0,55 г CH3COCOONa в 10 мл сверхчистогоH2O.
- Растворить 0,9 г галактозы(С6Н12О6)в сверхчистомН2О.
- Хорошо растворяют с помощью магнитной мешалки и стерилизуют растворы солей A, B, D и E путем автоклавирования, а раствор С, пируват и галактозу фильтрацией через шприцевой фильтр 200 мкм.
- После приготовления различных бульонных растворов, чтобы приготовить 100 мл рабочего раствора буфера, смешать вышеуказанные приготовленные растворы в следующей пропорции: 6,8 мл солевого раствора А, 4,14 мл В, 5 мл С, 2,5 мл D, 1,5 мл Е и 1,14 мл пирувата и галактозы. Внесите объем до 100 мл с помощью деионизированной воды.
ПРИМЕЧАНИЕ: Приведенный выше буфер теперь будет представлять ионный состав кишечного просвета, обнаруженного у пресноводных лососевых.
- Подготовьте шесть других аликвот буфера, описанного на этапе 2.6, и добавьте одну из следующих аминокислот (цистеин, метионин, глицин, гистидин, лизин и аргинин) для достижения конечной молярной концентрации 5 мМ.
- Добавьте к образцу корма просветный буфер пресной воды кишечника (реакционный объем = 3 мл; рН 7,4).
- Повторите этап 2.5 с буферами, описанными в 2.4 (в присутствии различных аминокислот в концентрации 5 мМ).
- Закройте трубки и дайте им вращаться во вращательном спиннере в течение 30 минут при 25 оборотах в минуту.
- Отделяйте растворимые и нерастворимые фракции центрифугированием в течение 10 мин при 1157 х г.
- Используйте гамма-кассер для измерения количества в минуту (cpm) 65Zn в растворимых и нерастворимых фракциях.
- Рассчитайте долю радиоизотопов Zn(65Zn), присутствующих в растворимых и нерастворимых фракциях.
3. Оценка поглощения химических веществ Zn с использованием кишечной модели in vitro (RTgutGC)
- Культура клеток RTgutGC
ПРИМЕЧАНИЕ: Все рабочие материалы, используемые на этом этапе, должны быть стерильными.- Осторожно оживите замороженные клетки RTgutGC на водяной бане при температуре 20 °C.
- Аккуратно вылейте в пипетку раствор, содержащий клетки, и суспендируйте их в 10 мл среды L15, содержащей 10% фетальной бытовой сыворотки (FBS).
ПРИМЕЧАНИЕ: 10% FBS используется только для восстановления замороженных клеток. Для последующего прохождения используется FBS на уровне 5%. Состав ФБС может варьироваться между партиями, поэтому желательно покупать и запасать столько, сколько требуется из одной партии, чтобы избежать межсерийных вариаций в составе сыворотки. - Добавьте клеточную суспензию в колбы для 75см2 культуры клеток и инкубируют в инкубаторе, установленном при 19 °C при нормальной атмосфере.
- Проверяют клетки и при слиянии (80% слияние, оценивают визуально, исследуя плотность клеточной поверхности под микроскопом), расщепляют клетки на новые колбы (последующее прохождение) или собирают урожай для использования в экспериментах.
ПРИМЕЧАНИЕ: Пример клеток RTgutGC через 1 ч и 1 неделю после посева в колбы для культивирования клеток показан на фиг.3.
- Сбор клеток и подготовка к экспериментам по воздействию
- Дважды промыть клетки раствором этилендиаминтетрауксусной кислоты (ЭДТА) 1 мл. После каждой промывки выкачивайте раствор ЭДТА с помощью стерильной всасываемой трубки.
- Обработайте клетки трипсином (0,7 мл трипсина, в 0,25% в фосфатно-буферном физиологическом растворе [PBS]).
- Осторожно поверните колбу под острыми углами, чтобы распределить трипсин по всей поверхности колбы.
- Продолжайте вращение в течение 2 мин, пока клетки отсоеся.
- После осторожного вращения в течение 2 мин добавьте 10 мл среды L15/FBS для нейтрализации трипсина.
- Декантированную клеточную суспензию в коническую нижнюю центрифужную трубку с помощью стерильной пипетки и центрифуги в течение 3 мин при 130 х г.
- Определить плотность собранных клеток можно методом ручного подсчета с помощью гемоцитометра.
- Добавьте необходимый объем среды L15/FBS для достижения плотности ячейки 5 x 104 ячеек/мл.
- Засеять клетки на пластины из 24 скважин путем пипетирования 1 мл клеточной суспензии на скважину для достижения конечной плотности клеток 5 х 104 ячейки / скважина.
ПРИМЕЧАНИЕ: Предпочтительно использовать мультираздаточные пипетки, чтобы свести к минимуму вариации и сократить время. - Поместите семенные пластины в инкубатор при нормальной атмосфере при 19 °C в течение 48 ч перед экспериментами.
ПРИМЕЧАНИЕ: Трипсин хранить при -20 °C; Раствор ЭДТА и среда L15/FBS при 4 °C. Отрегулируйте температуру всех рабочих растворов и сред до 19 °C непосредственно перед использованием.
- Подготовка экспозиционной среды
ПРИМЕЧАНИЕ: Этот шаг должен быть выполнен под вытяжным капотом в асептических и стерильных условиях.- Готовят L15/ex путем смешивания 6,8 мл солевого раствора А (этап 2.3.1), 1,14 мл В (этап 2.3.2), 5 мл С (этап 2.3.3) и 1,14 мл пирувата (этап 2.3.6) и галактозы (этап 2.3.7). Внесите объем до 100 мл с помощью дистиллированной воды класса стерильной клеточной культуры.
- Готовят FW путем смешивания 6,8 мл солевого раствора A (2.3.1), 4,14 мл B (2.3.2), 5 мл C (2.3.3), 2,5 мл D (2.3.4), 1,5 мл E (2.3.5) и 1,14 мл пирувата (2.3.6) и галактозы (2.3.7). Внесите объем до 100 мл с помощью стерильной дистиллированной воды клеточной культуры.
- Количественная оценка концентраций ионов в средах воздействия с использованием МСП-МС, как описано в другом месте12.
ПРИМЕЧАНИЕ: Анализируемые концентрации ионных веществ в препаратах сред представлены в таблице 2.
- Анализы притока цинка(65Zn)
- Высевают ячейки RTgutGC на пластины из 24 скважин (5 x 104 ячейки/лунка) в полную среду L15/FBS.
- Инкубировать в течение 48 ч в инкубаторе с нормальной атмосферой при 19 °C.
- Довести все экспериментальные препараты среды до рН 7,4 с использованием 0,5 М NaOH в присутствии или отсутствии L-метионина (L-Met) или DL-метионина (DL-Met) при концентрации 2 мМ.
ПРИМЕЧАНИЕ: Регулировка рН буферов, описанная в разделе 3.4.3, должна быть выполнена заново перед обработкой клеток на этапе 3.4.5. - После завершения инкубационного периода удалите среду из колодцев и тщательно промойте ПБС.
- Добавьте экспериментальную жиму FW с поправкой на pH и дайте акклиматизироваться в течение 20 мин.
- Подвергайте клетки RTgutGC воздействию номинальных концентраций 3,07, 6,14, 12,27 и 24,55 мкМ 65Zn(II) (как ZnCl2;~4 кБк/мл) в средах, описанных на этапе 3.4.3.
- Сразу после этого держите клетки в инкубаторе при 19 °C в течение 15 минут.
- После того, как 15-минутная инкубация закончится, аспирируют супернатант культуры и удаляют из лунки.
- Промыть клетки ледяной холодной средой FW (с 200 мкМ Zn, рН 7,4), а затем закалить, добавив 5 мМ этиленгликоля-бис(β-аминоэтиловый эфир)-N,N,N',N',N'-тетрауксусной кислоты (EGTA) буфер (рН 7,4) в течение 5 мин, чтобы избавиться от любых адсорбированных 65Zn(II).
- Подвергают клетки воздействию вышеуказанных сред препаратов в присутствии или отсутствии 10 мМ 2-Аминобицикло [2.2.1]гептан-2-карбоновой кислоты (БКГ), ингибитора транспорта аминокислот.
- После периода воздействия 15 мин повторите шаги 3.4.8 и 3.4.9.
- Ячейки RtgutGC будут прилипать к дну скважин в виде монослоя. Переваривайте клетки, используя 0,2% горячее моющее средство додецилсульфата натрия (SDS) (100 мкл / хорошо).
ПРИМЕЧАНИЕ: Перед использованием раствор SDS необходимо поместить на 1 ч в водяную баню, установленную на 90 °C. - Аспирировать и восстановить клеточный дигестат в пробирку объемом 1,5 мл.
- Измерьте радиоактивность клеточных перевариваемых с помощью гамма-счетчика.
ПРИМЕЧАНИЕ: Количество в минуту (cpm) должно быть скорректировано на радиоактивный распад, фоновую активность и подвергнуто расчетам конкретной активности в соответствии с формулами, описанными Гловером и Хогстрандом13. - Чтобы количественно оценить концентрацию белка в клетках, гомогенизируйте клетки с 500 мкл 0,5 M NaOH.
- Используйте набор для анализа Брэдфорда для измерения концентрации белка в образце клетки, с бытовым сывороточным альбумином (BSA) в качестве стандарта.
ПРИМЕЧАНИЕ: Как только концентрация белка количественно определена, скорость поглощения Zn клетками RTgutGC может быть выражена в виде пмоле Zn мин-1 мг-1 белка.
4. Кажущаяся доступность диетического Zn в атлантическом лососе(Salmo salar)
ПРИМЕЧАНИЕ: Корма для атлантического лосося были разработаны на основе коммерческих кормов, содержащих источники белка в основном из растительных ингредиентов (т.е. примерно 5% рыбьего белка, 10% рыбьего жира, 68% растительного белка и 12% растительного масла). Два корма были дополнены неорганическим источником (сульфат Zn) или органическим источником (хелат Zn глицина) для достижения концентрации Zn 150 мг/кг корма. Кроме того, оксид иттрия (кормовой сорт) добавляли в корм под 0,01% в качестве инертного маркера, чтобы можно было рассчитать коэффициент кажущейся доступности.
- Акклиматизируйте атлантического лосося (штамм SalmoBreed, возраст 1+ лет, смешанные половые группы) в соответствующих аквариумах до тех пор, пока рыба не будет использована в экспериментальных условиях.
- Оцените акклиматацию атлантического лосося, контролируя его ежедневное потребление корма.
ПРИМЕЧАНИЕ: Это испытание проводилось в тройных танках, таким образом, было использовано в общей сложности шесть танков. Во время испытания кормления температура воды составляла 11,9 ± 0,3 °C, а насыщение растворенным кислородом составляло 101 ± 5%. - Кормите рыб экспериментальными кормами в течение 11 дней.
- Усыпить рыбу путем передозировки, используя 6 мл раствора трикаина метансульфоната на литр воды.
- Соберите объединенный образец кала рыбы из того же аквариума в тарелку, перемещая от вентрального плавника к анусу.
- Удалите кал из пластины шпателем в коническую трубку 50 мл и немедленно храните образцы при -20 °C.
ПРИМЕЧАНИЕ: Образцы хранились при -20 °C до дальнейшего анализа. - Сублимационная сушка образцов кала в течение 72 ч при -80 °C.
- Вручную гомогенизируйте образец кала в мелкий порошок с использованием пестиков и ступки.
- Определить концентрацию Zn и иттрия в образцах кормов и фекалий с помощью ICP-MS (как описано в другом месте9).
- Определите коэффициент кажущейся доступности (AAC, %) по следующей формуле:

Результаты
Оценка химических веществ Zn в растворимой фракции корма атлантического лосося с использованием метода SEC-ICP-MS
Метод SEC-ICP-MS предоставляет данные о химических видах Zn, обнаруженных в растворимой фракции корма атлантического лосося. На фиг.4 показан хроматографический профиль Zn, обнаруженный в растворимой фракции. Эта хроматограмма была получена с использованием метода SEC-ICP-MS. Пять Zn-содержащих пиков были обнаружены в растворимых фракциях корма атлантического лосося. Каждый пик имеет различную молекулярную массу; пик один (~ 600 кДа), пик два и пик третий (от 32 до 17 кДа), пик четыре (от 17 до 1,36 кДа) и пик пять (> 1,36 кДа). Пик четыре был самым обильным, за ним следовали пик два, три, пять и один соответственно. Химические вещества Zn, обнаруженные в растворимой фракции, могут иметь различные источники, поскольку используемый корм содержит как морские, так и растительные ингредиенты, а также дополненную форму (т.е. сульфат Zn). Диапазон молекулярной массы химических видов Zn предполагает, что эти соединения могут быть металлопротеинами.
Растворимость in vitro дополненного Zn в кормах для атлантического лосося
Растворимость добавляемых 65Zn повышается в присутствии аминокислот. Все испытуемые аминокислоты повышали растворимость добавляемых 65Zn. Метионин, глицин, цистеин, гистидин и лизин улучшали растворимость на 65Zn; более высокая растворимость была обнаружена при гистидине и лизине(рисунок 5).
Оценка поглощения видов Zn с использованием кишечной модели in vitro (RTgutGC)
На апикальный захват цинка в клетках RTgutGC значительно влияло присутствие L-Met или DL-Met в концентрациях 2 мМ. Кроме того, влияние метионина на поглощение Zn в клетках RTgutGC отрицательно влияло присутствие BCH (блокатора транспортной системы аминокислот) по сравнению с клетками, необработанными BCH(рисунок 6).
Очевидная доступность диетического Zn в атлантическом лососе(Salmo salar)
В практических кормах для атлантического лосося очевидная доступность Zn была одинаковой при приеме добавок с неорганическим источником (сульфат Zn) или органическим источником (хелат Zn глицина). Оценочные значения кажущейся доступности Zn (%, n = 3) у атлантического лосося составили 31% ± 12% при приеме добавок с неорганическим источником (сульфат Zn) и 31% ± 3% при дополнении органического источника (хелат Zn глицина).
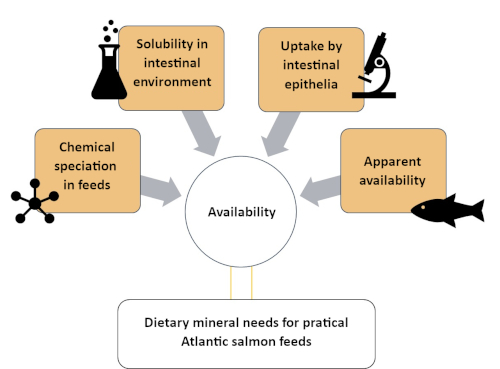
Рисунок 1:Краткое изложение системного подхода к оценке минеральной доступности с использованием дополнительных методов. Этот подход был использован для изучения доступности цинка в атлантическом лососе, включая видообразование Zn, растворимость Zn в кишечной среде, поглощение Zn кишечными клетками и кажущуюся доступность Zn. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
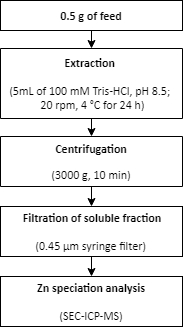
Рисунок 2:Краткое изложение процедуры извлечения Zn из образца корма. Цинк извлекается из образца корма с использованием мягких условий экстракции. За извлечением следует анализ видообразования Zn. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
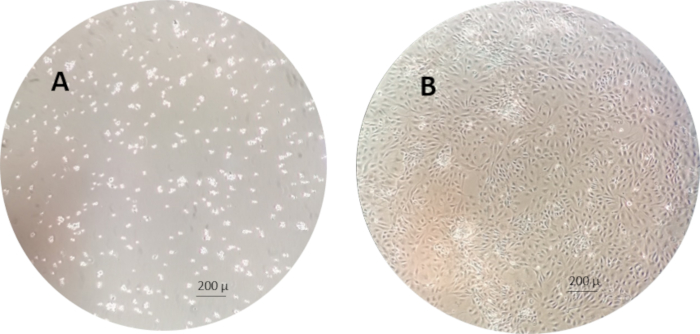
Рисунок 3:Пример клеток RTgutGC через 1 ч (слева) и 1 неделю (справа) после посева в колбы для культуры клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
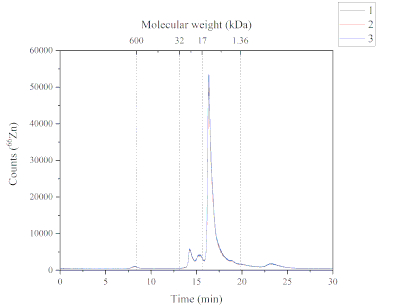
Рисунок 4:Хроматограмма, показывающая Zn-содержащие пики из растворимой фракции корма атлантического лосося и проанализированная SEC-ICP-MS. Три реплики характеризуются синей, красной и черной линиями. Калибровку молекулярной массы проводили с использованием тиреоглобулина (660 кДа, мониторинг 127I), супероксиддисмутазы Zn/Cu (32 кДа, мониторинг 66Zn), миоглобина (17 кДа, мониторинг 57Fe), витамина B12 (1,36 кДа, мониторинг 59Co); Пик 1 (P1): ~600 кДа, время удержания (RT) 8,2 мин; Пик 2+3 (P2+3): от 32 до 17 кДа, RT 14,2 + 15,3 мин; Пик 4 (P4): от 17 до 1,36 кДа, RT 16,3 мин; Пик 5 (P5): > 1,36 кДа, Rt 23,2 мин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
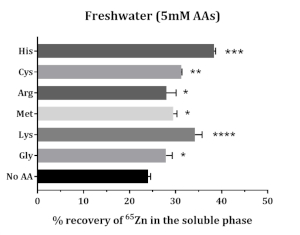
Рисунок 5:Влияние аминокислот на растворимость in vitro добавляемого Zn в кормах атлантического лосося. Данные представлены в виде среднего ± УР (n = 3). Данные были проанализированы с помощью односторонней ANOVA, за которой последовал тест на множественное сравнение Даннета, сравнивающий среднее значение каждой группы АА с контрольной группой (без АА). Звездочками обозначен уровень значимости ANOVA (P-значения < 0,05 (*), < 0,01 (**), < 0,001 (***) и < 0,0001 (****)). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
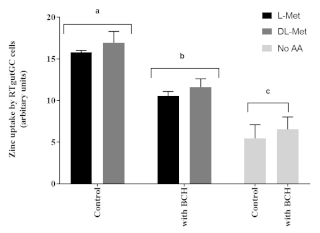
Рисунок 6:Влияние метионина и ингибитора транспорта аминокислот (2-Аминобицикло [2.2.1]гептан-2-карбоновой кислоты, BCH, 10 мМ). Данные представлены в виде среднего ± УР (n = 3). Данные были проанализированы с помощью двустороннего ANOVA, за которым последовал тест туки с множественным сравнением с уровнем значимости p < 0,05. Пост-специальные различия между группами представлены в виде надстрочного индекса над полосами; бары с разными надстрочными индексами статистически различны (p < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Настройки ВЭЖХ | |
| Столбец | Колонка SEC (30 см x 7,8 мм, размер частиц 5 мкм) + защитная колонна (размер частиц 7 мкм) |
| Диапазон калибровки | 1.0 × 104 - 5.0 × 105 да |
| Мобильная фаза | 50 мМ Tris-HCl + 3% MeOH (рН 7,5) |
| Расход | 0,7 мл мин−1 |
| Объем впрыска | 50 мкл |
| Параметры ICP–MS | |
| Мощность вперед | 1550 Вт |
| Поток плазменных газов | 15.0 л мин−1 |
| Расход газа-носителя | 0,86 л мин−1 |
| Поток подпитывного газа | 0,34 л мин−1 |
| Время пребывания | 0,1 с на изотоп |
| Мониторинг изотопов | 127 г. I, 66Zn, 59Co, 57Fe |
Таблица 1. Обзор настроек приборов для ВЭЖХ и МСП-МС.
| Химический состав (мМ) | L15/ex | Экспериментальная среда (L15/FW) |
| Нитрат натрия | 155 | 155 |
| Нитрат калия | 6.2 | 6.2 |
| Магния сульфат | 3.8 | 19.5 |
| Нитрат кальция | 1.5 | 5.4 |
| ХЕПЕС | 5 | 5 |
| Магния хлорид | - | 15 |
| Пируват натрия | 5.7 | 5.7 |
| Галактоза | 5.7 | 5.7 |
| рН | 7.1 | 7.4 |
| Ионная сила | 178 | 258 |
| Ионный состав (мММ) | ||
| Кальций, Ca2+ * | 1.6 ± 0.1 | 5.3 ± 0.2 |
| Магний, Мг2+ * | 3.9 ± 0.3 | 32.5 ± 0.7 |
| Калий, К+ * | 8.2 ± 1.2 | 8.6 ± 1.1 |
| Натрий, Na+ * | 160 ± 3 | 157 ± 2 |
| Нитрат, NO3- ** | 164 | 172.4 |
| Сульфат, SO4- ** | 3.8 | 18.7 |
| Хлорид, Cl- ** | 1.5 | 31.5 |
Таблица 2. Химический и ионный состав экспериментальной среды проверен.
Обсуждение
На кишечное всасывание Zn, по-видимому, влияет химическая форма вида Zn13. В связи с этим использование протоколов, описанных в данной статье, позволило последовательно изучать химические и биологические аспекты, лежащие в основе «доступности» Zn в атлантическом лососе.
В этом исследовании сообщалось об использовании метода анализа видообразования Zn. Метод SEC-ICP-MS предоставил качественные данные о молекулярной массе химических веществ Zn, присутствующих в растворимой фракции корма атлантического лосося. Это было достигнуто путем сравнения времени удержания калибровочных эталонов молекулярной массы (т.е. тиреоглобулина (660 кДа), супероксиддисмутазы Zn/Cu (32 кДа), миоглобина (17 кДа) и витамина B12 (1,36 кДа)) со временем удержания Zn, содержащего пики. Проблемой, обнаруженной в анализе видообразования Zn, была идентификация неизвестных химических видов Zn из-за отсутствия аналитических стандартов. В SEC разделение молекул основано на их размерах относительно пор в стационарной фазе. В принципе, более крупные молекулы будут путешествовать быстрее, элюируя первыми, а меньшие молекулы будут путешествовать медленнее, элюируя позже14. Следовательно, каждый Zn, содержащий пик, может содержать несколько соединений с аналогичной молекулярной массой15. Это также способствует проблеме идентификации неизвестных химических видов Zn. Кроме того, для извлечения Zn было протестировано несколько мягких условий экстракции. Извлеченный Zn был низким (~10%). Мягкие условия экстракции были применены для сохранения химических веществ Zn нетронутыми, но это, возможно, поставило под угрозу эффективность экстракции7.
В анализе растворимости in vitro растворимость дополненного Zn (в виде радиоизотопа 65ZnCl2)показала, что аминокислоты, особенно гистидин и лизин, увеличивают растворимость Zn(рисунок 5). Использование образцов корма непосредственно для анализа растворимости in vitro в смоделированных желудочно-кишечных условиях основано на знании того, что изменение видообразования Zn зависит от рН16. Однако кислые условия в начале желудочно-кишечного тракта могут привести к некоторому изменению видообразования, которое может быть необратимым (например, ZnO-> ZnCl2,в присутствии HCl в кислых условиях в желудке). Тем не менее, источником Zn, используемым здесь, являетсяZnSO 4, растворимость которого была улучшена аминокислотами в среде. Следующий вопрос, на который необходимо ответить, заключался в том, можно ли перевести повышенную растворимость в доступность? Для изучения этого вопроса была использована клеточная линия кишечника RTgutGC. В контексте минерального питания у животных термин «доступность» трудно определить и может регулироваться дифференцированно в клетках (in vitro) по сравнению с животным (in vivo). Следовательно, термин «поглощение» использовался, когда дело доходило до оценки in vitro с использованием кишечной клеточной линии. Клеточная линия предоставила полезную информацию о механизмах поглощения Zn в кишечном эпителии, который является частью сложного регуляторного процесса, регулирующего доступность минералов у животных. Клетки RTgutGC вызывали лучшую способность к апикального поглощению Zn в присутствии аминокислоты (т.е. метионина; Рисунок 6). Однако кажущаяся доступность in vivo существенно не различаться между неорганическими и органическими источниками Zn в атлантическом лососе. В исследовании доступности in vivo сравнение источников Zn проводилось при диетических уровнях Zn, значительно превышающих известные потребности в Zn атлантического лосося17,общую концентрацию Zn 150 мг / кг корма. Различия в доступности лучше визуализируются, когда тестируемые диетические уровни падают в линейном динамическом диапазоне до того, как животное достигнет насыщения. В настоящем исследовании in vivo возможно, что атлантический лосось был хорошо насыщен для наблюдаемой разницы в поглощении Zn между используемыми источниками.
Таким образом, первый метод предоставил качественную информацию о различных химических видах Zn, обнаруженных в растворимой фракции корма атлантического лосося; второй способ, in vitro растворимость дополненного Zn улучшалась в присутствии аминокислотных лигандов; третий метод подтвердил, что улучшенная растворимость аминокислот может улучшить поглощение эпителия кишечника; и наоборот, четвертый метод не смог найти различий в доступности Zn от неорганического или органического источника до атлантического лосося. В заключение, хотя и не в соответствии с выводами in vivo, протоколы in vitro предоставили интересное понимание различных компонентов доступности Zn.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была выполнена в рамках проекта APREMIA (Очевидная доступность и потребность в минералах в атлантическом лососе, грант No 244490), финансируемого Норвежским исследовательским советом.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Sartorius | ||
| 0.45 μm membrane filter | Pall | ||
| 10 % fetal bovine serum | Eurobio | ||
| 1282 Compugamma Laboratory Gamma Counter | LKB Wallac | ||
| 24 well plates (Falcon, TPP microplates) | Thermo Fisher Scientific | 10048760 | |
| 2-aminobicyclo(2.2.1)heptane-2-carboxylic acid | Sigma Aldrich | A7902 | |
| 75 cm2 cell culture flasks (Falcon, TPP tissue culture flasks) | TPP Techno Plastic Products AG | 90075 | |
| L-Arginine | Sigma Aldrich | A5006 | |
| Bradford assay kit | Bio-Rad | 5000001 | |
| Centrifuge | Eppendorf Centrifuge 5702 | ||
| L-Cysteine | Sigma Aldrich | 30089 | |
| DL-methionine | Alfa Aesar | 59-51-8 | |
| D-methionine | Sigma Aldrich | M9375 | |
| Experimental fish feeds | Skretting | ||
| Glycine | Sigma Aldrich | 410225 | |
| Guard column, TSKgel SWxl Type (7 μm particle size) | Tosoh | ||
| L-Histidine | Sigma Aldrich | 53319 | |
| HPLC coupled with a 7500ce ICP-MS | Agilent Technologies | ||
| Hydrochloric acid | Emsure ACS, ISO, 37% w/w, Merck | 1.00317 | |
| Knife mill | GM 300, Retsch Gmbh | ||
| L-15 medium | Invitrogen/Gibco | 21083027 | |
| L-methionine | Sigma Aldrich | M9625 | |
| L-Lysine | Sigma Aldrich | 23128 | |
| Methanol | LiChrosolv, HPLC grade, Merck | 1.06035 | |
| Milli-Q water (18.2 MΩ cm) | EMD Millipore Corporation | ||
| Myoglobin | Sigma Aldrich | M1882 | |
| NexION 350D ICP-MS | Perkin Elmer | ||
| Pasteur pipette | VWR | ||
| pH meter | inoLab | ||
| Phosphate-buffered saline (PBS) | Sigma Aldrich | 806552 | |
| RTgutGC cells | Obtained in kind from Professor Dr. Kristin Schirmer, Dept. of Environmental Toxicology, Eawag, Swiss Federal Institute of Aquatic Science and Technology, Switzerland | ||
| SEC column, TSKgel G3000SWxl | Tosoh | ||
| Sieve stainless steel (850?μm - 1.12?mm) | Retsch | ||
| Sodium dodecyl sulphate (SDS) | Sigma Aldrich | 436143 | |
| Superoxide dismutase | Sigma Aldrich | S7571 | |
| Thyroglobulin | Sigma Aldrich | T1001 | |
| Tricaine methanesulphonate | PharmaQ | ||
| Tris(hydroxymethyl)aminomethane | Sigma Aldrich | 252859 | |
| Trypsin in 0.25% in phosphate-buffer saline | Biowest | L0910 | |
| Versene EDTA solution | Invitrogen/Gibco | 15040-033 | |
| Vitamin B12 | Sigma Aldrich | V2876 | |
| Zinc chelate of glycine | Phytobiotics | ||
| Zinc sulphate | Vilomix |
Ссылки
- Ytrestoyl, T., Aas, T. S., Asgard, T. Utilisation of feed resources in production of Atlantic salmon (Salmo salar) in Norway. Aquaculture. 448, 365-374 (2015).
- Prabhu, P. A. J., et al. Evaluating dietary supply of microminerals as a premix in a complete plant ingredient-based diet to juvenile rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition. 24 (1), 539-547 (2018).
- Maret, W. Zinc biochemistry: from a single zinc enzyme to a key element of life. Advances in nutrition. 4 (1), 82-91 (2013).
- Hogstrand, C., Wood, C. M., Farrell, A. P., Brauner, C. J. . Fish Physiology. 31, 135-200 (2011).
- Baeverfjord, G., et al. Mineral nutrition and bone health in salmonids. Reviews in Aquaculture. , (2018).
- Maage, A., Julshamn, K. Assessment of zinc status in juvenile Atlantic salmon (Salmo salar) by measurement of whole body and tissue levels of zinc. Aquaculture. 117 (1), 179-191 (1993).
- Silva, M. S., Sele, V., Sloth, J. J., Araujo, P., Amlund, H. Speciation of zinc in fish feed by size exclusion chromatography coupled to inductively coupled plasma mass spectrometry – Using fractional factorial design for method optimization and mild extraction conditions. Journal of Chromatography B. , (2018).
- Prabhu, A. J., et al. Zinc uptake in fish intestinal epithelial model RTgutGC: Impact of media ion composition and methionine chelation. Journal of Trace Elements in Medicine and Biology. 50, 377-383 (2018).
- Silva, M. S., et al. Apparent availability of zinc, selenium and manganese as inorganic metal salts or organic forms in plant-based diets for Atlantic salmon (Salmo salar). Aquaculture. 503, 562-570 (2019).
- Persson, D. P., Hansen, T. H., Laursen, K. H., Schjoerring, J. K., Husted, S. Simultaneous iron, zinc, sulfur and phosphorus speciation analysis of barley grain tissues using SEC-ICP-MS and IP-ICP-MS. Metallomics. 1 (5), 418-426 (2009).
- Lothian, A., Roberts, B. R. Standards for Quantitative Metalloproteomic Analysis Using Size Exclusion ICP-MS. Journal of Visualized Experiments. (110), (2016).
- Minghetti, M., Schirmer, K. Effect of media composition on bioavailability and toxicity of silver and silver nanoparticles in fish intestinal cells (RTgutGC). Nanotoxicology. 10 (10), 1526-1534 (2016).
- Glover, C. N., Hogstrand, C. Amino acid modulation of in vivo intestinal zinc absorption in freshwater rainbow trout. Journal of Experimental Biology. 205 (1), 151-158 (2002).
- Ekman, R., Ekman, R. . Mass spectrometry: Instrumentation, interpretation, and applications. Wiley Series on Mass Spectrometry. , 105-115 (2009).
- Hong, P., Koza, S., Bouvier, E. S. P. A Review Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and Their Aggregates. Journal of Liquid Chromatography & Related Technologies. 35 (20), 2923-2950 (2012).
- Krezel, A., Maret, W. The biological inorganic chemistry of zinc ions. Archives of Biochemistry and Biophysics. 611, 3-19 (2016).
- National Research Council. . Nutrient Requirements of Fish and Shrimp. , (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены