Method Article
Avaliação da disponibilidade mineral em rações de peixe usando métodos complementares demonstrados com o exemplo de zinco no salmão atlântico
Neste Artigo
Resumo
Este artigo explica detalhadamente uma abordagem sistemática para avaliar a disponibilidade de micro minerais no salmão atlântico. A metodologia inclui ferramentas e modelos com crescente complexidade biológica: (1) análise de especiação química, (2) solubilidade in vitro, (3) estudos de absorção em linhas celulares e (4) estudos de peixe vivo.
Resumo
Avaliar a disponibilidade de micro minerais dietéticos é um grande desafio na nutrição mineral de espécies de peixes. O presente artigo tem como objetivo descrever uma abordagem sistemática que combina diferentes metodologias para avaliar a disponibilidade de zinco (Zn) em salmão atlântico (Salmo salar). Considerando que várias espécies químicas Zn podem estar presentes em uma ração de salmão do Atlântico, foi hipótese que a disponibilidade de Zn é influenciada pelas espécies químicas Zn presentes na alimentação. Assim, neste estudo, o primeiro protocolo é sobre como extrair as diferentes espécies químicas Zn da ração e analisá-las por um método de espectroscopia de massa plasmática indutivamente acoplada por cromatografia de tamanho (SEC-ICP-MS). Posteriormente, foi desenvolvido um método in vitro para avaliar a solubilidade da dieta Zn em rações de salmão do Atlântico. O terceiro protocolo descreve o método para estudar o impacto da mudança da composição de espécies químicas Zn na absorção de Zn em um modelo epitelial intestinal de peixe usando uma linha de células intestinais de truta arco-íris (RTgutGC). Juntos, os achados dos métodos in vitro foram comparados com um estudo in vivo que examinou a aparente disponibilidade de fontes inorgânicas e orgânicas de Zn complementadas às rações de salmão do Atlântico. Os resultados mostraram que várias espécies químicas Zn podem ser encontradas em rações e a eficiência de uma fonte orgânica Zn depende muito do ligante de aminoácidos usado para quelatar Zn. Os achados dos métodos in vitro apresentaram menor correlação com o desfecho do estudo in vivo. No entanto, os protocolos in vitro descritos neste artigo forneceram informações cruciais sobre a disponibilidade de Zn e sua avaliação em rações de peixe.
Introdução
Farinha de peixe e óleo de peixe eram tradicionalmente usados na ração de salmão do Atlântico. No entanto, esses ingredientes estão sendo cada vez mais substituídos por ingredientes à base de plantas1. A mudança acima mencionada na composição da ração resultou em baixa disponibilidade alimentar e aumento da disponibilidade mineral em rações de salmão do Atlântico, especialmente zinco (Zn)2. A redução da disponibilidade pode ser resultado de uma mudança no nível Zn, espécies químicas Zn ou/e fatores antinutricionais presentes na matriz alimentar. Nesse cenário, uma nova matriz de aditivos genericamente considerados como "fontes orgânicas" surgiram com potencial de ser uma fonte melhor disponível de minerais dietéticos para os peixes. Por isso, é importante compreender a química fundamental e a fisiologia que regem a disponibilidade de minerais e suas fontes para pescar. Zinco é um elemento de traço essencial para todos os organismos vivos3. O papel de Zn como uma molécula de sinalização foi descrito tanto no nível paracelular quanto intracelular empeixes 4. No salmão atlântico, a deficiência de ZN tem sido associada a anormalidades esqueléticas e atividade reduzida de vários metalloenzymes Zn5,6.
Este estudo descreve uma abordagem sistemática para entender a disponibilidade de Zn, categorizando-a em quatro compartimentos diferentes de variada complexidade química e biológica. Os métodos envolvidos são descritos em quatro seções, como pode ser visto na Figura 1: (1) avaliação de espécies químicas ZN na fração solúvel de uma ração de salmão do Atlântico usando uma exclusão de tamanho de espectroscopia de massa plasmática indutivamente acoplada (SEC-ICP-MS)método 7; (2) solubilidade in vitro de Zn suplementada na ração de salmão do Atlântico; (3) avaliação da absorção de espécies químicas Zn por modelo intestinal in vitro (RTgutGC)8; e (4) disponibilidade aparente de Zn no salmão atlântico(Salmo salar)9. Protocolos semelhantes podem ser desenvolvidos para outros minerais (por exemplo, manganês, selênio, cobre) de interesse nutricional para espécies de peixes de aquicultura.
Protocolo
O ensaio alimentar na seção 4 foi realizado de acordo com a legislação norueguesa (FOR-2015-06 - 18-761) e europeia (Diretiva 2010/63/UE).
1. Avaliação de espécies químicas ZN na fração solúvel de uma ração de salmão do Atlântico usando um método SEC-ICP-MS
- Tampão de extração (100 mM Tris-HCl, pH 8.5)
- Prepare o tampão de extração dissolvendo uma quantidade apropriada de tris (hidroximetila)aminometano para atingir a força iônica desejada (100 mM) em ultrapure H2O.
- Ajuste o pH da solução para pH 8.5 com solução HCl, monitorando a troca de pH com um medidor de pH.
- Preparação de amostras de ração
NOTA: A amostra de ração utilizada foi formulada com base em ração comercial para salmão atlântico, contendo fontes proteicas principalmente de ingredientes à base de plantas (ou seja, aproximadamente 5% de proteína de peixe, 10% óleo de peixe, 68% proteína à base de plantas e 12% óleo à base de plantas). Sulfato de zinco foi complementado à alimentação.- Triture a amostra de ração à mão usando um pilão e uma argamassa.
- Peneirar a amostra de ração para garantir que a extração seja realizada em uma fração de alimentação com tamanho de partícula semelhante (de 850 μm a 1,12 mm).
- Prossiga para realizar a extração de Zn.
- Extração de zinco de uma amostra de ração
- Pesar aproximadamente 0,5 g de ração em triplicado em tubos cônicos de 15 mL.
- Adicione o tampão de extração (5 mL de 100 mM Tris-HCl, pH 8.5) às amostras.
- Extrair as amostras em um rotador (20 rpm) a 4 °C por 24 h.
- Separe as frações solúveis e não solúveis por centrifugação por 10 min a 3000 x g.
- Use um filtro de seringa descartável de 0,45 μm para filtrar a fração solúvel.
- Transfira as amostras filtradas para tubos limpos.
- Realize a análise de especiação de Zn nas frações solúveis utilizando SEC-ICP-MS, conforme descrito na etapa 1.6.
NOTA: Um resumo do procedimento para extração de Zn de uma amostra de ração é descrito na Figura 2.
- Solução de fase móvel (50 mM Tris-HCl + 3% MeOH, pH 7.5)
- Prepare a solução de fase móvel dissolvendo 6,057 g de tris (hidroximetila)aminometano em 1 L de solução meOH de 3% (v/v).
- Ajuste o pH da solução para pH para 7,5 com solução HCl, monitorando a troca de pH com um medidor de pH.
- Filtre a solução de fase móvel através de um filtro de membrana de 0,45 μm.
- Calibração de peso molecular da faixa de separação da coluna SEC
- Calibrar o intervalo de separação realizando uma calibração de peso molecular.
NOTA: Neste estudo foram utilizadas a tireoglobulina (660 kDa), a dismutase de superóxido Zn/Cu (32 kDa), a mioglobina (17 kDa) e a vitamina B12 (1,36 kDa). - Prepare cada um dos padrões com uma concentração conhecida em ultrapure H2O.
- Prepare um frasco de cromatografia líquida de alto desempenho (HPLC) adicionando 250 μL de padrão a um frasco.
- Carregue os frascos com padrões para a sequência das amostras.
- Execute a calibração do peso molecular no início e no final da sequência analítica, monitorando 127I (tiroglobulina), 66Zn (zn/cu superóxido dismutase), 57Fe (mioglobina) e 59Co (vitamina B12).
NOTA: A calibração do peso molecular é realizada simultaneamente com a análise de especiação de Zn.
- Calibrar o intervalo de separação realizando uma calibração de peso molecular.
- Análise de especiação de zinco usando SEC-ICP-MS
NOTA: A análise de especiação de Zn pelo método SEC-ICP-MS foi desenvolvida com base em princípios descritos em outros lugares10,11 e outra otimização foi realizada para a análise de uma ração de salmão atlântico7.- Realize a análise de especiação de Zn nas frações solúveis usando uma coluna de cromatografia de exclusão de tamanho (SEC) e um HPLC juntamente com espectroscopia de massa plasmática indutivamente acoplada (ICP-MS).
- Prepare um frasco HPLC adicionando 250 μL de fração solúvel a um frasco.
- Antes da análise, aumente todas as amostras com 0,5 μL de vitamina B12. Esta etapa permite corrigir para mudanças de tempos de retenção, monitorando 59Co.
- Diluir a fração solúvel com tampão de extração (100 mM Tris-HCl, pH 8.5) e ajustar-se a um volume final de 1 mL.
- Prepare a sequência das amostras em ordem aleatória.
- Sintonize o ICP-MS de acordo com as instruções do fabricante.
- Siga as configurações do instrumento para o HPLC e ICP-MS executando a análise de especiação de Zn (ver Tabela 1).
2. Solubilidade in vitro de Zn suplementada na ração de salmão do Atlântico
NOTA: A amostra de ração utilizada foi formulada com base em ração comercial para salmão atlântico, contendo fontes proteicas principalmente de ingredientes à base de plantas (ou seja, aproximadamente 5% de farinha de peixe, 10% óleo de peixe, 68% ingredientes à base de plantas e 12% óleo vegetal).
- Triture as amostras de ração de salmão do Atlântico por 10 s a 3000 rpm usando uma usina de facas e armazene a 4 °C até uma análise mais aprofundada.
- Pese ~0,2 g das amostras de ração moídas na etapa 2.1 e adicione o radiotracer Zn(65Zn) de atividade específica conhecida em um tubo de amostra de volume de 5 mL (com uma tampa).
ATENÇÃO: Este procedimento deve ser realizado dentro de uma suíte de radionuclídeo. A pessoa que realiza esta etapa deve ser treinada e certificada para lidar com isótopos de rádio. As medidas de segurança e precaução aconselhadas pela administração de segurança de radiação do instituto devem ser rigorosamente seguidas. - Em seguida, prepare a solução de tampão luminal intestinal de água doce, conforme descrito abaixo.
- Para solução de sal A, pese 11,65 g de NaNO3, 0,55 g de KNO3 e 0,4 g de MgSO4. Dissolva os sais em ultrapura H2O e ajuste a um volume final de 60 mL.
- Para solução de sal B, pese 0,31 g de Ca(NO3)2· 4 H2O. Dissolva os sais em ultrapura H2O e ajuste a um volume final de 10 mL.
- Use a solução de estoque HEPES de 500 mM como solução de sal C.
- Para solução de sal D, pese 1,2 g de MgCl2,dissolva o sal em ultrapure H2O e ajuste a um volume final de 20 mL.
- Para solução de sal E, pesar 0,9 g de MgSO4,dissolver o sal em ultrapure H2O e ajustar a um volume final de 20 mL.
- Prepare a solução de piruvato dissolvendo 0,55 g de CH3COCOONa em 10 mL de ultrapure H2O.
- Dissolver 0,9 g de galactose (C6H12O6) em ultrapure H2O.
- Dissolver bem usando um agitador magnético e esterilizar soluções de sal A, B, D e E por autoclavagem, e solução C, piruvato e galactose por filtragem através de um filtro de seringa de 200 μm.
- Após a elaboração das diferentes soluções de estoque, para preparar 100 mL de solução de trabalho do buffer, misture as soluções acima preparadas na seguinte proporção: 6,8 mL de solução de sal A, 4,14 mL de B, 5 mL de C, 2,5 mL de D, 1,5 mL de E e 1,14 mL cada de pirutil e galactose. Coma o volume até 100 mL usando água deionizada.
NOTA: O tampão acima representará agora a composição iônica do lúmen intestinal encontrado em salmonides de água doce.
- Prepare seis outras alíquotas do tampão descritas na etapa 2.6 e adicione um dos seguintes aminoácidos (cisteína, metomínea, glicina, histidina, lisina e arginina) para alcançar uma concentração molar final de 5 mM.
- Adicione o tampão luminal intestinal de água doce (volume de reação = 3 mL; pH 7,4) à amostra de alimentação.
- Repita o passo 2.5 com os buffers descritos em 2.4 (na presença de diferentes aminoácidos na concentração de 5 mM).
- Feche os tubos e deixe-os girar em um rotador rotativo por 30 min a 25 rpm.
- Separe as frações solúveis e não solúveis por centrifugação por 10 min a 1157 x g.
- Use um caixa gama para medir as contagens por minuto (cpm) de 65Zn nas frações solúveis e não solúveis.
- Calcule a proporção dos isótopos de rádio de Zn (65Zn) presentes nas frações solúveis e não solúveis.
3. Avaliação da absorção de espécies químicas Zn utilizando um modelo intestinal in vitro (RTgutGC)
- Cultura de células RTgutGC
NOTA: Todos os materiais de trabalho utilizados nesta etapa devem ser estéreis.- Reviva as células RTgutGC congeladas suavemente em um banho de água a 20 °C.
- Pipeta suavemente a solução contendo as células e suspenda-as em 10 mL de meio L15 contendo 10% de soro bovino fetal (FBS).
NOTA: 10% FBS é usado apenas para reviver as células congeladas. Para passagem subsequente, o FBS é usado em 5%. A composição da FBS pode variar entre os lotes, por isso é aconselhável comprar e estocar o quanto for necessário de um único lote para evitar variações entre lotes na composição do soro. - Adicione a suspensão celular a frascos de cultura celularde 75 cm e incubar em uma incubadora a 19 °C sob atmosfera normal.
- Verifique as células e quando confluente (80% de confluência, avalie visualmente examinando a densidade da superfície celular sob um microscópio), divida as células em novos frascos (passagem subsequente) ou colheita para uso em experimentos.
NOTA: Um exemplo das células RTgutGC 1h e 1 semana após a semeadura para os frascos de cultura celular é mostrado na Figura 3.
- Colheita celular e preparação para experimentos de exposição
- Lave as células duas vezes com 1 solução de ácido edradiaminatraacético de 1 mL (EDTA). Após cada lavagem, sifão a solução EDTA usando um tubo de sucção estéril.
- Trate as células com trippsina (0,7 mL de trippsina, em 0,25% em soro fisiológico tamponado por fosfato [PBS]).
- Gire suavemente o frasco em ângulos agudos para espalhar a trippsina ao longo da superfície do frasco.
- Continue a rotação por 2 minutos, enquanto as células se desprendem.
- Depois de girar suavemente por 2 min, adicione 10 mL de meio L15/FBS para neutralizar a trippsina.
- Decante a suspensão celular resultante em um tubo cônico de centrífuga inferior usando uma pipeta estéril e centrífuga por 3 min a 130 x g.
- Determine a densidade das células colhidas por contagem manual usando hemótmetro.
- Adicione o volume necessário de meio L15/FBS para atingir uma densidade celular de 5 x 104 células/mL.
- Semear as células em placas de 24 poços, pipetando 1 mL de suspensão celular por poço para atingir a densidade celular final de 5 x 104 células/poço.
NOTA: Use preferencialmente pipetas de vários distribuidores para minimizar a variação e reduzir o tempo. - Coloque as placas semeadas em uma incubadora em atmosfera normal a 19 °C por 48 h antes dos experimentos.
NOTA: Trippsina a ser armazenada a -20 °C; Solução EDTA e mídia L15/FBS a 4 °C. Ajuste a temperatura de todas as soluções de trabalho e mídia para 19 °C pouco antes de usar.
- Preparação de mídia de exposição
NOTA: Este passo deve ser feito sob o capô da fumaça sob condições assépticas e estéreis.- Prepare L15/ex misturando 6,8 mL de solução de sal A (etapa 2.3.1), 1,14 mL de B (etapa 2.3.2), 5 m L de C (etapa 2.3.3), e 1,14 mL cada de piruvato (etapa 2.3.6) e galactose (etapa 2.3.7). Coma o volume até 100 mL usando água destilada de grau de cultura celular estéril.
- Prepare FW misturando 6,8 mL de solução de sal A (2.3.1), 4,14 mL de B (2.3.2), 5 mL de C (2.3.3), 2,5 mL de D (2.3.4), 1,5 mL de E (2,3,5) e 1,14 mL cada um de piruvato (2.3.6) e galactose (2.3.7). Coma o volume até 100 mL usando água destilada estéril e de grau de cultura celular.
- Quantifique as concentrações de íons nos meios de exposição usando ICP-MS como descrito em outros lugares12.
NOTA: As concentrações iônicas analisadas nos preparativos da mídia são apresentadas na Tabela 2.
- Ensaios de influxo de zinco(65Zn)
- Semente as células RTgutGC em placas de 24 poços (5 x 104 células/bem) em meio L15/FBS completo.
- Incubar por 48 h em uma incubadora com atmosfera normal a 19 °C.
- Ajuste todas as preparações experimentais de mídia para pH 7.4 usando 0,5 M NaOH na presença ou ausência de L-methionina (L-Met) ou DL-methionine (DL-Met) na concentração de 2 mM.
NOTA: O ajuste de pH dos buffers descritos em 3.4.3 precisa ser feito recentemente antes do tratamento das células na etapa 3.4.5. - Após a conclusão do período de incubação, retire o meio dos poços e enxágue bem com PBS.
- Adicione a mídia experimental FW ajustada por pH e deixe aclimatar por 20 minutos.
- Exponha as células RTgutGC a concentrações nominais de 3,07, 6,14, 12,27 e 24,55 μM 65Zn(II) (como ZnCl2; ~4 kBq/mL) na mídia descrita na etapa 3.4.3.
- Imediatamente depois, mantenha as células na incubadora a 19 °C por 15 min.
- Após o fim da incubação de 15 minutos, aspire a cultura supernante e retire do poço.
- Enxágüe as células com meio FW frio gelado (com 200 μM Zn, pH 7.4) e, em seguida, sacie a saciar adicionando o tampão de 5 mM de etileno glicol-bis (β-aminoetil ether)-N,N',N',N'-tetraactic acid (EGTA) tampão (pH 7.4) por 5 minutos, para se livrar de qualquer adsorte 65Zn(II).
- Exponha as células às preparações de mídia acima na presença ou ausência de 10 mM 2-Aminobicyclo [2.2.1] ácido heptano-2-carboxílico (BCH), um inibidor de transporte de aminoácidos.
- Após o período de exposição de 15 min, repetimos as etapas 3.4.8 e 3.4.9.
- As células RtgutGC serão aderidas à parte inferior dos poços como uma monocamada. Digerir as células usando detergente de sulfato de dodecyl de sódio quente (SDS) de 0,2% quente (SDS) detergente (100 μL/well).
NOTA: A solução SDS precisa ser colocada por 1h em um banho de água definido a 90 °C antes de ser usado. - Aspire e recupere a digestão celular em um tubo de 1,5 mL.
- Meça a radioatividade dos digestores celulares usando um contador gama.
NOTA: As contagens por minuto (cpm) precisam ser corrigidas para decomposição radioativa, atividade de fundo e são submetidas a cálculos de atividades específicas seguindo as fórmulas descritas por Glover e Hogstrand13. - Para quantificar a concentração proteica das células, homogeneize as células com 500 μL de 0,5 M NaOH.
- Use um kit de ensaio de Bradford para medir a concentração de proteína na amostra celular, com albumina de soro bovino (BSA) como padrão.
NOTA: Uma vez quantificada a concentração de proteína, a taxa de absorção de Zn por células RTgutGC pode ser expressa como pmoles Zn min-1 mg-1 proteína.
4. Aparente disponibilidade de Zn dietético em salmão atlântico(Salmo salar)
NOTA: As rações de salmão do Atlântico foram formuladas com base em rações comerciais, contendo fontes proteicas principalmente de ingredientes à base de plantas (ou seja, aproximadamente 5% de proteína de peixe, 10% óleo de peixe, 68% proteína à base de plantas e 12% óleo vegetal). Dois alimentos foram suplementados com uma fonte inorgânica (sulfato Zn) ou uma fonte orgânica (Zn chelate de glicina) para alcançar uma concentração de Zn de 150 mg/kg de ração. Além disso, o óxido de Ítrio (grau de alimentação) foi adicionado à alimentação em 0,01% como marcador inerte para permitir o cálculo do coeficiente de disponibilidade aparente.
- Aclimatize o salmão atlântico (cepa SalmoBreed, 1+ anos, grupos de sexo misto) em seus respectivos tanques até que os peixes estejam acostumados às condições experimentais.
- Avalie a aclimatação do salmão do Atlântico monitorando sua ingestão diária de ração.
NOTA: Este ensaio foi realizado em tanques triplicados, assim foram utilizados um total de seis tanques. Durante o ensaio de alimentação, a temperatura da água foi de 11,9 ± 0,3 °C e a saturação de oxigênio dissolvida foi de 101 ± 5%. - Alimente o peixe com rações experimentais por 11 dias.
- Eutanize o peixe por overdose usando 6 mL de solução de estoque de metanossulfonato tricaine por litro de água.
- Colete uma amostra agrupada de fezes do peixe do mesmo tanque em uma placa, retirando da barbatana ventral ao ânus.
- Remova as fezes da placa com uma espátula em um tubo cônico de 50 mL e armazene imediatamente as amostras a -20 °C.
NOTA: As amostras foram mantidas a -20 °C até uma análise posterior. - Congele as amostras de fezes por 72 h a -80 °C.
- Homogeneize manualmente a amostra de fezes em pó fino usando um pilão e argamassa.
- Determine a concentração de Zn e Ítrio nas amostras de ração e fezes utilizando um ICP-MS (conforme descrito em outros lugares9).
- Determine o coeficiente de disponibilidade aparente (AAC, %) utilizando a seguinte fórmula:

Resultados
Avaliação de espécies químicas ZN na fração solúvel de uma ração de salmão do Atlântico usando um método SEC-ICP-MS
O método SEC-ICP-MS fornece dados sobre as espécies químicas Zn encontradas na fração solúvel da ração de salmão do Atlântico. A Figura 4 ilustra o perfil cromatográfico de Zn encontrado na fração solúvel. Este cromatógrafo foi obtido utilizando-se o método SEC-ICP-MS. Cinco Zn contendo picos foram encontrados nas frações solúveis da ração de salmão do Atlântico. Cada pico tem um peso molecular diferente; pico um (~ 600 kDa), pico dois e pico três (de 32 a 17 kDa), pico quatro (de 17 a 1,36 kDa) e pico cinco (> 1,36 kDa). O pico quatro foi o mais abundante, seguido pelo pico dois, três, cinco e um, respectivamente. As espécies químicas Zn encontradas na fração solúvel podem ter diferentes fontes porque a ração utilizada contém ingredientes à base marinha e à base de plantas, e forma suplementada (ou seja, sulfato de Zn). A faixa de peso molecular das espécies químicas Zn sugeriu que esses compostos poderiam ser metaloproteínas.
Solubilidade in vitro de Zn suplementado na ração de salmão do Atlântico
A solubilidade de 65Zn suplementada aumentou na presença de aminoácidos. Todos os aminoácidos testados aumentaram a solubilidade de 65Zn. Methionine, glicina, cisteína, histidina e lisina melhorou a solubilidade de 65Zn; maior solubilidade foi encontrada com histidina e lise(Figura 5).
Avaliação da absorção de espécies Zn usando um modelo intestinal in vitro (RTgutGC)
A absorção apical de zinco em células RTgutGC foi significativamente influenciada pela presença de L-Met ou DL-Met em concentrações de 2 mM. Além disso, o impacto da methionina na absorção de Zn nas células RTgutGC foi afetado negativamente pela presença de BCH (um bloqueador do sistema de transporte de aminoácidos), quando comparado com células não tratadas com BCH(Figura 6).
Aparente disponibilidade de Zn dietético em salmão atlântico (Salmo salar)
Em rações práticas para salmão atlântico, a disponibilidade aparente de Zn foi a mesma ao suplementar com uma fonte inorgânica (sulfato Zn) ou uma fonte orgânica (quilato de Zn de glicina). Os valores estimados para disponibilidade aparente de Zn (%, n = 3) em salmão atlântico foram de 31% ± 12% ao suplementar com fonte inorgânica (sulfato Zn) e 31% ± 3% ao suprmentar uma fonte orgânica (quilato de Zn de glicina).
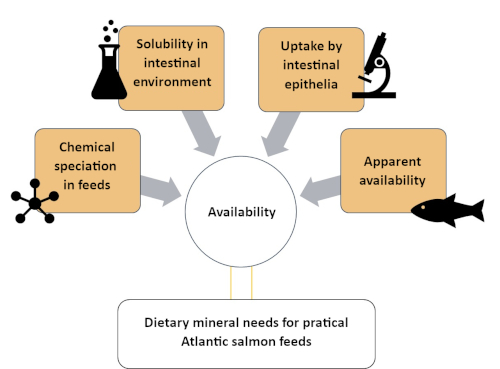
Figura 1: Um resumo da abordagem sistemática para avaliar a disponibilidade mineral utilizando métodos complementares. Esta abordagem foi utilizada para estudar a disponibilidade de zinco no salmão do Atlântico, incluindo especiação de Zn, solubilidade de Zn no ambiente intestinal, absorção de Zn por células intestinais e disponibilidade aparente de Zn. Clique aqui para ver uma versão maior desta figura.
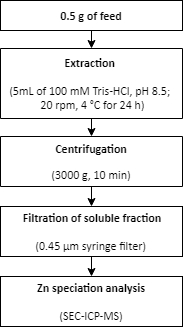
Figura 2: Um resumo do procedimento para extração de Zn a partir de uma amostra de ração. O zinco é extraído de uma amostra de ração usando condições leves de extração. A extração é seguida pela análise de especiação de Zn. Clique aqui para ver uma versão maior desta figura.
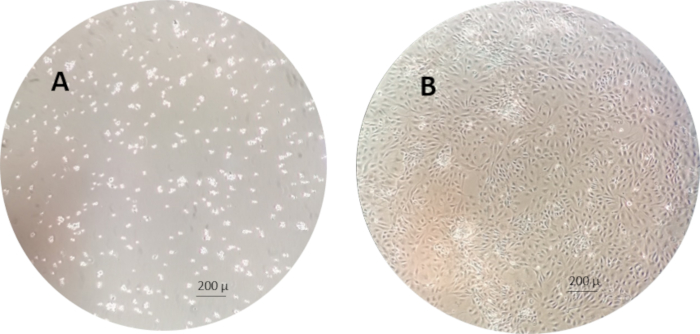
Figura 3: Um exemplo das células RTgutGC 1 h (esquerda) e 1 semana (direita) após a semeadura nos frascos de cultura celular. Por favor, clique aqui para ver uma versão maior desta figura.
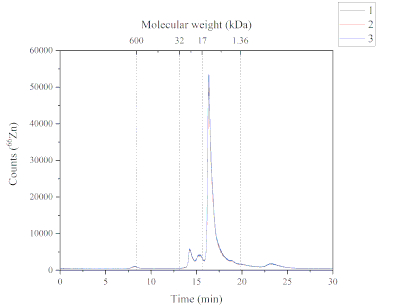
Figura 4: Um cromatógrafo mostrando os picos contendo ZN da fração solúvel da ração de salmão atlântico e analisado pela SEC-ICP-MS. As três réplicas são caracterizadas pelas linhas azul, vermelha e preta. Foi realizada calibração de peso molecular utilizando-se a tireoglobulina (660 kDa, monitorando 127I), dismutase de superóxido Zn/Cu (32 kDa, monitoramento de 66Zn), mioglobina (17 kDa, monitoramento 57Fe), vitamina B12 (1,36 kDa, monitoramento 59Co); Pico 1 (P1): ~600 kDa, tempo de retenção (RT) 8,2 min; Pico 2+3 (P2+3): de 32 a 17 kDa, RT 14.2 + 15,3 min; Pico 4 (P4): de 17 a 1,36 kDa, RT 16,3 min; Pico 5 (P5): > 1,36 kDa, Rt 23,2 min. Clique aqui para ver uma versão maior desta figura.
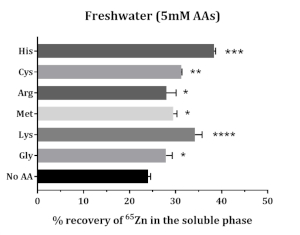
Figura 5: O impacto dos aminoácidos na solubilidade in vitro da Zn suplementada na alimentação de salmão atlântico. Os dados são apresentados como média ± SD (n = 3). Os dados foram analisados por meio de ANOVA unidirecional, seguidos pelo teste de comparação múltipla de Dunnet, comparando a média de cada grupo AA com a do grupo de controle (No AA). Os asteriscos denotam o nível de significância da ANOVA (valores P < 0,05 (*), < 0,01 (**), < 0,001 (***) e < 0,0001 (****)). Clique aqui para ver uma versão maior desta figura.
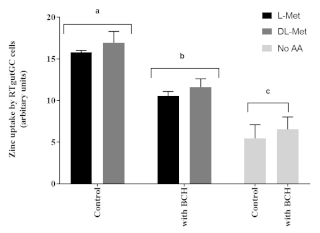
Figura 6: A influência da methionina e de um inibidor de transporte de aminoácidos (2-Aminobicyclo [2.2.1] ácido heptano-2-carboxílico, BCH, 10 mM). Os dados são apresentados como média ± SD (n = 3). Os dados foram analisados por meio de ANOVA bidirecional, seguido pelo teste de comparação múltipla de Tukey com p < nível de significância de 0,05. As diferenças pós-hoc entre os grupos são representadas como carta de sobrescrito acima das barras; barras com diferentes sobrescritos são estatisticamente diferentes (p < 0,05). Clique aqui para ver uma versão maior desta figura.
| Configurações HPLC | |
| Coluna | Coluna SEC (30 cm x 7,8 mm, tamanho de partícula de 5 μm) + coluna de proteção (tamanho de partícula de 7 μm) |
| Faixa de calibração | 1.0 × 104 - 5.0 × 105 Da |
| Fase móvel | 50 mM Tris-HCl + 3% MeOH (pH 7.5) |
| Vazão | 0,7 mL min−1 |
| Volume de injeção | 50 μL |
| Configurações ICP-MS | |
| Força dianteira | 1550 W |
| Fluxo de gás plasmádvo | 15.0 L min−1 |
| Fluxo de gás transportador | 0,86 L min−1 |
| Fluxo de gás de maquiagem | 0,34 L min−1 |
| Tempo de moradia | 0,1 s por isótopo |
| Isótopos monitorados | 127 I, 66Zn, 59Co, 57Fe |
Mesa 1. Uma visão geral das configurações dos instrumentos para o HPLC e ICP-MS.
| Composição química (mM) | L15/ex | Meio experimental (L15/FW) |
| Nitrato de sódio | 155 | 155 |
| Nitrato de potássio | 6.2 | 6.2 |
| Sulfato de magnésio | 3.8 | 19.5 |
| Nitrato de cálcio | 1.5 | 5.4 |
| HEPES | 5 | 5 |
| Cloreto de magnésio | - | 15 |
| Piruvato de sódio | 5.7 | 5.7 |
| Galactose | 5.7 | 5.7 |
| ph | 7.1 | 7.4 |
| Força iônica | 178 | 258 |
| Composição iônica (mM) | ||
| Cálcio, Ca2+ * | 1.6 ± 0.1 | 5.3 ± 0.2 |
| Magnésio, Mg2+ * | 3.9 ± 0.3 | 32,5 ± 0,7 |
| Potássio, K+ * | 8.2 ± 1.2 | 8.6 ± 1.1 |
| Sódio, Na+ * | 160 ± 3 | 157 ± 2 |
| Nitrato, NO3- ** | 164 | 172.4 |
| Sulfato, SO4- ** | 3.8 | 18.7 |
| Cloreto,Cl- ** | 1.5 | 31.5 |
Mesa 2. A composição química e iônica dos meios experimentais testados.
Discussão
A absorção intestinal de Zn parece ser influenciada pela forma química da espécie Zn13. Nesse sentido, a utilização dos protocolos descritos neste artigo permitiu o estudo sequencial dos aspectos químicos e biológicos subjacentes à "disponibilidade" de Zn no salmão atlântico.
Este estudo relatou o uso de um método de análise de especiação de ZN. O método SEC-ICP-MS forneceu dados qualitativos relativos ao peso molecular de espécies químicas Zn presentes na fração solúvel de uma ração de salmão do Atlântico. Isso foi alcançado em comparação com os tempos de retenção dos padrões de calibração de peso molecular (ou seja, tireglobulina (660 kDa), dismutase de superóxido de Zn/Cu (32 kDa), mioglobina (17 kDa) e vitamina B12 (1,36 kDa)) com os tempos de retenção de Zn contendo picos. Um desafio encontrado na análise de especiação de ZN foi a identificação das espécies químicas Zn desconhecidas devido à falta de padrões analíticos. Na SEC, a separação das moléculas baseia-se em seus tamanhos em relação aos poros na fase estacionária. Em princípio, moléculas maiores viajarão mais rápido, eluindo primeiro, e moléculas menores viajarão mais lentamente, eluindo mais tarde14. Consequentemente, cada Zn contendo pico pode conter vários compostos com peso molecular semelhante15. Isso também contribui para o desafio de identificar espécies químicas Zn desconhecidas. Além disso, várias condições de extração leve foram testadas para extração de Zn. O Zn extraído foi baixo (~10%). Condições de extração leves foram aplicadas para manter intactas as espécies químicas Zn, mas isso pode ter comprometido a eficiência de extração7.
No ensaio de solubilidade in vitro, a solubilidade do Zn suplementado (como isótopo de rádio 65ZnCl2) indicou que os aminoácidos, especialmente histidina e lisina, aumentaram a solubilidade de Zn(Figura 5). O uso de amostras de ração diretamente para ensaios de solubilidade in vitro em condições gastrointestinais simuladas baseia-se no conhecimento de que a mudança na especiação de Zn é dependente do pH16. No entanto, as condições ácidas no início do trato GI podem resultar em alguma mudança na especiação que pode ser irreversível (por exemplo, ZnO -> ZnCl2, na presença de HCl sob condições ácidas no estômago). No entanto, a fonte Zn usada aqui é ZnSO4 e a solubilidade foi melhorada por aminoácidos no meio. A próxima pergunta a ser respondida foi: o aumento da solubilidade pode ser traduzido para a disponibilidade? A linha de células intestinais RTgutGC foi utilizada para estudar essa questão. No contexto da nutrição mineral em animais, o termo 'disponibilidade' é difícil de definir e pode ser regulado diferencialmente nas células (in vitro) em comparação com um animal (in vivo). Assim, o termo "absorção" foi utilizado quando se tratava da avaliação in vitro utilizando linha celular intestinal. A linha celular forneceu informações úteis sobre os mecanismos de absorção de Zn no epitélio intestinal que faz parte do complexo processo regulatório que rege a disponibilidade mineral em animais. As células RTgutGC provocaram uma melhor capacidade de absorção apical de Zn na presença de um aminoácido (ou seja, methionina; Figura 6). No entanto, a aparente disponibilidade in vivo não difere significativamente entre fontes inorgânicas e orgânicas da Zn em salmão atlântico. No estudo de disponibilidade in vivo, a comparação da fonte ZN foi feita em níveis de Zn dietéticos bem superior aos requisitos conhecidos de Zn de salmão atlântico17, concentração total de Zn de 150 mg/kg de alimentação. As diferenças de disponibilidade são melhor visualizadas quando os níveis alimentares testados caem na faixa dinâmica linear antes que o animal atinja a saturação. No presente estudo in vivo, é possível que o salmão atlântico estivesse bem saturado à diferença observada na absorção de Zn entre as fontes utilizadas.
Em resumo, o primeiro método forneceu informações qualitativas sobre diferentes espécies químicas Zn encontradas na fração solúvel de uma ração de salmão do Atlântico; o segundo método, solubilidade in vitro de Zn suplementada foi melhorada na presença de ligantes de aminoácidos; o terceiro método confirmou que a solubilidade melhorada por aminoácidos pode melhorar a absorção no epitélio intestinal; por outro lado, o quarto método não encontrou diferenças na disponibilidade de Zn de fonte inorgânica ou orgânica ao salmão atlântico. Para concluir, embora não esteja alinhado com os achados in vivo, os protocolos in vitro forneceram insights interessantes sobre a compreensão dos diferentes componentes da disponibilidade Zn.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi realizado no âmbito do projeto APREMIA (Disponibilidade aparente e exigência de minerais em salmão atlântico, concessão nº 244490) financiada pelo Conselho Norueguês de Pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter | Sartorius | ||
| 0.45 μm membrane filter | Pall | ||
| 10 % fetal bovine serum | Eurobio | ||
| 1282 Compugamma Laboratory Gamma Counter | LKB Wallac | ||
| 24 well plates (Falcon, TPP microplates) | Thermo Fisher Scientific | 10048760 | |
| 2-aminobicyclo(2.2.1)heptane-2-carboxylic acid | Sigma Aldrich | A7902 | |
| 75 cm2 cell culture flasks (Falcon, TPP tissue culture flasks) | TPP Techno Plastic Products AG | 90075 | |
| L-Arginine | Sigma Aldrich | A5006 | |
| Bradford assay kit | Bio-Rad | 5000001 | |
| Centrifuge | Eppendorf Centrifuge 5702 | ||
| L-Cysteine | Sigma Aldrich | 30089 | |
| DL-methionine | Alfa Aesar | 59-51-8 | |
| D-methionine | Sigma Aldrich | M9375 | |
| Experimental fish feeds | Skretting | ||
| Glycine | Sigma Aldrich | 410225 | |
| Guard column, TSKgel SWxl Type (7 μm particle size) | Tosoh | ||
| L-Histidine | Sigma Aldrich | 53319 | |
| HPLC coupled with a 7500ce ICP-MS | Agilent Technologies | ||
| Hydrochloric acid | Emsure ACS, ISO, 37% w/w, Merck | 1.00317 | |
| Knife mill | GM 300, Retsch Gmbh | ||
| L-15 medium | Invitrogen/Gibco | 21083027 | |
| L-methionine | Sigma Aldrich | M9625 | |
| L-Lysine | Sigma Aldrich | 23128 | |
| Methanol | LiChrosolv, HPLC grade, Merck | 1.06035 | |
| Milli-Q water (18.2 MΩ cm) | EMD Millipore Corporation | ||
| Myoglobin | Sigma Aldrich | M1882 | |
| NexION 350D ICP-MS | Perkin Elmer | ||
| Pasteur pipette | VWR | ||
| pH meter | inoLab | ||
| Phosphate-buffered saline (PBS) | Sigma Aldrich | 806552 | |
| RTgutGC cells | Obtained in kind from Professor Dr. Kristin Schirmer, Dept. of Environmental Toxicology, Eawag, Swiss Federal Institute of Aquatic Science and Technology, Switzerland | ||
| SEC column, TSKgel G3000SWxl | Tosoh | ||
| Sieve stainless steel (850?μm - 1.12?mm) | Retsch | ||
| Sodium dodecyl sulphate (SDS) | Sigma Aldrich | 436143 | |
| Superoxide dismutase | Sigma Aldrich | S7571 | |
| Thyroglobulin | Sigma Aldrich | T1001 | |
| Tricaine methanesulphonate | PharmaQ | ||
| Tris(hydroxymethyl)aminomethane | Sigma Aldrich | 252859 | |
| Trypsin in 0.25% in phosphate-buffer saline | Biowest | L0910 | |
| Versene EDTA solution | Invitrogen/Gibco | 15040-033 | |
| Vitamin B12 | Sigma Aldrich | V2876 | |
| Zinc chelate of glycine | Phytobiotics | ||
| Zinc sulphate | Vilomix |
Referências
- Ytrestoyl, T., Aas, T. S., Asgard, T. Utilisation of feed resources in production of Atlantic salmon (Salmo salar) in Norway. Aquaculture. 448, 365-374 (2015).
- Prabhu, P. A. J., et al. Evaluating dietary supply of microminerals as a premix in a complete plant ingredient-based diet to juvenile rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition. 24 (1), 539-547 (2018).
- Maret, W. Zinc biochemistry: from a single zinc enzyme to a key element of life. Advances in nutrition. 4 (1), 82-91 (2013).
- Hogstrand, C., Wood, C. M., Farrell, A. P., Brauner, C. J. . Fish Physiology. 31, 135-200 (2011).
- Baeverfjord, G., et al. Mineral nutrition and bone health in salmonids. Reviews in Aquaculture. , (2018).
- Maage, A., Julshamn, K. Assessment of zinc status in juvenile Atlantic salmon (Salmo salar) by measurement of whole body and tissue levels of zinc. Aquaculture. 117 (1), 179-191 (1993).
- Silva, M. S., Sele, V., Sloth, J. J., Araujo, P., Amlund, H. Speciation of zinc in fish feed by size exclusion chromatography coupled to inductively coupled plasma mass spectrometry – Using fractional factorial design for method optimization and mild extraction conditions. Journal of Chromatography B. , (2018).
- Prabhu, A. J., et al. Zinc uptake in fish intestinal epithelial model RTgutGC: Impact of media ion composition and methionine chelation. Journal of Trace Elements in Medicine and Biology. 50, 377-383 (2018).
- Silva, M. S., et al. Apparent availability of zinc, selenium and manganese as inorganic metal salts or organic forms in plant-based diets for Atlantic salmon (Salmo salar). Aquaculture. 503, 562-570 (2019).
- Persson, D. P., Hansen, T. H., Laursen, K. H., Schjoerring, J. K., Husted, S. Simultaneous iron, zinc, sulfur and phosphorus speciation analysis of barley grain tissues using SEC-ICP-MS and IP-ICP-MS. Metallomics. 1 (5), 418-426 (2009).
- Lothian, A., Roberts, B. R. Standards for Quantitative Metalloproteomic Analysis Using Size Exclusion ICP-MS. Journal of Visualized Experiments. (110), (2016).
- Minghetti, M., Schirmer, K. Effect of media composition on bioavailability and toxicity of silver and silver nanoparticles in fish intestinal cells (RTgutGC). Nanotoxicology. 10 (10), 1526-1534 (2016).
- Glover, C. N., Hogstrand, C. Amino acid modulation of in vivo intestinal zinc absorption in freshwater rainbow trout. Journal of Experimental Biology. 205 (1), 151-158 (2002).
- Ekman, R., Ekman, R. . Mass spectrometry: Instrumentation, interpretation, and applications. Wiley Series on Mass Spectrometry. , 105-115 (2009).
- Hong, P., Koza, S., Bouvier, E. S. P. A Review Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and Their Aggregates. Journal of Liquid Chromatography & Related Technologies. 35 (20), 2923-2950 (2012).
- Krezel, A., Maret, W. The biological inorganic chemistry of zinc ions. Archives of Biochemistry and Biophysics. 611, 3-19 (2016).
- National Research Council. . Nutrient Requirements of Fish and Shrimp. , (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados