Method Article
Vielseitiges Dual-Inlet-Probeneinführungssystem für die Multimode-Massenspektrometrie mit induktiv gekoppeltem Einzelpartikelplasma
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir ein Protokoll für die Verwendung eines Dual-Inlet-Systems für die induktiv gekoppelte Einzelpartikel-Massenspektrometrie zur Verfügung, das eine standardunabhängige Nanopartikelcharakterisierung ermöglicht.
Zusammenfassung
Metallhaltige Nanopartikel (NP) können mit Massenspektrometern mit induktiv gekoppeltem Plasma (ICP-MS) hinsichtlich ihrer Größe und Anzahlkonzentration unter Verwendung des Einzelpartikelmodus des Gerätes (spICP-MS) charakterisiert werden. Die Genauigkeit der Messung hängt von der Einrichtung, den Betriebsbedingungen des Geräts und spezifischen Parametern ab, die vom Benutzer eingestellt werden. Die Transporteffizienz des ICP-MS ist entscheidend für die Quantifizierung des NP und erfordert in der Regel ein Referenzmaterial mit homogener Größenverteilung und einer bekannten Partikelanzahlkonzentration.
Derzeit sind NP-Referenzmaterialien nur für wenige Metalle und in begrenzten Größen verfügbar. Wenn Partikel ohne Referenzstandard charakterisiert werden, können die Ergebnisse sowohl der Größe als auch der Partikelanzahl verzerrt sein. Daher wurde ein Dual-Inlet-Aufbau zur Charakterisierung von Nanopartikeln mit spICP-MS entwickelt, um dieses Problem zu lösen. Dieser Aufbau basiert auf einem konventionellen Einführsystem, bestehend aus einem pneumatischen Vernebler (PN) für Nanopartikellösungen und einem Mikrotröpfchengenerator (μDG) für ionische Kalibrierlösungen. Eine neue und flexible Schnittstelle wurde entwickelt, um die Kopplung von μDG, PN und dem ICP-MS-System zu erleichtern. Die Schnittstelle besteht aus verfügbaren Laborkomponenten und ermöglicht die Kalibrierung, Charakterisierung von Nanopartikeln (NP) und Reinigung der Anordnung, während das ICP-MS-Instrument noch in Betrieb ist.
Für die Bestimmung der Partikelgröße und -anzahlkonzentration stehen drei unabhängige Analysemodi zur Verfügung. Jeder Modus basiert auf einem anderen Kalibrierprinzip. Während Modus I (Zählen) und Modus III (μDG) aus der Literatur bekannt sind, wird Modus II (Sensitivität) nur zur Bestimmung der Transporteffizienz durch anorganische ionische Standardlösungen verwendet. Es ist unabhängig von NP-Referenzmaterialien. Das hier beschriebene μDG-basierte Einlasssystem garantiert eine überlegene Analytsensitivität und damit niedrigere Nachweisgrenzen (LOD). Die erreichten größenabhängigen LODs betragen für alle untersuchten NP (Au, Ag, CeO2) weniger als 15 nm.
Einleitung
Massenspektrometer mit induktiv gekoppeltem Plasma werden häufig zur Quantifizierung von Größe und Anzahl von NP in verschiedenen Proben und Matrizen im sogenannten Einzelpartikelmodus 1,2,3 eingesetzt. Der Einzelpartikelmodus ist ein Betrieb des Datenerfassungssystems mit einer kurzen Integrations- oder Verweilzeit. Jeder gemessene NP erzeugt in diesem Zeitintervall ein integriertes Signal (Ereignis gemessen in Zählungen pro Sekunde: cps), wenn eine angemessene Verdünnung der NP-Suspension verwendet wurde, um Doppelereignisse zu vermeiden. Sowohl der Kalibrierstandard als auch die Probe werden in der Regel über ein konventionelles Probenzuführsystem auf Basis der pneumatischen Vernebelung (PN)4 in das ICP-MS eingeführt. Als Voraussetzung müssen jedoch die Durchflussrate der Probeneinleitung und die Transporteffizienz (η) bestimmt werden, um die Metallmasse pro NP genau zu quantifizieren und ihre Anzahlkonzentration in der Suspension zu bestimmen. Die Transporteffizienz beschreibt das Verhältnis der injizierten Masse oder Partikelzahl zur Masse (Abfallsammelmethode)) bzw. Partikelzahl (Zählmethode), die vom ICP-MS5 erfasst wird. Die Transporteffizienz wird am häufigsten mit nanopartikelbasierten Referenzmaterialienbestimmt 5. Die Transporteigenschaften hängen jedoch von der Struktur des NP ab und umfassen Eigenschaften wie Zusammensetzung und Dispergiermittel der Probe. Weitere Einflussfaktoren sind instrumentelle Parameter, wie z.B. die Probenaufnahmerate, die Gasdurchflussrate des Verneblers, die Verweilzeit und die Gesamtmesszeit.
Da nur begrenzte nanopartikuläre Referenzmaterialien zur Verfügung stehen, können die erhaltenen NP-Analyseergebnisse aufgrund von Unterschieden in der elementaren Zusammensetzung zwischen Referenz- und Probenpartikeln verzerrt sein. Neben der Verfügbarkeit einer begrenzten Auswahl an Referenzmaterialien stellt die Detektion mehrerer Teilchenereignisse pro Verweilzeit des Detektors eine weitere Herausforderung dar. Dies kann sich auch auf die Genauigkeit der zu bestimmenden Transporteffizienz auswirken.
Um unabhängig von Referenzmaterialien zu sein, ist im Idealfall ein Probenzuführsystem mit einer Transporteffizienz von nahezu 100% vorzuziehen. Gleichzeitig können bei Verwendung eines geringen Volumens im Vergleich zu herkömmlichen Einbringungssystemen höhere Partikelanzahlkonzentrationen verwendet werden. Selbst wenn sich zwei Partikel nahe beieinander befinden, können beide mit dem μDG-basierten System getrennt voneinander detektiert werden.
Das μDG ist in der Lage, monodisperse Tröpfchen mit einem festen Volumen im pL-Bereich zu erzeugen und ist für diesen Zweck gut geeignet 6,7,8,9. Das μDG ermöglicht die Injektion von ionischen und partikulären Proben in verschiedenen Lösungsmitteln in die ICP-MS. Bei ionischen Metallproben wird davon ausgegangen, dass die erzeugten Tröpfchen auf dem Weg zum ICP vollständig desolvatisiert werden. Dementsprechend verliert das Tröpfchen alles Wasser und aus dem restlichen Salz bildet sich ein Partikel. Der Durchmesser dieses Partikels ist direkt proportional zur verwendeten Konzentration. So können hausgemachte Referenzstandards gleicher Matrix, Masse und Größe mit unterschiedlichen Konzentrationen der ionischen Lösung des zu untersuchenden NP im eigenen Haus hergestellt werden. Das Volumen eines Tröpfchens lässt sich anhand des mit dem μDG gemessenen Tröpfchendurchmessers leicht berechnen. Dies ist mit einer PN nicht möglich, die eine breite Verteilung von Tröpfchen mit unterschiedlichen Durchmessern10,11 erzeugt. Durch die einheitliche Probenzuführung bei hoher Transporteffizienz von 100% des μDG kann eine hohe gerätespezifische Analytsensitivität erreicht werden. Abhängig von der verwendeten Matrix führt dies zu niedrigeren Nachweisgrenzen (LOD) der Partikelmasse und -größe im Vergleich zu den Ergebnissen herkömmlicher Einbringungssysteme auf Basis von PN12. Aufgrund des Designs des μDG können Proben jedoch nicht einfach ausgetauscht werden, wenn das ICP-MS-System noch in Betrieb ist. Zwischen den Messungen verschiedener Proben muss der μDG gereinigt und anschließend zur Systemstabilisierung mit der Probenlösung gespült werden. Darüber hinaus wurde seine Toleranz gegenüber schweren Matrixproben nicht in großem Umfang getestet. Darüber hinaus wäre aufgrund der extrem niedrigen Durchflussraten die Analysezeit bis zur Erzielung einer guten Statistik extrem lang, was den praktischen Nutzen einschränkt, wenn "echte" Proben, wie z.B. Umweltgewässer, analysiert werden sollen.
Um diese Einschränkungen zu überwinden, wurde das μDG bisher in Kombination mit einem konventionellen pneumatischen Verneblersystem betrieben, das den Namen eines Dual-Inlet-Systems13 erhielt. Durch die Einführung der Kalibrierstandards mit dem μDG und der NP-Suspension über einen pneumatischen Vernebler in das ICP-MS konnten Ramkorun-Schmidt et al. die Vorteile beider Systemenutzen 13. Es wurde eine hochgenaue Bestimmung des Metallmassenanteils von Au und Ag NP erreicht, ohne dass eine Bestimmung der Transporteffizienz erforderlich war. Mit diesem dualen Einlasssystem wurden jedoch keine Partikelanzahlkonzentrationen bestimmt. Auch die Reinigung und Ausrichtung des μDG-Systems erschwerte die Anwendbarkeit für die Routineanalyse.
In diesem Artikel schlagen wir eine flexible Dual-Inlet-Schnittstelle zur Bestimmung der NP-Partikelgröße und der Partikelanzahlkonzentration vor und demonstrieren deren Aufbau und praktische Anwendung. Wie das System von Ramkorun-Schmidt et al. besteht es sowohl aus einem μDG- als auch aus einem PN-Probeneinführungssystem. Wir zeigen, dass das Dual-Inlet-System in seinem derzeitigen Entwicklungsstadium die Anwendung von drei unabhängigen Analysemodi zur Untersuchung und Charakterisierung metallhaltiger NPs ermöglicht. Unser Dual-Inlet-System vereinfacht das Kalibrierverfahren für die NP-Bestimmung und verbessert die analytischen Kennzahlen, insbesondere die Genauigkeit14. Die Einlasssysteme ermöglichen einen bequemen Probenwechsel und eine Reinigung des μDG, auch wenn das ICP-MS noch in Betrieb ist, wodurch die Gesamtanalysezeit und das Risiko einer Fehlausrichtung reduziert werden. Um die Systemleistung zu testen, werden gut charakterisierte Referenz-NP (60 nm AuNP – NIST 8013, 75 nm AgNP – NIST 8017) zur Methodenvalidierung und Vergleichbarkeit verwendet.
Protokoll
1. Montage des Setups für die Probeneinführung mit zwei Eingängen
HINWEIS: Details zu den einzelnen Teilen sind in Tabelle 1 aufgeführt.
| Komponenten | |||
| Teil 1 | Kugelgelenk aus Glas mit ca. 10 mm Schaftlänge | ||
| Kugelgelenk aus Glas mit ca. 10 mm Schaftlänge | |||
| Metall-T-Stück (Abmessungen: 1/4 Zoll) | |||
| Glas-Metall-Kleber | |||
| Zwei Klemmen für kugelförmige Glasverbindungen | |||
| Teil 2 | ICP-MS Sprühkammer (empfohlener Typ: Prallraupen-Sprühkammer, Zyklon-Sprühkammer o.ä.) | ||
| Pneumatischer Vernebler (empfohlener Typ: konzentrischer Vernebler) | |||
| Klammer | |||
| Teil 3 | Quarzbrenner ohne O-Ring | ||
| Gasleitungsverbinder geschlossenes Ende | |||
| Gasleitungsverbinder mit offenem Ende | |||
| Leitfähiger und flexibler Silikonschlauch | |||
| Teil 4 | Piezoelektrische Anlage zur Erzeugung von Mikrotröpfchen | ||
| Teil 5 | Mikrotröpfchen-Steuergerät | ||
Tabelle 1: Liste der Komponenten, die zum Aufbau des Dual-Inlet-Setups verwendet wurden.
- Aufbau einer T-Stück-Verbindungseinheit (Bild 1 Teil 1).
HINWEIS: Dieser Teil verbindet das konventionelle Probenzuführsystem (Schritt 1.2) und die μDG-Transporteinheit (Schritt 1.3).- Setzen Sie ein männliches und ein weibliches Kugelgelenk in die gegenüberliegenden Öffnungen eines T-Stück-Verbinders ein.
- Befestigen Sie die Kugelgelenke mit einem Glas-Metall-Kleber (z. B. Silikonkleber).
- Verbinden Sie das weibliche Kugelgelenk mit einer Klemme mit dem Injektor des ICP-MS.
- Anbringung eines konventionellen Probenzuführsystems (Abbildung 1 Teil 2)
HINWEIS: Dieses Teil wird mit der T-Stück-Verbindungseinheit (Schritt 1.1) verbunden- Kombinieren Sie eine ICP-MS-Sprühkammer mit einem pneumatischen Vernebler (PN), der in die verwendete Sprühkammer passt.
- Verbinden Sie den Sprühkammerauslass mit einer Klemme mit dem Kugelgelenk des T-Stück-Verbinders (beschrieben in Schritt 1.1).
HINWEIS: Der Auslass der Sprühkammer ist in der Regel mit einer Kugelkupplung ausgestattet. Die in Abbildung 1 gezeigte Kombination besteht aus einem Vernebler und einer Prallperlensprühkammer. Anstelle der Prallraupen-Sprühkammer können auch andere Sprühkammern mit Transportwirkungsgraden im Bereich von 2 bis 10 % oder höher verwendet werden.
- Aufbau der Mikrotröpfchen-Transporteinheit (Abbildung 1 Teil 3)
HINWEIS: Dieses Teil verbindet die T-Stück-Verbindungseinheit (Schritt 1.1) und die μDG-Einheit (Schritt 1.4).- Befestigen Sie einen abnehmbaren Quarzbrenner mit entferntem Injektorrohr mit geeigneten Klemmen an einem Laborständer, wobei der Brennereinlass oben angebracht ist.
- Blockieren Sie den Plasma-/Hilfsgaseinlass des Brenners durch geschlossene Gasanschlüsse.
HINWEIS: Die Probe wird mit einer Schlauchpumpe zum Vernebler transportiert. Argongas wird für die Probenvernebelung in die Sprühkammer und den Weitertransport in das Plasma verwendet. - Schließen Sie eine Heliumgasleitung über den Kühlgaseinlass mit einem entsprechenden Gasanschluss an den Brenner an.
HINWEIS: Das aufgebrachte Heliumgas wird für die Desolvatisierung der erzeugten Tröpfchen verwendet und wirkt als Mantelgas, das eine Kollision des Tröpfchens mit den Wänden des Aufbaus verhindert und das ICP-MS-Instrument vor dem Einbringen von Sauerstoff in die Atmosphäre schützt, während der Probeneinlasskopf des μDG zur Reinigung und zum Probenaustausch entfernt werden muss. - Verbinden Sie einen 30 cm langen leitfähigen und flexiblen Silikonschlauch (i.d. 0,75 cm) mit einem Adapter mit dem Ausgangende des Brenners (Unterseite des Brenners).
- Verbinden Sie das nach unten gerichtete Ende des Silikonschlauchs mit der T-Stück-Verbindungseinheit, indem Sie den flexiblen Silikonschlauch über die verbleibende vertikale Metallverbindung spannen.
HINWEIS: Der flexible Silikonschlauch ermöglicht die X-Y-Z-Abstimmung des ICP-MS-Instruments mit dem angeschlossenen Setup.
- Anschluss der Mikrotröpfchenerzeugungseinheit und der Steuereinheit der Mikrotröpfchenerzeugung (Abbildung 1 Teil 4, Teil 5)
HINWEIS: Dieses Teil ist mit der μDG-Transporteinheit verbunden (Schritt 1.3)- Verbinden Sie die vorbereitete μDG-Einheit mit der Mikrotröpfchen-Transporteinheit, indem Sie den μDG-Kopf in das Probeneinlassende des Brenners einführen.
- Schließen Sie das Netzteil an das μDG-Steuergerät an.
HINWEIS: Der hier beschriebene Aufbau besteht aus einem handelsüblichen μDG-Kopf und einem μDG-Netzteil. Je nach verwendetem μDG-Kopf muss der Aufbau entsprechend angepasst werden.
2. Quantifizierung der Tröpfchengröße
- Verwenden Sie ein Stroboskoplicht und eine CCD-Kamera (z. B. in einer offenen Konfiguration, siehe Abbildung 1 Konfiguration der Größenmessung), um Bilder von erzeugten Tröpfchen durch das μDG aufzunehmen.
- Kalibrieren Sie die CCD-Kamera, indem Sie Bilder eines Objekts bekannter Größe im μm-Bereich aufnehmen (z. B. Kupferdraht mit einem Durchmesser von 150 μm).
- Nehmen Sie Bilder von mindestens 1.000 Tropfen mit den für das Experiment verwendeten Einstellungen auf (siehe Tabelle 2).
- Verwenden Sie eine geeignete grafische Software (siehe Materialtabelle), um die Bilder bezüglich des Objekts und der Tropfengröße in folgenden Schritten auszuwerten:
- Klicken Sie auf Datei und Öffnen , um das Bild des Objekts zu laden.
- Klicken Sie auf Bild | Anpassen | Schwellenwert, um den Bereich des Objekts durch Verschieben der Bildlaufleisten zu definieren.
- Klicken Sie auf Übernehmen , um die Einstellungen zu übernehmen.
- Klicken Sie auf die Schaltfläche Gerades Segment.
- Klicken Sie mit der linken Maustaste und halten Sie die linke Maustaste gedrückt, um eine Linie neben dem Objekt zu zeichnen.
- Drücken Sie Strg + M , um die Objektgröße zu messen.
- Messen Sie den Durchmesser des Objekts an 5 verschiedenen Punkten.
- Kopieren Sie die Tabelle "Ergebnisse" und fügen Sie sie in eine Tabellenkalkulationssoftware ein.
- Berechnen Sie das arithmetische Mittel der Spalte "Länge".
- Berechnen Sie das Pixel-Seitenverhältnis (PAR): tatsächliche Objektgröße (μm)/mittlere Objektgröße im Bild (px).
- Klicken Sie auf Datei | Importieren | Image Sequence zum Importieren und Laden der Bilder der Tröpfchen.
- Klicken Sie auf Rechteckig und markieren Sie das Tröpfchen des ersten Bildes.
- Führen Sie einen Rechtsklick auf dem Mauspad aus und wählen Sie Duplizieren , um die Tröpfchen der Bildsequenz vom Rest des Bildes zu trennen.
- Trennen Sie die Tröpfchen vom Hintergrund, wie in Schritt 2.4.2 beschrieben.
- Klicken Sie auf Prozess | Binär | Erodieren , um Lichtreflexionen auf der Tröpfchenoberfläche zu entfernen.
- Klicken Sie auf Prozess | Binär | Erweitern , um den Schritt "Erodieren" umzukehren.
- Klicken Sie auf Analysieren | Analysieren von Partikeln | Ok , um alle Tröpfchen zu messen.
- Kopieren Sie die Tabelle "Zusammenfassung" oder "Ergebnis" und fügen Sie sie in eine Tabellenkalkulationssoftware ein.
- Berechnen Sie das arithmetische Mittel des Frettchendurchmessers in px.
- Verwenden Sie den PAR, um den Durchmesser in μm zu transformieren: Frettchendurchmesser in px/PAR.
HINWEIS: Die Größe der vom μDG gebildeten Tröpfchen variiert in Abhängigkeit von der gewählten Länge und Dauer des Stromimpulses, der an das Piezoelement7 angelegt wird.
3. Vorbereitung der Probe
- Bereiten Sie eine ionische Kalibrierlösung des Analyten vor, der im Konzentrationsbereich von 0,2 bis 20 μg/l in verdünnter Säure (z. B. HCl (0,5 v/v), HNO3 (3,5 v/v)) gemessen werden soll.
- Bereiten Sie eine ionische Lösung für die Einpunktkalibrierung im Konzentrationsbereich zwischen 1 und 10 μg/L in verdünnter Säure vor.
- Bereiten Sie die NP-Standardsuspensionen gemäß den Anweisungen des Herstellers oder internen Protokollen vor.
HINWEIS: In den Schritten 3.3.1 bis 3.3.4 wird die Herstellung der NP-Standardsuspensionen am Beispiel von Ag, Au undCeO 2 NP erläutert.- Bereiten Sie 10 ml 0,05 μg/l AuNP-Lösung für die PN und 1 μg/l AuNP-Lösung in Reinstwasser für μDG vor. Vor der Verwendung 20–60 Sekunden lang vortexen.
- Bereiten Sie 0,05 μg/l AgNP-Lösung für die PN und 2 μg/l AgNP-Lösung, beide in Reinstwasser, für μDG vor. 20–60 Sekunden gut schütteln, bevor Sie15 Sekunden verwenden.
- CeO2 NP-Lösungen herstellen, die wie zuvor beschrieben für Metalloxide16, 17 verwendet werden sollen.
- Bereiten Sie 0,05 μg/L CeO2 NP-Lösung für die PN und 1 μg/L Lösung für die μDG vor.
- Wiegen Sie 25,6 mg/mL CeO2 NP in einem Glasgefäß von 15 mL – 20 mL insgesamt und fügen Sie 10 mL 0,05 (v/v) BSA-Lösung hinzu, die in Reinstwasser hergestellt wurde.
- Verwenden Sie einen Fingerspitzen-Ultraschallator mit einer Leistung von 7,35 W, um die Partikellösung 309 s lang zu homogenisieren.
4. Instrumentale Abstimmung und Parameter
- Stellen Sie sicher, dass der MDG-Generator ausgeschaltet ist, und verbinden Sie die in Schritt 1 eingebaute Probeneinführungseinrichtung mit zwei Eingängen mit dem Injektor des ICP-MS-Geräts mit einer Klemme. Spülen Sie das Zulaufsystem für 5 – 10 min mit dem Verneblergas (Ar) und dem Tröpfchentransportgas (He).
HINWEIS: Das ICP-MS-Gerät muss gegen das Eindringen hoher Sauerstoffmengen in den Plasmaraum geschützt werden. - Schalten Sie das Tröpfchentransportgas (He) aus und starten Sie das ICP-MS-System
- Stimmen Sie das Gerät in dem Messmodus, den Sie verwenden möchten, mit der vom Hersteller des ICP-MS-Systems angegebenen Standard-Stimmlösung des Instruments.
HINWEIS: Eine Standard-Abstimmlösung besteht z. B. aus Barium, Cer, Indium, Uran, Wismut, Kobalt, Lithium (alle 1 μg/L) in einem Gemisch aus 2,5 % (v/v) Salpetersäure und 0,5 % (v/v) Salzsäure. - Bestimmung der Probenaufnahmerate des PN.
- Füllen Sie ein Gefäß mit 15 ml Wasser.
- Wiegen Sie das Gefäß.
- Verbinden Sie das Gefäß mit dem Schlauch des PN.
- Starten Sie die Schlauchpumpe, indem Sie in der Gerätesoftware auf die Schaltfläche zum Starten der Schlauchpumpe klicken.
- Starten Sie einen 5-Minuten-Timer.
- Entfernen Sie die Aufnahmeleitung genau nach 5 min vom Gefäß. Wiegen Sie das Gefäß erneut.
- Berechnen Sie die Probenaufnahmerate (mL/min) mit der Formel: Gefäßgewicht vorher - Gefäßgewicht nach / Zeitdauer.
- Optimieren Sie bei Bedarf instrumentelle Parameter, um die Empfindlichkeit des Analyten zu verbessern, z. B. die Durchflussrate des Verneblergases, die Probenahmetiefe und die Plasmaleistung.
HINWEIS: In Tabelle 2 finden Sie ein Beispiel für instrumentelle Parameter, die in einem ICP-MS-System optimiert werden können. - Der He-Gasfluss wird so lange eingestellt, bis eine konstante Signalrate in Abhängigkeit von der Tropfenbildungsrate erkannt werden kann.
| Parameter | Wert | ||
| ICP – MS: | |||
| Plasmaleistung (W) | 1600 | ||
| Probenahmetiefe (mm) | 4 | ||
| Durchflussmengen (L min-1): | |||
| Hilfsgas | 0.65 | ||
| Kühlgas | 14 | ||
| Zeiten (s) | |||
| Datenerfassung(en) | 1200 | ||
| Verweildauer(en) | 0.01 | ||
| Schnittstelle: | |||
| PN Aufnahmerate der Probe (mL min-1) | 0.21 | ||
| Gasvernebler (L min-1) | 0.92 | ||
| μDG: | |||
| Kapillardurchmesser (μm) | 75 | ||
| Drop-Rate (Hz) | 10 | ||
| Er Schminke Gas (L min-1) | 0.27 | ||
| Betriebsart | Dreifacher Impuls | ||
| Satz 1 | Satz 2 | Satz 3 | |
| Spannung (V) | 53 | 51 | 47 |
| Pulsbreite (μs) | 20 | 25 | 12 |
| Impulsverzögerung (μs) | 4 | 2 | 1 |
Tabelle 2: Werte der verwendeten instrumentellen Parameter.
5. Multimode-Messung von Nanopartikelproben
- Vorbereiten des μDG-Steuergeräts
- Schalten Sie den Netzschalter des μDG-Steuergeräts ein.
- Klicken Sie auf dem ersten Bildschirm auf Start , um das Steuergerät zu starten.
- Klicken Sie auf Globale Einstellungen , um den zu verwendenden Impulsmodus auszuwählen.
- Klicken Sie auf die rechte grafische Schaltfläche im Impulsmodus, um den Dreifachimpulsmodus auszuwählen.
HINWEIS: Die Einstellungen für den Dreifachimpulsmodus sind in Tabelle 2 aufgeführt.
- Bereiten Sie die μDG-Einheit vor
- Klicken Sie auf Ein/Aus , um den μDG zu starten.
- Füllen Sie das Probengefäß mit der zu messenden Probenlösung.
- Verbinden Sie das Probengefäß mit der μDG-Einheit.
- Verwenden Sie eine 10-ml-Spritze, um Luft durch das Gefäß und die μDG-Einheit zu spülen.
- Verbinden Sie die Spritze mit dem Spritzenanschluss am Probenbehälterbehälter.
- Schieben Sie den Spritzenkolben, bis ein konstanter Flüssigkeitsstrom aus dem μDG-Kopf austritt.
- Halten Sie den Druck 10 s lang aufrecht.
- Entfernen Sie die Spritze.
- Platzieren Sie die μDG-Einheit in der Fokuszone der CCD-Kamera, um die gebildeten Tröpfchen zu beobachten.
- Schließen Sie die CCD-Kamera an einen PC oder Laptop an.
- Starten Sie die CCD-Kamerasoftware, um die gebildeten Tröpfchen zu beobachten
- Klicken Sie auf Start , um eine Live-Ansicht der Tröpfchen zu erhalten.
- Beobachten Sie eine konstante Tröpfchenbildung.
- Setzen Sie den μDG-Kopf auf den umgekehrten Brenner des Probeneinführungssystems mit zwei Eingängen.
- Validieren Sie sowohl die μDG-Einheit als auch die PN für jedes Element von Interesse, indem Sie wiederholte Mehrpunktkalibrierungen messen.
HINWEIS: Verwenden Sie für die ICP-MS-Datenerfassung die mit dem Gerät verknüpfte Software. - Bestimmen Sie den linearen Bereich der Mehrpunktkalibrierung, indem Sie die experimentellen Daten in eine Tabellenkalkulationssoftware importieren.
- Berechnen Sie das arithmetische Mittel jedes Kalibrierpunkts.
- Bestimmen Sie den Schnittpunkt, die Steigung und den Korrelationskoeffizienten.
HINWEIS: Für sp-ICP-MS sollte der Korrelationskoeffizient >0,9918 betragen.
- Wählen Sie für spätere Ein-Punkt-Kalibrierungen eine Konzentration im linearen Bereich der Kalibrierkurven.
- Befolgen Sie die folgenden Schritte zur Messung und Validierung (unter Verwendung von Referenzmaterialien wie NIST 8012, NIST 8013 oder NIST 8017 oder ähnlichem) der Multi-Mode-Nanomaterialquantifizierung (Abbildung 2).
- Wählen Sie ein Nanopartikel und einen Ionenstandard entsprechend dem interessierenden Analyten aus.
- Bereiten Sie die μDG-Einheit gemäß 5.2 mit einer ionischen Standardlösung vor.
- Geben Sie eine verdünnte saure Lösung (z. B. 0,5 % v/v HCl) über den PN hinzu.
- Starten Sie die Messung des ICP-MS-Systems im zeitaufgelösten Modus.
- Klicken Sie nach 120 s auf Ein/Aus , um den μDG zu stoppen und die verdünnte saure Lösung am PN gegen den Ionenstandard auszutauschen.
- Nach 330 s wird das Ionennormal an der PN wieder gegen eine verdünnte saure Lösung ausgetauscht.
- Entfernen Sie in der Zwischenzeit die μDG-Einheit aus dem Setup.
- Tauschen Sie das Probengefäß (Glasfläschchen) der μDG-Einheit gegen ein Gefäß aus, das eine verdünnte saure Lösung (z. B. 3,5 % HNO3) enthält, um die μDG-Einheit zu reinigen.
- Füllen Sie eine 10-ml-Spritze mit Luft.
- Schließen Sie die Spritze an den Injektionsanschluss des μDG-Geräts an und entleeren Sie die Spritze, bis ein Flüssigkeitsstrahl aus dem μDG-Kopf austritt, und halten Sie den Druck 30 s lang aufrecht.
- Bereiten Sie das μDG wie in Schritt 5.2 beschrieben mit der NP-Probe vor und befestigen Sie das μDG-Gerät bei 510 s wieder an der Aufbaueinheit.
- Klicken Sie nach 810 s auf Ein/Aus , um den μDG zu stoppen.
- Die verdünnte saure Lösung an der PN gegen die NP-Probe austauschen und weitere 300 s messen.
- Stoppen Sie die Messung nach ca. 1.200 s.
- Reinigen Sie die μDG-Einheit wie in Schritt 5.5.8 beschrieben.
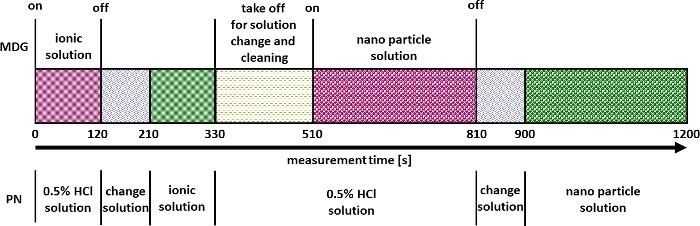
Abbildung 2: Messstrategie für die Multimode-Quantifizierung von Nanomaterialien. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Datenanalyse
HINWEIS: Um alle Berechnungsschritte zu vereinfachen, wurde eine entsprechende Tabelle erstellt (siehe Zusatzdatei).
- Verwenden Sie eine Tabellenkalkulation oder Software, die mit Datenrahmen umgehen kann, um die Daten zu verarbeiten und die gemessenen Daten zu importieren. Fügen Sie die Intensitätswerte der gesamten Messung in die Tabellenkalkulationssoftware (im elektronischen Anhang enthalten) in Spalte A ein, die Daten werden visualisiert. Tragen Sie alle notwendigen experimentellen Parameter für die Berechnung in die Tabelle "Eingabeparameter" ein.
- Definieren Sie die Regions of Interest (ROI) für μDG ionisch (I), PN ionisch (II), μDG NP (III) und PN NP (IV), indem Sie die entsprechenden Tabellenzellen auswählen. Anhand des Diagramms im vorbereiteten Blatt können Sie die Grenzen der ROIs definieren und die Werte in die Tabelle "Bestimmung des Interessenbereichs" (Zellen C1:E7) eingeben.
- Kopieren Sie die einzelnen Datasets, und fügen Sie sie in eine separate Spalte ein. Drücken Sie im vorbereiteten Blatt die Schaltfläche ROI kopieren , um die Messung in die vier ROIs aufzuteilen (Spalte M:P).
- Berechnen Sie das arithmetische Mittel von I und II.
- Wenden Sie den iterativen Ansatz an, um Partikel- oder Tröpfchensignale und den Hintergrund für III und IV zu trennen.
- Berechnen Sie das arithmetische Mittel und die Standardabweichung aller Messwerte.
- Berechnen Sie einen Grenzwert oder Cutoff-Wert anhand des Mittelwerts + 5*Standardabweichung.
- Entfernen Sie alle Signale, die kleiner als der Grenzwert von III und IV sind, indem Sie den Befehl "Schneiden " auf die identifizierten Teilchensignale anwenden. Verwenden Sie Einfügen , um sie in einer separaten Spalte einzufügen.
- Wiederholen Sie die Schritte 1 bis 3, bis der Mittelwert und die Standardabweichung konstant sind.
HINWEIS: In den Spalten Q bis BD des vorbereiteten Blattes wird der iterative Ansatz zur Trennung von Hintergrund- und Partikelsignalen fünfmal durchgeführt.
- Berechnen Sie das arithmetische Mittel der identifizierten Teilchensignale von III und IV.
- Berechnen Sie die minimal nachweisbare Partikelgröße (LOD-Größe - nm) für μDG NP und PN NP unter Verwendung der instrumentellen Nachweisgrenze des Analyten (LOD - Zählungen), der Analytempfindlichkeit (SC,ionisch – Zählung/(μg/L)), der Probenaufnahmerate (qs – mL/min), der Transporteffizienz (η – relative Einheit) und der Schüttgutdichte (ρ – g/cm³):
- Berechnen Sie die Masse (ma,p) und die Partikelgröße (d – nm, unter der Annahme, dass die Partikel kugelförmig sind) der identifizierten Partikelsignale für μDG NP und PN NP gemäß den drei angewandten Analysemodi unter Berücksichtigung der ionischen Metallkonzentration einer Standardlösung (ca - μg/L) und des Ionenflusses im Plasma (counts/s):
- Masse:

- Größe:

- Masse:
- Berechnung der spezifischen Transporteffizienz der Analysemodi anhand der Anzahl der detektierten Partikel (qp), der Partikelkonzentration der Probe (cp, verwendet - 1/mL), der Analytempfindlichkeit des PN und MDG (Sm, ionisch, PN, Sm, ionisch, MDG – Anzahl/(μg/L)), des Volumens des Tröpfchens (V Tropfen – pL), die Verweilzeit (td – ms), die Transporteffizienz des PN (ηPN), die Transporteffizienz des μDG (ημDG), die Intensität der mit PN und μDG gemessenen ionischen Lösungen ( Iionc, PN, Iionic, μDG – counts) und die Konzentration der ionischen Lösung, die für beide Injektionssysteme (cionic, PN, cionisch,μDG - μg/L):
- Modus I:

- Modus II:

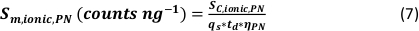

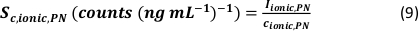
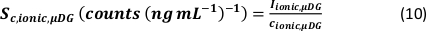
- Modus I:
- Angenommen, die Transporteffizienz von μDG ist gleich 1:19
- Berechnen Sie die Partikelanzahlkonzentration der analysierten NP-Lösung unter Berücksichtigung des injizierten Probenvolumens während der Messung (Vinjiziert):
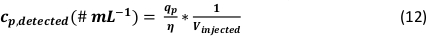
HINWEIS: Im vorbereiteten Blatt werden alle Berechnungen nach dem Splitten automatisch durchgeführt. Die Ergebnisse sind in der Tabelle "Ausgabeparameter" (Zellen BH7:BR35) dargestellt und enthalten die oben beschriebenen Formeln inklusive einzelner Berechnungsschritte.
Ergebnisse

Abbildung 3: Bestimmung der Tröpfchengröße mit der CCD-Kamera. Kalibrierung der CCD-Kamera mit einem 150 μm Kupferdraht (A) und Bestimmung der Tröpfchengröße nach Umwandlung der erzielten Tröpfchenbilder in ein binäres Farbbild (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
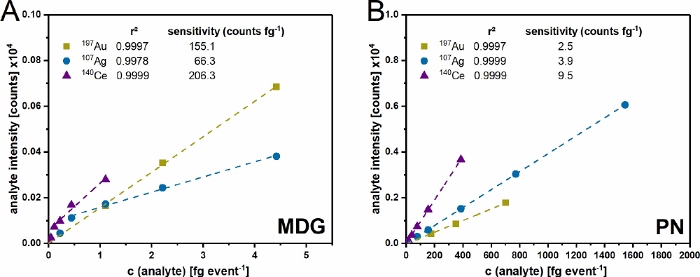
Abbildung 4: Validierung des Dual-Inlet-Setups. Mehrpunktkalibrierung des μDG (A) und PN (B) Einlasssystems für Gold (Au), Silber (Ag) und Cer (Ce). Die verwendete Konzentration im Bereich von 0,2 – 20 μg mL-1 wird je nach verwendeten Versuchsbedingungen in Masse pro detektiertem Ereignis umgerechnet. Bei den dargestellten Daten handelt es sich um die Durchschnittswerte von drei unabhängigen Replikaten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
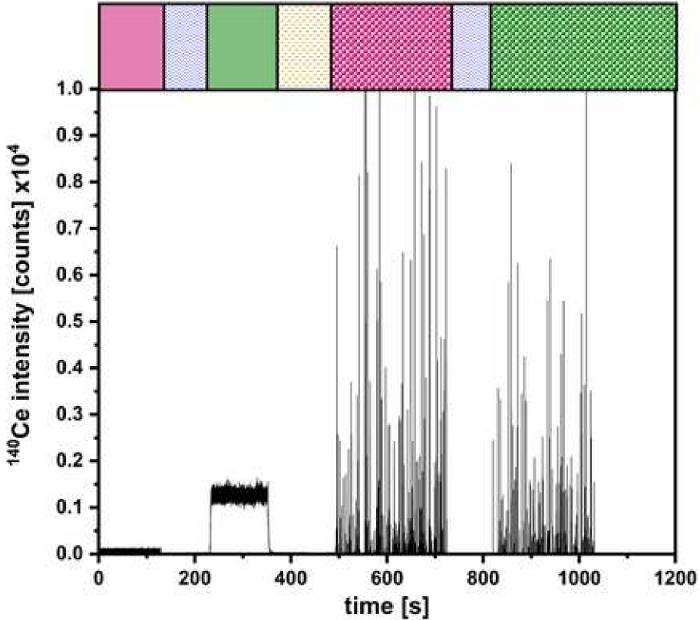
Abbildung 5: Darstellung der Messung für den Dual-Inlet-Aufbau. Die Quantifizierung vonCeO 2 NP mit farbigen Balken wie in Abbildung 2 für die verschiedenen Injektionsschritte durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Probe | Analyse-Modus / | Einlass für NP-Probe | Einlass für Kalibrierstandards | η | MA, P | NP-Größe (d) | #NPs | Rückgewinnung (%) | |
| η PN-Bestimmung | (%) | (fg) | (nm) | (mL-1 x103) | |||||
| Au 56 nm | Modus-I / | PN | PN: Au-Ionen- und AuNP-Standards | 1.8 (0.1) | 1.9 (0.5) | 57.2 (4.3) | 28.1 (0) | 100 | |
| NIST 8013 | Zählmethode | ||||||||
| Modus-II / | PN | PN/μDG: | 1.9 (0.1) | 2 (0.4) | 58 (3.6) | 25.6 (1.6) | 91 | ||
| Empfindlichkeitsverhältnis | Au-Ionen-Standards | ||||||||
| Modus-III / | μDG | μDG: | 100 | 1.7 (0.2) | 55 (2.4) | 394.4 (29.3) | 70 | ||
| ημDG = 1 | Au-Ionen-Standard | ||||||||
| Erwartete Größe (nm) | 56.0 (0.5) | ||||||||
| Ag 75 nm | Modus-I / | PN | PN: Ag-Ionen- und AgNP-Standards | 2.3 (0.2) | 1.9 (0.2) | 70.2 (2.3) | 21.6 (0) | 100 | |
| NIST 8017 | Zählmethode | ||||||||
| Modus-II / | PN | PN/μDG: | 2.5 (0.2) | 2 (0.2) | 71.5 (2.1) | 20.5 (1.9) | 95 | ||
| Empfindlichkeitsverhältnis | Ag-Ionen-Standards | ||||||||
| Modus-III / | μDG | μDG: | 100 | 2.5 (0.2) | 76.7 (2.3) | 757.1 (68.7) | 88 | ||
| ημDG = 1 | Ag-Ionen-Standard | ||||||||
| Erwartete Größe (nm) | 74.6 (3.8) | ||||||||
| CeO2 JRC NM212 | Modus-I / | PN | PN: Ce-Ionen- und AuNP-Standards | 1.7 (0) | 0.90 (0.09) | 61.9 (2.0) | 7.59 (0.32) | - | |
| 10-100 nm | Zählmethode | ||||||||
| Modus-II / | PN | PN/μDG: | 4.9 (1.4) | 1.36 (0.35) | 70.6 (5.9) | 5.42 (1.7) | - | ||
| Empfindlichkeitsverhältnis | Ce-Ionen-Standards | ||||||||
| Modus-III / | μDG | μDG: | 100 | 1.63 (0.62) | 74.4 (9.2) | 590 (168) | - | ||
| ημDG = 1 | Ce-Ionen-Standard | ||||||||
Tabelle 3: Ergebnisse des Dual-Inlet-Setups. Transporteffizienz, Metallmassenanteil, Durchmesser und NP-Zahlkonzentration für Au NIST 8013, Ag NIST 8017 und CeO2 JRC NM 212 (n=3) NP-Materialien unter Verwendung von drei Analysemodi und drei Methoden zur Bestimmung der Transporteffizienz. Die prozentuale Wiederfindung ist definiert als das Verhältnis der ermittelten #NPs zur erwarteten #NPs. Die Tabelle wird mit Genehmigung von Referenz14 nachgedruckt.
Das hier vorgestellte Protokoll ermöglicht die Bestimmung der Partikelmasse und -anzahlkonzentration. Die μDG-Tröpfchenbildung einschließlich der Tröpfchengröße (Abbildung 3) wurde zuvor charakterisiert (Tabelle 3).
Nachdem der Aufbau aufgebaut war (Abbildung 1) und die Tröpfchengröße bestimmt war, wurden beide Injektionssysteme mit ionischen Standards validiert (Abbildung 4). Mit beiden Einspritzsystemen konnte für alle untersuchten Elemente eine Genauigkeit von r² > 0,99 erreicht werden. Bei beiden Systemen gibt es jedoch Unterschiede aufgrund der Menge an Analyt, die eingebracht und transportiert wird. Da das μDG eine sehr hohe Transporteffizienz (bis zu 100%) aufweist, werden bei gleichzeitig geringem Masseneintrag höhere Analytsensitivitäten im Vergleich zum PN beobachtet. Die gemessenen Konzentrationen, die durch das μDG eingebracht werden, müssen jedoch in zwei lineare Bereiche unterteilt werden. Für Ag kann der erste lineare Bereich zwischen 0 und 0,5 fg event-1 und der zweite zwischen 0,5 und fg event-1 beobachtet werden. Im Gegensatz dazu liegt der erste lineare Bereich für Ce zwischen 0 und 0,25 fg event-1 und der zweite zwischen 0,25 und 3 fg event-1. Der lineare Bereich für PN für die gemessenen Konzentrationen scheint höher zu sein. Dies hängt höchstwahrscheinlich mit der Differenz der in die ICP-MS eingebrachten Masse pro Detektionsereignis zusammen. Das μDG injiziert eine konstante absolute Menge in einem geringen Volumen pro Tropfen und Detektionsereignis, was zu einer geringeren detektierten Masse im Vergleich zur Einführung von Proben mit dem PN führt.
Nach der erfolgreichen Validierung können Experimente durchgeführt werden, wie in Abbildung 2 beschrieben. Ein Ergebnis solcher Versuche ist in Abbildung 5 beispielhaft für die Bestimmung der Partikelgrößen- und Anzahlkonzentration vonCeO2 NP dargestellt. Hier können die Signale für die über μDG und PN eingeführten ionischen und NP-Lösungen identifiziert werden. Für alle untersuchten Partikel wurde eine dreifache Bestimmung durchgeführt.
Die Auswertung der gewonnenen Daten erfolgte wie oben beschrieben und ist in Tabelle 3 zusammengefasst. Für den Au- und Ag-NP, der für die Validierung des Duel-Inlet-Setups und der drei Analysemodi verwendet wurde, konnte die zertifizierte Partikelgröße und -anzahlkonzentration mit allen durchgeführten Analysemodi erreicht werden. Die fürCeO 2 erhaltenen mittleren Partikelgrößen liegen zwischen 10 und 100 nm, dem vom Hersteller angegebenen Bereich.
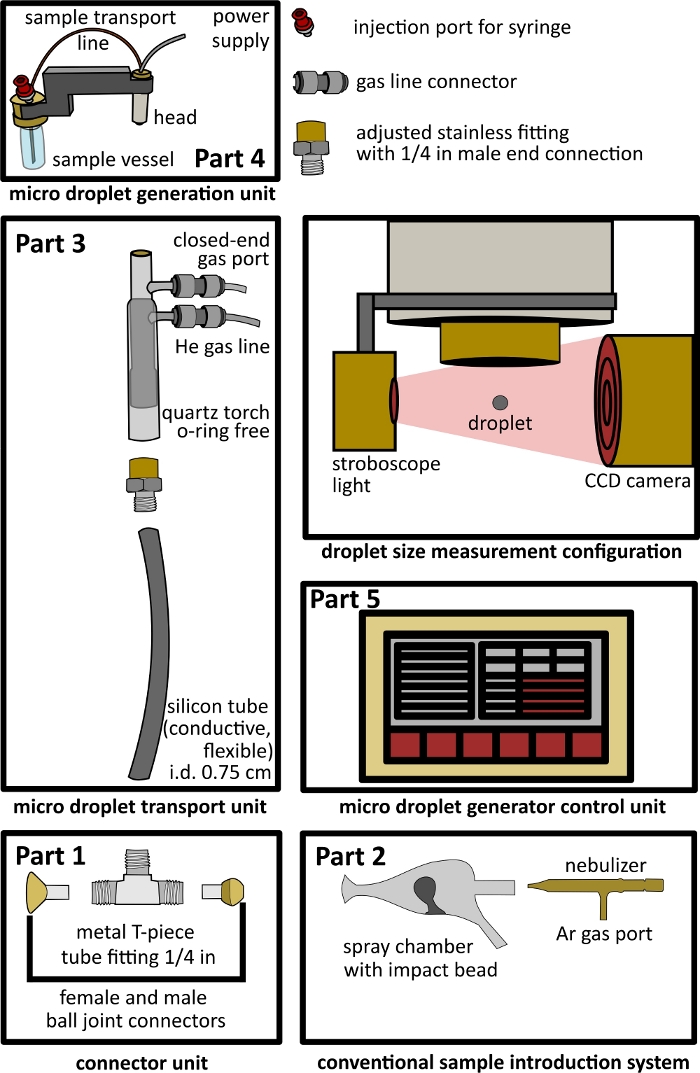
Abbildung 1: Aufbau des Setups der Dual-Inlet-Schnittstelle. Teil 1 - Anschlusseinheit, Teil 2 - konventionelles Einführsystem, Teil 3 - Mikrotröpfchentransporteinheit, Teil 4 - Mikrotröpfchenerzeugungseinheit, Teil 5 - Mikrotröpfchensteuerung und offene Konfiguration für die Tröpfchengrößenmessung einschließlich einer Stroboskopleuchte und einer CCD-Kamera. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Ziel des entwickelten Dual-Inlet-Aufbaus ist die möglichst genaue Charakterisierung und Quantifizierung von NP hinsichtlich ihrer Größe und Anzahlkonzentration unter Verwendung verschiedener Analysemodi, unabhängig vom zu untersuchenden Analyten. Durch die Kombination eines Einführsystems mit geringem Volumen (pL) und hohem Massentransport (bis zu 100%) (μDG) mit einem konventionellen Einführsystem (PN) ist dies möglich. Mit Hilfe des in dieser Arbeit vorgestellten Aufbaus kann die elementspezifisch basierte Transporteffizienz, die für die Quantifizierung der Partikelmasse erforderlich ist, auf der Grundlage ionischer Standards und unabhängig von NP-Referenzmaterialien bestimmt werden. Darüber hinaus weisen die NPs, die mit dem μDG in die ICP-MS eingebracht werden, eine engere (AuNP) oder ähnliche (AgNP) Partikelgrößenverteilung auf. Ansonsten wurde für CeO2 eine breitere Größenverteilung für das μDG beobachtet, die auf die höhere Polydispersität der analysierten Probe zurückzuführen ist. Durch die Einführung eines geringen Volumens können zwei NPs getrennt voneinander detektiert werden, die sonst im herkömmlichen Aufbau14 als ein NP interpretiert würden.
Die Vorteile, die sich aus der μDG-Transporteinheit ergeben, sind die hohe Flexibilität durch den flexiblen Silikonschlauch, der das Ausrichten des Aufbaus vereinfacht. Der Brenner mit dem Injektor kann auch während des Setups eingestellt werden, während er noch mit dem ICP-MS verbunden ist. Die zusätzlich angelegte He-Gasströmung verhindert eine Kollision der durch den μDG-Kopf gebildeten Tröpfchen mit den Schlauchwänden20. Darüber hinaus ermöglicht das He-Gas die Entfernung des μDG-Kopfes während des Probenaustauschs, auch wenn die ICP-MS noch in Betrieb ist. Das ICP in einem betriebsbereiten Zustand zu halten, ist entscheidend für eine stabile und robuste Messung. Da der μDG-Kopf mit jeder neuen Probe oder jedem neuen Standard gereinigt und gespült werden muss, ist die He-Strömung für den Betrieb des in dieser Arbeit vorgestellten Einlasssystems von entscheidender Bedeutung. Darüber hinaus müssen alle Teile des Dual-Inlet-Setups korrekt angeschlossen werden, um das Eindringen von Sauerstoff in das System zu verhindern. Um den Sauerstoffgehalt in dem vorgestellten Aufbau zu verringern, wird das System vor der Zündung des Plasmas für mindestens 5 bis 10 Minuten mit dem Vernebler und dem Tröpfchentransportgas gespült.
Wenn die gebildeten Tröpfchen die Verbindungseinheit erreichen, werden sie durch einen vernebelten Flüssigkeitsstrom in das Plasma transportiert, was auch als Nassplasmazustand bezeichnet wird. Im Vergleich zum Einsatz von trockenen Plasmabedingungen führt dies zu einem erhöhten Flüssigkeitsgehalt des Plasmas. Folglich nimmt die Signalintensität ebenso ab wie die Fluktuation der Signalzunahme, d. h. eine höhere Standardabweichung des mittleren Messsignals13. Durch die Verwendung des μDG und Konzentrationen im Bereich von 0,2 μg/L können jedoch Signale über dem Hintergrund detektiert werden. Die entsprechende injizierte Masse pro Tröpfchen hat einen niedrigen Metallgehalt, der nahe an den Nachweisgrenzen für einige Elemente (z. B. Au, Ag, Ce) liegt. Werden unterschiedliche Konzentrationen für die Kalibrierung entlang dieser Grenze verwendet, so können zwei lineare Bereiche mit einer Überlappung bei etwa 0,05 μg/L für Ce und 2 μg/L für Ag beobachtet werden. Unterhalb des überlappenden Bereichs liegen die beobachteten Signale nahe am elementspezifischen Hintergrund21. Oberhalb dieser Grenze kann der lineare Arbeitsbereich des μDG identifiziert werden. Selbst mit der Fähigkeit, niedrige Konzentrationen zu messen, ist es unmöglich, zwischen Ionen und NP desselben Analyten in einem Tröpfchen zu unterscheiden, wenn sie gleichzeitig vorhanden sind. Andernfalls kann mit dem herkömmlichen Einführungssystem der durchschnittliche ionenische Hintergrund bestimmt und von allen Signalen subtrahiert werden, um nur die Teilchensignale zu erhalten.
MDG-basierte Systeme weisen auch mehrere Einschränkungen auf, die durch die Anwendung des vorgeschlagenen Systems mit zwei Einlässen teilweise umgangen werden können. Wenn die Tröpfchenfrequenz von μDG jedoch 50 Hz überschreitet, ist es nicht möglich, ein konsistentes Tröpfchenmuster zu erzeugen. Die gebildeten Tröpfchen können kollidieren und daher kommt es zu einem Austausch von Analyten. Die korrekte Einstellung der Gasdurchflussraten ist auch wichtig für einen zuverlässigen Transport des Tropfens in das ICP-MS-System sowie für den korrekten Betrieb des PN. Das vorgeschlagene Dual-Inlet-System unterstützt derzeit keine Automatisierung des Messverfahrens, da die Probenlösungen manuell gewechselt werden müssen.
In Zukunft kann μDG zur Charakterisierung und Quantifizierung von NPs in komplexen Matrices und Umweltproben verwendet werden. Um ein Verstopfen von μDG aufgrund der höheren Lösungsviskosität, Komplexität und Oberflächenspannung zu vermeiden, sollte ein geeignetes Kopfdesign verwendet werden. Abhängig vom Design des μDG-Kopfes und dem Betrieb des Netzteils kann es möglich sein, Tröpfchen zu erzeugen, die partikelähnliche Systeme wie Zellen, Mizellen oder Lipidträger enthalten, für die Standardreferenzmaterialien überhaupt nicht verfügbar sind.
Offenlegungen
Alle Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Diese Arbeit wurde unterstützt durch das BfR SFP 1322-642 für F.L.K und P.R., das BfR SFP 1322-724 für die D.R. und das BfR Senior Scientist Fellowship für S.A.P.
Materialien
| Name | Company | Catalog Number | Comments |
| Au ionic (1000 mg L-1 stock) | VWR, UK | 85550.18E | |
| Ag ionic (1000 mg L-1 stock) | Ultra Scientific, RI, USA | ICM-103 | |
| Ag NP (75nm, NIST 8017) | NIST, Gaithersburg, MD, USA | no longer available | |
| Au NP (60nm, NIST 8013) | NIST, Gaithersburg, MD, USA | no longer available | |
| Ce ionic (1000 mg L-1 stock) | VWR, UK | 85557.18E | |
| CeO2 (10-100nm, NM212) | EU Joint Research Centre | NM212 | |
| Excel 2016 | Microsoft | ||
| Fiji | ImageJ | ||
| Glass female spherical ball + Glass male ball | Fisher Scientific | 12499016 | |
| HCl (emprove bio) | Merck, Germany | 100317 | |
| ICP-MS spray chamber with ipact bead | LabKings | LK6-45013 (OEM 3600170) | |
| Metal clamps for spherical glass joint | Fisher Scientific | 11322015 | |
| Metal T-Piece | Swagelok | SS-4-VCR-T | |
| Microdrop Dispenser Head, non heated | microdrop Technologies | 944 | |
| Microdrop Dispensing System MD-E-3000 | microdrop Technologies | ||
| MilliQ water (MilliPore gradient) | Merck MilliPore, Darmstadt, Germany | ||
| O-ring free quartz torch | Analytical West | 450-301 | |
| PFA-ST concentric nebulizer | Elemental Scientific | ES-2042 | |
| Silicone Rubber Tubing - 60° Shore - Platinum Cured - Black | Silex | ||
| XIMEA Cam Tool | XIMEA |
Referenzen
- Linsinger, T. P. J., Peters, R., Weigel, S. International interlaboratory study for sizing and quantification of Ag nanoparticles in food simulants by single-particle ICPMS. Analytical and Bioanalytical Chemistry. 406 (16), 3835-3843 (2014).
- Krystek, P., et al. Method development and inter-laboratory comparison about the determination of titanium from titanium dioxide nanoparticles in tissues by inductively coupled plasma mass spectrometry. Analytical and Bioanalytical Chemistry. 406 (16), 3853-3861 (2014).
- Degueldre, C., Favarger, P. Y., Bitea, C. Zirconia colloid analysis by single particle inductively coupled plasma-mass spectrometry. Analytica Chimica Acta. 518 (1-2), 137-142 (2004).
- Degueldre, C., Favarger, P. Y. Colloid analysis by single particle inductively coupled plasma-mass spectroscopy: a feasibility study. Colloid Surface A. 217 (1-3), 137-142 (2003).
- Pace, H. E., et al. Determining transport efficiency for the purpose of counting and sizing nanoparticles via single particle inductively coupled plasma mass spectrometry. Analytical Chemistry. 83 (24), 9361-9369 (2011).
- Verboket, P. E., Borovinskaya, O., Meyer, N., Gunther, D., Dittrich, P. S. A new microfluidics-based droplet dispenser for ICPMS. Analytical Chemistry. 86 (12), 6012-6018 (2014).
- Shigeta, K., et al. Application of a micro-droplet generator for an ICP-sector field mass spectrometer - optimization and analytical characterization. Journal of Analytical Atomic Spectrometry. 28 (5), 646-656 (2013).
- Gschwind, S., Hagendorfer, H., Frick, D. A., Gunther, D. Mass quantification of nanoparticles by single droplet calibration using inductively coupled plasma mass spectrometry. Analytical Chemistry. 85 (12), 5875-5883 (2013).
- Gschwind, S., et al. Capabilities of inductively coupled plasma mass spectrometry for the detection of nanoparticles carried by monodisperse microdroplets. Journal of Analytical Atomic Spectrometry. 26 (6), 1166-1174 (2011).
- Zarrln, F., K, S. L., Socha, J. R. Droplet size measurements of various nebulizers using differential electrical mobluty particle sizer. Journal of Aerosol Science. 22, 343-346 (1991).
- Geertsen, V., Lemaitre, P., Tabarant, M., Chartier, F. Influence of design and operating parameters of pneumatic concentric nebulizer on micro-flow aerosol characteristics and ICP-MS analytical performances. Journal of Analytical Atomic Spectrometry. 27 (1), 146-158 (2012).
- Mehrabi, K., Günther, D., Gundlach-Graham, A. Single-particle ICP-TOFMS with online microdroplet calibration for the simultaneous quantification of diverse nanoparticles in complex matrices. Environmental Science. Nano. 6, 3349-3358 (2019).
- Ramkorun-Schmidt, B., Pergantis, S. A., Esteban-Fernandez, D., Jakubowski, N., Gunther, D. Investigation of a combined microdroplet generator and pneumatic nebulization system for quantitative determination of metal-containing nanoparticles using ICPMS. Analytical Chemistry. 87 (17), 8687-8694 (2015).
- Rosenkranz, D., et al. Improved validation for single particle ICP-MS analysis using a pneumatic nebulizer/microdroplet generator sample introduction system for multi-mode nanoparticle determination. Analytica Chimica Acta. 1099, 16-25 (2020).
- National Institute of Standards and Technology. Report of investigation reference material. Reference material 8017. National Institute of Standards and Technology. , (2015).
- Tavares, A. M., et al. Genotoxicity evaluation of nanosized titanium dioxide, synthetic amorphous silica and multi-walled carbon nanotubes in human lymphocytes. Toxicology In Vitro. 28 (1), 60-69 (2014).
- Au-Kaur, I., et al. Dispersion of Nanomaterials in Aqueous Media: Towards Protocol Optimization. Journal of Visualized Experiments. (130), e56074(2017).
- Nanotechnologies. Size distribution and concentration of inorganic nanoparticles in aqueous media via single particle inductively coupled plasma mass spectrometry. ISO/TS19590 Nanotechnologies. , (2017).
- Shigeta, K., et al. Application of a micro-droplet generator for an ICP-sector field mass spectrometer - optimization and analytical characterization. Journal of Analytical Atomic Spectrometry. 28, 646-656 (2013).
- Koch, J., et al. Accelerated evaporation of microdroplets at ambient conditions for the on-line analysis of nanoparticles by inductively-coupled plasma mass spectrometry. Journal of Analytical Atomic Spectrometry. 28 (11), 1707-1717 (2013).
- Tuoriniemi, J., Cornelis, G., Hassellov, M. A new peak recognition algorithm for detection of ultra-small nano-particles by single particle ICP-MS using rapid time resolved data acquisition on a sector-field mass spectrometer. Journal of Analytical Atomic Spectrometry. 30 (8), 1723-1729 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten


