Method Article
Système polyvalent d’introduction d’échantillons à double entrée pour l’analyse et la validation de la spectrométrie de masse à plasma à couplage inductif multimode à particule unique
Dans cet article
Résumé
Nous fournissons ici un protocole pour l’utilisation d’un système à double entrée pour la spectrométrie de masse à couplage inductif de particules uniques qui permet une caractérisation standard indépendante des nanoparticules.
Résumé
Les nanoparticules contenant du métal (NP) peuvent être caractérisées à l’aide de spectromètres de masse à plasma à couplage inductif (ICP-MS) en termes de taille et de concentration en nombre en utilisant le mode à particule unique de l’instrument (spICP-MS). La précision de la mesure dépend de la configuration, des conditions de fonctionnement de l’instrument et des paramètres spécifiques définis par l’utilisateur. L’efficacité de transport de l’ICP-MS est cruciale pour la quantification du NP et nécessite généralement un matériau de référence avec une distribution granulométrique homogène et une concentration connue en nombre de particules.
À l’heure actuelle, les matériaux de référence NP ne sont disponibles que pour quelques métaux et dans des tailles limitées. Si les particules sont caractérisées sans étalon de référence, les résultats de la taille et du nombre de particules peuvent être biaisés. Par conséquent, une configuration à double entrée pour caractériser les nanoparticules avec spICP-MS a été développée pour surmonter ce problème. Cette configuration est basée sur un système d’introduction conventionnel composé d’un nébuliseur pneumatique (PN) pour les solutions de nanoparticules et d’un générateur de microgouttelettes (μDG) pour les solutions d’étalonnage ionique. Une nouvelle interface flexible a été développée pour faciliter le couplage de μDG, PN et du système ICP-MS. L’interface se compose des composants de laboratoire disponibles et permet l’étalonnage, la caractérisation des nanoparticules (NP) et le nettoyage de l’ensemble, pendant que l’instrument ICP-MS est encore en marche.
Trois modes d’analyse indépendants sont disponibles pour déterminer la taille et la concentration en nombre de particules. Chaque mode est basé sur un principe d’étalonnage différent. Alors que le mode I (comptage) et le mode III (μDG) sont connus dans la littérature, le mode II (sensibilité) est utilisé pour déterminer l’efficacité du transport par des solutions étalons ioniques inorganiques uniquement. Il est indépendant des matériaux de référence NP. Le système d’entrée basé sur μDG décrit ici garantit des sensibilités supérieures aux analytes et, par conséquent, des limites de détection (LOD) inférieures. Les LD dépendantes de la taille obtenues sont inférieures à 15 nm pour tous les NP (Au, Ag, CeO2) étudiés.
Introduction
Les spectromètres de masse à plasma à couplage inductif sont largement utilisés pour quantifier la taille et le nombre de NP dans divers échantillons et matricesen mode 1,2,3 à particule unique. Le mode particule unique est un fonctionnement du système d’acquisition de données avec une intégration ou un temps d’arrêt court. Chaque NP mesuré produit un signal intégré dans cet intervalle de temps (événement mesuré en comptages par seconde : cps) si une dilution adéquate de la suspension NP a été utilisée pour éviter les doubles événements. L’étalon d’étalonnage, ainsi que l’échantillon, sont généralement introduits dans l’ICP-MS via un système conventionnel d’introduction d’échantillons basé sur la nébulisation pneumatique (PN)4. Cependant, comme condition préalable, le débit d’introduction de l’échantillon et l’efficacité de transport (η) doivent être déterminés pour quantifier avec précision la masse de métal par NP et pour déterminer leur concentration en nombre dans la suspension. L’efficacité de transport décrit le rapport entre la masse ou le nombre de particules injectées et la masse (méthode de collecte des déchets)) ou le nombre de particules (méthode de comptage) détectés par l’ICP-MS5. L’efficacité du transport est le plus souvent déterminée à l’aide de matériaux de référence à base de nanoparticules5. Cependant, les propriétés de transport dépendent de la structure du NP et impliquent des propriétés telles que la composition et le dispersant de l’échantillon. D’autres facteurs d’influence sont des paramètres instrumentaux, tels que le taux d’absorption d’échantillons, le débit de gaz du nébuliseur, le temps de séjour et le temps total de mesure.
Étant donné que seuls des matériaux de référence nanoparticulaires limités sont disponibles, les résultats d’analyse NP obtenus peuvent être biaisés en raison des différences de composition élémentaire entre les particules de référence et les particules de l’échantillon. Outre la disponibilité d’une gamme limitée de matériaux de référence, la détection de plusieurs événements de particules par temps de séjour du détecteur représente un défi supplémentaire. Cela peut également affecter la précision de l’efficacité du transport à déterminer.
Pour être indépendant des matériaux de référence, idéalement, un système d’introduction d’échantillons avec une efficacité de transport de près de 100 % est préférable. Dans le même temps, lorsqu’un faible volume est utilisé par rapport aux systèmes d’introduction conventionnels, des concentrations de particules plus élevées peuvent être utilisées. Même si deux particules sont proches l’une de l’autre, les deux peuvent être détectées séparément avec le système basé sur μDG.
Le μDG est capable de générer des gouttelettes monodispersées avec un volume fixe dans la gamme pL et est bien adapté à cet effet 6,7,8,9. Le μDG facilite l’injection d’échantillons ioniques et particulaires dans différents solvants dans l’ICP-MS. Dans le cas d’échantillons de métaux ioniques, on suppose que les gouttelettes générées sont entièrement désolvées sur le chemin de l’ICP. En conséquence, la gouttelette perd toute l’eau et une particule se forme à partir du sel restant. Le diamètre de cette particule est directement proportionnel à la concentration utilisée. Ainsi, des étalons de référence faits maison de la même matrice, de la même masse et de la même taille, avec une concentration variable de la solution ionique du NP à étudier, peuvent être produits en interne. Le volume d’une gouttelette peut être calculé facilement sur la base du diamètre de la gouttelette mesuré par le μDG. Ce n’est pas possible avec un PN qui produit une large distribution de gouttelettes de différents diamètres10,11. Grâce à l’introduction uniforme de l’échantillon à une efficacité de transport élevée de 100 % de la μDG, une sensibilité élevée de l’analyte spécifique à l’instrument peut être obtenue. Selon la matrice utilisée, cela conduit à des limites de détection (LOD) inférieures de la masse et de la taille des particules par rapport aux résultats des systèmes d’introduction conventionnels basés sur le PN12. Cependant, en raison de la conception de la μDG, les échantillons ne peuvent pas être échangés facilement lorsque le système ICP-MS est encore en fonctionnement. Entre les mesures de différents échantillons, le μDG doit être nettoyé puis rincé avec la solution d’échantillon pour la stabilisation du système. De plus, sa tolérance aux échantillons matriciels lourds n’a pas été testée dans une large mesure. De plus, en raison des débits extrêmement faibles, le temps d’analyse pour obtenir de bonnes statistiques serait extrêmement long, ce qui limite son utilisation pratique, si de « vrais » échantillons, comme par exemple les eaux environnementales, devaient être analysés.
Pour surmonter ces limitations, le μDG a déjà été utilisé en combinaison avec un système conventionnel basé sur un nébuliseur pneumatique, qui a reçu le nom de système à double entrée13. En introduisant les étalons d’étalonnage avec le μDG et la suspension NP via un nébuliseur pneumatique dans l’ICP-MS, Ramkorun-Schmidt et al. ont pu tirer parti des deux systèmes13. Une détermination très précise de la fraction massique métallique de l’Au et de l’Ag NP a été obtenue, sans qu’il soit nécessaire de déterminer l’efficacité du transport. Cependant, aucune concentration en nombre de particules n’a été déterminée avec ce système à double entrée. De plus, le nettoyage et l’alignement du système μDG compliquaient l’applicabilité de l’analyse de routine.
Dans cet article, nous proposons une interface d’entrée double flexible pour déterminer la taille et la concentration en nombre de particules NP et démontrons son assemblage et son utilisation pratique. Comme le système de Ramkorun-Schmidt et al., il se compose à la fois d’un système d’introduction d’échantillons μDG et PN. Nous démontrons que le système à double entrée, dans son stade actuel de développement, permet l’application de trois modes d’analyse indépendants pour étudier et caractériser les NP contenant des métaux. Notre système à double entrée simplifie la procédure d’étalonnage pour la détermination du NP et améliore les chiffres analytiques de mérite, en particulier la précision14. Les systèmes d’entrée permettent un échange d’échantillon et un nettoyage pratiques du μDG même lorsque l’ICP-MS est encore en fonctionnement, réduisant ainsi le temps d’analyse global et le risque de désalignement. Afin de tester les performances du système, des NP de référence bien caractérisés (60 nm AuNP – NIST 8013, 75 nm AgNP – NIST 8017) sont utilisés pour la validation et la comparabilité des méthodes.
Protocole
1. Assemblage de la configuration d’introduction de l’échantillon à double entrée
REMARQUE : Les détails sur les différentes pièces sont indiqués dans le tableau 1.
| Composants | |||
| Partie 1 | Rotule sphérique femelle en verre avec une longueur de tige d’environ 10 mm | ||
| Rotule mâle en verre avec une longueur de tige d’environ 10 mm | |||
| Pièce en T en métal (dimensions : 1/4 po) | |||
| Adhésif verre-métal | |||
| Deux pinces pour joints sphériques en verre | |||
| Partie 2 | Chambre de pulvérisation ICP-MS (type suggéré : chambre de pulvérisation à billes d’impact, chambre de pulvérisation cyclonique ou similaire) | ||
| Nébuliseur pneumatique (type suggéré : nébuliseur concentrique) | |||
| Attache | |||
| Partie 3 | Torche à quartz sans joint torique | ||
| Raccord de conduite de gaz à extrémité fermée | |||
| Raccord de conduite de gaz à extrémité ouverte | |||
| Tube en silicone conducteur et flexible | |||
| Partie 4 | Unité de génération de micro-gouttelettes piézoélectriques | ||
| Partie 5 | Unité de contrôle des micro-gouttelettes | ||
Tableau 1 : Liste des composants utilisés pour construire la configuration à double entrée.
- Construction d’une unité de connecteur à pièce en T (Figure 1, partie 1).
REMARQUE : Cette pièce relie le système d’introduction d’échantillon conventionnel (étape 1.2) et l’unité de transport μDG (étape 1.3).- Insérez des joints à rotule mâle et femelle dans les ouvertures opposées d’un connecteur de pièce en T.
- Fixez les joints à rotule mâle et femelle à l’aide d’un adhésif verre-métal (par exemple, de la colle silicone).
- Connectez la rotule femelle à l’injecteur de l’ICP-MS à l’aide d’une pince.
- Fixation d’un système conventionnel d’introduction d’échantillons (Figure 1 Partie 2)
REMARQUE : Cette pièce est connectée à l’unité de connecteur de la pièce en T (étape 1.1)- Combinez une chambre de pulvérisation ICP-MS avec un nébuliseur pneumatique (PN), qui s’adapte à la chambre de pulvérisation utilisée.
- À l’aide d’une pince, connectez la sortie de la chambre de pulvérisation à la rotule mâle du connecteur de la pièce en T (décrite à l’étape 1.1).
REMARQUE : La sortie de la chambre de pulvérisation est généralement équipée d’un connecteur à rotule femelle. La combinaison illustrée à la figure 1 se compose d’un nébuliseur et d’une chambre de pulvérisation à billes d’impact. Au lieu de la chambre de pulvérisation à billes d’impact, d’autres chambres de pulvérisation avec des efficacités de transport de 2 à 10 % ou plus peuvent être utilisées.
- Construction de l’unité de transport de microgouttelettes (Figure 1 Partie 3)
REMARQUE : Cette pièce relie l’unité de connecteur à pièce en T (étape 1.1) et l’unité μDG (étape 1.4).- Fixez une torche à quartz démontable, avec son tube d’injection retiré, à un support de laboratoire avec l’entrée de la torche sur le dessus à l’aide de pinces appropriées.
- Bloquez l’entrée plasma/gaz auxiliaire de la torche par des connecteurs de gaz à extrémité fermée.
REMARQUE : L’échantillon est transporté à l’aide d’une pompe péristaltique vers le nébuliseur. Le gaz argon est utilisé pour la nébulisation des échantillons dans la chambre de pulvérisation et le transport ultérieur dans le plasma. - Raccordez une conduite d’hélium gazeux à la torche via son entrée de gaz de refroidissement à l’aide d’un connecteur de gaz approprié.
REMARQUE : L’hélium gazeux appliqué est utilisé pour la désolvatation des gouttelettes générées et agit comme une gaine gazeuse empêchant la gouttelette d’entrer en collision avec les parois de l’installation et empêchant l’instrument ICP-MS d’insérer de l’oxygène atmosphérique tandis que la tête d’entrée de l’échantillon du μDG doit être retirée pour le nettoyage et l’échange d’échantillon. - Connectez un tube en silicone conducteur et flexible de 30 cm de long (d.i. 0,75 cm), à l’aide d’un adaptateur, à l’extrémité de sortie de la torche (bas de la torche).
- Connectez l’extrémité inférieure du tube en silicone à l’unité de connecteur à pièce en T en étirant le tube en silicone flexible sur sa connexion métallique verticale restante.
REMARQUE : Le tube en silicone flexible permet l’accord x-y-z de l’instrument ICP-MS avec la configuration connectée.
- Raccordement de l’unité de génération de microgouttelettes et de l’unité de commande de génération de microgouttelettes (Figure 1 Partie 4, Partie 5)
REMARQUE : Cette pièce est connectée à l’unité de transport μDG (étape 1.3)- Connectez l’unité μDG préparée à l’unité de transport de microgouttelettes en insérant la tête μDG dans l’extrémité d’entrée de l’échantillon de la torche.
- Connectez l’alimentation électrique à l’unité de commande μDG.
REMARQUE : La configuration décrite ici se compose d’une tête μDG disponible dans le commerce et d’une alimentation μDG. En fonction de la tête DG utilisée, la configuration doit être adaptée en conséquence.
2. Quantification de la taille des gouttelettes
- Utilisez une lampe stroboscope et une caméra CCD (par exemple, dans une configuration ouverte, voir la configuration de mesure de la taille de la figure 1 ) pour prendre des images des gouttelettes produites par le μDG.
- Calibrez la caméra CCD en prenant des images d’un objet de taille connue dans la portée du μm (par exemple, un fil de cuivre d’un diamètre de 150 μm).
- Prendre des images d’au moins 1 000 gouttes aux paramètres utilisés pour l’expérience (voir tableau 2).
- À l’aide d’un logiciel graphique approprié (voir la Table des matériaux), évaluez les images concernant l’objet et la taille de la goutte en procédant comme suit :
- Cliquez sur Fichier et Ouvrir pour charger l’image de l’objet.
- Cliquez sur l’image | Ajuster | Seuil permettant de définir la zone de l’objet en déplaçant les barres de défilement.
- Cliquez sur Appliquer pour appliquer les paramètres.
- Cliquez sur le bouton Segment droit .
- Cliquez et maintenez le bouton gauche de la souris enfoncé pour tracer une ligne le long de l’objet.
- Appuyez sur Ctrl + M pour mesurer la taille de l’objet.
- Mesurez le diamètre de l’objet en 5 points différents.
- Copiez et collez le tableau « Résultats » dans un tableur.
- Calculez la moyenne arithmétique de la colonne « Longueur ».
- Calculez le rapport d’aspect en pixels (PAR) : taille réelle de l’objet (μm)/taille moyenne de l’objet dans l’image (px).
- Cliquez sur Fichier | Importation | Séquence d’images pour importer et charger les images des gouttelettes.
- Cliquez sur Rectangulaire et marquez la gouttelette de la première image.
- Effectuez le clic droit sur le tapis de souris et choisissez Dupliquer pour séparer les gouttelettes de la séquence d’images du reste de l’image.
- Séparez les gouttelettes de l’arrière-plan comme spécifié à l’étape 2.4.2.
- Cliquez sur Traiter | Binaire | Érodez pour éliminer les reflets de lumière sur la surface des gouttelettes.
- Cliquez sur Traiter | Binaire | Dilater pour inverser l’étape « Erode ».
- Cliquez sur Analyser | Analyser les particules | Ok pour mesurer toutes les gouttelettes.
- Copiez et collez le tableau « Résumé » ou « Résultat » dans un tableur.
- Calculez la moyenne arithmétique du diamètre du furet en px.
- Utilisez le PAR pour transformer le diamètre en μm : diamètre du furet en px/PAR.
REMARQUE : La taille des gouttelettes formées par le μDG varie en fonction de la longueur et de la durée sélectionnées de l’impulsion de courant appliquée à l’élément piézoélectrique7.
3. Préparation de l’échantillon
- Préparer une solution d’étalonnage ionique de l’analyte à mesurer dans la plage de concentration de 0,2 à 20 μg/L dans de l’acide dilué (p. ex., HCl (0,5 v/v), HNO3 (3,5 v/v)).
- Préparez une solution ionique pour l’étalonnage en un point dans la plage de concentration entre 1 et 10 μg/L dans de l’acide dilué.
- Préparez les suspensions étalons NP selon les instructions du fabricant ou les protocoles internes.
REMARQUE : Les étapes 3.3.1 à 3.3.4 expliquent la préparation des suspensions d’étalon NP en prenant l’exemple des NP Ag, Au, CeO2 .- Préparez 10 mL de solution d’AuNP à 0,05 μg/L pour le PN et une solution de 1 μg/L d’AuNP dans de l’eau ultrapure pour le μDG. Vortex pendant 20 à 60 s avant de l’utiliser.
- Préparer une solution d’AgNP de 0,05 μg/L pour le PN et une solution d’AgNP de 2 μg/L, toutes deux dans de l’eau ultrapure, pour le μDG. Agitez bien pendant 20 à 60 secondes avant d’en utiliser15.
- Préparer les solutions de CeO2 NP à utiliser comme décrit précédemment pour les oxydes métalliques16,17.
- Préparer une solution de CeO2 NP à 0,05 μg/L pour le PN et une solution à 1 μg/L pour le μDG.
- Peser 25,6 mg/mL de CeO2 NP dans un récipient en verre de 15 mL à 20 mL au total et ajouter 10 mL de solution de BSA à 0,05 (v/v) préparée dans de l’eau ultrapure.
- À l’aide d’un sonicateur du bout des doigts d’une puissance de 7,35 W, homogénéiser la solution de particules pendant 309 s.
4. Accordage et paramètres instrumentaux
- Assurez-vous que le générateur MDG est éteint et connectez la configuration d’introduction d’échantillon à double entrée qui a été construite à l’étape 1 avec l’injecteur de l’instrument ICP-MS avec une pince. Rincez le système d’entrée pendant 5 à 10 minutes avec le gaz de nébulisation (Ar) et le gaz de transport de gouttelettes (He).
REMARQUE : L’instrument ICP-MS doit être protégé contre la pénétration de niveaux élevés d’oxygène dans la salle plasma. - Éteignez le gaz de transport de gouttelettes (He) et démarrez le système ICP-MS
- Accordez l’instrument dans le mode de mesure que l’on souhaite utiliser à l’aide de la solution d’accordage standard de l’instrument spécifiée par le fabricant du système ICP-MS.
REMARQUE : Une solution d’accordage standard comprend, par exemple, du baryum, du cérium, de l’indium, de l’uranium, du bismuth, du cobalt, du lithium (tous 1 μg/L) dans un mélange de 2,5 % (v/v) d’acide nitrique et de 0,5 % (v/v) d’acide chlorhydrique. - Détermination du taux d’absorption de l’échantillon du PN.
- Remplissez un récipient avec 15 ml d’eau.
- Pesez le récipient.
- Connectez le récipient au tube du PN.
- Démarrez la pompe péristaltique en cliquant sur le bouton de démarrage de la pompe péristaltique dans le logiciel de l’instrument.
- Démarrez une minuterie de 5 minutes.
- Retirez la conduite d’absorption du récipient exactement après 5 min. Pesez à nouveau le récipient.
- Calculer le taux d’absorption de l’échantillon (mL/min) à l’aide de la formule : poids du récipient avant - poids du récipient après / durée.
- Optimiser les paramètres instrumentaux pour améliorer la sensibilité de l’analyte si nécessaire, par exemple, le débit de gaz du nébuliseur, la profondeur d’échantillonnage, la puissance du plasma.
REMARQUE : Voir le Tableau 2 à titre d’exemple de paramètres instrumentaux qui peuvent être optimisés dans un système ICP-MS. - Ajustez le débit de gaz He jusqu’à ce qu’un débit de signal constant puisse être détecté en fonction du taux de formation de gouttes.
| Paramètre | Valeur | ||
| ICP – MS : | |||
| Puissance du plasma (W) | 1600 | ||
| Profondeur d’échantillonnage (mm) | 4 | ||
| Débits (L min-1) : | |||
| Gaz auxiliaire | 0.65 | ||
| Gaz de refroidissement | 14 | ||
| Fois (s) | |||
| Acquisition de données | 1200 | ||
| Temps de séjour (s) | 0.01 | ||
| Interface: | |||
| PN Taux d’absorption de l’échantillon (mL min-1) | 0.21 | ||
| Gaz de nébulisation (L min-1) | 0.92 | ||
| μDG : | |||
| Diamètre capillaire (μm) | 75 | ||
| Taux de chute (Hz) | 10 | ||
| Il gaz d’appoint (L min-1) | 0.27 | ||
| Mode de fonctionnement | Triple impulsion | ||
| Ensemble1 | Ensemble2 | Ensemble3 | |
| Tension (V) | 53 | 51 | 47 |
| Largeur d’impulsion (μs) | 20 | 25 | 12 |
| Retard d’impulsion (μs) | 4 | 2 | 1 |
Tableau 2 : Valeurs des paramètres instrumentaux utilisés.
5. Mesure multimode d’échantillons de nanoparticules
- Préparation de l’unité de contrôle μDG
- Allumez l’interrupteur d’alimentation de l’unité de commande μDG.
- Cliquez sur Démarrer sur le premier écran pour démarrer l’unité de contrôle.
- Cliquez sur Paramètres globaux pour choisir le mode d’impulsion à utiliser.
- Cliquez sur le bouton graphique de droite en mode impulsion pour choisir le mode d’impulsion triple.
REMARQUE : Les paramètres du mode triple impulsion sont indiqués dans le tableau 2.
- Préparer l’unité μDG
- Cliquez sur On/Off pour démarrer le μDG.
- Remplissez le récipient d’échantillon avec la solution d’échantillon à mesurer.
- Connectez le récipient d’échantillonnage à l’unité μDG.
- À l’aide d’une seringue de 10 mL pour purger l’air à travers le récipient et l’unité μDG.
- Connectez la seringue à l’orifice de la seringue sur le récipient du récipient d’échantillon.
- Poussez le piston de la seringue jusqu’à ce qu’un jet de liquide constant sorte de la tête μDG.
- Maintenez la pression pendant 10 s.
- Retirez la seringue.
- Placez l’unité μDG dans la zone de mise au point de la caméra CCD pour observer les gouttelettes formées.
- Connectez la caméra CCD à un PC ou à un ordinateur portable.
- Démarrez le logiciel de la caméra CCD pour observer les gouttelettes formées
- Cliquez sur Démarrer pour obtenir une vue en direct des gouttelettes.
- Observez la formation constante de gouttelettes.
- Placez la tête μDG sur la torche inversée du système d’introduction d’échantillon à double entrée.
- Validez à la fois l’unité μDG et le PN pour chaque élément d’intérêt en mesurant des étalonnages multipoints répétés.
REMARQUE : Pour l’acquisition de données ICP-MS, utilisez le logiciel associé à l’instrument. - Déterminez la plage linéaire de l’étalonnage multipoint en important les données expérimentales dans un tableur.
- Calculez la moyenne arithmétique de chaque point d’étalonnage.
- Déterminez l’ordonnée à l’origine, la pente et le coefficient de corrélation.
REMARQUE : Pour sp-ICP-MS, le coefficient de corrélation doit être de >0,9918.
- Choisissez une concentration dans la plage linéaire des courbes d’étalonnage pour des étalonnages en un point par la suite.
- Suivre les étapes ci-dessous pour la mesure et la validation (en utilisant des matériaux de référence tels que NIST 8012, NIST 8013 ou NIST 8017 ou similaires) de la quantification multimode des nanomatériaux (Figure 2).
- Sélectionnez une nanoparticule et un étalon ionique en fonction de l’analyte d’intérêt.
- Préparez l’unité μDG conformément à 5.2 avec une solution étalon ionique.
- Ajouter une solution acide diluée (p. ex., HCl à 0,5 % v/v) via le PN.
- Démarrez la mesure du système ICP-MS en mode résolu dans le temps.
- Après 120 s , cliquez sur On/Off pour arrêter le μDG et remplacer la solution acide diluée au PN par l’étalon ionique.
- Après 330 s, remplacez à nouveau l’étalon ionique au niveau du PN par une solution acide diluée.
- Pendant ce temps, retirez l’unité μDG de la configuration.
- Remplacez le récipient d’échantillon (flacon en verre) de l’unité μDG par un récipient contenant une solution acide diluée (p. ex., 3,5 % HNO3) afin de nettoyer l’unité μDG.
- Remplissez une seringue de 10 ml avec de l’air.
- Connectez la seringue à l’orifice d’injection de l’unité μDG et videz la seringue jusqu’à ce qu’un jet de liquide apparaisse de la tête μDG et maintenez la pression pendant 30 s.
- Préparez le μDG comme spécifié à l’étape 5.2 avec l’échantillon NP et fixez l’unité μDG à la configuration à 510 s.
- Cliquez sur On/Off après 810 s pour arrêter le μDG.
- Remplacez la solution acide diluée au niveau du PN par l’échantillon NP et mesurez pendant 300 s supplémentaires.
- Arrêtez la mesure après environ 1 200 s.
- Nettoyez l’unité μDG comme spécifié à l’étape 5.5.8.
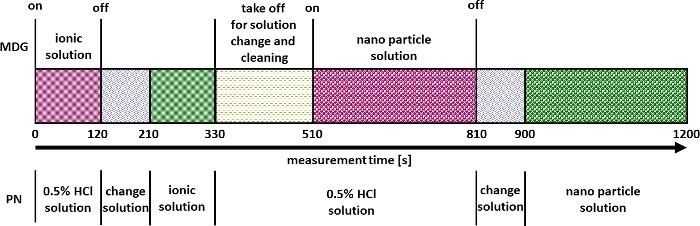
Figure 2 : Stratégie de mesure pour la quantification multimode des nanomatériaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Analyse des données
REMARQUE : Pour simplifier toutes les étapes de calcul, une feuille de calcul correspondante a été préparée (voir Fichier supplémentaire).
- Utilisez une feuille de calcul ou un logiciel capable de gérer les trames de données pour traiter les données et importer les données mesurées. Collez les valeurs d’intensité de l’ensemble de la mesure dans le tableur (inclus dans le supplément électronique) dans la colonne A, les données seront visualisées. Entrez tous les paramètres expérimentaux nécessaires au calcul dans le tableau « Paramètre d’entrée ».
- Définissez les régions d’intérêt (ROI) pour μDG ionique (I), PN ionique (II), μDG NP (III) et PN NP (IV) en sélectionnant les cellules de feuille de calcul appropriées. À l’aide du graphique de la feuille préparée, définir les limites des retours sur investissement et entrer les valeurs dans le tableau « Détermination de la région d’intérêt » (cellules C1 :E7).
- Copiez et collez chaque ensemble de données dans une colonne distincte. Appuyez sur le bouton Copier le ROI dans la feuille préparée pour diviser la mesure en quatre ROI (colonne M :P).
- Calculez la moyenne arithmétique de I et II.
- Appliquez l’approche itérative pour séparer les signaux de particules ou de gouttelettes et le bruit de fond pour III et IV.
- Calculez la moyenne arithmétique et l’écart-type de toutes les valeurs mesurées.
- Calculez une valeur limite ou seuil par la valeur moyenne + 5* écart type.
- Supprimez tous les signaux inférieurs à la valeur limite de III et IV à l’aide de la commande Couper sur les signaux de particules identifiés. Utilisez Coller pour les coller dans une colonne distincte.
- Répétez les étapes 1 à 3 jusqu’à ce que la valeur moyenne et l’écart type soient constants.
REMARQUE : Dans les colonnes Q à BD de la feuille préparée, l’approche itérative consistant à séparer les signaux de fond et les signaux de particules est exécutée cinq fois.
- Calculer la moyenne arithmétique des signaux de particules identifiés de III et IV.
- Calculer la taille minimale détectable des particules (taille LOD - nm) pour μDG NP et PN NP en utilisant la limite de détection instrumentale de l’analyte (LOD - counts), la sensibilité de l’analyte (SC,ionic – counts/(μg/L)), le taux d’absorption de l’échantillon (qs – mL/min), l’efficacité de transport (η – unité relative) et la masse volumique du matériau en vrac (ρ – g/cm³) :
- Calculer la masse (m,a,p) et la taille des particules (d – nm, en supposant que les particules sont sphériques) des signaux de particules identifiés pour μDG NP et PN NP selon les trois modes d’analyse appliqués, en tenant compte de la concentration en métaux ioniques d’une solution étalon (ca - μg/L) et du flux d’ions dans le plasma (counts/s) :
- Masse:

- Taille:

- Masse:
- Calculer l’efficacité spécifique de transport des modes d’analyse en utilisant le nombre de particules détectées (qp), la concentration en particules de l’échantillon (cp,utilisée - 1/mL), la sensibilité de l’analyte du PN et du MDG (Sm,ionique,PN, S m,ionique,MDG – comptes/(μg/L)), le volume de la gouttelette (goutte V – pL), le temps de séjour (td – ms), l’efficacité de transport du PN (ηPN), l’efficacité de transport du μDG (ημDG), l’intensité des solutions ioniques mesurée par le PN et le μDG ( Iionc, PN, Iionique, μDG – comptes) et la concentration de la solution ionique utilisée pour les deux systèmes d’injection (cionique, PN, cionique,μDG - μg/L) :
- Mode I :

- Mode II :

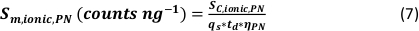

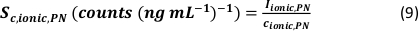
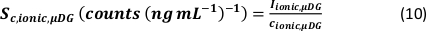
- Mode I :
- Supposons que l’efficacité de transport de μDG est égale à 1:19
- Calculer la concentration en nombre de particules de la solution de NP analysée en tenant compte du volume de l’échantillon injecté lors de la mesure (Vinjecté) :
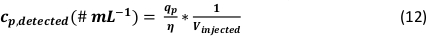
REMARQUE : Dans la feuille préparée, tous les calculs sont effectués automatiquement après le fractionnement. Les résultats sont présentés dans le tableau « Paramètres de sortie » (cellules BH7 :BR35) et contiennent les formules décrites ci-dessus, y compris les différentes étapes de calcul.
Résultats

Figure 3 : Détermination de la taille des gouttelettes avec la caméra CCD. Étalonnage de la caméra CCD avec un fil de cuivre de 150 μm (A) et détermination de la taille des gouttelettes après conversion des images de gouttelettes obtenues en une image couleur binaire (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
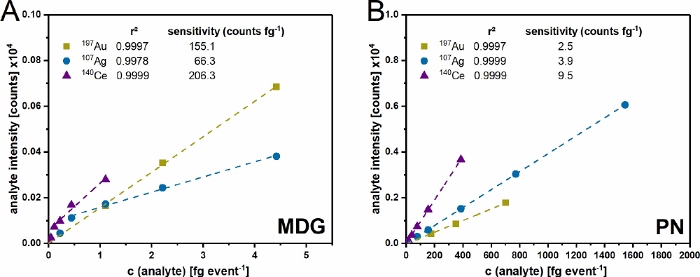
Figure 4 : Validation de la configuration à double entrée. Étalonnage multipoint du système d’entrée μDG (A) et PN (B) pour l’or (Au), l’argent (Ag) et le cérium (Ce). La concentration utilisée dans la plage de 0,2 à 20 μg mL-1 est convertie en masse par événement détecté en fonction des conditions expérimentales utilisées. Les données présentées sont les valeurs moyennes de trois répétitions indépendantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
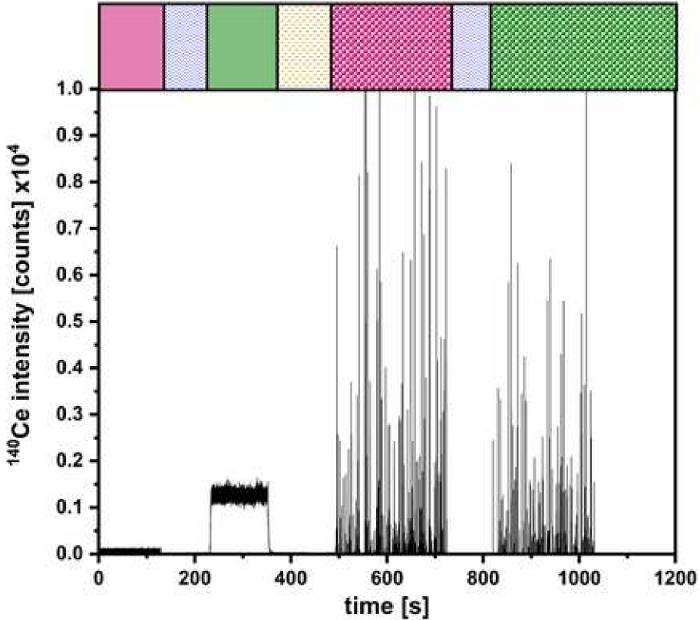
Figure 5 : Mesure de la configuration à double entrée. La quantification de CeO2 NP avec des barres colorées comme fait sur la Figure 2 pour les différentes étapes d’injection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Échantillon | Mode d’analyse / | Entrée de l’échantillon NP | Entrée pour étalons d’étalonnage | η | ma, p | Taille NP (d) | #NPs | Récupération ( %) | |
| η détermination du PN | (%) | (fg) | (nm) | (mL-1 x103) | |||||
| Au 56 nm | Mode-I / | PN | PN : Étalons Au ionique et AuNP | 1.8 (0.1) | 1.9 (0.5) | 57.2 (4.3) | 28.1 (0) | 100 | |
| NIST 8013 | Méthode de comptage | ||||||||
| Mode-II / | PN | PN/μDG : | 1.9 (0.1) | 2 (0.4) | 58 (3.6) | 25.6 (1.6) | 91 | ||
| Rapport de sensibilité | Étalons ioniques | ||||||||
| Mode-III / | μDG | μDG : | 100 | 1.7 (0.2) | 55 (2.4) | 394.4 (29.3) | 70 | ||
| ημDG = 1 | Étalon ionique | ||||||||
| Taille attendue (nm) | 56.0 (0.5) | ||||||||
| Ag 75 nm | Mode-I / | PN | PN : Étalons Ag ionic et AgNP | 2.3 (0.2) | 1.9 (0.2) | 70.2 (2.3) | 21.6 (0) | 100 | |
| NIST 8017 | Méthode de comptage | ||||||||
| Mode-II / | PN | PN/μDG : | 2.5 (0.2) | 2 (0.2) | 71.5 (2.1) | 20.5 (1.9) | 95 | ||
| Rapport de sensibilité | Étalons ioniques | ||||||||
| Mode-III / | μDG | μDG : | 100 | 2.5 (0.2) | 76.7 (2.3) | 757.1 (68.7) | 88 | ||
| ημDG = 1 | Étalon ionique agricole | ||||||||
| Taille attendue (nm) | 74.6 (3.8) | ||||||||
| CeO2 JRC NM212 | Mode-I / | PN | PN : Étalons Ce ionic et AuNP | 1.7 (0) | 0.90 (0.09) | 61.9 (2.0) | 7.59 (0.32) | - | |
| 10 à 100 milles marins | Méthode de comptage | ||||||||
| Mode-II / | PN | PN/μDG : | 4.9 (1.4) | 1.36 (0.35) | 70.6 (5.9) | 5.42 (1.7) | - | ||
| Rapport de sensibilité | Étalons ioniques | ||||||||
| Mode-III / | μDG | μDG : | 100 | 1.63 (0.62) | 74.4 (9.2) | 590 (168) | - | ||
| ημDG = 1 | Norme ionique CE | ||||||||
Tableau 3 : Résultats de la configuration à double entrée. Efficacité de transport, fraction massique de métal, diamètre et concentration en nombre NP pour les matériaux NP Au NIST 8013, Ag NIST 8017 et CeO2 JRC NM 212 (n=3) à l’aide de trois modes d’analyse et de trois méthodes de détermination de l’efficacité de transport. Le % de récupération est défini comme le rapport entre le #NPs déterminé et le #NPs attendu. Le tableau est reproduit avec la permission de la référence14.
Le protocole présenté ici permet de déterminer la concentration en masse et en nombre des particules. La formation des gouttelettes μDG, y compris la taille des gouttelettes (figure 3), a été caractérisée au préalable (tableau 3).
Une fois l’installation assemblée (figure 1) et la taille des gouttelettes déterminée, les deux systèmes d’injection ont été validés avec des étalons ioniques (figure 4). Une précision de r² > 0,99 a pu être obtenue avec les deux systèmes d’injection pour tous les éléments étudiés. Cependant, il existe des différences entre les deux systèmes en raison de la quantité d’analyte introduite et transportée. Étant donné que le μDG a une efficacité de transport très élevée (jusqu’à 100 %), des sensibilités d’analytes plus élevées par rapport au PN sont observées avec une faible entrée de masse en même temps. Cependant, les concentrations mesurées introduites par le μDG doivent être séparées en deux plages linéaires. Pour Ag, la première plage linéaire peut être observée entre 0 et 0,5 fg événement-1 et la seconde entre 0,5 et fg événement-1. En revanche, la première plage linéaire pour Ce est comprise entre 0 et 0,25 fg événement-1 et la seconde entre 0,25 et 3 fg événement-1. La plage linéaire du PN pour les concentrations mesurées semble être plus élevée. Ceci est très probablement lié à la différence de masse introduite dans l’ICP-MS par événement de détection. Le μDG injecte une quantité absolue constante dans un faible volume par goutte et par événement de détection, ce qui entraîne une masse détectée plus faible par rapport à l’introduction d’échantillons avec le PN.
Une fois la validation réussie, des expériences peuvent être réalisées comme décrit à la figure 2. La figure 5 illustre un résultat de ces expériences pour la détermination de la taille et de la concentration en nombre de particules de CeO2 NP. Ici, les signaux pour les solutions ioniques et NP introduites via μDG et PN peuvent être identifiés. Un triple dosage a été effectué pour toutes les particules étudiées.
L’évaluation des données obtenues a été effectuée comme décrit ci-dessus et est résumée dans le tableau 3. Pour les NP Au et Ag utilisés pour la validation de la configuration à deux entrées et les trois modes d’analyse, la concentration granulométrique et numérique certifiée a pu être obtenue avec tous les modes d’analyse effectués. La taille moyenne des particules obtenue pour le CeO2 est comprise entre 10 et 100 nm, la plage spécifiée par le fabricant.
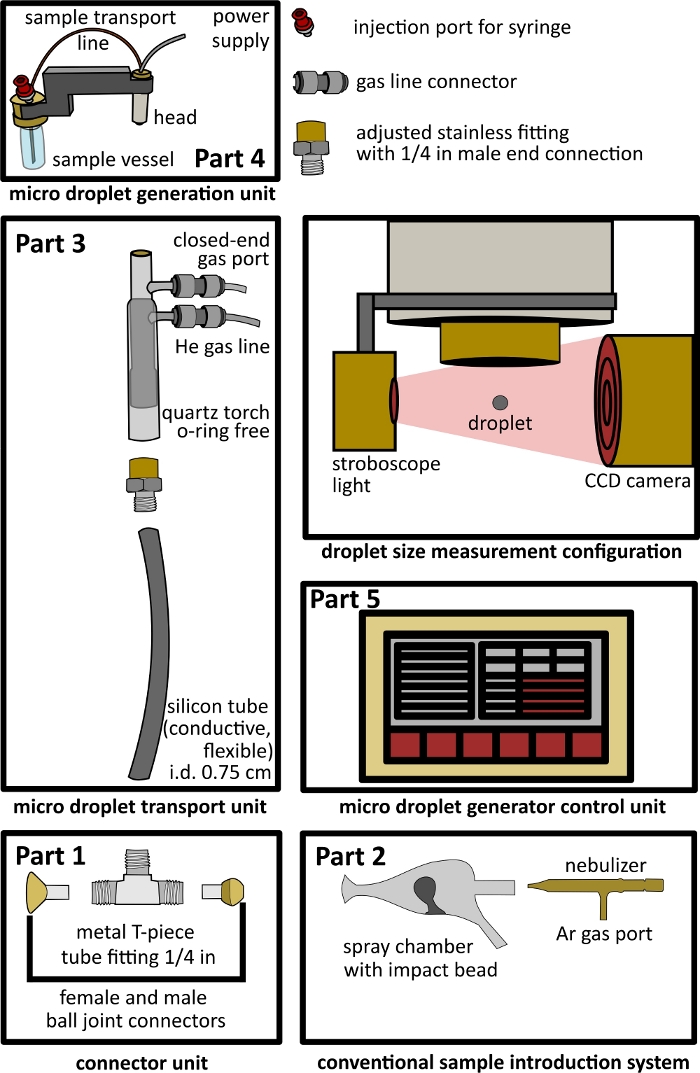
Figure 1 : Conception de la configuration de l’interface à double entrée. Partie 1 - unité de connexion, partie 2 - système d’introduction conventionnel, partie 3 - unité de transport de microgouttelettes, partie 4 - unité de génération de microgouttelettes, partie 5 - unité de contrôle des microgouttelettes, et configuration ouverte pour la mesure de la taille des gouttelettes comprenant une lumière stroboscope et une caméra CCD. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’objectif de la configuration à double entrée développée est de caractériser et de quantifier les NP aussi précisément que possible en ce qui concerne leur taille et leur concentration en nombre en utilisant différents modes d’analyse, indépendants de l’analyte à étudier. Il est possible d’obtenir cet objectif en combinant un système d’introduction à faible volume (pL) et à transport de masse élevée (jusqu’à 100 %) (μDG) avec un système d’introduction conventionnel (PN). En utilisant la configuration présentée dans ce travail, l’efficacité de transport basée sur un élément spécifique nécessaire à la quantification de la masse des particules peut être déterminée sur la base d’étalons ioniques et indépendamment des matériaux de référence NP. De plus, les NP introduits dans l’ICP-MS avec le μDG ont une distribution granulométrique plus étroite (AuNP) ou similaire (AgNP). Sinon, pour CeO2 , une distribution de taille plus large pour le μDG a été observée et peut être attribuée à la polydispersité plus élevée de l’échantillon analysé. En raison de l’introduction d’un faible volume, deux NP peuvent être détectées séparément l’une de l’autre, ce qui serait autrement interprété comme une NP dans la configuration conventionnelle14.
Les avantages résultant de l’unité de transport μDG sont la grande flexibilité due au tube en silicone flexible, qui simplifie l’alignement de la configuration. La torche avec l’injecteur peut également être réglée pendant la configuration tout en restant connectée à l’ICP-MS. Le flux de gaz He supplémentaire appliqué empêche une collision des gouttelettes formées par la tête μDG avec les parois du tube20. De plus, le gaz He permet d’enlever la tête μDG pendant l’échange d’échantillons, même lorsque l’ICP-MS est encore en fonctionnement. Le maintien de l’ICP dans un état opérationnel est crucial pour une mesure stable et robuste. Étant donné que la tête DG doit être nettoyée et rincée à chaque nouvel échantillon ou étalon, le débit He est vital pour le fonctionnement du système d’entrée introduit dans ce travail. De plus, toutes les pièces de la configuration à double entrée doivent être correctement connectées afin d’empêcher la pénétration de l’oxygène dans le système. Afin de diminuer l’oxygène dans la configuration présentée, le système est rincé avec le nébuliseur et le gaz de transport des gouttelettes avant l’allumage du plasma pendant au moins 5 à 10 min.
Lorsque les gouttelettes formées atteignent l’unité de connexion, elles sont transportées dans le plasma par un flux de liquide nébulisé, également appelé état de plasma humide. Par rapport à l’utilisation de plasma sec, cela conduit à une teneur en liquide accrue du plasma. Par conséquent, l’intensité du signal diminue ainsi que la fluctuation de l’augmentation du signal, c’est-à-dire un écart-type plus élevé du signal de mesure moyen13. Cependant, en utilisant le μDG et des concentrations dans la gamme de 0,2 μg/L, des signaux au-dessus du bruit de fond peuvent être détectés. La masse injectée correspondante par gouttelette a une faible teneur en métal, ce qui est proche des limites de détection pour certains éléments (c’est-à-dire Au, Ag, Ce). Si l’on utilise des concentrations différentes pour l’étalonnage le long de cette limite, deux régions linéaires peuvent être observées avec un chevauchement d’environ 0,05 μg/L pour Ce et 2 μg/L pour Ag. En dessous de la région de chevauchement, les signaux observés sont proches du bruit de fond spécifique de l’élément21. Au-dessus de ces limites, la plage de travail linéaire du μDG peut être identifiée. Même avec la capacité de mesurer de faibles concentrations, il est impossible de faire la distinction entre les ions et le NP du même analyte dans une gouttelette s’ils sont simultanément présents. Sinon, en utilisant le système d’introduction conventionnel, le fond ionique moyen peut être déterminé et soustrait de tous les signaux pour obtenir uniquement les signaux de particules.
Les systèmes fondés sur les OMD présentent également plusieurs limitations qui peuvent être partiellement contournées par l’application du système à double entrée proposé. Cependant, si la fréquence des gouttelettes de μDG dépasse 50 Hz, il n’est pas possible de créer un motif de gouttelettes cohérent. Les gouttelettes formées peuvent entrer en collision et, par conséquent, un échange d’analyte se produit. Le réglage correct des débits de gaz est également important pour un transport fiable des gouttelettes dans le système ICP-MS ainsi que pour le bon fonctionnement du PN. À l’heure actuelle, le système à double entrée proposé ne prend pas en charge l’automatisation de la procédure de mesure, car il est nécessaire de changer manuellement les solutions d’échantillons.
À l’avenir, μDG pourra être utilisé pour caractériser et quantifier les NP dans des matrices complexes et des échantillons environnementaux. Pour éviter le colmatage de μDG en raison de la viscosité, de la complexité et de la tension superficielle de la solution plus élevées, une conception de tête appropriée doit être utilisée. En fonction de la conception de la tête μDG et du fonctionnement de l’alimentation, il peut être possible de générer des gouttelettes contenant des systèmes de type particulaire tels que des cellules, des micelles ou des transporteurs de lipides pour lesquels des matériaux de référence standard ne sont pas du tout disponibles.
Déclarations de divulgation
Tous les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par le BfR SFP 1322-642 pour F.L.K et P.R., le BfR SFP 1322-724 pour D.R. et la bourse BfR senior scientist pour S.A.P.
matériels
| Name | Company | Catalog Number | Comments |
| Au ionic (1000 mg L-1 stock) | VWR, UK | 85550.18E | |
| Ag ionic (1000 mg L-1 stock) | Ultra Scientific, RI, USA | ICM-103 | |
| Ag NP (75nm, NIST 8017) | NIST, Gaithersburg, MD, USA | no longer available | |
| Au NP (60nm, NIST 8013) | NIST, Gaithersburg, MD, USA | no longer available | |
| Ce ionic (1000 mg L-1 stock) | VWR, UK | 85557.18E | |
| CeO2 (10-100nm, NM212) | EU Joint Research Centre | NM212 | |
| Excel 2016 | Microsoft | ||
| Fiji | ImageJ | ||
| Glass female spherical ball + Glass male ball | Fisher Scientific | 12499016 | |
| HCl (emprove bio) | Merck, Germany | 100317 | |
| ICP-MS spray chamber with ipact bead | LabKings | LK6-45013 (OEM 3600170) | |
| Metal clamps for spherical glass joint | Fisher Scientific | 11322015 | |
| Metal T-Piece | Swagelok | SS-4-VCR-T | |
| Microdrop Dispenser Head, non heated | microdrop Technologies | 944 | |
| Microdrop Dispensing System MD-E-3000 | microdrop Technologies | ||
| MilliQ water (MilliPore gradient) | Merck MilliPore, Darmstadt, Germany | ||
| O-ring free quartz torch | Analytical West | 450-301 | |
| PFA-ST concentric nebulizer | Elemental Scientific | ES-2042 | |
| Silicone Rubber Tubing - 60° Shore - Platinum Cured - Black | Silex | ||
| XIMEA Cam Tool | XIMEA |
Références
- Linsinger, T. P. J., Peters, R., Weigel, S. International interlaboratory study for sizing and quantification of Ag nanoparticles in food simulants by single-particle ICPMS. Analytical and Bioanalytical Chemistry. 406 (16), 3835-3843 (2014).
- Krystek, P., et al. Method development and inter-laboratory comparison about the determination of titanium from titanium dioxide nanoparticles in tissues by inductively coupled plasma mass spectrometry. Analytical and Bioanalytical Chemistry. 406 (16), 3853-3861 (2014).
- Degueldre, C., Favarger, P. Y., Bitea, C. Zirconia colloid analysis by single particle inductively coupled plasma-mass spectrometry. Analytica Chimica Acta. 518 (1-2), 137-142 (2004).
- Degueldre, C., Favarger, P. Y. Colloid analysis by single particle inductively coupled plasma-mass spectroscopy: a feasibility study. Colloid Surface A. 217 (1-3), 137-142 (2003).
- Pace, H. E., et al. Determining transport efficiency for the purpose of counting and sizing nanoparticles via single particle inductively coupled plasma mass spectrometry. Analytical Chemistry. 83 (24), 9361-9369 (2011).
- Verboket, P. E., Borovinskaya, O., Meyer, N., Gunther, D., Dittrich, P. S. A new microfluidics-based droplet dispenser for ICPMS. Analytical Chemistry. 86 (12), 6012-6018 (2014).
- Shigeta, K., et al. Application of a micro-droplet generator for an ICP-sector field mass spectrometer - optimization and analytical characterization. Journal of Analytical Atomic Spectrometry. 28 (5), 646-656 (2013).
- Gschwind, S., Hagendorfer, H., Frick, D. A., Gunther, D. Mass quantification of nanoparticles by single droplet calibration using inductively coupled plasma mass spectrometry. Analytical Chemistry. 85 (12), 5875-5883 (2013).
- Gschwind, S., et al. Capabilities of inductively coupled plasma mass spectrometry for the detection of nanoparticles carried by monodisperse microdroplets. Journal of Analytical Atomic Spectrometry. 26 (6), 1166-1174 (2011).
- Zarrln, F., K, S. L., Socha, J. R. Droplet size measurements of various nebulizers using differential electrical mobluty particle sizer. Journal of Aerosol Science. 22, 343-346 (1991).
- Geertsen, V., Lemaitre, P., Tabarant, M., Chartier, F. Influence of design and operating parameters of pneumatic concentric nebulizer on micro-flow aerosol characteristics and ICP-MS analytical performances. Journal of Analytical Atomic Spectrometry. 27 (1), 146-158 (2012).
- Mehrabi, K., Günther, D., Gundlach-Graham, A. Single-particle ICP-TOFMS with online microdroplet calibration for the simultaneous quantification of diverse nanoparticles in complex matrices. Environmental Science. Nano. 6, 3349-3358 (2019).
- Ramkorun-Schmidt, B., Pergantis, S. A., Esteban-Fernandez, D., Jakubowski, N., Gunther, D. Investigation of a combined microdroplet generator and pneumatic nebulization system for quantitative determination of metal-containing nanoparticles using ICPMS. Analytical Chemistry. 87 (17), 8687-8694 (2015).
- Rosenkranz, D., et al. Improved validation for single particle ICP-MS analysis using a pneumatic nebulizer/microdroplet generator sample introduction system for multi-mode nanoparticle determination. Analytica Chimica Acta. 1099, 16-25 (2020).
- National Institute of Standards and Technology. Report of investigation reference material. Reference material 8017. National Institute of Standards and Technology. , (2015).
- Tavares, A. M., et al. Genotoxicity evaluation of nanosized titanium dioxide, synthetic amorphous silica and multi-walled carbon nanotubes in human lymphocytes. Toxicology In Vitro. 28 (1), 60-69 (2014).
- Au-Kaur, I., et al. Dispersion of Nanomaterials in Aqueous Media: Towards Protocol Optimization. Journal of Visualized Experiments. (130), e56074 (2017).
- Nanotechnologies. Size distribution and concentration of inorganic nanoparticles in aqueous media via single particle inductively coupled plasma mass spectrometry. ISO/TS19590 Nanotechnologies. , (2017).
- Shigeta, K., et al. Application of a micro-droplet generator for an ICP-sector field mass spectrometer - optimization and analytical characterization. Journal of Analytical Atomic Spectrometry. 28, 646-656 (2013).
- Koch, J., et al. Accelerated evaporation of microdroplets at ambient conditions for the on-line analysis of nanoparticles by inductively-coupled plasma mass spectrometry. Journal of Analytical Atomic Spectrometry. 28 (11), 1707-1717 (2013).
- Tuoriniemi, J., Cornelis, G., Hassellov, M. A new peak recognition algorithm for detection of ultra-small nano-particles by single particle ICP-MS using rapid time resolved data acquisition on a sector-field mass spectrometer. Journal of Analytical Atomic Spectrometry. 30 (8), 1723-1729 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon


