Method Article
Versatile sistema di introduzione del campione a doppio ingresso per l'analisi e la convalida della spettrometria di massa al plasma accoppiato induttivamente a singola particella multimodale
In questo articolo
Riepilogo
Qui forniamo un protocollo per l'uso di un sistema a doppio ingresso per la spettrometria di massa accoppiata induttivamente a singola particella che consente una caratterizzazione standard indipendente delle nanoparticelle.
Abstract
Le nanoparticelle contenenti metalli (NP) possono essere caratterizzate con spettrometri di massa al plasma accoppiati induttivamente (ICP-MS) in termini di dimensioni e concentrazione numerica utilizzando la modalità a singola particella dello strumento (spICP-MS). L'accuratezza della misura dipende dalla configurazione, dalle condizioni operative dello strumento e dai parametri specifici impostati dall'utente. L'efficienza di trasporto dell'ICP-MS è fondamentale per la quantificazione dell'NP e di solito richiede un materiale di riferimento con distribuzione dimensionale omogenea e una concentrazione nota del numero di particelle.
Attualmente, i materiali di riferimento NP sono disponibili solo per pochi metalli e in dimensioni limitate. Se le particelle sono caratterizzate senza uno standard di riferimento, i risultati sia della dimensione che del numero di particelle possono essere distorti. Pertanto, per superare questo problema, è stata sviluppata una configurazione a doppio ingresso per la caratterizzazione delle nanoparticelle con spICP-MS. Questa configurazione si basa su un sistema di introduzione convenzionale costituito da un nebulizzatore pneumatico (PN) per soluzioni di nanoparticelle e da un generatore di microgocce (μDG) per soluzioni di calibrazione ionica. È stata sviluppata un'interfaccia nuova e flessibile per facilitare l'accoppiamento di μDG, PN e il sistema ICP-MS. L'interfaccia è costituita da componenti di laboratorio disponibili e consente la calibrazione, la caratterizzazione delle nanoparticelle (NP) e la pulizia della disposizione, mentre lo strumento ICP-MS è ancora in funzione.
Sono disponibili tre modalità di analisi indipendenti per determinare la dimensione delle particelle e la concentrazione numerica. Ogni modalità si basa su un diverso principio di calibrazione. Mentre la modalità I (conteggio) e la modalità III (μDG) sono note in letteratura, la modalità II (sensibilità) viene utilizzata per determinare l'efficienza di trasporto solo con soluzioni standard ioniche inorganiche. È indipendente dai materiali di riferimento NP. Il sistema di ingresso basato su μDG qui descritto garantisce una sensibilità superiore all'analita e, quindi, limiti di rilevamento (LOD) più bassi. I LOD dipendenti dalle dimensioni raggiunti sono inferiori a 15 nm per tutte le NP (Au, Ag, CeO2) studiate.
Introduzione
Gli spettrometri di massa al plasma accoppiati induttivamente sono ampiamente utilizzati per quantificare le dimensioni e il numero di NP in vari campioni e matrici nella cosiddetta modalitàa singola particella 1,2,3. La modalità a singola particella è un'operazione del sistema di acquisizione dati con un breve tempo di integrazione o di permanenza. Ogni NP misurata produce un segnale integrato in questo intervallo di tempo (evento misurato in conteggi al secondo: cps) se è stata utilizzata un'adeguata diluizione della sospensione NP per evitare eventi doppi. Lo standard di calibrazione, così come il campione, vengono solitamente introdotti nell'ICP-MS tramite un sistema di introduzione del campione convenzionale basato sulla nebulizzazione pneumatica (PN)4. Tuttavia, come prerequisito, la portata di introduzione del campione e l'efficienza di trasporto (η) devono essere determinate per quantificare con precisione la massa metallica per NP e per determinare la loro concentrazione numerica nella sospensione. L'efficienza di trasporto descrive il rapporto tra la massa o il numero di particelle iniettate e la massa (metodo di raccolta dei rifiuti) o il numero di particelle (metodo di conteggio) rilevati dall'ICP-MS5. L'efficienza di trasporto è più frequentemente determinata utilizzando materiali di riferimento a base di nanoparticelle5. Tuttavia, le proprietà di trasporto dipendono dalla struttura della NP e coinvolgono proprietà come la composizione e il disperdente del campione. Altri fattori che influenzano sono i parametri strumentali, come la velocità di assorbimento del campione, la portata del gas del nebulizzatore, il tempo di permanenza e il tempo di misurazione totale.
Poiché sono disponibili solo materiali di riferimento nanoparticellari limitati, i risultati dell'analisi NP ottenuti possono essere distorti a causa delle differenze nella composizione elementare tra le particelle di riferimento e quelle del campione. Oltre alla disponibilità di una gamma limitata di materiali di riferimento, il rilevamento di più eventi di particelle per tempo di permanenza del rivelatore rappresenta un'ulteriore sfida. Ciò può anche influire sull'accuratezza dell'efficienza del trasporto da determinare.
Per essere indipendenti dai materiali di riferimento, idealmente, è preferibile un sistema di introduzione del campione con un'efficienza di trasporto di quasi il 100%. Allo stesso tempo, quando si utilizza un volume basso rispetto ai sistemi di introduzione convenzionali, è possibile utilizzare concentrazioni di particelle più elevate. Anche se due particelle sono vicine l'una all'altra, entrambe possono essere rilevate separatamente con il sistema basato su μDG.
Il μDG è in grado di generare goccioline monodisperse con un volume fisso nell'intervallo dei pL ed è adatto a questo scopo 6,7,8,9. Il μDG facilita l'iniezione di campioni ionici e particolati in diversi solventi nell'ICP-MS. Nel caso di campioni di metalli ionici, si presume che le goccioline generate siano completamente desolvatate durante il percorso verso l'ICP. Di conseguenza, la gocciolina perde tutta l'acqua e dal sale rimanente si forma una particella. Il diametro di questa particella è direttamente proporzionale alla concentrazione utilizzata. Pertanto, è possibile produrre internamente standard di riferimento fatti in casa della stessa matrice, massa e dimensione, con concentrazione variabile della soluzione ionica della NP da studiare. Il volume di una gocciolina può essere calcolato facilmente in base al diametro della gocciolina misurato dal μDG. Questo non è possibile con un PN che produce un'ampia distribuzione di goccioline con diversi diametri10,11. Grazie all'introduzione uniforme del campione con un'elevata efficienza di trasporto del 100% del μDG, è possibile ottenere un'elevata sensibilità dell'analita specifico dello strumento. A seconda della matrice utilizzata, ciò porta a limiti di rilevamento (LOD) inferiori della massa e delle dimensioni delle particelle rispetto ai risultati dei sistemi di introduzione convenzionali basati su PN12. Tuttavia, a causa del design del μDG, i campioni non possono essere scambiati facilmente quando il sistema ICP-MS è ancora in funzione. Tra le misurazioni di diversi campioni, il μDG deve essere pulito e successivamente lavato con la soluzione del campione per la stabilizzazione del sistema. Inoltre, la sua tolleranza a campioni di matrice pesante non è stata testata in modo approfondito. Inoltre, a causa delle portate estremamente basse, il tempo di analisi per ottenere buone statistiche sarebbe estremamente lungo, il che ne limita l'uso pratico, se si dovessero analizzare campioni "reali", come ad esempio le acque ambientali.
Per superare queste limitazioni, il μDG è stato precedentemente utilizzato in combinazione con un sistema convenzionale basato su nebulizzatore pneumatico, a cui è stato dato il nome di sistema a doppio ingresso13. Introducendo gli standard di calibrazione con la sospensione μDG e NP tramite un nebulizzatore pneumatico nell'ICP-MS, Ramkorun-Schmidt et al. sono stati in grado di sfruttare entrambi i sistemi13. È stata ottenuta una determinazione estremamente accurata della frazione di massa metallica di Au e Ag NP, senza la necessità di determinare l'efficienza del trasporto. Tuttavia, con questo sistema a doppia aspirazione non sono state determinate concentrazioni del numero di particelle. Inoltre, la pulizia e l'allineamento del sistema μDG complicavano l'applicabilità per l'analisi di routine.
In questo articolo, proponiamo un'interfaccia flessibile a doppio ingresso per determinare la dimensione delle particelle NP e la concentrazione del numero di particelle e ne dimostriamo l'assemblaggio e l'uso pratico. Come il sistema di Ramkorun-Schmidt et al., è costituito sia da un sistema di introduzione del campione μDG che da un sistema PN. Dimostriamo che il sistema a doppio ingresso, nella sua attuale fase di sviluppo, consente l'applicazione di tre modalità di analisi indipendenti per studiare e caratterizzare le NP contenenti metallo. Il nostro sistema a doppio ingresso semplifica la procedura di calibrazione per la determinazione delle NP e migliora le figure analitiche di merito, in particolare l'accuratezza14. I sistemi di ingresso consentono un comodo scambio di campioni e la pulizia del μDG anche quando l'ICP-MS è ancora in funzione, riducendo così il tempo di analisi complessivo e il rischio di disallineamento. Al fine di testare le prestazioni del sistema, per la validazione e la comparabilità del metodo vengono utilizzati NP di riferimento ben caratterizzati (60 nm AuNP – NIST 8013, 75 nm AgNP – NIST 8017).
Protocollo
1. Assemblaggio della configurazione di introduzione del campione a doppio ingresso
NOTA: I dettagli sulle diverse parti sono mostrati nella Tabella 1.
| Componenti | |||
| Parte 1 | Snodo sferico femmina in vetro con lunghezza del gambo di circa 10 mm | ||
| Snodo sferico maschio in vetro con lunghezza del gambo di circa 10 mm | |||
| Raccordo a T in metallo (dimensioni: 1/4 di pollice) | |||
| Adesivo vetro-metallo | |||
| Due morsetti per giunti sferici in vetro | |||
| Parte 2 | Camera di nebulizzazione ICP-MS (tipo consigliato: camera di nebulizzazione a cordone d'urto, camera di nebulizzazione ciclonica o simile) | ||
| Nebulizzatore pneumatico (tipo consigliato: nebulizzatore concentrico) | |||
| Morsetto | |||
| Parte 3 | Torcia al quarzo libera con O-ring | ||
| Connettore linea gas chiuso | |||
| Connettore linea gas aperto | |||
| Tubo in silicone conduttivo e flessibile | |||
| Parte 4 | Unità piezoelettrica per la generazione di micro gocce | ||
| Parte 5 | Unità di controllo micro gocce | ||
Tabella 1: Elenco dei componenti utilizzati per costruire la configurazione a doppio ingresso.
- Costruzione di un'unità di collegamento con raccordo a T (Figura 1 Parte 1).
NOTA: Questa parte collega il sistema convenzionale di introduzione del campione (passaggio 1.2) e l'unità di trasporto μDG (passaggio 1.3).- Inserire un giunto sferico maschio e femmina nelle aperture opposte di un connettore a T.
- Fissare i giunti sferici maschio e femmina utilizzando un adesivo vetro-metallo (ad es. colla siliconica).
- Collegare il giunto sferico femmina all'iniettore dell'ICP-MS utilizzando un morsetto.
- Collegamento di un sistema convenzionale di introduzione del campione (Figura 1 Parte 2)
NOTA: Questa parte è collegata all'unità connettore a T (passaggio 1.1)- Combinare una camera di nebulizzazione ICP-MS con un nebulizzatore pneumatico (PN), che si inserisce nella camera di nebulizzazione in uso.
- Utilizzare un morsetto per collegare l'uscita della camera di nebulizzazione al giunto sferico maschio del connettore a T (descritto al punto 1.1).
NOTA: L'uscita della camera di nebulizzazione è solitamente dotata di un connettore femmina con giunto sferico. La combinazione mostrata nella Figura 1 è costituita da un nebulizzatore e da una camera di nebulizzazione a microsfere a percussione. Al posto della camera di nebulizzazione a microsfere d'urto possono essere utilizzate altre camere di nebulizzazione con efficienze di trasporto comprese tra il 2 e il 10% o superiori.
- Costruzione dell'unità di trasporto delle microgocce (Figura 1 Parte 3)
NOTA: Questa parte collega l'unità connettore a T (passaggio 1.1) e l'unità μDG (passaggio 1.4).- Fissare una torcia al quarzo smontabile, con il tubo dell'iniettore rimosso, a un supporto da laboratorio con l'ingresso della torcia sulla parte superiore utilizzando i morsetti appropriati.
- Bloccare l'ingresso del plasma della torcia/gas ausiliario tramite connettori del gas chiusi.
NOTA: Il campione viene trasportato al nebulizzatore utilizzando una pompa peristaltica. Il gas argon viene utilizzato per la nebulizzazione del campione nella camera di nebulizzazione e per l'ulteriore trasporto nel plasma. - Collegare una linea di gas elio alla torcia tramite l'ingresso del gas di raffreddamento utilizzando un connettore del gas appropriato.
NOTA: L'elio gassoso applicato viene utilizzato per la desolvatazione delle goccioline generate e funge da gas di guaina impedendo alla gocciolina di entrare in collisione con le pareti della configurazione e impedendo allo strumento ICP-MS di inserire ossigeno atmosferico mentre la testa di ingresso del campione del μDG deve essere rimossa per la pulizia e lo scambio del campione. - Collegare un tubo in silicone conduttivo e flessibile lungo 30 cm (i.d. 0,75 cm), utilizzando un adattatore, all'estremità di uscita della torcia (parte inferiore della torcia).
- Collegare l'estremità inferiore del tubo in silicone all'unità connettore del raccordo a T allungando il tubo flessibile in silicone sulla sua connessione metallica verticale rimanente.
NOTA: Il tubo flessibile in silicone consente l'accordatura x-y-z dello strumento ICP-MS con la configurazione collegata.
- Collegamento dell'unità di generazione di microgocce e dell'unità di controllo per la generazione di microgocce (Figura 1 Parte 4, Parte 5)
NOTA: Questa parte è collegata all'unità di trasporto μDG (passaggio 1.3)- Collegare l'unità μDG preparata all'unità di trasporto delle microgocce inserendo la testa μDG nell'estremità di ingresso del campione della torcia.
- Collegare l'alimentatore all'unità di controllo μDG.
NOTA: La configurazione qui descritta consiste in una testa μDG disponibile in commercio e un alimentatore μDG. A seconda della testa μDG utilizzata, la configurazione deve essere adattata di conseguenza.
2. Quantificazione della dimensione delle goccioline
- Utilizzare una luce stroboscopica e una telecamera CCD (ad esempio, in una configurazione aperta, vedere la Figura 1 configurazione di misurazione delle dimensioni) per acquisire immagini delle goccioline prodotte dal μDG.
- Calibrare la telecamera CCD scattando immagini di un oggetto di dimensioni note nell'intervallo dei μm (ad esempio, filo di rame con un diametro di 150 μm).
- Scattare immagini di almeno 1.000 gocce con le impostazioni utilizzate per l'esperimento (vedere la Tabella 2).
- Utilizzare un software grafico appropriato (vedi Tabella dei materiali) per valutare le immagini relative all'oggetto e la dimensione della goccia nei seguenti passaggi:
- Fare clic su File e Apri per caricare l'immagine dell'oggetto.
- Clicca sull'immagine | Regola | Soglia per definire l'area dell'oggetto spostando le barre di scorrimento.
- Fare clic su Applica per applicare le impostazioni.
- Fare clic sul pulsante Segmento dritto .
- Fare clic e tenere premuto il pulsante sinistro del mouse per tracciare una linea accanto all'oggetto.
- Premi Ctrl + M per misurare le dimensioni dell'oggetto.
- Misura il diametro dell'oggetto in 5 punti diversi.
- Copia e incolla la tabella "Risultati" in un software per fogli di calcolo.
- Calcola la media aritmetica della colonna "Lunghezza".
- Calcola il rapporto d'aspetto dei pixel (PAR): dimensione effettiva dell'oggetto (μm)/dimensione media dell'oggetto nell'immagine (px).
- Fare clic su File | Importazione | Sequenza di immagini per importare e caricare le immagini delle goccioline.
- Fare clic su Rettangolare e contrassegnare la goccia della prima immagine.
- Esegui il clic destro sul tappetino del mouse e scegli Duplica per separare le goccioline della sequenza di immagini dal resto dell'immagine.
- Separare le goccioline dallo sfondo come specificato nel passaggio 2.4.2.
- Fare clic su Elabora | Binario | Erodere per rimuovere i riflessi di luce sulla superficie delle goccioline.
- Fare clic su Elabora | Binario | Dilatare per invertire il passaggio "Erode".
- Fare clic su Analizza | Analisi delle particelle | Ok per misurare tutte le goccioline.
- Copia e incolla la tabella "Riepilogo" o "Risultato" in un software per fogli di calcolo.
- Calcola la media aritmetica del diametro del furetto in px.
- Usa il PAR per trasformare il diametro in μm: il diametro del furetto in px/PAR.
NOTA: La dimensione delle goccioline formate dal μDG varia a seconda della lunghezza selezionata e della durata dell'impulso di corrente applicato all'elemento piezoelettrico7.
3. Preparazione del campione
- Preparare una soluzione di calibrazione ionica dell'analita da misurare nell'intervallo di concentrazione da 0,2 a 20 μg/L in acido diluito (ad es. HCl (0,5 v/v), HNO3 (3,5 v/v)).
- Preparare una soluzione ionica per la calibrazione a un punto nell'intervallo di concentrazione compreso tra 1 e 10 μg/L in acido diluito.
- Preparare le sospensioni standard NP secondo le istruzioni del produttore o i protocolli interni.
NOTA: I passaggi 3.3.1 – 3.3.4 spiegano la preparazione delle sospensioni standard NP considerando come esempio Ag, Au, CeO2 NP.- Preparare 10 mL di soluzione AuNP da 0,05 μg/L per il PN e 1 μg/L di soluzione AuNP in acqua ultrapura per μDG. Vortice per 20-60 secondi prima dell'uso.
- Preparare una soluzione di AgNP da 0,05 μg/L per il PN e una soluzione di AgNP da 2 μg/L, entrambe in acqua ultrapura, per μDG. Agitare bene per 20-60 secondi prima di usarne15.
- Preparare le soluzioni di CeO2 NP da utilizzare come descritto in precedenza per gli ossidi metallici16,17.
- Preparare 0,05 μg/L di soluzione CeO2 NP per il PN e 1 μg/L di soluzione per il μDG.
- Pesare 25,6 mg/mL di CeO2 NP in un recipiente di vetro da 15 mL – 20 mL in totale e aggiungere 10 mL di soluzione BSA 0,05 (v/v) preparata in acqua ultrapura.
- Utilizzare un sonicatore a punta di dito con una potenza di 7,35 W per omogeneizzare la soluzione di particelle per 309 s.
4. Accordatura strumentale e parametri
- Assicurarsi che il generatore MDG sia spento e collegare la configurazione di introduzione del campione a doppio ingresso, che è stata costruita nel passaggio 1, con l'iniettore dello strumento ICP-MS con un morsetto. Lavare il sistema di ingresso per 5 – 10 minuti con il gas del nebulizzatore (Ar) e il gas di trasporto delle goccioline (He).
NOTA: Lo strumento ICP-MS deve essere protetto contro la penetrazione di alti livelli di ossigeno nella sala plasma. - Spegnere il gas di trasporto delle goccioline (He) e avviare il sistema ICP-MS
- Sintonizzare lo strumento nella modalità di misurazione che si desidera utilizzare utilizzando la soluzione di sintonizzazione standard dello strumento specificata dal produttore del sistema ICP-MS.
NOTA: Una soluzione di sintonizzazione standard è costituita, ad esempio, da bario, cerio, indio, uranio, bismuto, cobalto, litio (tutti 1 μg/L) in una miscela di acido nitrico al 2,5% (v/v) e acido cloridrico allo 0,5% (v/v). - Determinazione del tasso di assorbimento del campione del PN.
- Riempire un recipiente con 15 ml di acqua.
- Pesare il recipiente.
- Collegare il recipiente al tubo del PN.
- Avviare la pompa peristaltica facendo clic sul pulsante di avvio della pompa peristaltica nel software dello strumento.
- Avvia un timer di 5 minuti.
- Rimuovere la linea di aspirazione dal recipiente esattamente dopo 5 minuti. Pesare nuovamente il recipiente.
- Calcolare la velocità di assorbimento del campione (mL/min) utilizzando la formula: peso del vaso prima - peso del vaso dopo / durata del tempo.
- Ottimizza i parametri strumentali per migliorare la sensibilità dell'analita, se necessario, ad esempio la portata del gas del nebulizzatore, la profondità di campionamento, la potenza del plasma.
NOTA: Vedere la Tabella 2 come esempio di parametri strumentali che possono essere ottimizzati in un sistema ICP-MS. - Regolare il flusso di gas He fino a quando non è possibile rilevare una velocità del segnale costante in funzione della velocità di formazione delle gocce.
| Parametro | Valore | ||
| ICP – SM: | |||
| Potenza al Plasma (W) | 1600 | ||
| Profondità di campionamento (mm) | 4 | ||
| Portate (L min-1): | |||
| Gas ausiliario | 0.65 | ||
| Gas di raffreddamento | 14 | ||
| Tempi (s) | |||
| Acquisizione dei dati | 1200 | ||
| Tempo di permanenza (s) | 0.01 | ||
| Interfaccia: | |||
| PN Velocità di assorbimento del campione (mL min-1) | 0.21 | ||
| Gas nebulizzatore (L min-1) | 0.92 | ||
| μDG: | |||
| Diametro capillare (μm) | 75 | ||
| Frequenza di caduta (Hz) | 10 | ||
| Gas per il trucco (L min-1) | 0.27 | ||
| Modalità di funzionamento | Triplo impulso | ||
| Impostazione 1 | Impostazione 2 | Impostazione 3 | |
| Tensione (V) | 53 | 51 | 47 |
| Larghezza dell'impulso (μs) | 20 | 25 | 12 |
| Ritardo dell'impulso (μs) | 4 | 2 | 1 |
Tabella 2: Valori dei parametri strumentali utilizzati.
5. Misurazione multimodale di campioni di nanoparticelle
- Preparare l'unità di controllo μDG
- Accendere l'interruttore di alimentazione dell'unità di controllo μDG.
- Fare clic su Start nella prima schermata per avviare la centralina.
- Fare clic su Impostazioni globali per scegliere la modalità a impulsi da utilizzare.
- Fare clic sul pulsante grafico destro in modalità a impulsi per scegliere la modalità a triplo impulso.
NOTA: Le impostazioni per la modalità a triplo impulso sono riportate nella Tabella 2.
- Preparare l'unità μDG
- Fare clic su On/Off per avviare il μDG.
- Riempire il recipiente del campione con la soluzione del campione da misurare.
- Collegare il recipiente del campione all'unità μDG.
- Utilizzando una siringa da 10 ml per spurgare l'aria attraverso il recipiente e l'unità μDG.
- Collegare la siringa alla porta della siringa sul recipiente del contenitore del campione.
- Spingere lo stantuffo della siringa fino a quando non si osserva un flusso costante di liquido che fuoriesce dalla testa μDG.
- Mantenere la pressione per 10 s.
- Rimuovere la siringa.
- Posizionare l'unità μDG nella zona di messa a fuoco della telecamera CCD per osservare le goccioline formate.
- Collegare la telecamera CCD a un PC o laptop.
- Avviare il software della telecamera CCD per osservare le goccioline formate
- Fare clic su Avvia per ottenere una visualizzazione in tempo reale delle goccioline.
- Osservare la formazione costante di goccioline.
- Posizionare la testa μDG sulla torcia invertita del sistema di introduzione del campione a doppio ingresso.
- Convalidate sia l'unità μDG che il PN per ogni elemento di interesse misurando ripetute calibrazioni multipunto.
NOTA: Per l'acquisizione dei dati ICP-MS, utilizzare il software associato allo strumento. - Determinare l'intervallo lineare della calibrazione multipunto importando i dati sperimentali in un software per fogli di calcolo.
- Calcolare la media aritmetica di ciascun punto di calibrazione.
- Determinare l'intercetta, la pendenza e il coefficiente di correlazione.
NOTA: Per sp-ICP-MS il coefficiente di correlazione deve essere >0,9918.
- Scegliere una concentrazione all'interno dell'intervallo lineare delle curve di calibrazione per le calibrazioni a un punto in un secondo momento.
- Seguendo i passaggi seguenti per la misurazione e la convalida (utilizzando materiali di riferimento come NIST 8012, NIST 8013 o NIST 8017 o simili) della quantificazione multimodale dei nanomateriali (Figura 2).
- Selezionare una nanoparticella e uno standard ionico in base all'analita di interesse.
- Preparare l'unità μDG secondo 5.2 con una soluzione standard ionica.
- Aggiungere una soluzione acida diluita (ad es. 0,5% v/v HCl) tramite il PN.
- Avviare la misura del sistema ICP-MS in modalità risolta nel tempo.
- Fare clic su On/Off dopo 120 s per arrestare il μDG e scambiare la soluzione acida diluita al PN con lo standard ionico.
- Dopo 330 s sostituire nuovamente lo standard ionico al PN con una soluzione acida diluita.
- Nel frattempo rimuovere l'unità μDG dalla configurazione.
- Sostituire il recipiente del campione (fiala di vetro) dell'unità μDG con un recipiente contenente una soluzione acida diluita (ad es. HNO3 al 3,5%) per pulire l'unità μDG.
- Riempire una siringa da 10 ml con aria.
- Collegare la siringa alla porta di iniezione dell'unità μDG e svuotare la siringa fino a quando non fuoriesce un getto di liquido dalla testa μDG e mantenere la pressione per 30 s.
- Preparare il μDG come specificato al punto 5.2 con il campione NP e ricollegare l'unità μDG alla configurazione a 510 s.
- Fare clic su On/Off dopo 810 s per arrestare il μDG.
- Scambiare la soluzione acida diluita al PN con il campione NP e misurare per altri 300 s.
- Interrompere la misurazione dopo circa 1.200 s.
- Pulire l'unità μDG come specificato al punto 5.5.8.
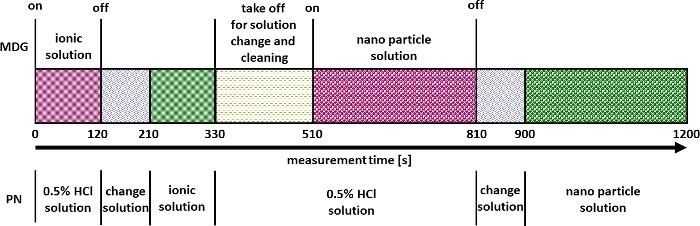
Figura 2: Strategia di misura per la quantificazione multimodale dei nanomateriali. Clicca qui per visualizzare una versione più grande di questa figura.
6. Analisi dei dati
NOTA: Per semplificare tutte le fasi di calcolo, è stato preparato un foglio di calcolo corrispondente (vedi File supplementare).
- Utilizzare un foglio di calcolo o un software in grado di gestire i frame di dati per elaborare i dati e importare i dati misurati. Incolla i valori di intensità dell'intera misurazione nel software del foglio di calcolo (incluso nel supplemento elettronico) nella colonna A, i dati verranno visualizzati. Inserire tutti i parametri sperimentali necessari per il calcolo nella tabella "Parametro di input".
- Definisci le regioni di interesse (ROI) per μDG ionico (I), PN ionico (II), μDG NP (III) e PN NP (IV) selezionando le celle del foglio di calcolo appropriate. Utilizzando il grafico nel foglio preparato per definire i confini delle ROI e inserire i valori nella tabella "Determinazione della regione di interesse" (celle C1:E7).
- Copia e incolla ogni set di dati in una colonna separata. Premere il pulsante Copia ROI nel foglio preparato per suddividere la misurazione nelle quattro ROI (colonna M:P).
- Calcola la media aritmetica di I e II.
- Applicare l'approccio iterativo per separare i segnali di particelle o goccioline e il fondo per III e IV.
- Calcola la media aritmetica e la deviazione standard di tutti i valori misurati.
- Calcolare un valore limite o di cut-off in base al valore medio + 5*deviazione standard.
- Rimuovere tutti i segnali inferiori al valore limite di III e IV utilizzando il comando Taglia sui segnali delle particelle identificate. Usa Incolla per incollarli in una colonna separata.
- Ripetere i passaggi 1-3 fino a quando il valore medio e la deviazione standard non sono costanti.
NOTA: Nelle colonne da Q a BD del foglio preparato, l'approccio iterativo per separare i segnali di fondo e di particelle viene eseguito cinque volte.
- Calcola la media aritmetica dei segnali delle particelle identificate di III e IV.
- Calcolare la dimensione minima rilevabile delle particelle (dimensioneLOD - nm ) per μDG NP e PN NP utilizzando il limite strumentale di rilevazione dell'analita (LOD - conteggi), la sensibilità dell'analita (SC,ionico - conteggi/(μg/L)), il tasso di assorbimento del campione (qs - mL/min), l'efficienza di trasporto (η - unità relativa) e la densità del materiale sfuso (ρ - g/cm³):
- Calcolare la massa (ma,p) e la dimensione delle particelle (d - nm, supponendo che le particelle siano sferiche) dei segnali delle particelle identificate per μDG NP e PN NP secondo le tre modalità di analisi applicate tenendo conto della concentrazione di metallo ionico di una soluzione standard (ca - μg/L) e del flusso di ioni nel plasma (conteggi/s):
- Un sacco:

- Grandezza:

- Un sacco:
- Calcolare l'efficienza di trasporto specifico delle modalità di analisi utilizzando il numero di particelle rilevate (qp), la concentrazione di particelle del campione (cp, utilizzato - 1/mL), la sensibilità dell'analita del PN e dell'MDG (Sm, ionico, PN, Sm, ionico, MDG - conteggi/(μg/L)), il volume della gocciolina (Vgoccia - pL), il tempo di permanenza (td – ms), l'efficienza di trasporto del PN (ηPN), l'efficienza di trasporto del μDG (ημDG), l'intensità delle soluzioni ioniche misurate dal PN e dal μDG ( Iionc, PN, Iionic, μDG – conteggi) e la concentrazione della soluzione ionica utilizzata per entrambi i sistemi di iniezione (cionico, PN, cionico,μDG - μg/L):
- Modalità I:

- Modalità II:

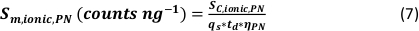

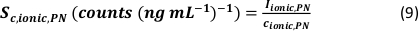
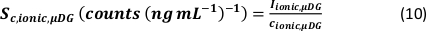
- Modalità I:
- Supponiamo che l'efficienza di trasporto di μDG sia uguale a 1:19
- Calcolare la concentrazione del numero di particelle della soluzione di NP analizzata tenendo conto del volume del campione iniettato durante la misurazione (Viniettato):
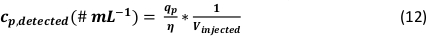
NOTA: Nel foglio preparato tutti i calcoli vengono eseguiti automaticamente dopo la divisione. I risultati sono riportati nella tabella "Parametri di uscita" (celle BH7:BR35) e contengono le formule sopra descritte, comprese le singole fasi di calcolo.
Risultati

Figura 3: Determinazione della dimensione delle gocce con la telecamera CCD. Calibrazione della telecamera CCD con un filo di rame da 150 μm (A) e determinazione della dimensione delle gocce dopo aver convertito le immagini delle gocce ottenute in un'immagine binaria a colori (B). Clicca qui per visualizzare una versione più grande di questa figura.
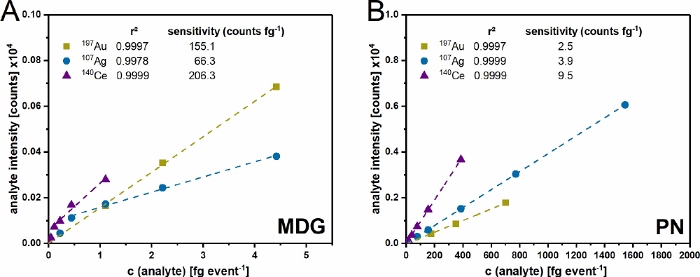
Figura 4: Convalida della configurazione a doppio ingresso. Calibrazione multipunto del sistema di ingresso μDG (A) e PN (B) per oro (Au), argento (Ag) e cerio (Ce). La concentrazione utilizzata nell'intervallo 0,2 – 20 μg mL-1 viene convertita, a seconda delle condizioni sperimentali utilizzate in massa per evento rilevato. I dati presentati sono i valori medi di tre repliche indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.
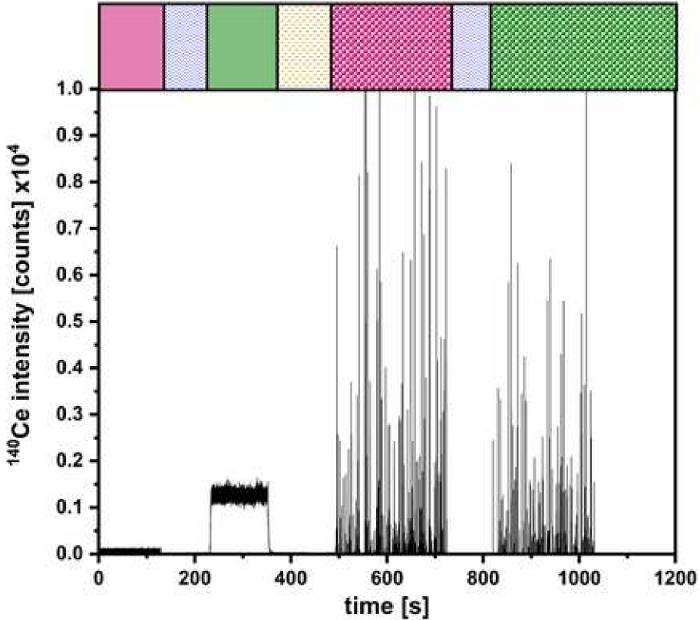
Figura 5: Rappresentazione della misura per la configurazione a doppio ingresso. La quantificazione di CeO2 NP con barre colorate come fatto in Figura 2 per le diverse fasi di iniezione. Clicca qui per visualizzare una versione più grande di questa figura.
| Campione | Modalità Analisi / | Ingresso per campione NP | Ingresso per standard di calibrazione | η | ma, p | Dimensione NP (d) | #NPs | Recupero (%) | |
| η Determinazionedel PN | (%) | (fg) | (nm) | (mL-1 x103) | |||||
| Au 56 nm | Modalità-I / | PN | PN: Standard Au ionici e AuNP | 1.8 (0.1) | 1.9 (0.5) | 57.2 (4.3) | 28.1 (0) | 100 | |
| NIST 8013 | Metodo di conteggio | ||||||||
| Modalità-II / | PN | PN/μDG: | 1.9 (0.1) | 2 (0.4) | 58 (3.6) | 25.6 (1.6) | 91 | ||
| Rapporto di sensibilità | Standard auionici | ||||||||
| Modalità-III / | μDG | μDG: | 100 | 1.7 (0.2) | 55 (2.4) | 394.4 (29.3) | 70 | ||
| ημDG = 1 | Standard ionico Au | ||||||||
| Dimensione prevista (nm) | 56.0 (0.5) | ||||||||
| Ag 75 nm | Modalità-I / | PN | PN: Standard Ag ionici e AgNP | 2.3 (0.2) | 1.9 (0.2) | 70.2 (2.3) | 21.6 (0) | 100 | |
| NIST 8017 | Metodo di conteggio | ||||||||
| Modalità-II / | PN | PN/μDG: | 2.5 (0.2) | 2 (0.2) | 71.5 (2.1) | 20.5 (1.9) | 95 | ||
| Rapporto di sensibilità | Standard agionici | ||||||||
| Modalità-III / | μDG | μDG: | 100 | 2.5 (0.2) | 76.7 (2.3) | 757.1 (68.7) | 88 | ||
| ημDG = 1 | Standard ag ionico | ||||||||
| Dimensione prevista (nm) | 74.6 (3.8) | ||||||||
| CeO2 JRC NM212 | Modalità-I / | PN | PN: Standard Ce ionici e AuNP | 1.7 (0) | 0.90 (0.09) | 61.9 (2.0) | 7.59 (0.32) | - | |
| 10-100 nm | Metodo di conteggio | ||||||||
| Modalità-II / | PN | PN/μDG: | 4.9 (1.4) | 1.36 (0.35) | 70.6 (5.9) | 5.42 (1.7) | - | ||
| Rapporto di sensibilità | Norme ioniche CE | ||||||||
| Modalità-III / | μDG | μDG: | 100 | 1.63 (0.62) | 74.4 (9.2) | 590 (168) | - | ||
| ημDG = 1 | Norma ionica Ce | ||||||||
Tabella 3: Risultati della configurazione a doppio ingresso. Efficienza di trasporto, frazione di massa metallica, diametro e concentrazione del numero NP per materiali Au NIST 8013, Ag NIST 8017 e CeO2 JRC NM 212 (n=3) NP utilizzando tre modalità di analisi e tre metodi di determinazione dell'efficienza di trasporto. La % di recupero è definita come il rapporto tra il #NPs determinato e il #NPs atteso. La tabella è ristampata con il permesso del riferimento14.
Il protocollo qui presentato consente di determinare la massa delle particelle e la concentrazione numerica. La formazione di goccioline μDG, compresa la dimensione delle goccioline (Figura 3) è stata caratterizzata in anticipo (Tabella 3).
Dopo l'assemblaggio della configurazione (Figura 1) e la determinazione della dimensione delle gocce, entrambi i sistemi di iniezione sono stati convalidati con gli standard ionici (Figura 4). Con entrambi i sistemi di iniezione è stato possibile ottenere una precisione di r² > 0,99 per tutti gli elementi studiati. Tuttavia, ci sono differenze in entrambi i sistemi a causa della quantità di analita introdotta e trasportata. Poiché il μDG ha un'efficienza di trasporto molto elevata (fino al 100%), si osservano contemporaneamente sensibilità all'analita più elevate rispetto al PN con un basso input di massa. Tuttavia, le concentrazioni misurate introdotte dal μDG devono essere separate in due intervalli lineari. Per Ag, il primo intervallo lineare può essere osservato tra 0 e 0,5 fg evento-1 e il secondo tra 0,5 e fg evento-1. Al contrario, il primo intervallo lineare per Ce è compreso tra 0 e 0,25 fg evento-1 e il secondo tra 0,25 e 3 fg evento-1. L'intervallo lineare per il PN per le concentrazioni misurate sembra essere più elevato. Ciò è molto probabilmente correlato alla differenza di massa introdotta nell'ICP-MS per evento di rilevamento. Il μDG inietta una quantità assoluta costante in un volume basso per goccia ed evento di rilevamento, con conseguente riduzione della massa rilevata rispetto all'introduzione di campioni con il PN.
Dopo la convalida riuscita, gli esperimenti possono essere eseguiti come descritto nella Figura 2. Un risultato di tali esperimenti è esemplificato nella Figura 5 per la determinazione della dimensione delle particelle e della concentrazione numerica di CeO2 NP. Qui è possibile identificare i segnali per le soluzioni ioniche e NP introdotte tramite μDG e PN. È stata effettuata una triplice determinazione per tutte le particelle studiate.
La valutazione dei dati ottenuti è stata eseguita come descritto sopra ed è riassunta nella Tabella 3. Per l'Au e l'Ag NP utilizzati per la convalida della configurazione a duel-ingresso e delle tre modalità di analisi, la dimensione e la concentrazione del numero di particelle certificate possono essere raggiunte con tutte le modalità di analisi eseguite. Le dimensioni medie delle particelle ottenute per CeO2 sono comprese tra 10 e 100 nm, l'intervallo specificato dal produttore.
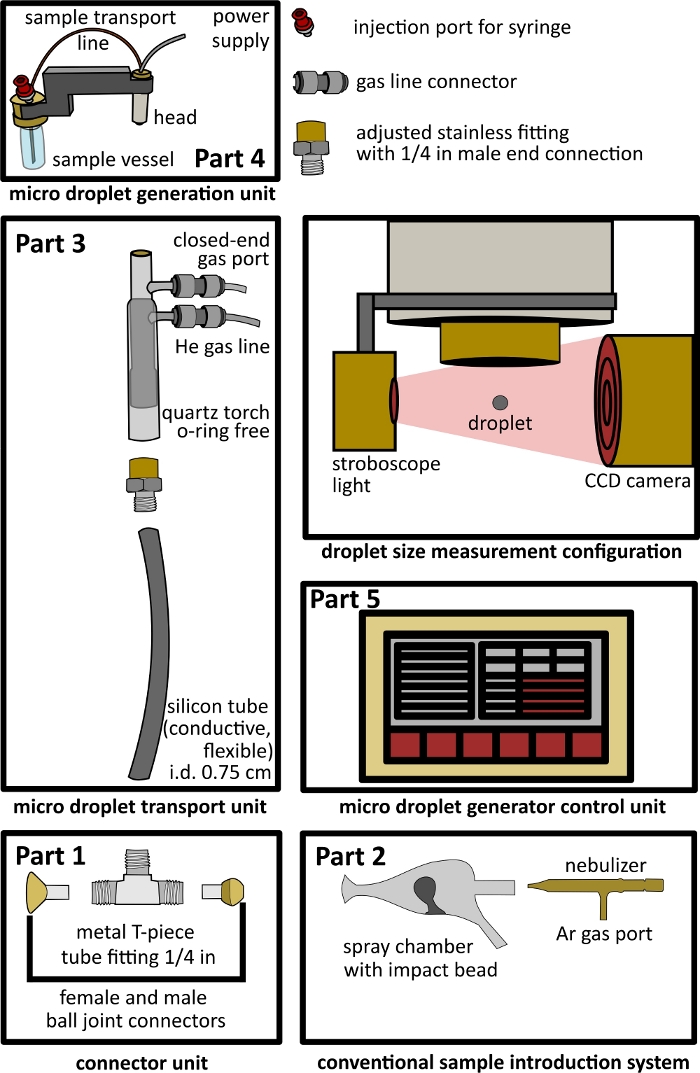
Figura 1: Progettazione della configurazione dell'interfaccia a doppio ingresso. Parte 1 - unità di connessione, Parte 2 - sistema di introduzione convenzionale, Parte 3 - unità di trasporto di microgocce, Parte 4 - unità di generazione di microgocce, Parte 5 - unità di controllo delle microgocce e configurazione aperta per la misurazione delle dimensioni delle gocce che include una luce stroboscopica e una telecamera CCD. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'obiettivo della configurazione a doppio ingresso sviluppata è la caratterizzazione e la quantificazione delle NP nel modo più accurato possibile per quanto riguarda la loro dimensione e concentrazione numerica utilizzando diverse modalità di analisi, indipendenti dall'analita da indagare. Combinando un sistema di introduzione a basso volume (pL) e ad alto trasporto di massa (fino al 100%) (μDG) con un sistema di introduzione convenzionale (PN), questo è possibile. Utilizzando la configurazione presentata in questo lavoro, l'efficienza di trasporto basata sull'elemento specifico richiesta per la quantificazione della massa delle particelle può essere determinata sulla base di standard ionici e indipendentemente dai materiali di riferimento NP. Inoltre, le NP introdotte nell'ICP-MS con il μDG hanno una distribuzione granulometrica più stretta (AuNP) o simile (AgNP). In caso contrario, per il CeO2 è stata osservata una distribuzione dimensionale più ampia per il μDG e può essere attribuita alla maggiore polidispersione del campione analizzato. A causa dell'introduzione di un volume ridotto, due NP possono essere rilevate separatamente l'una dall'altra, che altrimenti verrebbero interpretate come un'unica NP nella configurazione convenzionale14.
I vantaggi derivanti dall'unità di trasporto μDG sono l'elevato grado di flessibilità dovuto al tubo flessibile in silicone, che semplifica l'allineamento della configurazione. La torcia con l'iniettore può essere regolata anche durante la messa in servizio mentre è ancora collegata all'ICP-MS. Il flusso di gas He aggiuntivo applicato impedisce la collisione delle goccioline formate dalla testa μDG con le pareti del tubo20. Inoltre, il gas He consente la rimozione della testa μDG durante lo scambio del campione anche quando l'ICP-MS è ancora in funzione. Mantenere l'ICP in uno stato operativo è fondamentale per una misurazione stabile e robusta. Poiché la testa μDG deve essere pulita e risciacquata con ogni nuovo campione o standard, il flusso di He è vitale per il funzionamento del sistema di ingresso introdotto in questo lavoro. Inoltre, tutte le parti della configurazione a doppio ingresso devono essere collegate correttamente per evitare la penetrazione di ossigeno nel sistema. Al fine di diminuire l'ossigeno nella configurazione presentata, il sistema viene lavato con il nebulizzatore e il gas di trasporto delle goccioline prima dell'accensione del plasma per almeno 5-10 minuti.
Quando le goccioline formate raggiungono l'unità connettore, vengono trasportate nel plasma da un flusso di liquido nebulizzato, noto anche come condizione di plasma umido. Rispetto all'uso di condizioni di plasma secco, ciò porta ad un aumento del contenuto di liquidi nel plasma. Di conseguenza, l'intensità del segnale diminuisce così come la fluttuazione del segnale aumenta, ovvero una deviazione standard più elevata del segnale di misura medio13. Tuttavia, utilizzando il μDG e le concentrazioni nell'intervallo di 0,2 μg/L è possibile rilevare segnali al di sopra del fondo. La corrispondente massa iniettata per gocciolina ha un basso contenuto di metalli, che è vicino ai limiti di rilevamento per alcuni elementi (ad esempio, Au, Ag, Ce). Se si utilizzano concentrazioni diverse per la calibrazione lungo questo limite, si possono osservare due regioni lineari con una sovrapposizione a circa 0,05 μg/L per Ce e 2 μg/L per Ag. Al di sotto della regione di sovrapposizione, i segnali osservati sono vicini al fondo specifico dell'elemento21. Al di sopra di questi limiti, è possibile identificare il campo di lavoro lineare del μDG. Anche con la capacità di misurare basse concentrazioni, è impossibile distinguere tra ioni e NP dello stesso analita all'interno di una gocciolina se sono presenti contemporaneamente. Altrimenti, utilizzando il sistema di introduzione convenzionale, il fondo ionico medio può essere determinato e sottratto da tutti i segnali per ottenere solo i segnali delle particelle.
I sistemi basati su MDG presentano anche diverse limitazioni che possono essere parzialmente aggirate dall'applicazione del sistema a doppia aspirazione proposto. Tuttavia, se la frequenza delle goccioline di μDG supera i 50 Hz, non è possibile creare un modello di goccioline coerente. Le goccioline formate potrebbero entrare in collisione e, quindi, si verifica lo scambio di analita. La corretta regolazione delle portate di gas è importante anche per un trasporto affidabile della gocciolina nel sistema ICP-MS e per il corretto funzionamento del PN. Il sistema a doppia aspirazione proposto attualmente non supporta l'automazione della procedura di misurazione in quanto è necessario modificare manualmente le soluzioni del campione.
In futuro, μDG potrà essere utilizzato per caratterizzare e quantificare le NP in matrici complesse e campioni ambientali. Per evitare l'intasamento del μDG a causa della maggiore viscosità, complessità e tensione superficiale della soluzione, è necessario utilizzare un design della testa appropriato. A seconda del design della testa μDG e del funzionamento dell'alimentatore, potrebbe essere possibile generare goccioline che contengono sistemi simili a particelle come cellule, micelle o vettori lipidici per i quali non sono disponibili materiali di riferimento standard.
Divulgazioni
Tutti gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto dal BfR SFP 1322-642 per F.L.K e P.R., dal BfR SFP 1322-724 per D.R. e dal BfR senior scientist fellowship per S.A.P.
Materiali
| Name | Company | Catalog Number | Comments |
| Au ionic (1000 mg L-1 stock) | VWR, UK | 85550.18E | |
| Ag ionic (1000 mg L-1 stock) | Ultra Scientific, RI, USA | ICM-103 | |
| Ag NP (75nm, NIST 8017) | NIST, Gaithersburg, MD, USA | no longer available | |
| Au NP (60nm, NIST 8013) | NIST, Gaithersburg, MD, USA | no longer available | |
| Ce ionic (1000 mg L-1 stock) | VWR, UK | 85557.18E | |
| CeO2 (10-100nm, NM212) | EU Joint Research Centre | NM212 | |
| Excel 2016 | Microsoft | ||
| Fiji | ImageJ | ||
| Glass female spherical ball + Glass male ball | Fisher Scientific | 12499016 | |
| HCl (emprove bio) | Merck, Germany | 100317 | |
| ICP-MS spray chamber with ipact bead | LabKings | LK6-45013 (OEM 3600170) | |
| Metal clamps for spherical glass joint | Fisher Scientific | 11322015 | |
| Metal T-Piece | Swagelok | SS-4-VCR-T | |
| Microdrop Dispenser Head, non heated | microdrop Technologies | 944 | |
| Microdrop Dispensing System MD-E-3000 | microdrop Technologies | ||
| MilliQ water (MilliPore gradient) | Merck MilliPore, Darmstadt, Germany | ||
| O-ring free quartz torch | Analytical West | 450-301 | |
| PFA-ST concentric nebulizer | Elemental Scientific | ES-2042 | |
| Silicone Rubber Tubing - 60° Shore - Platinum Cured - Black | Silex | ||
| XIMEA Cam Tool | XIMEA |
Riferimenti
- Linsinger, T. P. J., Peters, R., Weigel, S. International interlaboratory study for sizing and quantification of Ag nanoparticles in food simulants by single-particle ICPMS. Analytical and Bioanalytical Chemistry. 406 (16), 3835-3843 (2014).
- Krystek, P., et al. Method development and inter-laboratory comparison about the determination of titanium from titanium dioxide nanoparticles in tissues by inductively coupled plasma mass spectrometry. Analytical and Bioanalytical Chemistry. 406 (16), 3853-3861 (2014).
- Degueldre, C., Favarger, P. Y., Bitea, C. Zirconia colloid analysis by single particle inductively coupled plasma-mass spectrometry. Analytica Chimica Acta. 518 (1-2), 137-142 (2004).
- Degueldre, C., Favarger, P. Y. Colloid analysis by single particle inductively coupled plasma-mass spectroscopy: a feasibility study. Colloid Surface A. 217 (1-3), 137-142 (2003).
- Pace, H. E., et al. Determining transport efficiency for the purpose of counting and sizing nanoparticles via single particle inductively coupled plasma mass spectrometry. Analytical Chemistry. 83 (24), 9361-9369 (2011).
- Verboket, P. E., Borovinskaya, O., Meyer, N., Gunther, D., Dittrich, P. S. A new microfluidics-based droplet dispenser for ICPMS. Analytical Chemistry. 86 (12), 6012-6018 (2014).
- Shigeta, K., et al. Application of a micro-droplet generator for an ICP-sector field mass spectrometer - optimization and analytical characterization. Journal of Analytical Atomic Spectrometry. 28 (5), 646-656 (2013).
- Gschwind, S., Hagendorfer, H., Frick, D. A., Gunther, D. Mass quantification of nanoparticles by single droplet calibration using inductively coupled plasma mass spectrometry. Analytical Chemistry. 85 (12), 5875-5883 (2013).
- Gschwind, S., et al. Capabilities of inductively coupled plasma mass spectrometry for the detection of nanoparticles carried by monodisperse microdroplets. Journal of Analytical Atomic Spectrometry. 26 (6), 1166-1174 (2011).
- Zarrln, F., K, S. L., Socha, J. R. Droplet size measurements of various nebulizers using differential electrical mobluty particle sizer. Journal of Aerosol Science. 22, 343-346 (1991).
- Geertsen, V., Lemaitre, P., Tabarant, M., Chartier, F. Influence of design and operating parameters of pneumatic concentric nebulizer on micro-flow aerosol characteristics and ICP-MS analytical performances. Journal of Analytical Atomic Spectrometry. 27 (1), 146-158 (2012).
- Mehrabi, K., Günther, D., Gundlach-Graham, A. Single-particle ICP-TOFMS with online microdroplet calibration for the simultaneous quantification of diverse nanoparticles in complex matrices. Environmental Science. Nano. 6, 3349-3358 (2019).
- Ramkorun-Schmidt, B., Pergantis, S. A., Esteban-Fernandez, D., Jakubowski, N., Gunther, D. Investigation of a combined microdroplet generator and pneumatic nebulization system for quantitative determination of metal-containing nanoparticles using ICPMS. Analytical Chemistry. 87 (17), 8687-8694 (2015).
- Rosenkranz, D., et al. Improved validation for single particle ICP-MS analysis using a pneumatic nebulizer/microdroplet generator sample introduction system for multi-mode nanoparticle determination. Analytica Chimica Acta. 1099, 16-25 (2020).
- National Institute of Standards and Technology. Report of investigation reference material. Reference material 8017. National Institute of Standards and Technology. , (2015).
- Tavares, A. M., et al. Genotoxicity evaluation of nanosized titanium dioxide, synthetic amorphous silica and multi-walled carbon nanotubes in human lymphocytes. Toxicology In Vitro. 28 (1), 60-69 (2014).
- Au-Kaur, I., et al. Dispersion of Nanomaterials in Aqueous Media: Towards Protocol Optimization. Journal of Visualized Experiments. (130), e56074(2017).
- Nanotechnologies. Size distribution and concentration of inorganic nanoparticles in aqueous media via single particle inductively coupled plasma mass spectrometry. ISO/TS19590 Nanotechnologies. , (2017).
- Shigeta, K., et al. Application of a micro-droplet generator for an ICP-sector field mass spectrometer - optimization and analytical characterization. Journal of Analytical Atomic Spectrometry. 28, 646-656 (2013).
- Koch, J., et al. Accelerated evaporation of microdroplets at ambient conditions for the on-line analysis of nanoparticles by inductively-coupled plasma mass spectrometry. Journal of Analytical Atomic Spectrometry. 28 (11), 1707-1717 (2013).
- Tuoriniemi, J., Cornelis, G., Hassellov, M. A new peak recognition algorithm for detection of ultra-small nano-particles by single particle ICP-MS using rapid time resolved data acquisition on a sector-field mass spectrometer. Journal of Analytical Atomic Spectrometry. 30 (8), 1723-1729 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon


