Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Trans-vivo hipersensibilidad de tipo retardada Ensayo para Antigen Reglamento Específico
En este artículo
Resumen
Se describe un ensayo de diagnóstico valiosa que potencialmente podría ser utilizado para decidir la retirada de la inmunosupresión después del trasplante sin riesgo elevado de rechazo del injerto. El ensayo utiliza los principios de la hipersensibilidad de tipo retardado y proporciona una evaluación precisa de ambos donantes respuestas inmunes efectoras y reglamentarias específicas montados por los destinatarios.
Resumen
Respuesta de hipersensibilidad de tipo retardado (DTH) es una rápida en la manifestación in vivo de la respuesta inmune dependiente de células T a un antígeno extraño (Ag) que el sistema inmune del huésped ha experimentado en el pasado reciente. Reacciones de DTH a menudo se dividen en una fase de sensibilización, en referencia a la experiencia inicial antígeno, y una fase de desafío, que por lo general sigue varios días después de la sensibilización. La falta de una respuesta de hipersensibilidad de tipo retardado a una recuperación Ag demostrada por pruebas cutáneas a menudo se considera como una prueba de anergia. El ensayo de DTH tradicional ha utilizado con eficacia en el diagnóstico de muchas infecciones microbianas.
A pesar de compartir características inmunológicas similares, tales como la infiltración de linfocitos, edema y necrosis de los tejidos, la DTH directa no es una técnica de diagnóstico factible en pacientes trasplantados debido a la posibilidad de inyección directa que resulta en la sensibilización a los antígenos del donante y la pérdida del injerto. Para evitar este problema, el zumbidouna-a-mouse "trans-vivo" ensayo de DTH fue desarrollado 1,2. Esta prueba es esencialmente un ensayo de DTH de transferencia, en la que las células humanas mononucleares de sangre periférica (CMSP) y antígenos específicos se inyectaron por vía subcutánea en el pabellón auricular o pata de un ratón ingenuo e hinchazón DTH-como se mide después de 18-24 horas 3. La presentación de antígenos por las células presentadoras de antígenos humanos, tales como los macrófagos o DCS a las células T en el tejido altamente vascular ratón desencadena la cascada inflamatoria y atrae a las células inmunes de ratón resultantes en las respuestas de hinchazón. La respuesta es antígeno-específica y requiere sensibilización previa antígeno. Una respuesta DTH donante-reactiva positiva en el ensayo de Tv-DTH refleja que el paciente de trasplante ha desarrollado una disposición inmune proinflamatoria hacia aloantígenos de injerto.
La característica más importante de este ensayo es que también se puede utilizar para detectar células T reguladoras, que provocan la supresión transeúnte. Supresión de un espectadorRespuesta de recuerdo DTH en la presencia de antígeno del donante es característica de los receptores de trasplante con aloinjertos aceptados 2,4-14. El seguimiento de los pacientes trasplantados de alorreactividad y regulación por Tv-DTH puede identificar un subgrupo de pacientes que podrían beneficiarse de la reducción de la inmunosupresión y sin alto riesgo de rechazo o de la función renal deteriorada.
Un área prometedora es la aplicación del ensayo Tv-DTH en el monitoreo de la autoinmunidad 15,16 y también en la inmunología tumoral 17.
Protocolo
1. Preparación de los linfocitos
- Recoger la sangre en tubos ACD (ácido citrato dextrosa).
- Aislar PBMC de sangre periférica humana fresca usando medio de separación de linfocitos de acuerdo con métodos estándar.
- Lavar las PBMC tres veces con PBS para eliminar las plaquetas contaminantes. Las plaquetas se encontraron para interferir con el ensayo de DTH trans-in vivo. Máxima permisible de contaminación por plaquetas preparación PBMC es ≤ 1x10 7 / inyección.
- Si hay una contaminación de células rojas de la sangre notable, lleve a cabo la lisis de glóbulos rojos usando tampón de lisis ACK después del primer lavado. Eliminar el tampón ACK por lavado 2 veces con PBS.
2. Preparación de aloantígeno
- Aislar PBMC de la sangre periférica de donantes utilizando el procedimiento mostrado anteriormente.
- Se resuspende el PBMC de donantes en PBS a una concentración de 120x10 6 células / ml (4x10 6 células / 30 l).
- Añadir 1 mM PMSF a la mezcla para evitar que la proteínala degradación.
- Someter a ultrasonidos la suspensión celular usando 1-siete segundos pulsos con un sonicador de sonda mm-2. (Nota: Mantenga el frío material y evitar burbujas excesivas Si se produce la formación de espuma, deje que la suspensión de células se sientan en el hielo por un 2-3 min.).
- Verificar la interrupción de> 90% de las células utilizando un hemocitómetro.
- Centrifugar la mezcla a 14.000 rpm a 4 ° C durante 20 min en microcentrífuga refrigerada.
- Transferir el sobrenadante a un nuevo tubo Safe-Lock 2,0 ml y determinar la concentración de proteína.
3. Preparación de las células para preparaciones inyectables
- Para cada alícuota inyección 7x10 6 PBMC en tubos Safe-Lock 2,0 ml.
- Centrifugar a 6000 rpm durante un minuto en microcentrífuga y eliminar el sobrenadante.
- Resuspender las células en PBS con o sin antígenos. Ajustar el volumen de inyección de 35 l con PBS. El siguiente esquema se utiliza para inyecciones:
Control negativo: PBMC + PBS
Control Positivo: las PBMC + TT / DT (25 y mu; G / inyección)
Experimental antígeno específico de respuesta: PBMC + prueba de Ag (4-8 mg / inyección)
Experimental Reglamento de antígeno específico: prueba PBMC + Ag + TT / DT
4. Pre-medición, inyección, y después de la medición
- Anestesie CB17 ratón SCID con isoflurano. Medir el espesor de la almohadilla plantar trasera utilizando una pinza de resorte. Ponga calibrador en el centro de la almohadilla de la pata, con un borde de tocar la última almohadilla de pie del pie, para proporcionar un punto de referencia para mantener el sitio de medición consistente. Espesor almohadilla se registra cuando lectura del indicador se ha estabilizado.
- Inyecte lentamente suspensiones de células por vía subcutánea en las almohadillas de las patas de los ratones utilizando ½ cc jeringas de insulina con una aguja de calibre 28. Realizar la inyección con la aguja apuntando hacia los dedos de los pies, y el bisel hacia arriba. (Nota: asegúrese de que no hay fugas).
- 18-24 horas después de la inyección, anestesiar el ratón con la medición isoflurano y repetición de la DTH.
- Subtractuar el espesor de cada almohadilla de la pata antes de la inyección a partir del valor después de la inyección para obtener el valor de hinchamiento almohadilla de la pata, expresa los datos en unidades de 10 pulgadas -4. Calcular el antígeno específico de la hinchazón neta mediante la sustracción de control de la DTH (PBMC + PBS) a partir de los valores de hinchazón de la pata obtenidos a partir de los tratamientos (PBMC + donante aloantígeno, TT / DT, o donante aloantígeno + TT / DT). Se requiere una respuesta de control positivo recordar antígeno TT / DT de ≥ 25x10 pulgadas -4 más respuesta de fondo a PBS para que la prueba se considerará válida.
- Determinar la inhibición de respuestas de memoria en la presencia de antígenos del donante mediante la comparación de la hinchazón neta de cada inyección utilizando la siguiente fórmula:
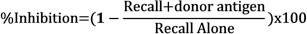
Resultados
1. Evaluación de los receptores de trasplante renal para la respuesta específica de antígeno donante usando un ensayo Tv-DTH
Para probar el donante reactivo con la inmunidad celular en los receptores de trasplante renal se inyecta PBMC de estos pacientes con antígenos del donante solo o con un antígeno de recuerdo del toxoide tetánico (TT). Como células de control positivo fueron inyectados sólo con TT. Observamos tres patrones principales de hipersensibilidad de tipo retardado en los r...
Discusión
El ensayo de DTH trans-vivo es una prueba de diagnóstico novela con una aplicación clínica potencial en la evaluación de las respuestas mediadas por células en trasplante, pacientes de cáncer y autoinmunes. Es valioso porque no sólo es útil en el seguimiento de las respuestas de recuerdo T efectoras, sino que también puede detectar respuestas T reguladoras. Un método confiable para detectar la regulación DTH humano puede predecir la seguridad de la retirada de inmunosupresión en los pacientes que son candida...
Divulgaciones
Los autores de este manuscrito no tienen conflictos de intereses a revelar.
Agradecimientos
Los autores desean agradecer las contribuciones de AM VanBuskirk al desarrollo de nuestra comprensión de la respuesta DTH regulada en los receptores de trasplantes. Este trabajo fue apoyado subvenciones del NIH PO1AI084853 y R01AI066219-06 y la UE-patrocinado un estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
Referencias
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados