É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Trans-vivo Atraso Tipo Ensaio Hipersensibilidade para o Antigen Regulamento Específico
Neste Artigo
Resumo
Descreve-se um ensaio de diagnóstico potencialmente valiosa, que pode ser utilizada para decidir a retirada da imunossupressão após transplante sem risco elevado de rejeição do enxerto. O ensaio utiliza os princípios do tipo hipersensibilidade cutânea tardia e fornece uma avaliação precisa do dador respostas imunes efetoras e reguladoras específicas montadas pelos destinatários.
Resumo
Resposta de hipersensibilidade do tipo retardado (DTH) é um rápido em manifestação in vivo da resposta imunitária dependente da célula T a um antigénio exógeno (Ag), de que o sistema imunitário do hospedeiro tem tido no passado recente. Reacções DTH são frequentemente dividido numa fase de sensibilização, referindo-se a experiência inicial de antigénio, e uma fase de desafio, o que geralmente resulta de vários dias após a sensibilização. A falta de uma resposta de hipersensibilidade tardia a um Ag recuperação demonstrada pelo teste de pele é frequentemente considerado como uma evidência de anergia. O ensaio de DTH tradicional tem sido usado eficazmente no diagnóstico de várias infecções microbianas.
Apesar partilhando características imunológicas similares, tais como a infiltração de linfócitos, edema e necrose do tecido, o DTH directa não é uma técnica viável de diagnóstico em doentes transplantados, devido à possibilidade de injecção directa, resultando na sensibilização para antigénios do dador e perda do enxerto. Para evitar este problema, o zumbidoum-para-rato de "trans-vivo" ensaio de DTH foi desenvolvido 1,2. Este teste é, essencialmente, um ensaio de transferência de DTH, em que as células mononucleares de sangue periférico humano (PBMC) e antigénios específicos foram injectados por via subcutânea na pata traseira ou pinas de um rato ingénuos e DTH-como inchaço é medido após 18-24 h 3. A apresentação de antigénio por células apresentadoras de antigénios humanos, tais como macrófagos ou células dendríticas para as células T no tecido altamente vascularizado rato desencadeia a cascata inflamatória e atrai as células imunes do rato, resultando em respostas do inchaço. A resposta é específica para o antigénio e requer sensibilização antigénio antes. Uma resposta DTH dador reactivo positivo no ensaio de DTH Tv reflecte que o paciente de transplante desenvolveu uma disposição imunológica pró-inflamatória para aloantigénios de garfo.
A característica mais importante deste ensaio é que ele pode também ser usado para detectar células T reguladoras, que causam a supressão de espectador. Supressão de um espectadorSensibilidade resposta DTH na presença do antigénio do doador é característico dos receptores de transplante com aloenxertos aceites 2,4-14. O monitoramento de pacientes transplantados para alloreactivity e regulação por Tv-DTH pode identificar um subgrupo de pacientes que poderiam se beneficiar de redução da imunossupressão sem risco elevado de rejeição ou de deterioração da função renal.
Uma área promissora é a aplicação do ensaio de DTH em Tv-vigilância da autoimunidade 15,16 e também na área da imunologia tumoral 17.
Protocolo
1. Preparação de Linfócitos
- Coletar sangue para ACD (ácido citrato dextrose) tubos.
- Isolar CMSP a partir de sangue periférico humano fresco, utilizando Meio de Separação de Linfócitos de acordo com métodos padrão.
- Lavar as PBMC três vezes com PBS para remover as plaquetas contaminantes. As plaquetas foram encontrados para interferir com o ensaio de trans-DTH in vivo. Máximo permitido de contaminação de plaquetas preparação PBMC é ≤ 1x10 7 / injeção.
- Se houver uma contaminação de glóbulos vermelhos perceptível, realizar a lise de glóbulos vermelhos usando tampão de lise ACK após a primeira lavagem. Remover tampão ACK por lavagem duas vezes com PBS.
2. Preparação de aloantigénio
- Isolar CMSP a partir do sangue periférico de doadores utilizando o procedimento indicado acima.
- Ressuspender o doador de PBMC em PBS a uma concentração de 120x10 6 células / ml (4x10 6 células / 30 ul).
- Adicionar 1 uM de PMSF, à mistura de proteína para evitardegradação.
- Sonicar a suspensão de células utilizando sete impulsos de 1 segundo, com uma sonda de ultra-sons 2 mm. (Nota: Mantenha o material frio e evitar bolhas excessivas Se ocorrer a formação de espuma, deixe a suspensão de células sentar-se no gelo por um 2-3 min.).
- Verifique o rompimento de> 90% das células utilizando um hemocitómetro.
- Centrifugar a mistura a 14000 rpm a 4 ° C durante 20 minutos em microcentrifuga refrigerado.
- Transfira o sobrenadante para um novo tubo ml seguro-lock 2.0 e determinar a concentração de proteína.
3. Preparação de células para Injectáveis
- Para cada alíquota injeção 7x10 6 PBMC em ml tubos seguro-lock 2.0.
- Centrifugar a 6000 rpm, durante um minuto, em microcentrifuga e remover o sobrenadante.
- Ressuspender as células em PBS com ou sem antigénios. Ajustar o volume de injecção de 35 ul com PBS. O esquema a seguir é usado para injeções:
Controle Negativo: PBMC + PBS
Controlo positivo: PBMC + TT / DT (25 e mu, G / injecção)
Experimental Antigénio Específico da resposta: teste de CMSP + Ag (4-8 ug / injecção)
Antígeno Experimental Regulamento Específico: PBMC + teste Ag + TT / DT
4. Pré-medição, Injection, e Pós-medição
- Anestesiar CB17 rato SCID com isoflurano. Medir a espessura da pata traseira usando uma mola paquímetro. Coloque o cursor no centro da almofada da pata, com uma borda de tocar no último andar da almofada do pé, para proporcionar um ponto de referência para manter o local de medida consistente. Espessura da pata é registrado quando a leitura calibre estabilizou.
- Lentamente injetar suspensões de células por via subcutânea em coxim plantar de camundongos usando ½ cc seringas de insulina com agulha de calibre 28. Realize injeção com a agulha apontando para os dedos dos pés, e o bisel voltado para cima. (Nota: verifique se não há nenhum vazamento).
- 18-24 horas após a injeção, anestesiar rato com medição isoflurano e repetição da pata inchaço.
- Subtractuar a espessura de cada almofada da pata antes da injecção, a partir do valor pós-injecção para se obter o valor de inchaço da almofada da pata, expressa os dados em unidades de 10 polegadas -4. Calcular o antigénio específico do líquido inchaço subtraindo o inchaço da almofada da pata de controlo (CMSP + PBS) a partir dos valores de inchamento coxins plantares obtidos a partir dos tratamentos de (PBMC + dador aloantigénio, TT / DT ou dador aloantigénio + TT / DT). A resposta de controle positivo para recordar antígeno TT / DT de ≥ 25x10 -4 polegadas sobre a resposta de fundo à PBS é necessário para que o teste seja considerado válido.
- Determinar a inibição de respostas de recolha, na presença de antigénios do dador através da comparação do inchaço líquido de cada injecção com a seguinte fórmula:
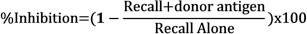
Resultados
1. Avaliação dos receptores de transplante renal para a resposta antígeno-específica de doadores usando ensaio Tv-DTH
Para testar o doador reactivo imunidade celular em pacientes transplantados renais foram injetados PBMC de pacientes com estes antigénios do dador, isoladamente ou com um antigénio de toxóide do tétano (TT). Como um controlo positivo de células foram injectadas com o TT por si só. Observamos três padrões principais de tipo de hipersensibilidade retardada em receptore...
Discussão
O ensaio de DTH trans in vivo é um teste de diagnóstico de novo com uma aplicação potencial clínico para avaliar as respostas mediadas por células em transplantes, cancro e pacientes auto-imunes. É importante porque não só é útil no monitoramento de recall T efetoras respostas, mas também pode detectar respostas T reguladoras. A maneira confiável para detectar regulação DTH humano pode prever a segurança da retirada da imunossupressão em pacientes que são candidatos à monoterapia ou tolerância ensaio...
Divulgações
Os autores deste manuscrito não têm conflitos de interesse de divulgar.
Agradecimentos
Os autores gostariam de agradecer as contribuições da AM VanBuskirk para o desenvolvimento da nossa compreensão da resposta DTH regulado em receptores de transplante. Este trabalho foi apoiado bolsas NIH PO1AI084853 e R01AI066219-06 e da UE-patrocinado um estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
Referências
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados