このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
抗原特異的規制用のトランス生体内遅延型過敏アッセイ
要約
我々は潜在的に移植片拒絶反応のリスク上昇せずに移植後免疫抑制の撤退を決定するために使用することができる貴重な診断アッセイを記述します。アッセイは、遅延型過敏の原則を使用し、受信者によってマウントされたドナーの特定のエフェクターと規制免疫応答の両方の正確な評価を提供します。
要約
遅延型過敏反応(DTH)は、宿主の免疫系は、最近、過去に経験した外来抗原銀(Ag)に対するT細胞依存性免疫応答のインビボ発現で迅速である。 DTH反応は、多くの場合、通常、感作した後、数日に続く最初の抗原の経験、およびチャレンジ相を参照して、感作段階に分かれています。皮膚試験により実証リコール銀に対する遅延型過敏反応の欠如は、しばしばアネルギーの証拠としてみなされている。従来のDTHアッセイを効果的に多くの微生物感染症の診断に使用されている。
このようなリンパ球浸潤、浮腫、および組織壊死と同様の免疫機能を共有することにもかかわらず、直接のDTHがあるため、ドナー抗原および移植片喪失感をもたらし直接噴射の可能性の移植患者における実現可能な診断技術ではありません。この問題を回避するには、ハムツーマウス"トランス生体" DTHアッセイは1,2を開発しました。この試験は、本質的にヒト末梢血単核球(PBMC)と特異的抗原がナイーブマウスの耳介又は足蹠に皮下注射し、DTH状の膨潤が18-24時間で3後に測定される転送DTHアッセイである。このような高度に血管マウス組織におけるT細胞にマクロファージや樹状細胞などのヒト抗原提示細胞による抗原提示は、炎症カスケードをトリガし、腫脹応答の結果、マウスの免疫細胞を魅了しています。応答は、抗原特異的であり、事前の抗原感作を必要とします。 TV-DTHアッセイで陽性ドナー反応性DTH応答は移植患者が移植アロ抗原に向かって前炎症性免疫処分を開発したことを反映している。
このアッセイの最も重要な特徴は、それはまた、バイスタンダー抑制を引き起こす調節性T細胞を検出するために使用することができることである。のバイスタンダー抑制ドナー抗原の存在下でDTHリコール応答が認められた同種移植2,4-14で移植レシピエントの特徴である。 TV-DTHによって同種反応性と規制のための移植のモニタリングは、拒絶反応のリスク上昇や腎機能が悪化することなく、免疫抑制の減少から利益を得ることができる患者のサブセットを識別することができる。
有望なエリアは、自己免疫15,16のモニタリングと、腫瘍免疫学17でTV-DTHアッセイのアプリケーションです。
プロトコル
1。リンパ球の調製
- ACD(クエン酸デキストロース)のチューブに血液を集める。
- 標準的な方法に従ってリンパ球分離媒体を使用して新鮮なヒト末梢血からPBMCを分離します。
- 汚染血小板を除去するためにPBSでPBMC 3回洗浄する。血小板は、トランスの体内DTHアッセイを妨害することが見出された。 PBMC準備の最大許容血小板汚染は≤1×10 7 /注射です。
- 顕著な赤血球の混入がある場合は、最初の洗浄後にACK溶解緩衝液を用いた赤血球の溶解を行う。 PBSで2回洗浄することによりACKバッファを削除します。
2。アロ抗原の調製
- 上に示した手順を使用して、ドナー末梢血からPBMCを分離します。
- 120x10 6細胞/ ml(4×10 6細胞/ 30μL)の濃度でPBSに再懸ドナーPBMC。
- タンパク質を防ぐために、混合物に1μMPMSFを追加劣化。
- 2mmのプローブ音波処理器で7 1秒パルスを用いた細胞懸濁液を超音波処理。 (注:材料の寒さを維持し、過度の泡を避ける発泡が発生した場合は、細胞懸濁液は、2〜3分間氷上で座らせて。)
- 血球計算板を用いて細胞の> 90%の崩壊を確認してください。
- 冷蔵微量で20分間4℃で14,000 rpmで混合物を遠心分離します。
- 新しい2.0ミリリットル安全ロックチューブに上清を移し、タンパク質濃度を決定する。
3。注射用の細胞調製
- 2.0ミリリットルのセーフロックチューブにそれぞれ注射アリコート7×10 6 PBMCのため。
- 微量で分間6,000 rpmで遠心し、上清を除去します。
- 抗原の有無にかかわらずPBSで細胞を再懸濁します。 PBSで35μlに注入量を調整します。以下のスキームは、注射のために使用されます。
ネガティブコントロール:PBMC + PBS
ポジティブコントロール:PBMC + TT / DT(25&ムー; G /注射)
実験的な抗原特異的応答:PBMC +テストのAg(4-8μgの/注射)
実験的な抗原特異的レギュレーション:PBMC +テストのAg + TT / DT
4。事前測定、注射、とポストの測定
- イソフルランとCB17 SCIDマウスを麻酔。バネ式キャリパーを使用してリア足蹠の厚さを測定します。測定部位の一貫性を保つためのベンチマークを提供するために、一方の端が足の最後の歩行パッドに触れて、足蹠の中心にキャリパーを配置します。ゲージの読みが安定したときに足蹠の厚さが記録されます。
- ゆっくりと28ゲージの針で½ccのインスリン注射器を使用してマウスの足蹠に皮下細胞懸濁液を注入する。針がつま先の方向を向いて、ベベルを上に向けて注射を行います。 (注:漏れがないことを確認してください)。
- 注入後18-24時間は、足蹠の腫脹のイソフルラン及び繰り返し測定にマウスを麻酔。
- Subtr足蹠の腫れ値を取得するためにポスト噴射値から注入前に各足蹠の厚さを作用、10 -4インチの単位でデータを表す。治療(PBMC +ドナーアロ抗原、TT / DT、またはドナーアロ+ TT / DT)から得蹠腫脹値からコントロール足蹠腫脹(PBMC + PBS)を差し引くことにより、抗原特異的純腫れを計算します。 PBSの背景応答上≥25×10 -4インチの抗原TT / DTをリコールする陽性対照応答が有効であると考えられるためにテストするために必要です。
- 次の式を使用して、各注入の純腫れを比較することにより、ドナー抗原の存在下でリコール反応の阻害を決定する:
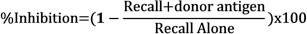
結果
1。テレビ-DTHアッセイを用いてドナー抗原特異的応答のための腎臓移植レシピエントの評価
腎移植におけるドナー反応性の細胞性免疫をテストするには、我々は、ドナー抗原単独またはリコール抗原破傷風トキソイド(TT)と、これらの患者からPBMCを注入した。陽性対照として、細胞を、TT単独を注射した。私たちは、移植レシピエントにおける遅延型過敏症( ?...
ディスカッション
トランス生体DTHアッセイは移植、がんや自己免疫患者における細胞性免疫応答を評価する上での潜在的な臨床応用を有する新規な診断テストです。それがリコールTエフェクター応答をモニタリングに有用であるだけでなくので、それは貴重ですが、またそれはT調節応答を検出することができます。人間DTHレギュレーションを検出する信頼性の高い方法は、単剤療法または耐性試験の対象で?...
開示事項
この原稿の著者は、開示する利害の衝突を持っていません。
謝辞
著者らは、移植レシピエントにおける規制DTH応答の我々の理解の発展にAM VanBuskirkの貢献を承諾したいと思います。この作品は、NIHの助成金PO1AI084853とR01AI066219-06を支持し、EU主催の一つの研究でされました。
資料
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
参考文献
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved