Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Trans-vivo de type hypersensibilité retardée test pour le règlement spécifique de l'antigène
Dans cet article
Résumé
Nous décrivons un test de diagnostic précieux qui pourrait être utilisé pour décider du retrait de l'immunosuppression après transplantation sans risque élevé de rejet du greffon. Le test utilise les principes de type hypersensibilité retardée et fournit une évaluation précise de ces deux réponses immunitaires effectrices et réglementaires spécifiques donneur supporté par les bénéficiaires.
Résumé
Réponse d'hypersensibilité de type retardé (DTH) est une rapide manifestation vivo de la réponse immunitaire des cellules T dépendantes à un antigène étranger (Ag) que le système immunitaire de l'hôte a connu dans un passé récent. Réactions SRD sont souvent divisés en une phase de sensibilisation, se référant à l'expérience initiale de l'antigène, et une phase de défi, qui suit généralement plusieurs jours après la sensibilisation. L'absence d'une réaction d'hypersensibilité de type retardé à un Ag rappel démontré par des tests cutanés est souvent considéré comme une preuve d'anergie. Le test de SRD traditionnel a été effectivement utilisé dans le diagnostic de nombreuses infections microbiennes.
Bien qu'ils partagent des caractéristiques immunitaires similaires tels que l'infiltration lymphocytaire, l'œdème et une nécrose des tissus, le DTH directe n'est pas une technique de diagnostic possible chez les patients transplantés en raison de la possibilité d'une injection directe entraîne une sensibilisation à des antigènes du donneur et la perte du greffon. Pour éviter ce problème, le bourdonnementun-à-souris de test DTH "trans-vivo" a été développé 1,2. Ce test est essentiellement un test de DTH de transfert, dans lequel les cellules humaines mononucléées du sang périphérique (CMSP) et les antigènes spécifiques ont été injectés par voie sous cutanée dans le coussinet plantaire pennes ou d'une souris naïve et gonflement DTH-like est mesurée après 18-24 h 3. La présentation de l'antigène par les cellules présentatrices d'antigènes humains telles que les macrophages ou DCS pour les cellules T dans un tissu très vasculaire de la souris déclenche la cascade inflammatoire et attire les cellules du système immunitaire de la souris dans les réponses résultant de gonflement. La réaction est spécifique de l'antigène et nécessite une sensibilisation préalable de l'antigène. Une réponse DTH donateurs réactive positive dans le dosage Tv-SRD reflète le fait que le patient transplanté a développé une disposition pro-inflammatoire immunitaire vers alloantigènes greffe.
La caractéristique la plus importante de ce test est qu'il peut également être utilisé pour détecter les cellules T régulatrices, qui provoquent la suppression du spectateur. suppression du spectateur d'unRéponse de rappel DTH en présence de l'antigène de donneur est caractéristique des greffés avec des allogreffes acceptées 2,4-14. Le suivi des patients transplantés pour alloréactivité et la régulation par la télévision DTH peut identifier un sous-ensemble de patients qui pourraient bénéficier de la réduction de l'immunosuppression sans risque élevé de rejet ou de détérioration de la fonction rénale.
Un domaine prometteur est l'application du test Tv-DTH dans le suivi de l'auto-immunité 15,16 et également en immunologie tumorale 17.
Protocole
1. Préparation des lymphocytes
- Recueillir le sang dans des tubes ACD (acide citrate dextrose).
- Isoler PBMC du sang périphérique humain frais en utilisant des lymphocytes milieu de séparation selon les méthodes classiques.
- Laver les CMSP trois fois avec PBS pour éliminer les plaquettes contaminantes. Les plaquettes ont été trouvés pour interférer avec dosage de SRD trans-vivo. Maximal admissible de contamination plaquettaire préparation des CMSP est ≤ 1x10 7 / injection.
- S'il ya une contamination des globules rouges visibles, effectuer la lyse des globules rouges en utilisant un tampon de lyse ACK après le premier lavage. Retirer tampon ACK par lavage 2 fois avec PBS.
2. Préparation de alloantigène
- Isoler PBMC du sang périphérique des bailleurs de fonds en utilisant la procédure ci-dessus.
- Remettre en suspension donateurs PBMC dans PBS à une concentration de 120x10 6 cellules / ml (4x10 6 cellules / 30 pi).
- Ajouter 1 uM PMSF au mélange pour empêcher la protéinedégradation.
- Soniquer la suspension de cellules à l'aide de sept impulsions de 1 seconde avec un sonicateur 2 mm-sonde. (Remarque: Conservez le froid de matériel et éviter les bulles excessives Si de la mousse se produit, laissez la suspension cellulaire assis sur la glace pour un 2-3 min.).
- Vérifier la perturbation de> 90% des cellules en utilisant un hémocytomètre.
- Centrifuger à 14000 rpm à 4 ° C pendant 20 min dans microfuge réfrigéré.
- Transférer le surnageant dans un nouveau tube Safe-Lock 2,0 ml et déterminer la concentration en protéines.
3. Préparation des cellules pour préparations injectables
- Pour chaque aliquote d'injection 7x10 6 PBMC en ml tubes Safe-Lock 2.0.
- Centrifuger à 6000 rpm pendant une minute à centrifuger et éliminer le surnageant.
- Reprendre les cellules dans du PBS avec ou sans antigènes. Réglez le volume d'injection à 35 pi avec PBS. Le schéma suivant est utilisé pour les injections:
Contrôle négatif: CMSP + PBS
Contrôle positif: CMSP + TT / DT (25 & mu; G / injection)
Experimental Antigène spécifique Réponse: CMSP + test Ag (4-8 mg / injection)
Règlement spécifique de l'antigène expérimental: CMSP + test Ag + TT / DT
4. Pré-mesure, Injection et Post-mesure
- Anesthésier CB17 souris SCID avec isoflurane. Mesurer l'épaisseur de la patte arrière à l'aide d'un ressort étrier. Mettez curseur au centre de la patte, avec un bord de toucher le dernier pad de marche du pied, afin de fournir un point de référence pour maintenir le site de mesure constante. Épaisseur du talon est constatée lorsque la lecture de la jauge s'est stabilisée.
- Injecter lentement suspensions cellulaires sous-cutanée dans les pattes des souris en utilisant ½ cc seringues à insuline avec aiguille de calibre 28. Effectuer injection avec pointant l'aiguille vers les orteils et le biseau vers le haut. (Note: assurez-vous qu'il n'ya pas de fuite).
- 18-24 h après l'injection, anesthésier la souris avec mesure isoflurane et répétition de patte gonflement.
- Subtragir l'épaisseur de chaque pied avant l'injection de la valeur post-injection pour obtenir la valeur de gonflement du coussinet plantaire, exprime les données en unités de 10 pouces -4. Calculer l'antigène spécifique de gonflement net en soustrayant le contrôle du coussinet plantaire gonflement (CMSP + PBS) à partir des valeurs de gonflement coussinet plantaire obtenus à partir des traitements (CMSP + donateur alloantigène, TT / DT, ou donateur alloantigène + TT / DT). Une réponse du contrôle positif de rappeler antigène TT / DT de ≥ 25x10 pouces -4 plus de réponse de fond à PBS est nécessaire pour que le test soit considéré comme valide.
- Déterminer l'inhibition des réponses de rappel en présence d'antigènes de donneur en comparant le gonflement net de chaque injection à l'aide de la formule suivante:
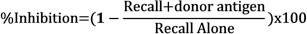
Résultats
1. Évaluation des receveurs de transplantation rénale pour une réponse spécifique de l'antigène donneur en utilisant un dosage Tv-DTH
Pour tester le donneur réactif immunité cellulaire chez les transplantés rénaux nous avons injecté PBMC de ces patients avec des antigènes du donneur seul ou avec un rappel antigène anatoxine tétanique (TT). En tant que cellules de contrôle positif ont été injectés avec TT seul. Nous observons trois grandes tendances de l'hypersensibilit?...
Discussion
Le test DTH trans-vivo est un test diagnostique roman avec une application clinique potentielle dans l'évaluation des réponses à médiation cellulaire en transplantation, le cancer et les patients auto-immunes. Il est précieux car il n'est pas seulement utile dans le suivi rappel réponses effectrices T, mais il peut aussi détecter des réponses T régulatrices. Un moyen fiable de détecter la réglementation DTH humain peut prédire la sécurité du retrait de l'immunosuppression chez les patients qui ...
Déclarations de divulgation
Les auteurs de ce manuscrit n'ont aucun conflit d'intérêts à déclarer.
Remerciements
Les auteurs tiennent à souligner la contribution de AM VanBuskirk au développement de notre compréhension de la réponse DTH réglementé chez les greffés. Ce travail a été soutenu subventions des NIH PO1AI084853 et R01AI066219-06, et par l'UE parrainé une étude.
matériels
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
Références
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon