Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Транс-естественных условиях отложенного типа анализа гиперчувствительности к антигену Специальное регулирование
В этой статье
Резюме
Мы описываем ценный диагностический анализ, которые потенциально могут быть использованы для вывода решить иммуносупрессии после трансплантации без повышенного риска отторжения трансплантата. Анализ использует принципы гиперчувствительность замедленного типа и обеспечивает точную оценку как доноров, так и конкретные нормативные эффекторных иммунных реакций установлен получателями.
Аннотация
Гиперчувствительности замедленного типа ответа (DTH) является быстрым в естественных условиях проявления Т-клетками иммунного ответа на чужеродный антиген (Ag), что иммунная система хозяина пережила в недавнем прошлом. DTH реакции часто делятся на фаза сенсибилизации, ссылаясь на начальный опыт антигена, и вызов фазу, которая обычно следует несколько дней после сенсибилизации. Отсутствие гиперчувствительности замедленного типа ответ на отзыве Ag свидетельствует тестирование кожи часто рассматривается как свидетельство анергии. Традиционный анализ DTH была эффективно использована в диагностике многих микробных инфекций.
Несмотря схожими иммунной функции, такие как инфильтрацией лимфоцитами, отек и некроз тканей, прямой DTH не является возможным методом диагностики у пациентов после трансплантации из-за возможности прямого впрыска в результате сенсибилизации к антигенам донора и потери трансплантата. Чтобы избежать этой проблемы, гулк мыши "Транс-естественных" DTH был разработан анализ 1,2. Данный тест является по существу анализом передачи DTH, в котором человеческие мононуклеарные клетки периферической крови (МКПК) и специфических антигенов вводили подкожно в ушных раковин или подушечку из наивных мыши и DTH, как набухание измеряется после 18-24 часов 3. Презентация антигена на человека антигенпредставляющих клеток, таких как макрофаги или РСУ Т-клеткам в сильно сосудистой ткани мыши вызывает воспалительный каскад и привлекает мышей иммунные клетки в результате отека ответов. Реакция антиген-специфических и требует предварительной сенсибилизации антигеном. Положительное донора-реактивного DTH ответ в Tv-DTH анализа отражает, что пересадка пациенту разработала провоспалительных иммунных предрасположенность к аллоантигенам трансплантата.
Наиболее важной особенностью данного метода является то, что он также может быть использован для обнаружения регуляторных Т-клеток, которые вызывают подавление наблюдателем. Свидетеля подавленияDTH отзыве ответа в присутствии донора антигена характерно для реципиентов с принятыми аллотрансплантатами 2,4-14. Мониторинг реципиентов для аллореактивность и регулирования Tv-DTH может идентифицировать подгруппе пациентов, которые могли бы выиграть от снижения иммуносупрессии без повышенного риска отказа или ухудшения функции почек.
Перспективным направлением является применение Tv-DTH анализа в мониторинге аутоиммунных 15,16, а также в иммунологии опухолей 17.
протокол
1. Подготовка лимфоцитов
- Сбор крови в ACD (кислый цитрат декстроза) труб.
- Изолят PBMC из свежей человеческой периферической крови с использованием среды для отделения лимфоцитов в соответствии со стандартными методами.
- Вымойте РВМС три раза PBS для удаления загрязняющих тромбоцитов. Тромбоциты были обнаружены помехи транс-естественных DTH анализа. Максимально допустимая тромбоцитов загрязнения МПК препарата ≤ 1x10 7 / инъекций.
- Если есть заметные красные клетки крови загрязнения, производят лизис эритроцитов использованием ACK буфера для лизиса после первой стирки. Удалить ACK буфера путем промывания 2 раза ЗФР.
2. Подготовка Аллоантиген
- Изолировать РВМС от донора периферической крови с помощью процедуры показано выше.
- Ресуспендируют доноров PBMC в PBS при концентрации 120x10 6 клеток / мл (4х10 6 клеток / 30 мкл).
- Добавить 1 мкМ PMSF к смеси, чтобы предотвратить белокдеградации.
- Обрабатывают ультразвуком суспензию клеток с использованием семи 1-вторых импульсов с 2 мм ультразвукового зонда. (Примечание: Сохраните материал холодной и избежать чрезмерного пузыри Если происходит вспенивание, пусть клеточной суспензии на лед на 2-3 мин.).
- Убедитесь, что нарушение> 90% клеток с использованием гемоцитометра.
- Центрифуга смеси при 14000 оборотов в минуту при температуре 4 ° С в течение 20 мин в охлажденный микроцентрифуге.
- Передача супернатант в новую 2,0 мл Safe-Lock трубку и определяют концентрацию белка.
3. Подготовка клеток для инъекций
- Для каждой инъекции аликвотой 7x10 6 МПК в 2,0 мл Safe-Lock труб.
- Центрифуга при 6000 оборотов в минуту на минуту в микроцентрифужную и удалить супернатант.
- Ресуспендируют клеток в PBS с или без антигена. Отрегулируйте объемом впрыска до 35 мкл PBS. Следующая схема используется для инъекций:
Отрицательный контроль: МПК + PBS
Положительный контроль: МПК + TT / DT (25 & му; Г / инъекций)
Экспериментальные Антиген специфическая реакция: МПК + тест Ag (4-8 мкг / инъекций)
Экспериментальные Антиген Конкретные регуляции: МПК + тест Ag + TT / DT
4. Предварительно измерения, инъекции, и после измерения
- Обезболить СВ17 SCID мышей изофлураном. Измерение толщины задних лап помощью подпружиненных суппорта. Поместите измеритель в центре подушечку лапы с одним краем касается последнего площадку ходьбе стопы, чтобы служить ориентиром сохранить место измерения последовательно. Footpad толщины записывается при манометра стабилизировалась.
- Медленно введите клеточные суспензии подкожно в Сапоги мышей с использованием ½ шприцы CC инсулина с 28-иглы. Осуществляет литье с иглой по направлению к пальцам, и конические вверх. (Примечание: убедитесь, что нет утечки).
- 18-24 ч после инъекции, анестезия мыши изофлураном и повторить измерение набухания подушечку.
- Subtrдействовать толщина каждой лапы перед инъекцией с поста значение инъекций, чтобы получить отек лапы значение, выражающее данные в единицах 10 -4 дюймов. Рассчитать антиген-специфические отек чистая путем вычитания управления подушечку набухание (МПК + PBS) от отека лапы значения, полученные из процедуры (МПК + донор аллоантигена, TT / DT, или донора аллоантигена TT + / ТД). Положительный ответ управления вспомнить TT антиген / DT из ≥ 25x10 дюймов -4 на фоне ответ на PBS требуется для теста, чтобы считаться действительным.
- Определение ингибирования напомнить реакции в присутствии донора антигенов путем сравнения чистых набухание каждой инъекции с использованием следующей формулы:
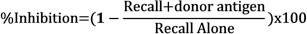
Результаты
1. Оценка трансплантации почек донора для антиген-специфической ответ, используя TV-DTH анализа
Для проверки доноров-реактивного клеточного иммунитета при трансплантации почек мы вводили МПК у этих пациентов с донорскими антигенами в одиночку или с напомним антиген столбн...
Обсуждение
Транс-естественных DTH анализа является новым диагностическим тестом с потенциальным клиническое применение при оценке клеточного ответа в трансплантации, рака и аутоиммунных пациентов. Она ценна тем, что это не только полезны для мониторинга отзыве реакции эффекторных T, но и он может...
Раскрытие информации
Авторы этой рукописи не имеют конфликта интересов раскрывать.
Благодарности
Авторы хотели бы отметить вклад AM VanBuskirk в развитие нашего понимания регулируемых ответ DTH реципиентов. Эта работа была поддержана грантами NIH PO1AI084853 и R01AI066219-06, а также при финансовой поддержке ЕС одном исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
Ссылки
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены