Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Trans-vivo Überempfindlichkeit vom verzögerten Typ Assay für Antigen-spezifische Verordnung
In diesem Artikel
Zusammenfassung
Wir beschreiben eine wertvolle diagnostische Assays, die möglicherweise verwendet werden könnten, um den Abzug der Immunsuppression nach der Transplantation ohne erhöhten Risiko einer Abstoßungsreaktion zu entscheiden. Der Test basiert auf den Grundsätzen der Überempfindlichkeit vom verzögerten Typ und liefert genaue Beurteilung der beiden Spender spezifischen Effektor-und regulatorischen Immunantworten durch Empfänger montiert.
Zusammenfassung
Spättypallergie Antwort (DTH) ist ein schneller in vivo Manifestation der T-Zell-abhängige Immunantwort auf ein fremdes Antigen (Ag), dass das Immunsystem des Wirts hat in der jüngsten Vergangenheit erlebt. DTH-Reaktionen werden oft in einer Sensibilisierung Phase unterteilt, die sich auf der ersten Antigen Erfahrung und Herausforderung Phase, die in der Regel folgt einige Tage nach der Sensibilisierung. Das Fehlen einer Überempfindlichkeit vom verzögerten Typ Reaktion auf einen Rückruf Ag durch Hauttests nachgewiesen wird oft als Beweis für Anergie angesehen. Die traditionelle DTH-Assay wurde effektiv bei der Diagnose vieler mikrobieller Infektionen eingesetzt.
Trotz, die ähnliche Funktionen wie immun Lymphozyteninfiltration, Ödeme und Nekrosen, ist die direkte DTH keine praktikable diagnostische Technik bei transplantierten Patienten, da die Möglichkeit der direkten Einspritzung, was zur Sensibilisierung auf Spender-Antigene und Verlust des Transplantats. Um dieses Problem zu vermeiden, das Brummenein-zu-Maus "trans-vivo" DTH-Assay wurde 1,2 entwickelt. Dieser Test ist im Wesentlichen eine Übertragung DTH Test, wobei in menschlichen peripheren mononukleären Blutzellen (PBMCs) und Antigene wurden subkutan in die Ohrmuschel injiziert oder Fußballen naiven Maus und DTH-wie Schwellung nach 18-24 h 3 gemessen. Die Antigen-Präsentation von humanen Antigen-präsentierenden Zellen wie Makrophagen oder T-Zellen, DCs in gefäßreiches Mausgewebe löst die entzündliche Kaskade und zieht Maus Immunzellen, was zu Schwellung Antworten. Die Antwort ist Antigen-spezifischen Antigen und erfordert eine vorherige Sensibilisierung. Ein positiver Spender-reaktiven DTH-Reaktion in der Tv-DTH-Assay spiegelt wider, dass die transplantierten Patienten hat eine pro-inflammatorische Immunantwort Disposition zur Graft Alloantigene entwickelt.
Das wichtigste Merkmal dieses Assays ist, dass es auch verwendet werden, um regulatorische T-Zellen, die Zuschauer Unterdrückung verursachen detektieren. Bystander Unterdrückung einesDTH Rückruf Reaktion in Gegenwart von Donor-Antigen ist charakteristisch für Transplantationspatienten mit anerkannten Allotransplantate 2,4-14. Die Überwachung von Transplantationspatienten für Alloreaktivität und Regulierung durch Tv-DTH kann identifizieren eine Untergruppe von Patienten, die aus der Reduktion der Immunsuppression ohne erhöhtes Risiko einer Abstoßung oder sich verschlechternder Nierenfunktion profitieren könnten.
Ein viel versprechender Bereich ist die Anwendung des Tv-DTH-Assay bei der Überwachung von Autoimmunität 15,16 und auch in Tumorimmunologie 17.
Protokoll
1. Herstellung von Lymphozyten
- Sammle Blut in ACD (Säure Citrate Dextrose) Röhren.
- Isolieren PBMC aus frischem menschlichem peripheren Blut-Lymphozyten mit Separation Medium nach Standardmethoden.
- Waschen Sie die PBMC dreimal mit PBS zu verunreinigen Thrombozyten zu entfernen. Thrombozyten wurden gefunden, um mit trans-vivo DTH Assay stören. Maximal zulässige Thrombozyten Kontamination von PBMC Vorbereitung ist ≤ 1x10 7 / Injektion.
- Wenn es eine auffallende rote Blutkörperchen Kontamination führen Lyse von roten Blutkörperchen mit ACK-Lysepuffer beim ersten Waschen. Entfernen ACK Puffer und dann Waschen 2-mal mit PBS.
2. Herstellung von Alloantigen
- Isolieren PBMC vom Spender peripheren Blut unter Verwendung des Verfahrens oben gezeigt.
- Resuspendieren Spender PBMC in PBS in einer Konzentration von 120x10 6 Zellen / ml (4x10 6 Zellen / 30 ul).
- 1 uM PMSF zu der Mischung, um Protein zu verhindernAbbau.
- Beschallen der Zellsuspension mit sieben 1-Sekunden-Impulse mit einer 2 mm-Ultraschallsonde. (Hinweis: Bewahren Sie das Material kalt und vermeiden Sie Blasen Wenn Schäumen auftritt, lassen Sie die Zellsuspension auf Eis sitzen für 2-3 min.).
- Überprüfen Sie die Störung von> 90% der Zellen mit einer Zählkammer.
- Zentrifuge die Mischung bei 14.000 rpm bei 4 ° C für 20 min in gekühlten Mikrofuge.
- Überstand in ein neues 2,0 ml Safe-Lock-Rohr und Protein-Konzentration bestimmen.
3. Handy Vorbereitung für Injektionen
- Für jede Injektion Aliquot 7x10 6 PBMC in 2,0 ml Safe-Lock Tubes.
- Zentrifuge bei 6.000 rpm für eine Minute in Mikrofuge und entfernen Sie den Überstand.
- Resuspendieren der Zellen in PBS mit oder ohne Antigene. Passen Sie das Injektionsvolumen bis 35 ul mit PBS. Das folgende Schema ist für Injektionen verwendet:
Negative Kontrolle: PBMC + PBS
Positive Kontrolle: PBMC + TT / DT (25 & mu; G / Injektion)
Experimentelle Antigen-spezifische Antwort: PBMC + Test Ag (4-8 g / Injektion)
Experimentelle Antigenspezifische Verordnung: PBMC + Test Ag + TT / DT
4. Pre-Messung, Injektion, und Post-Messung
- Anesthetize CB17 SCID-Maus mit Isofluran. Messen hinteren Fußballen Dicke mit einem gefederten Sattel. Setzen Bremssattel in der Mitte der Fußsohle, mit einer Kante berühren die letzte Walking Pad des Fußes, um eine Benchmark zu halten, der Messstelle konsistent bereitzustellen. Footpad Dicke wird aufgezeichnet, wenn Manometer-Anzeige stabilisiert hat.
- Langsam injizieren Zellsuspensionen subkutan in die Fußsohlen der Mäuse mit ½ cc Insulinspritzen mit 28-Gauge-Nadel. Führen Injektion mit der Nadel zeigt in Richtung der Zehen, und die Schräge nach oben. (Hinweis: Stellen Sie sicher, dass keine Leckage).
- 18-24 Stunden nach der Injektion betäuben Maus mit Isofluran und wiederholen Messung der Fußballen Schwellung.
- Subtrhandeln die Dicke jeder Fußballen vor der Injektion aus der Nacheinspritzung Wert auf die Fußballen Schwellung Wert zu erhalten, drückt die Daten in Einheiten von 10 -4 Zoll. Berechnen Sie die Antigen-spezifische net Schwellung durch Subtraktion Kontrolle Fußballen Schwellung (PBMC + PBS) aus den Fußballen Schwellungen Werte aus den Behandlungen (PBMC + Spender Alloantigen, TT / DT oder Spender Alloantigen + TT / DT) erhalten. Eine positive Kontrolle Reaktion auf Antigen TT / DT von ≥ 25x10 -4 Zentimeter über Hintergrund Reaktion auf PBS erinnern wird, damit der Test als gültig betrachtet werden benötigt.
- Bestimmen der Hemmung der Rückruf Reaktionen in Gegenwart von Spender-Antigenen durch Vergleichen der Netto Schwellung jeder Injektion unter Verwendung der folgenden Formel:
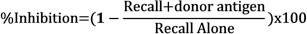
Ergebnisse
1. Auswertung der Nierentransplantation für Spender Antigen-spezifische Antwort mit Tv-DTH-Assay
Um die Spender-reaktiven zelluläre Immunität in Nierentransplantierten testen wir injiziert PBMC von Patienten mit Spender-Antigenen alleine oder mit einem Recall-Antigen Tetanus Toxoid (TT). Als positive Kontrolle wurden die Zellen mit TT allein injiziert. Wir beobachten drei Muster der Überempfindlichkeit vom verzögerten Typ in Transplantationspatienten (Abbildung 1). Alle Pa...
Diskussion
Die trans-vivo DTH Test ein neuer diagnostischer Test mit einer möglichen klinischen Anwendung bei der Beurteilung zellvermittelte Antworten in der Transplantationsmedizin, Krebs und Autoimmunerkrankungen Patienten. Es ist wertvoll, weil es nicht nur nützlich bei der Überwachung Rückruf T Effektor Antworten ist, aber es kann auch regulatorische T-Antworten erkennen. Eine zuverlässige Möglichkeit, menschliche DTH Regulierung erkennen könnte Sicherheit von Immunsuppression Rückzug in Patienten, die Kandidaten für...
Offenlegungen
Die Autoren dieses Manuskripts haben keine Interessenkonflikte offen zu legen.
Danksagungen
Die Autoren bedanken sich bei den Beiträgen von AM VanBuskirk zur Entwicklung unseres Verständnisses des regulierten DTH-Reaktion in Transplantationspatienten anzuerkennen. Diese Arbeit wurde unterstützt NIH Zuschüsse PO1AI084853 und R01AI066219-06, und von der EU-geförderten einer Studie.
Materialien
| Name | Company | Catalog Number | Comments |
| ACD tube for blood collection | BD | 02-684-26 | |
| Lymphocyte Separation Medium | Cellgro | 25-072-CV | |
| Dulbecco's Phosphate-Buffered Saline | Cellgro | 21-031-CM | Without calcium & magnesium |
| ACK Lysis Buffer | BioWhittaker | 10-548E | |
| TT/DT or EBV | Sanofi Pasteur Inc./ Meridian Life Science, Inc. | TT/DT 25 μg/injection EBV 8 μg/injection | |
| Protease inhibitor PMSF | Sigma-Aldrich | 78830 | |
| Eosine for cell count | Sigma-Aldrich | E-6003 | |
| Alloantigen | Purified HLA antigens, synthetic allopeptides can be used instead of donor cell-free lysates | ||
| 50 ml sterile centrifuge tubes | Fisher Scientific | 06-443-18 | |
| 10 ml pipettes and pipettor | BD Falcon | 13-675-20 | |
| 2 ml safe-lock tubes | Costar | 3213 | |
| 1000 μl, 100 μl , 10 μl pipettes with sterile tips | |||
| Hemocytometer | Fisher | 02-671-10 | |
| Full size centrifuge and microfuge | Beckman Coulter/Eppendorf | ||
| 1/2cc or 1cc insulin syringes | Becton Dickinson | 14-826-79 | 28 gauge |
| Vibracell sonicator | Divtech Equipment Co. Sonocs Materials Inc | 2 mm probe | |
| Dial thickness gauge | Mitutoyo, Japan | ||
| SCID mice | Harlan | ||
| Isoflurane | Piramal Healthcare | Inhalant anesthesia |
Referenzen
- Carrodeguas, L., et al. Trans vivo analysis of human delayed-type hypersensitivity reactivity. Hum. Immunol. 60, 640-651 (1999).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J. Clin. Invest. 106, 145-155 (2000).
- Burlingham, W. J., Jankowska-Gan, E. Mouse strain and injection site are crucial for detecting linked suppression in transplant recipients by trans-vivo DTH assay. Am. J. Transplant. 7, 466-470 (2007).
- Burlingham, W. J., et al. Loss of tolerance to a maternal kidney transplant is selective for HLA class II: Evidence from trans-vivo DTH and alloantibody analysis. Human Immunology. 61, 1395-1402 (2000).
- Geissler, F., et al. Human liver allograft acceptance and the 'tolerance assay': In vitro anti-donor T cell assays show hyporeactivity to donor cells but, unlike DTH, fail to detect linked suppression. Transplantation. 72, 571-580 (2001).
- Jankowska-Gan, E., et al. Human liver allograft acceptance and the 'tolerance assay'. II. donor HLA-A, -B but not DR antigens are able to trigger regulation of DTH. Hum. Immunol. 63, 862 (2002).
- Cai, J., et al. Minor H Antigen HA-1-specific Regulator and Effector CD8+ T Cells, and HA-1 Microchimerism, in Allograft Tolerance. J. Exp. Med. 199, 1017-1023 (2004).
- Rodriguez, D. S., et al. Immune regulation and graft survival in kidney transplant recipients are both enhanced by human leukocyte antigen matching. Am. J. Transplant. 4, 537-543 (2004).
- Xu, Q., et al. Human CD4+CD25low adaptive T regulatory cells suppress delayed-type hypersensitivity during transplant tolerance. J. Immunol. 178, 3983-3995 (2007).
- Derks, R. A., Jankowska-Gan, E., Xu, Q., Burlingham, W. J. Dendritic cell type determines the mechanism of bystander suppression by adaptive T regulatory cells specific for the minor antigen HA-1. J. Immunol. 179, 3443-3451 (2007).
- Jankowska-Gan, E., et al. Successful reduction of immunosuppression in older renal transplant recipients who exhibit donor-specific regulation. Transplantation. 88, 533-541 (2009).
- Jankowska-Gan, E., et al. Pretransplant immune regulation predicts allograft outcome: bidirectional regulation correlates with excellent renal transplant function in living-related donor-recipient pairs. Transplantation. 93, 283-290 (2012).
- Knechtle, S. J., et al. Early and limited use of tacrolimus to avoid rejection in an alemtuzumab and sirolimus regimen for kidney transplantation: clinical results and immune monitoring. Am. J. Transplant. 9, 1087-1098 (2009).
- Haynes, L. D., et al. Donor-specific indirect pathway analysis reveals a B-cell-independent signature which reflects outcomes in kidney transplant recipients. Am. J. Transplant. 12, 640-648 (2012).
- Burlingham, W. J., et al. IL-17-dependent cellular immunity to collagen type V predisposes to obliterative bronchiolitis in human lung transplants. J. Clin. Invest. 117, 3498-3506 (2007).
- Bobadilla, J. L., et al. TH-17, Monokines, Collagen Type V, and Primary Graft Dysfunction in Lung Transplantation. Am. J. Respir. Crit. Care Med. 177 (6), (2008).
- Olson, B. M., et al. Human prostate tumor antigen-specific CD8+ regulatory T cells are inhibited by CTLA-4 or IL-35 blockade. J. Immunol. 189, 5590-5601 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten